适于番茄叶片蛋白质组分析的双向电泳优化体系的建立
王 强,王 娟,李 宁,唐亚萍,杨 涛,王柏柯,杨生保,帕提古丽,余庆辉
(1.新疆农业科学院园艺作物研究所/新疆园艺作物生物技术与分子育种重点实验室,乌鲁木齐 830091;2. 新疆农业科学院经济作物研究所,乌鲁木齐 830091)
适于番茄叶片蛋白质组分析的双向电泳优化体系的建立
王 强1,王 娟2,李 宁1,唐亚萍1,杨 涛1,王柏柯1,杨生保1,帕提古丽1,余庆辉1
(1.新疆农业科学院园艺作物研究所/新疆园艺作物生物技术与分子育种重点实验室,乌鲁木齐830091;2. 新疆农业科学院经济作物研究所,乌鲁木齐830091)
【目的】建立适于番茄叶片蛋白质组分析的双向电泳(2-DE)技术,为开展番茄蛋白质组学研究奠定技术基础。【方法】对番茄叶片蛋白质提取方法、蛋白质裂解液、上样量、胶条pH范围等关键步骤进行优化。【结果】采用三氯乙酸/丙酮法提取番茄叶片总蛋白质,含有7 mol/L尿素,2 mol/L硫脲,4% CHAPS,30 mmol/L Tris-HCl(pH 8.0)裂解缓冲液,上样量为100 mg,以pH 4~7、18 cm的IPG 胶条在12%SDS-PAGE凝胶浓度下进行双向电泳,得到了蛋白点均匀分布、低峰度蛋白点较为清晰,蛋白点数目多且分辨率高的2-DE图谱。【结论】建立了一套适于番茄叶片蛋白质分析的双向电泳技术体系,为下一步在蛋白组学水平上分析番茄逆境胁迫等相关蛋白提供了技术支持。
番茄叶片;蛋白质组;双向电泳(2-DE)
0 引 言
【研究意义】蛋白质组学是后基因组时代研究生物学功能的重要组学,双向电泳技术(2- DE) 已经成为了蛋白组学研究的核心技术之一,而双向电泳技术涉及的环节较多,样品制备中植物组织中存在影响双向电泳的物质(如核酸、多糖和脂类等生物大分子以及盐类) 会阻塞凝胶孔径,盐浓度过高会使等电聚焦的电压降低,甚至损坏IPG 胶条[1]。其次植物组织中含有的色素、酚、多糖等代谢产物也会对后续蛋白质的分离和鉴定造成影响[2]。除了样品制备外,上样量的大小、蛋白质裂解的配方、IPG胶条的选择等都会对双向电泳的产生影响。任何一个环节出现问题都无法得到分辨率高的凝胶图谱。因此,建立一套分辨率高的双向电泳体系是成功开展番茄蛋白质组学分析的基础。【前人研究进展】近年来,双向电泳技术广泛应用于植物等方面的研究,由于不同研究作物的蛋白质组成千差万别,套用常规试验程序有可能得不到满意结果[3]。番茄不同器官蛋白质组学方面的研究有一些报道,如叶片[4-5]、根[6]和果实[7]等,由于双向电泳涉及的环节较多,植物组织中代谢产物、材料的多样性及不同器官所含蛋白种类及数量等也不相同,往往对电泳结果影响较大。【本研究切入点】国内外研究番茄蛋白质组学的研究报道还很有限。利用双向电泳技术,比较番茄叶片总蛋白质的提取方法、蛋白质裂解液、上样量、IPG胶条等进一步的优化。【拟解决的关键问题】探索出一套适于番茄叶片的双向电泳技术,以期得到蛋白质点数目多,背景清晰,条纹较少,拖尾现象不明显的电泳图谱,为开展番茄蛋白质组学研究提供技术支撑。
1 材料与方法
1.1材 料
供试番茄材料为M82,于2014 年 4 月种植于新疆农业科学院安宁渠综合试验基地,幼苗4片真叶时取样,置于-80℃冰箱备用。实验所用的载体两性电解质、线性18 cm pH 3~10、pH 4~7 IPG胶条、矿物油均购于美国Bio-Rad公司。其它试剂均为国产分析纯。
1.2方 法
1.2.1蛋白质提取
采用以下三种方法提取番茄叶片总蛋白并对提取效果进行比较。
三氯乙酸/丙酮沉淀法参照Gallardo等[8]并略作修改。取番茄叶片1 g在液氮中研磨成粉末,转移至离心管中,加入-20℃预冷的丙酮4 mL(含10%三氯乙酸和0.07%β-巯基乙醇) 充分涡旋,-20℃静置过夜,在4℃低温离心机12 000 r/min,离心 30 min,弃上清,留沉淀;然后加80%丙酮4 mL (含0.07% β-巯基乙醇)去除色素及杂质,12 000 r/min,4℃低温离心30 min,弃上清,留沉淀。再加入100%丙酮(含0.07%β-巯基乙醇),-20℃冷藏30 min。然后4°C,12 000 r/min离心30 min,弃上清,洗涤步骤重复2~3次,直到有机相成无色,将所得蛋白沉淀置于-20℃冷冻成干粉,在-80℃保存备用。
饱和酚/甲醇醋酸铵法参照Mireille等[9]并略作修改。取番茄叶片 1 g 及少量的 PVP放入提前预冷的研钵中,在液氮中研磨成粉末,然后转至离心管,加入3~4倍体积蛋白质提取缓冲液( pH 8.0,0.50 mmol/L Tris-HCl,700 mmol/L 蔗糖,5 mmol/L EDTA-Na2,0.1% 蛋白酶抑制剂)充分混匀。在12 000 r/min,4℃低温离心机上离心 3 min,吸取上清液转入另一离心管中,向管中加 1.2 倍体积的水饱和酚充分混匀,12 000 r/min 离心20 min,取上清液加3倍体积 0.1 mol/L 乙酸铵/甲醇,-20℃过夜,然后12 000 r/min离心20 min,收集沉淀; 再用乙酸铵/甲醇洗涤 1 次,依次再用预冷的甲醇洗涤 2 次,80%丙酮洗涤 1 次,最后将沉淀在-20℃冷冻干燥,得到粉末状蛋白放入-80℃保存备用。
二硫苏糖醇/丙酮法参照王红等[10]并略作修改。取 1 g 番茄叶片,液氮中研磨成粉末,转移至离心管中,加入 5 mL 2%二硫苏糖醇的水溶液,在 4℃ 下12 000 r/min离心 30 min,取上清液,弃沉淀;上清液加4倍体积的冷丙酮,放于-20℃冰箱过夜。之后 4℃下 12 000 r/min 离心 30 min,沉淀用80%丙酮溶液清洗 2~3 次;最后沉淀在-20℃冷冻干燥,放入-80℃冰箱备用。
1.2.2蛋白质定量
测定蛋白质浓度参考 Bradford[11]的方法,称取蛋白质沉淀,以10 mg 蛋白加入200 μL 蛋白质裂解液复溶,在冰浴超声波中处理15 min,取出后在4℃摇床摇匀30 min,然后在4℃, 12 000 r/min 离心 30 min,取上清液,即为蛋白样品。采用的蛋白裂解液如下:
蛋白裂解液Ⅰ:7 mol/L尿素,2 mol/L硫脲,2% CHAPS,2% SB3-10;
蛋白裂解液Ⅱ:7 mol/L尿素,2 mol/L硫脲,4% CHAPS,30 mmol/L Tris-HCl(pH 8.0);
蛋白裂解液Ⅲ:0.05 mol/L NaCl,0.1 mol/L Tris-HCl;
1.2.3单向SDS-PAGE凝胶电泳
将浓度为12%的分离胶注入玻璃板夹层中,用去离子水封胶面,待分离胶聚合后,配制浓度为4%浓缩胶,倒去分离胶表面的去离子水,灌入浓缩胶,插入点样梳,待浓缩胶聚合后,在电泳槽中加入电泳缓冲液,拔去上样梳点样,蛋白上样量为20 μL。加样完毕开始电泳,起始电压为80 V,待溴酚蓝线到达分离胶时把电压提高到120 V。当溴酚蓝指示剂达到分离胶底部时停止电泳。
1.2.4第一向等电聚焦
采用Protean IEF cell等电聚焦系统。将提取的番茄蛋白样品加裂解液至总体积为500 μL,均匀加入上样IPG 胶条槽,将IPG胶条保护膜揭掉,IPG 胶条与胶条槽正负极一致,放在加有蛋白上样液的IPG 胶条槽内,然后在胶面上加2~3 mL矿物油,置于等电聚焦仪上,聚焦条件为20℃。运行参数:50 V水化12 h,250 V,30 min;500 V,1 h;1 000 V,30 min;4 000 V稳压聚焦,总电压时间积达到20 000 Vh时结束电泳。
1.2.5第二SDS-PAGE凝胶电泳
等一向等电聚焦结束后,将IPG 胶条从胶条槽中取出,放入滤纸上吸取胶条表面的矿物油,然后将胶面朝上的IPG 胶条放于5 mL 胶条平衡缓冲液 I[6 mol /L尿素,20%甘油,0.375 mol /L Tris-HCl (pH 8.8),2% SDS,2%DTT]中在脱色摇床上缓慢摇荡平衡15 min,再将IPG 胶条放入滤纸上吸取胶条表面的溶液,再转入5 mL 胶条平衡缓冲液 II [6 mol/ L尿素,2.5%碘乙酰胺,20%甘油,0.375 mol /L Tris-HCl (pH 8.8),2%SDS]中在脱色摇床上缓慢摇荡平衡15 min。使用Mini Protein 3垂直电泳仪,将平衡完毕的IPG胶条转移到提前预制的12%SDS-PAGE 凝胶上,使IPG胶条与凝胶表面充分接触,用低熔点琼脂糖封胶,在120 V 电压下进行电泳,待溴酚蓝移至电泳槽凝胶底部时停止电泳。
1.2.6蛋白质染色与图像分析
第二SDS-PAGE凝胶电泳结束后,采用改良的考马斯亮蓝染色法[12],固定、致敏、染色、脱色至凝胶背景清晰为止,脱色后的凝胶在GE Healthcare凝胶扫描仪上扫描获取图像;用PDQuest8.0软件进行蛋白点检测及图像分析。
2 结果与分析
2.1不同方法提取番茄叶片总蛋白质比较
二硫苏糖醇/丙酮法、饱和酚/甲醇醋酸铵法、改良的三氯乙酸/丙酮法分别提取番茄叶片蛋白质样品并通过单向SDS-PAGE凝胶电泳进行检测,结果表明,利用二硫苏糖醇/丙酮法提取蛋白质含量较丰富,条带较多,蛋白经多次洗脱后呈黄色色素,最终难以消除。(泳道1~3);饱和酚/甲醇醋酸铵法所提取的蛋白质含量少,且条带较少不清晰(泳道4~6);而利用三氯乙酸/丙酮法所提取蛋白质含量丰富,条带数量最多(泳道7~9);因此,研究认为三氯乙酸/丙酮法是较为理想的番茄叶片蛋白质的提取方法。图1
2.2蛋白质裂解液选择
蛋白质裂解液直接影响蛋白质样品中各种蛋白质能否充分溶解,并是其能否在2-DE凝胶上分离出来的关键因素[13]。蛋白样品制备,应尽可能的避免蛋白质的降解与损失,保证蛋白样品最大程度的溶解,因此选择合适的裂解液也十分重要[14]。SDS-PAGE分析结果显示,三种裂解液对蛋白质样品的溶解效果差异明显。不同蛋白质提取方法在三种裂解液配方溶解后,通过单向SDS-PAGE凝胶电泳看出裂解液I、II对蛋白质样品的溶解效果较好,但裂解液II在不同方法提取样品中蛋白裂解效果好于裂解液I,蛋白质条带范围较为广泛。裂解液III在三氯乙酸/丙酮提取法、饱和酚/甲醇醋酸铵提取法中蛋白条带模糊不清,在二硫苏糖醇/丙酮法提取蛋白中显示蛋白条带较弱,范围内的条带较少。图2
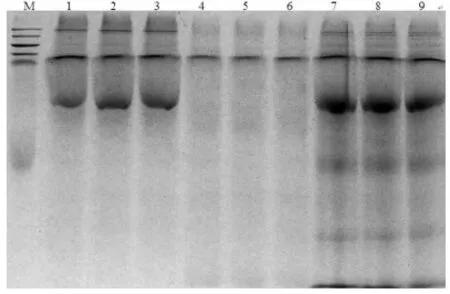
注:1~3:二硫苏糖醇/丙酮法;4~6:饱和酚/甲醇醋酸铵法;7~9:改良的三氯乙酸/丙酮法
Note:1-3:DTT- acetone method;4-6:Phenol-methanol-ammonium acetate method;7-9:modified TCA- acetone method
图1三种方法提取番茄叶片总蛋白SDS-PAGE分析
Fig.1SDS-PAGE pattern of tomato levers proteins extracted by three sample preparation methods
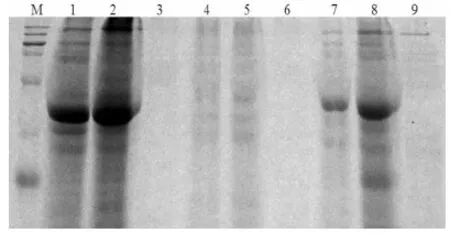
饱和酚/甲醇醋酸铵法 二硫苏糖醇/丙酮法 三氯乙酸/丙酮法
注:1、4、7为裂解液I;2、5、8为裂解液II;3、6、9为裂解液III
Note:1,4,7 for lysis buffer I;2,5,8 for lysis buffer II;3,6,9 for lysis buffer III
图2 不同裂解液配方和方法提取蛋白溶解效果
Fig.2 Different lysis buffer formula of dissolution effect in different methods to extract protein
2.3上样量对2-DE图谱的影响
等电聚焦的上样量多少直接影响到聚焦的效果及双向电泳的分辨率,上样量过少,低丰度蛋白不容易检出,上样量太多,高丰度蛋白的斑点掩盖低丰度蛋白点,而且盐离子越多,等电聚焦时电压的上升受到干扰,直接影响聚焦效果[15]。采用18 cm IPG(pH 3~10)胶条、12%SDS-PAGE浓度、改良考马斯亮蓝染色后的2-DE图谱可以看出,不同浓度蛋白质上样量对2-DE图谱分辨率有明显的影响,当番茄叶片蛋白质的上样量为75 mg时(图3A), 蛋白质点虽然无拖尾现象,但2-DE图谱上只检出了约343个蛋白质点,而且低丰度蛋白检出数量很少。上样量为100 mg时(图3B),蛋白点呈圆点型,形态好,几乎无拖尾现象,蛋白质点数量约为757个蛋白质点。上样量为125 mg时(图3C),高丰度蛋白质之间重叠现象严重,与其临近的低丰度蛋白质点有很多被覆盖,条纹较多,同时也出现较多蛋白质点拖尾的现象。据此认为,适合于番茄叶片蛋白质双向电泳的最佳上样量为100 mg。图3
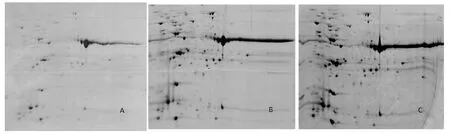
注:18 cm,pH 3~10,12%SDS-PAGE,改良的考马斯亮蓝染色;A.上样量为75 mg;B.上样量为100 mg;C.上样量为125 mg
Note:18 cm,pH 3-10,12%SDS-PAGE,modified coomassie R-250 staining;A.75 mg;B.100 mg;C.125 mg
图3不同上样量番茄叶片蛋白质2-DE图谱
Fig.3The effect of different protein-loading amounts on 2-DE map of tomato leaf protein
2.4胶条范围对2-DE图谱的影响
分别采用18 cm,pH 3~10和pH 4~7的IPG胶条,从图4A可以看出,当使用pH 3~10的胶条进行2-DE电泳时,2-DE凝胶图谱中的蛋白质点大部分集中在酸性端范围内,碱性端蛋白质点分布极少,且图中椭圆区域部分蛋白质点丰度低,模糊不清,导致分辨率低。根据观察结果,进一步将2~DE图谱分为:3≤pH<4、4≤pH<7、7≤pH<10三个区域,利用PDQuest8.0软件对各区域中蛋白质点数检测,有72%蛋白点稳定分布在4 注:A. 18 cm,IPG胶条pH 3~10;B. 18 cm,IPG胶条pH 4~7 Note:A.18 cm,IPG strips of pH 3-10;B. 18 cm,IPG strips of pH 4-7 图4不同IPG胶条pH范围下2-DE图谱 Fig.4The effect of different IPG strips of pH on 2-DE map of tomato leaf protein 番茄叶片组织中含有大量盐离子、多酚、色素及多糖等次生代谢物[16]。在蛋白质提取过程中选择适宜的蛋白质提取方法,除去上述次生代谢等干扰物质,并减少蛋白质的损失和降解[17],是影响2-DE成败的关键因素。实验通过比较前人研究结果,以二硫苏糖醇/丙酮法、饱和酚/甲醇醋酸铵法、三氯乙酸/丙酮法分别提取番茄叶片蛋白质,结果显示饱和酚/甲醇醋酸铵法所提取的蛋白质含量少,且条带不清晰,可能由于该方法只收集酚相与水相界面层液,丢弃大量沉淀物,导致蛋白样品在制备过程中损失过多。二硫苏糖醇/丙酮法提取番茄叶片蛋白含量相对较丰富,条带较多,蛋白呈黄色色素,经多次洗脱后还是难以消除。表明二硫苏糖醇/丙酮反复洗涤蛋白质,虽然可除去盐离子,但对色素、多糖等杂质的去除效果并不理想。实验中,三氯乙酸/丙酮法在蛋白提取液中加入β-巯基乙醇,通过丙酮沉淀达到有效除去色素、盐类等干扰物质,并且减少蛋白酶在提取过程中酶的失活和降解,对去除次生代谢物中杂质也有很好效果。 蛋白质的溶解影响2-DE蛋白质分离,选用合适的裂解液来充分溶解蛋白质是蛋白质组学研究中的一个重要的技术因素[18]。实验结果显示裂解液I、II对番茄叶片蛋白质样品的溶解效果较好,表明尿素与硫脲混合有利于增加番茄叶片蛋白质样品的溶解。裂解液II中7 mol/L尿素、2 mol/L硫脲混合4%CHAPS对番茄叶片蛋白质的溶解效果最佳,这与相关文献结论相近[19]。因此,裂解液中是否含有尿素、硫脲对番茄叶片蛋白质的溶解能力有很大影响。实验不同配方裂解蛋白质样品的单向SDS-PAGE凝胶表明,采用7 mol/L尿素,2 mol/L硫脲,4% CHAPS,30 mmol/L Tris-HCl (pH 6.8)作为番茄叶片蛋白复溶的裂解液效果最好。 蛋白上样量的大小和IPG胶条pH对2-DE凝胶的分辨率有直接影响。上样量太大易引起蛋白上样溶液中盐离子及其它杂质含量的提高,导致第一向等电聚焦时蛋白质不能有效均匀分布IPG胶条上,并且易发生蛋白质的凝聚和沉淀,在SDS-PAGE凝胶上,易产生“点饱和”现象,使低丰度蛋白易被掩盖[20],或产生水平和垂直纹理现象[21]。上样量过低,较低丰度的蛋白点有可能无法检测,进而影响对2-DE凝胶图谱蛋白点的准确识别。另外,要对2-DE凝胶进行差异蛋白图谱比较,尤其是低丰度蛋白点,在2-DE凝胶图谱上达到可识别与分辨,需要选择适宜的IPG胶条。研究首先釆用pH 3~10的IPG胶条对番茄叶片蛋白质样品2-DE凝胶分离,结果显示大部分蛋白点集中在酸性端范围内少数蛋白点之间相互紧密相连,甚至重叠,个别高分度蛋白点周围的低丰度蛋白点被覆盖,导致低丰度蛋白点模糊不清不易区分。用pH 4~7的IPG胶条进行2-DE分离,极大地提高了此区域蛋白点的分辨率,通过2-DE凝胶图谱比较分析,获得的2-DE图谱背景清晰,检测到的蛋白点数增多且分辨率高。 以三氯乙酸/丙酮法提取番茄叶片蛋白质,选择蛋白质裂解液为[7 mol/L尿素,2 mol/L硫脲,4%CHAPS,30 mmol/L Tris-HCl(pH 8.0)]溶解,上样量为100 mg,18 cm、pH 4~7的IPG胶条更适合番茄叶片总蛋白质2-DE的分离,经PDQuest8.0软件统计分析,可在2-DE图谱上分辨出947个蛋白点,蛋白点清晰呈圆形,分布均匀、检测到的蛋白点数增多且低峰度蛋白较为清晰,分辨率高,优化后的体系更适合于番茄叶片蛋白质组双向电泳的分析。 References) [1] 郭尧君. 蛋白质电泳实验技术[M].北京:科学出版社,2005:215-224. GUO Yao-jun. (2005).Proteinelectrophoresisexperimenttechnology[M]. Beijing: Science Press:215-224. (in Chinese) [2] Bodzon-Kulakowska, A., Bierczynska-Krzysik, A., Dylag, T., Drabik, A., Suder, P., & Noga, M., et al. (2007). Methods for samples preparation in proteomic research.JournalofChromatographyBAnalyticalTechnologiesintheBiomedical&LifeSciences, 849(s 1-2):1-31. [3]黎飞,徐秋芳,臧宪朋,等.番茄子叶总蛋白双向电泳体系的建立[J].园艺学报,2010,37(4):661-668. LI Fei,XU Qiu-fang,ZANG Xian-peng,et al. (2010). Establishment of Two-dimensional Electrophoresis System of Tomato Cotyledons [J].ActaHorticulturaeSinica,37(4):661-668. (in Chinese) [4] 张超,郭斌,祁洋,等.转HBsAg基因樱桃番茄组培苗叶片总蛋白双向电泳体系的建立[J].核农学报,2012,26(8): 1 111-1 117. ZHANG Chao, GUO Bin,QI Yang, et al. (2012). Establishment of Two-dimensional Gel Electrophoresis System for Leaf Proteins of HBsAg Transgenic Cherry Tomato [J].JournalofNuclearAgriculturalSciences, 26(8): 1,111 -1,117. (in Chinese) [5]白汝瑾,庄天明,刘杨,等.利用双向电泳技术分离盐胁迫下番茄叶片蛋白[J].上海交通大学学报,2008,25(4):363-366. BAI Ru- jin,ZHUANG Tian- ming,LIU Yang, et al. (2008). 2D- PAGE Analysis of Wild Tomato Leaf Protein under Salt Stress [J].JournalofShanghaiJiaotongUiversity, 25(4):363-366. (in Chinese) [6]邢佳毅,雷慧,程继鸿,等.番茄幼苗根系总蛋白SDS-PAGE方法的优化[J].安徽农业科学, 2012,40(2):675-677. XING Jia-yi,LEI Hui,CHENG Ji-hong, et al.(2012). Optimization of SDS-PAGE Procedures for Analyzing the Total Protein in Seedling Roots of Lycopersicon esculentum [J].JournalofAnhuiAgriculturalSciences, 40(2):675-677. (in Chinese) [7]卢丞文,潘晓琪,田慧琴,等.番茄果实中蛋白质的提取和双向电泳条件的优化[J].食品科技,2010 ,35(10):196-200. LU Cheng-wen,PAN Xiao-qi,TIAN Hui-qin, et al. (2010). Improvement of extraction method and two-dimensional electrophoresis conditions for proteome study of tomato fruit [J].Foodscienceandtechnology,35 (10 ):196-200. (in Chinese) [8] Gallardo, K., Spc, J. C., Puype, M., Demol, H., & Vandekerckhove, J. (2001). Proteomic analysis of arabidopsis seed germination and priming 1.PlantPhysiology, 126(2):835-848. [9] Faurobert, M., Pelpoir, E., & Cha b, J. (2007). Phenol extraction of proteins for proteomic studies of recalcitrant plant tissues.MethodsinMolecularBiology, 355:9-14. [10]王红,李浩戈,杨涛,等.黄瓜叶片蛋白质双向电泳条件优化[J]. 辽宁农业科学,2012,(3) : 11-14. WANG Hong,LI Hao-ge,YANG Tao, et al. (2012). Conditions Optimization of Cucumber Leaf Protein Two-dimensional Electrophoresis [J].LiaoningAgriculturalSciences,(3) : 11-14. (in Chinese) [11] Bradford, M. M. (1976). A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, anal. biochem.AnalyticalBiochemistry, 72(s 1-2):248-254. [12] Wang, X., Li, X., & Li, Y. (2007). A modified coomassie brilliant blue staining method at nanogram sensitivity compatible with proteomic analysis.BiotechnologyLetters, 29(10):1,599-1,603. [13] Valcu, C., & Schlink, K. (2006). Efficient extraction of proteins from woody plant samples for two-dimensional electrophoresis.Proteomics,6(14):4,166-4,175. [14] 陈蕊红,张改生,刘卫,等.小麦花药蛋白质组双向电泳技术体系的优化[J].核农学报,2008,22(4):404-409. CHEN Rui-hong,ZHANG Gai-sheng,LIU Wei,et al. (2008). Optimization of Two-dimensional Gel Electrophoresis for Proteome from Wheat Anthers [J].JournalofNuclearAgriculturalSciences,22(4):404-409. (in Chinese) [15] Giavalisco, P., Nordhoff, E., Lehrach, H., Gobom, J., & Klose, J. (2003). Extraction of proteins from plant tissues for two-dimensional electrophoresis analysis.Electrophoresis, 24(1-2):207-216. [16]赵新准,徐红华,姜毓君.食品蛋白质[M].北京:科学出版社,2009: 244-245. ZHAO Xin-zhun,XU Hong-hua,JIANG Yu-jun.(2009).Foodprotein[M]. Beijing: Science Press:244-245.(in Chinese) [17]Rober, P.,Timothy, J. F.,Anthony, L. M.,et al. (2006). An accurate and reproducible method for proteome profiling of the effects of salt stress in the rice leaf lamina.ExperimentalBotany,57(5): 1,109-1,118. [18] Méchin, V., Consoli, L., Guilloux, M. L., & Damerval, C. (2003). An efficient solubilization buffer for plant proteins focused in immobilized ph gradients.Proteomics, 3(7):1,299-1,302. [19] Rabilloud, T., Adessi, C., Giraudel, A., & Lunardi, J. (1997). Improvement of the solubilization of proteins in two-dimensional electrophoresis with immobilized ph gradients.Electrophoresis,18(3-4):307-316. [20] Giavalisco, P., Nordhoff, E., Lehrach, H., Gobom, J., & Klose, J. (2003). Extraction of proteins from plant tissues for two-dimensional electrophoresis analysis.Electrophoresis, 24(1-2):207-216. [21]王丽娟,任学敏,杜艳慧,等.菜籽蛋白质组双向电泳技术体系的优化研究[J].安徽农业科学,2011,39(17): 10 178-10 181. WANG Li-juan,REN Xue-min,DU Yan-hui, et al.(2011). Optimization of Two-dimensional Electrophoresis Technology System for Rapeseed Proteome [J].JournalofAnhuiAgriculturalSciences,39(17):10,178-10,181.(in Chinese) Fund project:Supported Natural science foundation project of Xinjiang Uygur Autonomous Region(2014211B035) Establishment of Two-dimensional Electrophoresis Optimization System for Proteomic Analysis of Tomato Leaves WANG Qiang1,WANG Juan2,LI Ning1,TANG Ya-ping1,YANG Tao1,WANG Bai-ke1,YANG Sheng-bao1,Patiguli1,YU Qing-hui1 (1.ResearchInstituteofHorticulture/KeyLaboratoryofHorticulturalBiotechnology&MolecularBreedingofXinjiang,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China;2.ResearchInstituteofEconomicCrops,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China;) 【Objective】 To establish a two-dimensional gel electrophoresis (2-DE) protocol for proteomic analysis of tomato leaves,this system aims to make a foundation for tomato proteomic research.【Method】 The method of protein extraction,reagent of lysis buffer,the sampling amount,pH gradient of IPG strip and other factors were optimized.【Result】 The results showed that optimal tomato leaf protein extraction was obtained by the improved TCA/acetone method,with lysis buffer containing 7 mol/L Urea,2 mol/L Thiourea,4% CHAPS,30 mmol/L Tris-HCl(pH 8.0),a protein loading amount of 100 mg. Under pH 4-7,18 cm IPG strip and 12% concentrations of the SDS-AGE gel. The protein spots we got were evenly distributed and the low protein kurtosis were clearer,with more numbers of protein and higher resolution two-dimensional electrophoresis. 【Conclusion】 This established experiment is sui tomato leaves;proteomic;two-dimensional electrophoresis(2-DE) 10.6048/j.issn.1001-4330.2016.04.004 2015-11-17 新疆维吾尔自治区自然科学基金项目(2014211B035) 王强(1983-),男,甘肃人,副研究员,研究方向为蔬菜栽培生理与逆境胁迫,(E-mail)wangqiang201004@sina.com 余庆辉(1970-),男,广东人,研究员,研究方向为加工番茄新品种选育和栽培,(E-mail)tomato-yu@xaas.ac.cn S188;S641.2 A 1001-4330(2016)04-0610-07
3 讨 论
4 结 论
Table for the tomato leaf protein analysis system of two-dimensional electrophoresis,which might provide technical support for the next step proteomics level analysis of tomato stress conditions and other related proteins.

