南方典型植物原料制备纳米纤维素
徐 威 宇, 付 时 雨, 彭 洋 洋, 刘 浩
( 华南理工大学 制浆造纸国家重点实验室, 广东 广州 510640 )
南方典型植物原料制备纳米纤维素
徐 威 宇,付 时 雨,彭 洋 洋,刘 浩
( 华南理工大学 制浆造纸国家重点实验室, 广东 广州510640 )
以南方典型植物大王椰、榕树和杧果树为原料提取α-纤维素,用硫酸水解制备了纳米纤维素,并对制备的纳米纤维素的形貌及性能进行了对比。经透射电镜和扫描电镜分析,大王椰、榕树和杧果树纳米纤维素纤维长度分别在50~400、50~350和60~120 nm;热重分析结果表明,3种纳米纤维素的热稳定性由高到低顺序为杧果树、大王椰、榕树;红外分析表明,酸水解前后纤维素的化学结构保留完整;X衍射分析仪表明,酸水解前后晶型都保持了纤维素Ⅱ型的晶体结构,而且结晶度指数都有一定程度的增加。
纳米纤维素;大王椰;杧果树;榕树;酸水解
0 引 言
纳米纤维素是一种从天然纤维素分离制备的新型原材料,具有表面积大、杨氏模量高、高长径比等独特性能,可以应用到很多领域,如再生医学、组织工程支架、药物载体、食品包装和绿色纳米复合材料等[1-3]。因此,纳米纤维素的制备及应用成为国内外研究热点。
纳米纤维素基于制备方法和原料的不同可分为微纤化纤维素、纳米晶体纤维素和细菌纤维素[4-5]。纳米纤维素的制备方法主要有化学法、机械法和酶处理法等,不同原料以及不同方法制备的纳米纤维素的形态和性能各有差异[6-8]。本试验从我国南方的3种典型植物原料(大王椰、杧果树和榕树)提取了α-纤维素,并利用化学法中常用的硫酸水解法由3种原料的α-纤维素制备了纳米纤维素,对比了3种原料制备的纳米纤维素形貌及性能。
1 试 验
1.1材料与仪器
材料:大王椰、榕树和杧果树粉末;苯、乙醇、硫酸(H2SO4,98%)、氢氧化钠(NaOH)、溴化钠(NaBr)及次氯酸钠(NaClO,6%)等,均为分析纯。
仪器:透射电镜、傅里叶红外光谱仪、X射线衍射仪、热重分析仪等。
1.2试验方法
1.2.1α-纤维素的制备
将一定量的原料粉末用滤纸包裹,并放入索氏抽提器进行苯-乙醇(液比为2∶1)抽提6 h,抽提完风干。将风干样放入综纤维素反应瓶中并加入一定比例的蒸馏水、亚氯酸钠和冰醋酸,在75 ℃ 水浴锅中进行脱木素数次直至纤维变白为止,然后进行过滤洗涤,直至中性。将风干的综纤维素先后用17.5%和9.5%氢氧化钠浸渍一定时间,然后进行洗涤得到α-纤维素[9]。
1.2.2酸水解制备纳米纤维素
将5 g α-纤维素与45 mL质量分数64%的硫酸混合,在三口烧瓶中进行机械搅拌(500 r/min),温度45 ℃,时间90 min。反应完成后,向混合物中加入500 mL去离子水终止水解反应,将反应产物进行高速离心(10 000 r/min,15 min)洗涤,倒去上清液,加入去离子水重复离心至上清液pH约为2,最后用去离子水透析至中性,得到的纤维素悬浮液再进行细胞粉碎机粉碎[10]。将最后得到的悬浮液在4 ℃环境下保存,并取一定量的悬浮液在-50 ℃冷冻干燥48 h后成固体样品。
1.2.3纳米纤维素粒径和表面电荷
样品质量分数为0.1%,分散剂为水,折射率1.47,色散折射率为1.33,温度25 ℃,将纳米纤维素悬浮液的pH调节到7,放在比色皿中用Zetasizer Nano ZS 仪器分析,进而表示悬浮液的稳定性。
1.2.4透射电镜分析(TEM)
将纳米纤维素样品稀释到0.01%,然后分散均匀。吸取稀释后的溶液10 μL,滴在碳膜铜网(200目)上,多余液体用干净的滤纸吸走。几分钟后,吸取3%磷钨酸染色剂(pH 7) 10 μL,滴在铜网上负染数分钟,用干净滤纸吸走遗漏液体,烘干过夜。在80 kV加速电压条件下进行TEM观察,每个试样选取多点进行观察。
1.2.5产率分析
冻干后的纳米纤维素样品放入已经称量过的培养皿中,50 ℃真空干燥至恒重,取出后在干燥器内冷却30 min,计算产率。
w=(m1-m2)/m3×100%
式中:w为纳米纤维素的产率,%;m1为真空干燥后的纳米纤维素与培养皿质量,g;m2为培养皿质量,g;m3为纤维素原料质量(绝干质量),g。
1.2.6红外光谱分析(FT-IR)
用傅里叶红外光谱仪观察样品的FT-IR谱图,测量波长范围4 000~500 cm-1。
1.2.7X射线衍射分析(XRD)
实验条件:铜靶,40 kV,40 mA,扫描范围10°~40°,扫描步长0.04°,扫描速度1°/min。纤维结晶度:

1.2.8热重分析(TG)
测试条件:氮气气氛,升温速率10 ℃/min,温度范围30~600 ℃。
2 结果与讨论
2.1纳米纤维素产率、Zeta电位
植物纤维原料无定形区分子间氢键较弱,没有形成紧密结构,容易受到酸的进攻而发生糖苷键的断裂[11]。硫酸水解制备纳米纤维素的过程就是去除无定形区纤维素,获得结晶区纤维素,具有纳米尺寸,即称为纳米纤维素。对大王椰、杧果树、榕树3种纤维进行酸解处理制备纳米纤维素,发现大王椰相对于杧果树和榕树相比产率较高,达到29.7%,而榕树产率为24.3%,杧果树产率最少,仅有20.4%。结果表明从大王椰、杧果树、榕树3种α-纤维素硫酸水解制备的纳米纤维素,大王椰相对于杧果树和榕树相比产率较高,达到29.7%,榕树产率为24.3%,杧果树产率仅有20.4%。可能大王椰纤维的密度较大,酸进攻较难,纤维素结晶保持较多,因此得率高。
硫酸水解后的纳米纤维素表面具有硫酸酯基,带负电荷,测定Zeta点位为负值。因此Zeta电位大小可以表示溶液稳定性, Zeta电位在-15~15 mV,胶体就会有絮聚现象发生,当Zeta电位绝对值大于15 mV时,电荷之间的相互排斥力使粒子更稳定[12]。如表1所示,榕树和杧果树制备的纳米纤维素悬浮液Zeta电位分别为-37.8 和-32.9 mV,而大王椰Zeta电位为-25.7 mV,它们的绝对值均大于 15 mV,因此制备出的纳米纤维素具有较好的稳定性。

表1 纳米纤维素产率和Zeta电位
2.2纳米纤维素表面形貌分析
通过扫描电镜对大王椰、榕树和杧果树纳米纤维素(图1)进行观察可知,经过酸水解后,3种原料制备的纳米纤维素都是两边窄、中间宽的针状纳米晶须结构,单根纤维随机分布,而且无序地交错搭接,部分纤维之间发生团聚或缠绕,整体分布较均匀。硫酸水解过程中,结晶纤维素表面有硫酯基,使得纳米纤维素粒子间存在静电斥力的作用,因此3种纳米纤维素都呈现出较好的分散性。SEM谱图能够看到单根纤维的形态,但是在制备样品前需要镀上一层金层,因此观察到的图像不能精确地表示纳米纤维素的长度和宽度,因此需要用TEM观察纳米纤维素的表面形貌。3种纳米纤维素的TEM形貌如图2所示,纳米纤维素因为浓度较大,样品中存在均匀分布球形颗粒杂质但对于观察纤维的长度和宽度并无影响。单根纤维聚集在一起成为纤维束,但是仍能够观察到单根纤维的长度和直径。大王椰纳米纤维素的直径主要分布在4~10 nm,长度主要分布在60~300 nm。榕树的直径在3~10 nm,长度在70~300 nm。杧果树的直径在3~8 nm,纤维长度分布在60~120 nm。综合可知,3种原料经过酸水解之后,单根纤维的直径并无较大区别,都在10 nm之内,而纤维的长度分布有一定的区别。但总体来说,不同原料酸解得到的纳米纤维素区别不大。纳米纤维素的长度对悬浮液的性质有影响,而且对纳米纤维素基材料的功能及应用也有较大的影响[13]。
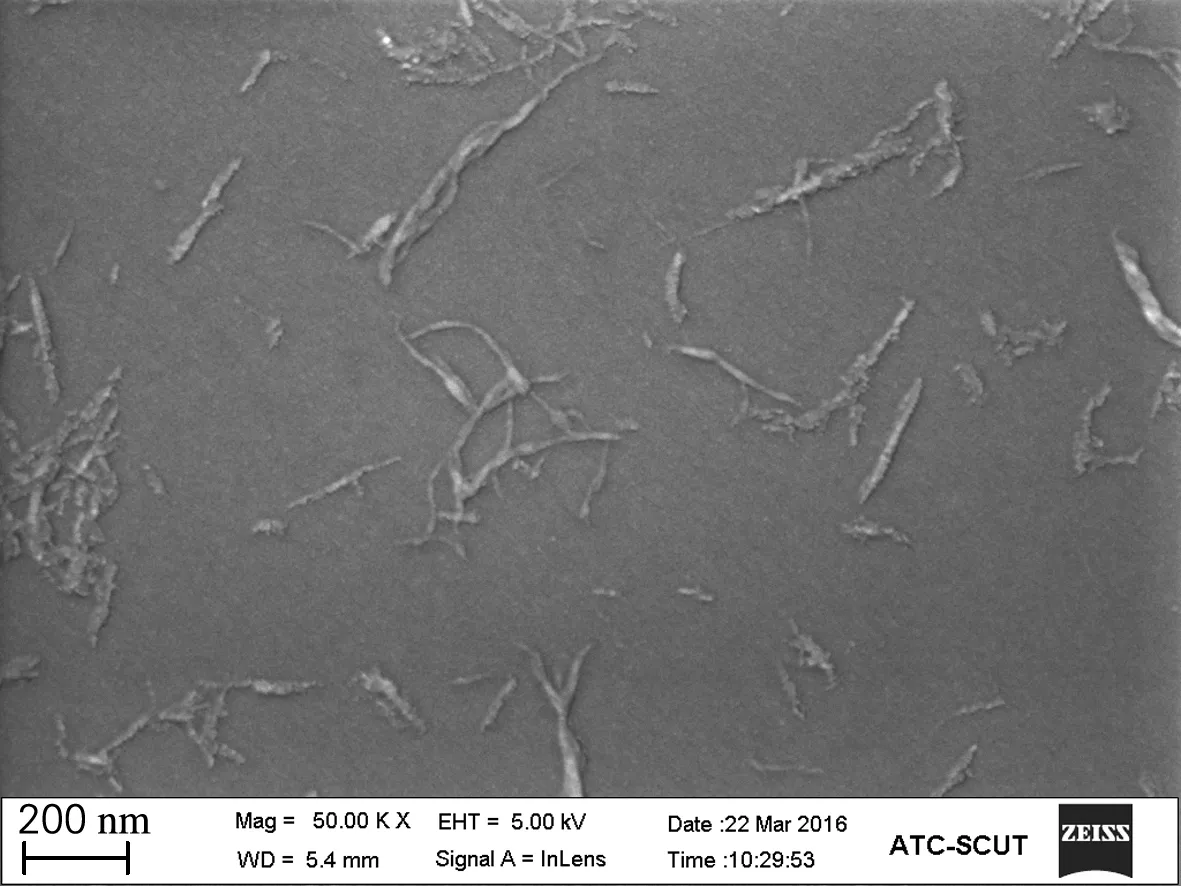
(a) 大王椰 (b) 榕树 (c) 杧果树

(a) 大王椰 (b) 榕树 (c) 杧果树
2.3纳米纤维素的粒径分析
用HORIBA Nano Particle Analyzer SZ-100 测得每种纳米纤维素的粒径如图3所示。大王椰纳米纤维素的粒径分布较广,40~500 nm分布较宽,其中在60和250 nm两个范围的粒径比例较大。同样,榕树纳米纤维素的粒径分布范围也比较大,50~400 nm有一定的分布,分别在70和250 nm 处呈现出两个区域的集中分布。也就是说,两种纳米纤维素悬浮液存在两种粒子,一种较短(60~70 nm),一种较长(250 nm)。而杧果树纳米纤维素的粒径分布范围相对于大王椰纳米纤维素和榕树纳米纤维素长度分布较窄,分布在50~140 nm,主要集中在80 nm。分析发现,同样酸解条件,杧果树纤维制备的纳米纤维素粒径和长度均相对较小,可能是由于该树的纤维较细,在酸解时被切断和降解严重所致。
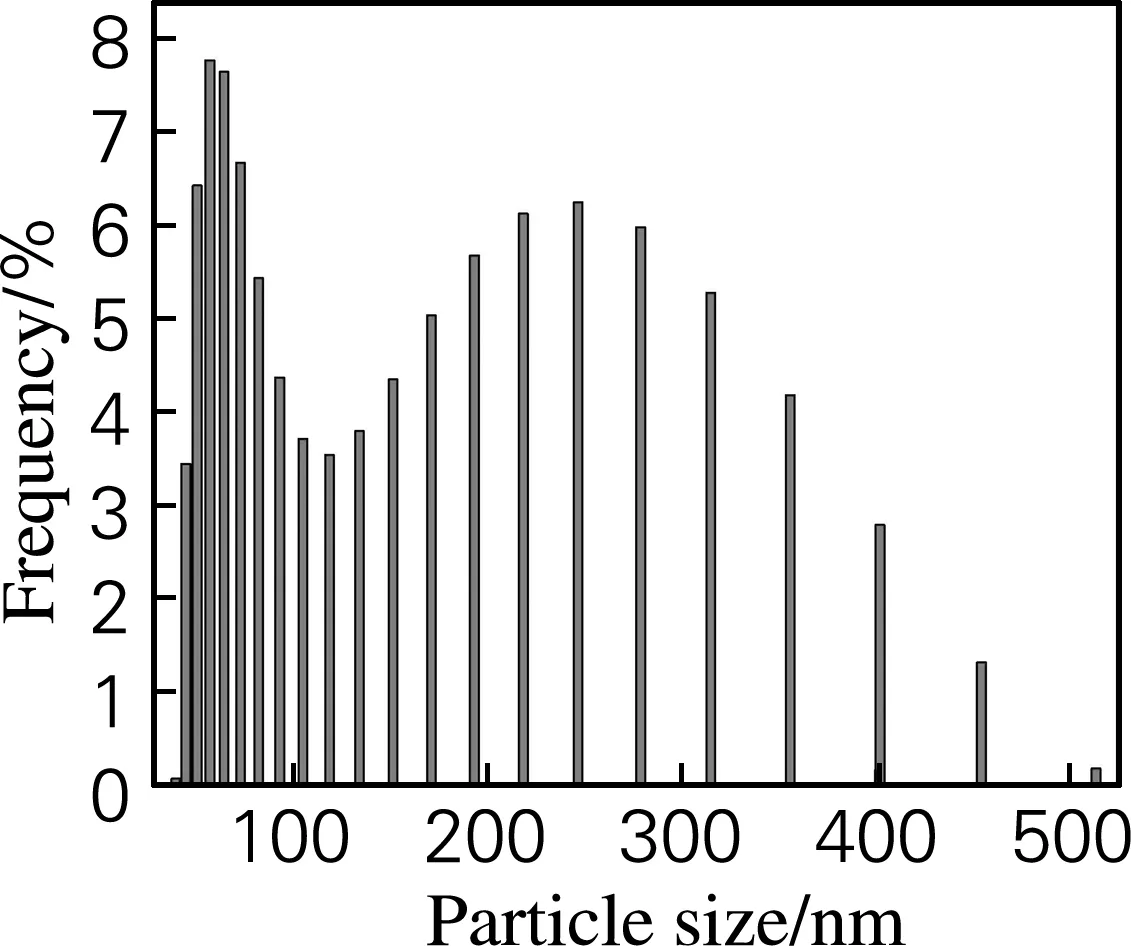
(a) 大王椰 (b) 榕树 (c) 杧果树
2.4纳米纤维素结晶度分析
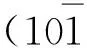
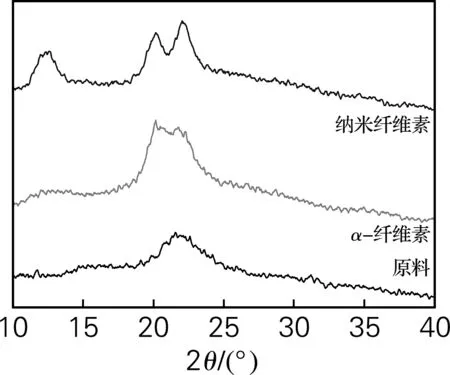
(a) 大王椰 (b) 榕树 (c) 杧果树
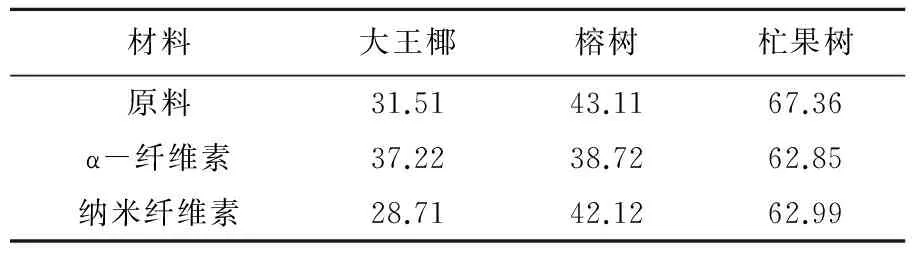
表2 原浆和纳米纤维素的结晶度
2.5化学结构分析
大王椰、榕树和杧果树α-纤维素及其纳米纤维素进行FT-IR扫描,对制备纳米纤维素前后的化学基团进行分析。从图5中可以看出,3种α-纤维素在经过酸水解前后的吸收峰没有发生变化,比如在3 600~3 200 cm-1—OH的伸展振动峰,1 640 cm-1处—OH的变形振动峰,以及在1 247 cm-1处C6的C—OH变形振动峰和897 cm-1处纤维素中β-糖苷键的特征吸收峰。在3 800~3 000 cm-1的O—H特征峰变窄,是因为纳米纤维素内氧键的缔合作用增强。因此,3种α-纤维素在硫酸水解制备纳米纤维素后保持了较完整的化学结构。
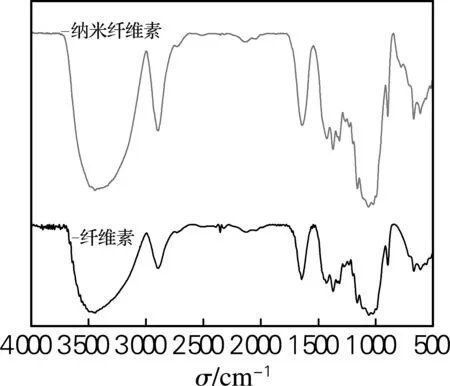
(a) 大王椰 (b) 榕树 (c) 杧果树
2.6热性能分析
从3种原料的TG曲线(图6)中可以看出,大王椰、榕树和杧果树原料在加热过程中表现出一步热降解过程,而酸水解制备的大王椰、榕树和杧果树纳米纤维素呈现出两步热降解过程。纤维素热降解主要有以下几个阶段:第一阶段,主要是纤维素的物理吸水解吸的过程,一般温度在150 ℃ 以下,同时3种原料制备的纳米纤维素失重较α-纤维素多,这是因为纳米纤维素具有更强的吸水性。第二阶段,温度范围在150~260 ℃,大王椰、榕树和杧果树原料的TG曲线都成一个水平线,主要是纤维素大分子的一个缓慢活化和解聚的过程,这一过程会有少量的失重。大王椰、榕树和杧果树纳米纤维素在该阶段出现了降解峰,主要是由纳米纤维素表面的硫酯基在较低温度下催化直接接触的纤维素链单元,是一种酸催化热解过程[15],同时大王椰、榕树和杧果树α-纤维素开始降解。第三阶段,在260~400 ℃,3种原料及其酸水解制备的纳米纤维素都出现一个热降解过程,也是纤维素材料的主要降解阶段,纤维素结构分解成各种挥发物质和小分子的气体[16]。第四阶段,在400 ℃之后,纤维素降解已基本完成,反应残留物分解成分子质量相对较低的气体,还有炭残余物和焦炭的生成。根据TG和DTG曲线可知,α-纤维素的稳定性由低到高依次为大王椰、杧果树、榕树,而纳米纤维素的热降解峰没有一定的规律,大王椰纳米纤维素的第一个降解峰最低,而第二个降解峰温度较高,榕树纳米纤维素的两个降解峰温度相差较小,整体表现出稳定性较低,杧果树纳米纤维素的第一个峰较高,综合得出热稳定性由高到低依次为杧果树纳米纤维素、大王椰纳米纤维素、榕树纳米纤维素。

(a) 大王椰
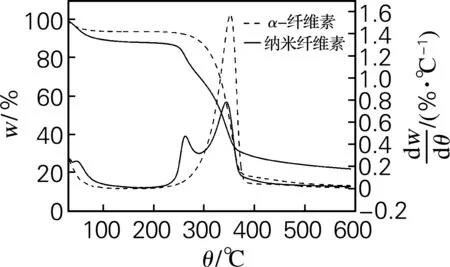
(b) 榕树
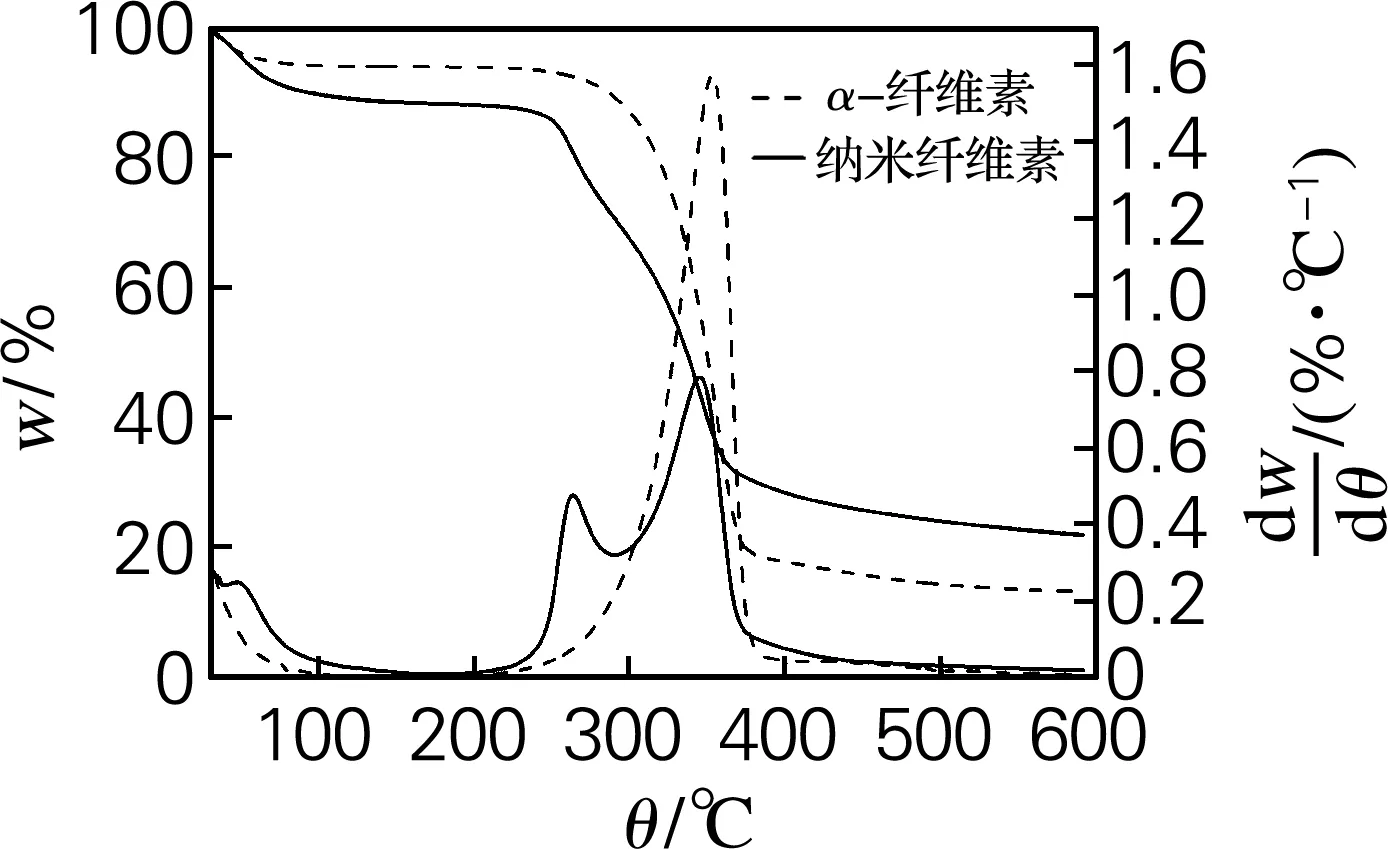
(c) 杧果树
图6原料及其纳米纤维素的TG和DTG曲线
Fig.6TG and DTG curves of raw materials and nanocellulose
3 结 论
大王椰、榕树和杧果树为原料提取α-纤维素,经过硫酸水解成功制备了纳米纤维素。大王椰、杧果树和榕树经硫酸水解制备的纳米纤维素均为棒状纳米晶体,大王椰纳米纤维素直径在4~10 nm,纤维长度在5~400 nm;杧果树纳米纤维素直径在3~8 nm,纤维长度分布在60~120 nm;榕树纳米纤维素的直径在3~10 nm,纤维长度在50~350 nm。
重量分析法测定大王椰纳米纤维素的得率为29.6%,榕树纳米纤维素得率为24.3%,杧果树纳米纤维素的得率为20.4%。Zeta电位表明大王椰纳米纤维素、杧果树纳米纤维素和榕树纳米纤维素溶液都是相对稳定的胶体溶液。
大王椰、杧果树和榕树α-纤维素经酸水解后得到纳米纤维素的化学结构没有发生改变。XRD分析表明,3种原料经过丝光化处理的纤维素都符合纤维素Ⅱ型晶体结构,酸水解后得到的纳米纤维素仍保留了纤维素Ⅱ型结构,纤维素的结晶度有较大的增加。热重分析结果表明,大王椰、杧果树和榕树α-纤维素的热稳定性大于相应硫酸水解制备的纳米纤维素。研究结果为南方植物纤维原料制备纳米纤维素提供了理论指导。
[1] KLEMM D, KRAMER F, MORITZ S, et al. Nanocelluloses: a new family of nature-based materials[J]. Angewandte Chemie International Edition, 2011, 50(24): 5438-5466.
[2] DENG H B, ZHOU X, WANG X Y, et al. Layer-by-layer structured polysaccharides film-coated cellulose nanofibrous mats for cell culture[J]. Carbohydrate Polymers, 2010, 80(2): 474-479.
[3] SACUI I A, NIEUWENDAAL R C, BURNETT D J, et al. Comparison of the properties of cellulose nanocrystals and cellulose nanofibrils isolated from bacteria, tunicate, and wood processed using acid, enzymatic, mechanical, and oxidative methods[J]. ACS Applied Materials and Interfaces, 2014, 6(9): 6127-6138.
[4] SIRO I, PLACKETT D. Microfibrillated cellulose and new nanocomposite materials: a review[J]. Cellulose, 2010, 17(3): 459-494.
[5] BRINCHI L, COTANA F, FORTUNATI E, et al. Production of nanocrystalline cellulose from lignocellulosic biomass: technology and applications[J]. Carbohydrate Polymers, 2013, 94(1): 154-169.
[6] CHIRAYIL C J, JOY J, MATHEW L, et al. Isolation and characterization of cellulose nanofibrils fromHelicteresisoraplant[J]. Industrial Crops and Products, 2014, 59: 27-34.
[7] MATHEW A P, OKSMAN K, KARIM Z, et al. Process scale up and characterization of wood cellulose nanocrystals hydrolysed using bioethanol pilot plant[J]. Industrial Crops and Products, 2014, 58: 212-219.
[8] LIN J Y, YU L B, TIAN F, et al. Cellulose nanofibrils aerogels generated from jute fibers[J]. Carbohydrate Polymers, 2014, 109: 35-43.
[9] 石淑兰,何福望.制浆造纸分析与检测[M].北京:中国轻工业出版社,2003.
[10] TIAN C, FU S Y, CHEN J H, et al. Graft polymerization of ε-caprolactone to cellulose nanocrystals and optimization of grafting conditions utilizing a response surface methodology[J]. Nordic Pulp and Paper Research Journal, 2014, 29: 58-68.
[11] MONTANARI S, ROUMANI M, HEUX L, et al. Topochemistry of carboxylated cellulose nanocrystals resulting from TEMPO-mediated oxidation[J]. Macromolecules, 2005, 38(5): 1665-1671.
[12] KHOURI S. Experimental characterization and theoretical calculations of responsive polymeric systems[D]. Waterloo: University of Waterloo, 2010.
[13] FUKUZUMI H, SAITO T, ISOGAI A. Influence of TEMPO-oxidized cellulose nanofibril length on film properties[J]. Carbohydrate Polymers, 2013, 93(1): 172-177.
[14] DONG X M, REVOL J F, GRAY D G. Effect of microcrystallite preparation conditions on the formation of colloid crystals of cellulose[J]. Cellulose, 1998, 5(1): 19-32.
[15] WANG N, DING E Y, CHENG R S. Thermal degradation behaviors of spherical cellulose nanocrystals with sulfate groups[J]. Polymer, 2007, 48(12): 3486-3493.
[16] SHEN D K, GU S. The mechanism for thermal decomposition of cellulose and its main products[J]. Bioresource Technology, 2009, 100(24): 6496-6504.
Preparation of nanocellulose from three typical plants in the south area
XUWeiyu,FUShiyu,PENGYangyang,LIUHao
( State Key Laboratory of Pulp and Paper Engineering, South China University of Technology, Guangzhou 510640, China )
Theα-cellulosesextractedfromtypicalsouthernplantsourcesofpalmsheaths,mangotreeandbanyantreewereusedtopreparenanocellulosesbyhydrolyzingwithsulfuricacid.Theresultsindicatedthatthelengthofnanocellulosesfrompalmsheaths,banyantreeandmangotreeweremainlyinrangeof50-400, 50-350,and60-120nm,respectively,anddescendingorderofnanocellulosesthermalstabilitywereasfollows:mangotree,palmsheath,banyantree.Themainchemicalstructureofnanocellulosesandα-cellulosesfrompalmsheaths,mangotreeandbanyandidnotchange.XdiffractionanalysisshowedthatthecrystalstructureofcelluloseⅡwasmaintained,andthecrystallinityofnanocellulosesincreasedsomeextentafteramorphouscelluloseremovedbyacid.
nanocelluloses; royal palm residue; banyan tree; mango tree; acid hydrolysis
2016-06-23.
广东省自然科学基金资助重点项目(2014A030311030).
徐威宇(1989-),男,硕士研究生;通信作者:付时雨(1963-),男,教授.
TS721.1
A
1674-1404(2016)05-0347-06
徐威宇,付时雨,彭洋洋,刘浩.南方典型植物原料制备纳米纤维素[J].大连工业大学学报,2016,35(5):347-352.
XU Weiyu, FU Shiyu, PENG Yangyang, LIU Hao. Preparation of nanocellulose from three typical plants in the south area[J]. Journal of Dalian Polytechnic University, 2016, 35(5): 347-352.

