海洋细菌Vibrioagarivorans-1产琼胶酶培养基优化及其酶学性质
修 爽, 贾 馨 媛,祖国仁
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
海洋细菌Vibrioagarivorans-1产琼胶酶培养基优化及其酶学性质
修 爽,贾 馨 媛,祖国仁
( 大连工业大学 生物工程学院, 辽宁 大连116034 )
以琼胶酶的酶活力为指标,对海洋细菌Vibrioagarivorans-1的培养基组分进行优化,并研究琼胶酶粗酶液的酶学性质。通过单因素和正交试验对海洋细菌Vibrioagarivorans-1的培养条件进行优化,结果表明最佳营养组分为: 酵母膏的质量浓度为12 g/L,琼脂粉质量浓度为3 g/L,NaCl质量浓度为45 g/L,在该条件下酶活力达到7.689 U/g。其粗酶液的最适反应温度为40 ℃,最适反应pH为7,在pH范围为6~8的内酶活性较稳定,温度在20~40 ℃时酶的稳定性较好,但温度达到80 ℃基本失活。
琼胶酶;海洋细菌Vibrioagarivorans-1;酶学性质
0 引 言
琼胶酶能将琼胶多糖降解为琼胶寡糖,目前琼胶寡糖作为抗氧化剂、甜味填充剂等,被广泛用于抑制淀粉的老化、食品的防腐等方面[1]。琼胶酶是一种重要的酶工具,用于制备海藻的多糖结构或单细胞以及其原生质体。琼胶酶具有专一性,并且能够切断特定链的特定位置,可用于制备低聚糖,α-琼胶酶降解琼脂糖结构中的α-L-1,3糖苷键,产生以3,6-内醚-L-半乳糖为还原端的琼胶寡糖;β-琼胶酶降解琼脂糖结构中的β-D-l,4-糖苷键,产生以D-半乳糖为还原端的新琼胶寡糖[2]。其降解流程容易于控制,反应条件较温和,对于环境污染小,目前有报道对于双歧杆菌的生长琼胶寡糖能起到促进作用,并能清除自由基等生理功能[3-4]。
我国对于海洋细菌产琼胶酶菌株的研究还很少报道,目前大部分的文献显示研究还在产酶菌株的筛选、酶的制备纯化与性质分析及酶的应用等初级阶段,由于目前还没筛选出高效的产酶菌株,无法进行大规模发酵生产[5]。因此,优化高产琼胶酶产生菌培养基有重要的理论意义和应用价值,本实验对产琼胶酶海洋细菌Vibrioagarivorans-1发酵培养基进行优化及酶学性质研究,以期为琼胶酶的深入研究及开发应用提供基础。
1 材料与方法
1.1材料
1.1.1菌种
海洋细菌Vibrioagarivorans-1,大连黑石礁附近海域的江篱中分离得到,本实验室保藏。
1.1.2培养基
液体种子培养基(g/L):酵母膏 10,CaCl20.5,NaCl 25,K2HPO41.0,FeSO40.3,FePO41.0,蛋白胨5.0,pH 7.2。
液体发酵培养基(g/L):蛋白胨 5.0,CaCl20.5,酵母膏10.0,FePO41.0,K2HPO41.0,琼脂粉 2.0,FeSO40.3,NaCl 25,pH 7.2。
试管斜面培养基(2216培养基) (g/L):酵母膏1.0,蛋白胨5.0,琼脂粉20,磷酸铁0.1,海水1.0 L,pH 7.2。
1.2方法
1.2.1DNS配制方法
溶液Ⅰ:取10%的NaOH溶液15.2 mL,加入6.8 g 结晶苯酚,将溶液稀释至70 mL,并加入6.9 g的NaHSO3。
溶液Ⅱ:取10%的NaOH溶液300 mL,加入255 g的酒石酸钾钠,继续加入880 mL、1%的3,5-二硝基水杨酸溶液。
将溶液Ⅰ与溶液Ⅱ混合均匀,得到的混合溶液放在避光处7~10 d后使用[6]。
1.2.2酶活力测定方法
分别向试管中加入1 mL的发酵溶液和1 mL 0.2%的H3PO4缓冲溶液,在40 ℃恒温条件下水浴30 min,向处理后的溶液中加入2 mL DNS,将试管置于沸水中10 min,在25 mL的定容管定容,8 000 r/min离心10 min,取离心后的上清液在540 nm处测OD值。
酶活力定义:1 mL酶液1 min产1 μg还原糖定义为一个活力单位。
1.2.3培养基组分优化
研究酵母膏、琼脂粉、NaCl质量浓度3个因素对产酶的影响。在单因素试验的基础上进行三因素三水平正交试验,确定最佳产酶培养基组分。
1.2.4琼胶酶酶学性质
通过优化后的培养基组分发酵产酶24 h后得到的粗酶液。
1.2.4.1最适反应温度
将琼胶酶粗酶液分别于20、30、40、50、60、70、80 ℃反应,测定酶活力,确定琼胶酶粗酶液的最适反应温度。
1.2.4.2最适pH
分别用pH 4~10的缓冲液配制0.2%的琼脂底物,在40 ℃条件下测定酶活力,确定琼胶酶粗酶液的最适反应pH。
1.2.4.3酶的热稳定性
将酶液分别在20、30、40、50、60、70、80 ℃下保温l h,冷却后测粗酶液残余的相对酶活力。
1.2.4.4酶的pH稳定性
将琼胶酶粗酶液分别用pH为4~10的缓冲溶液进行稀释,在42 ℃的水浴锅中放置4 h,测定琼胶酶的相对酶活力。
2 结果与讨论
2.1琼脂粉质量浓度对琼胶酶酶活力的影响
将琼脂粉质量浓度分别为1、2、3、4、5、6 g/L的培养基在30 ℃、160 r/min条件下培养24 h,分别测定琼胶酶活力,结果见图1。由图1可知,当琼脂粉质量浓度达到3 g/L时,酶活力最高值为5.83 U/g,琼胶质量浓度继续升高,酶活力反而降低。
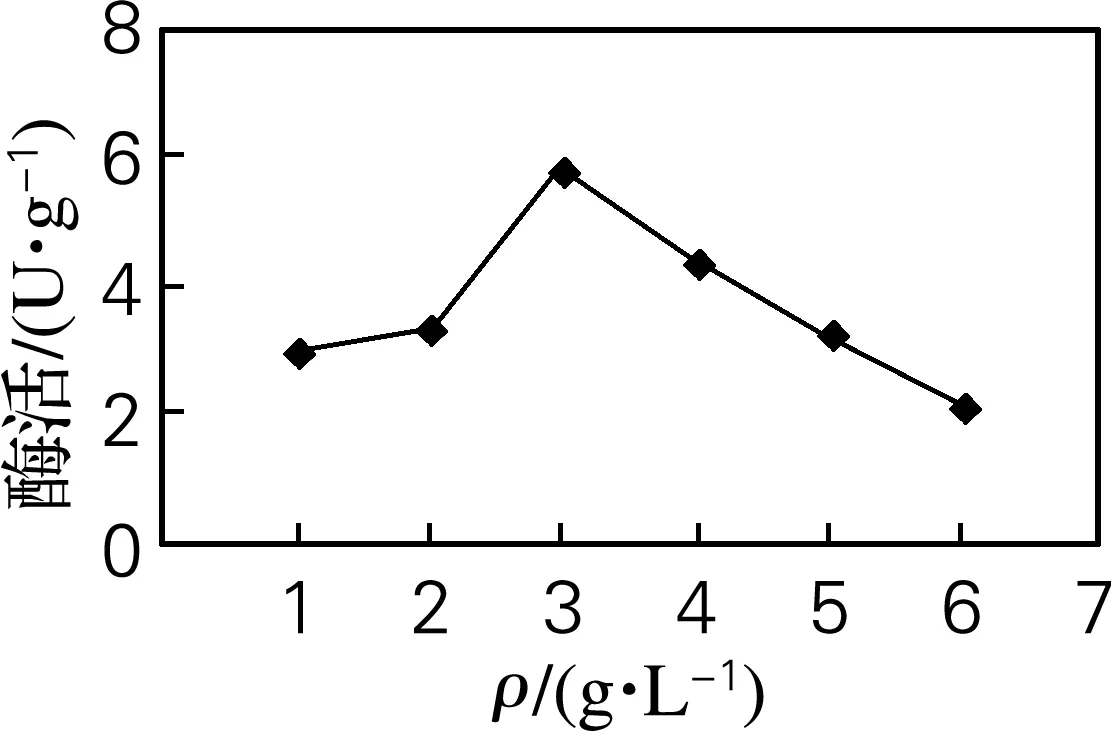
图1 琼脂粉质量浓度对琼胶酶酶活力的影响
2.2NaCl质量浓度对琼胶酶酶活力的影响
配制NaCl质量浓度分别为15、25、35、45、55、65 g/L,琼脂粉质量浓度为3 g/L的液体发酵培养基。28 ℃、150 r/min摇床培养箱中恒温培养24 h,分别测定琼胶酶酶活力,结果见图2。由图2可知,当NaCl质量浓度达到45 g/L时,酶活力最高值为6.58 U/g。NaCl质量浓度继续升高,酶活力反而降低,

图2 NaCl质量浓度对琼胶酶酶活力的影响
2.3酵母膏质量浓度对琼胶酶酶活力的影响
配制酵母膏质量浓度分别为6、8、10、12、14、16 g/L,琼脂粉质量浓度为3 g/L、NaCl质量浓度为45 g/L的液体发酵培养基,将培养基放在28 ℃、150 r/min摇床培养箱中恒温培养24 h,分别测定琼胶酶酶活力,结果见图3。由图3可知,当酵母膏质量浓度达到12 g/L时,酶活力最高值为6.910 U/g。酵母膏质量浓度继续升高,酶活力反而降低。

图3 酵母膏质量浓度对琼胶酶酶活力的影响
2.4正交试验
在单因素的基础上,对琼脂粉质量浓度、NaCl质量浓度、酵母膏质量浓度进行优化,故采用L9(34)正交试验(表1),试验结果见表2。由表2可知,各因素对琼胶酶活力的影响顺序为A,B,C,其最优培养基条件为A2B2C2,即琼脂粉质量浓度3 g/L,NaCl质量浓度45 g/L,酵母膏质量浓度12 g/L,此条件下所得琼胶酶活力为7.689 U/g。
2.5琼胶酶酶学性质
2.5.1最适pH
从图4中可以看出,pH为7时酶活力最高,但随着pH的升高酶活力逐渐下降,因此确定酶的最适反应pH为7。
表1正交试验因素和水平
Tab.1Factors and levels of orthogonal experiment
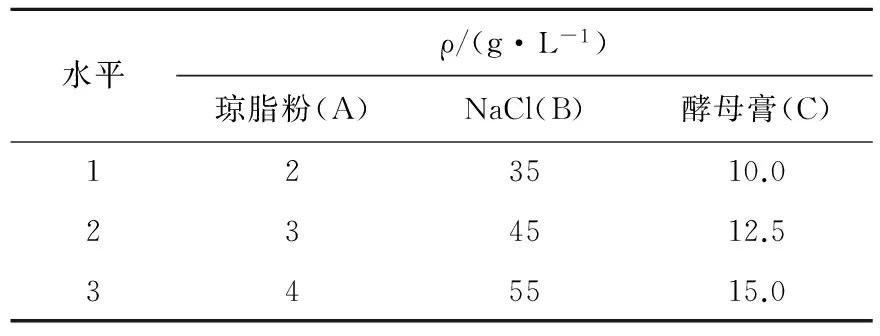
水平ρ/(g·L-1)琼脂粉(A)NaCl(B)酵母膏(C)123510.0234512.5345515.0
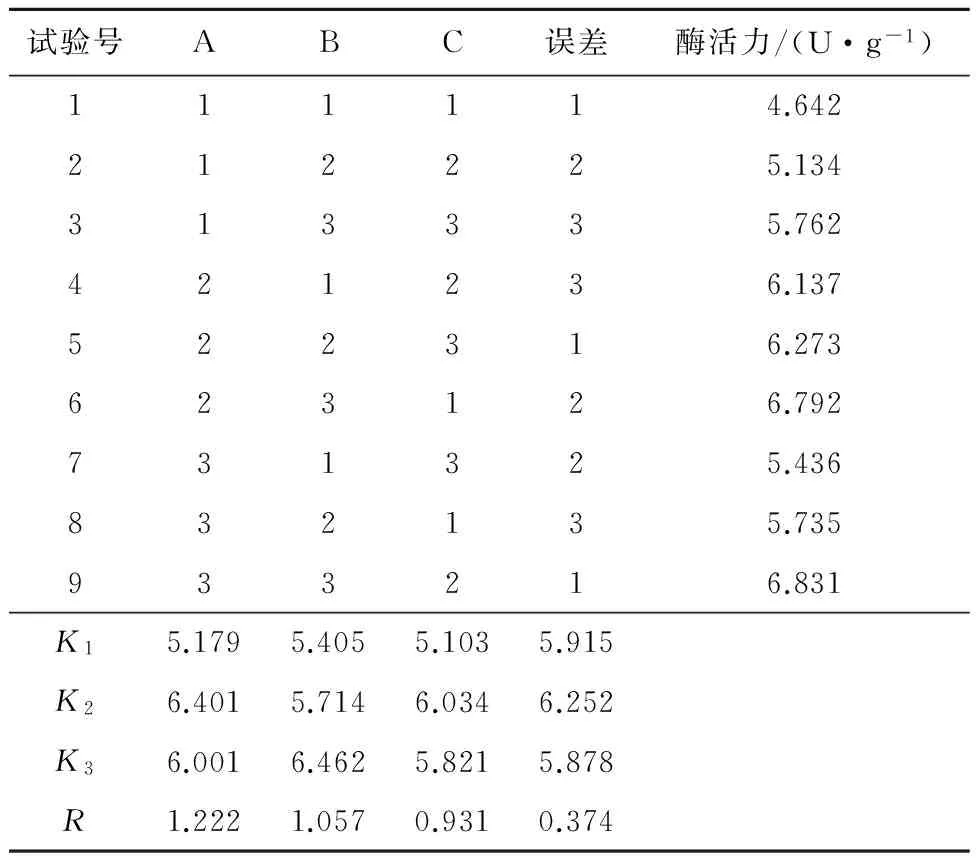
表2 发酵培养基正交试验结果

图4 酶的最适反应pH
2.5.2最适反应温度
从图5中可以看出,琼胶酶的最适反应温度为40 ℃,当温度超过40 ℃时酶活力逐渐下降,当温度达到80 ℃以上时琼胶酶基本失活。
2.5.3酶的pH稳定性
从图6可以看出,pH在6~8,相对酶活力达80%以上,低于或高于此范围相对酶活力将迅速下降。
2.5.4酶的热稳定性
从图7可以看出,琼胶酶在20~40 ℃保温1 h,相对酶活力在80%以上,酶活稳定性较好,温度逐渐升高,相对酶活力逐渐下降,温度达到80 ℃时基本失活。因此该酶在40 ℃以下时酶活稳定。
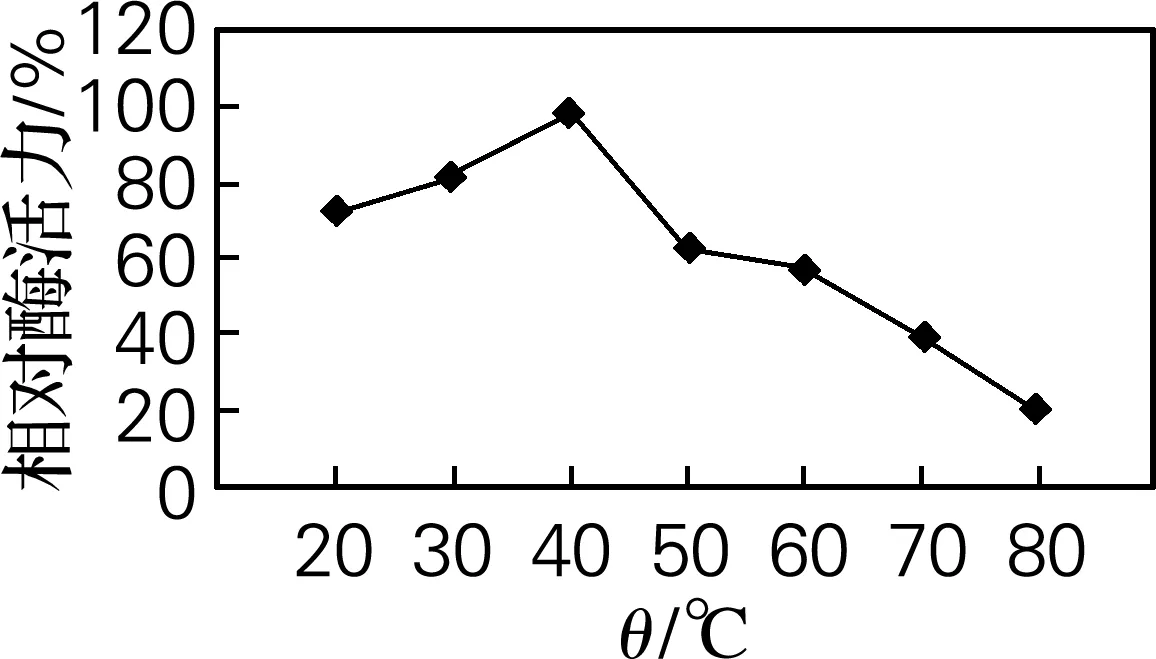
图5 酶的最适反应温度

图6 酶液的pH稳定性

图7 酶的热稳定性
3 结 论
通过单因素试验和正交试验确定产琼胶酶菌最优培养基组分为:NaCl质量浓度45 g/L,琼脂粉质量浓度3 g/L,酵母膏质量浓度12 g/L,此条件下酶活力达到7.689 U/g。初步研究了琼胶酶的酶学性质,该菌株所产的琼胶酶最适反应温度为40 ℃,最适反应pH为7,在pH 6~8酶活性较稳定,温度在20~40 ℃时酶活性稳定性较好,温度达到80 ℃基本失活。
[1] 刘江涛,蔡俊鹏,吴冰.琼胶酶及其综合应用的研究概况[J].现代食品科技,2005,21(1):177-179.
[2] VERA J, ALVAREZ R, MURANO E, et al. Identification of a marine agarolyticPseudoalteromonasisolate and characterization of its extracellular agarase[J]. Applied and Environmental Microbiology, 1998, 64(11): 4378-4383.
[3] FLORIAN W, CHRISTOPHE W, BERNAR K, et al. Structure-activity relationships of oligoagar elicitors towardsGracilariaconferta(Rhodophyta)[J]. Journal of Phycology, 2001, 37(3): 418-426.
[4] GU Y S. Determination methods of enzymatic activities of pectinase as a biologic additive in textile[J]. Textile Research Journal, 2002(3): 29-35.
[5] 汤海青.高产琼胶酶菌株的选育和产酶的研究[D]. 青岛:中国海洋大学,2004.
[6] IMOTO T, YEGISHITA K. A simple activity measurement of lysozyme[J]. Agricultural and Biological Chemistry, 1971, 35: 1154-1156.
Fermentation medium optimization of marine microorganisms producing agarase and its zymology properties
XIU Shuang, JIZ xinyuan,ZU guoren
( School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China )
ThecomponentsofliquidfermentationmediumofmarinemicroorganismsVibrio agarivorans-1producingagarasewereoptimizedwiththeactivityofagaraseasindicatorsandtheenzymaticpropertiesofcrudeagarasesolutionwasstudied.ThecultureconditionsofthemarinemicroorganismsVibrio agarivorans-1wereoptimizedbysinglefactorandorthogonalexperiment.Theexperimentalresultindicatedthattheactivityofagarasereachedat7.689U/gastheconcentrationofagar,NaClandyeastextractwas3, 45and12g/L,respectively.Theoptimalreactiontemperatureforcrudeagarasewasat40 ℃,andtheoptimalpHwas7.TheactivityofagarasewasstablewhenpHwasintherangeof6-8andtheactivityofagarasewashigherinatemperaturerangeof20-40 ℃,buttheactivityofagaraselostat80 ℃.
agarase; marine microorganismsVibrioagarivorans-1; zymology properties
2015-03-29.
修 爽(1989-),女,硕士研究生.
TS201.6
A
1674-1404(2016)05-0328-04
修爽,贾馨媛,祖国仁.海洋细菌Vibrioagarivorans-1产琼胶酶培养基优化及其酶学性质[J].大连工业大学学报,2016,35(5):328-331.


