微生物除草剂禾长蠕孢菌孢子助剂筛选
张建萍,段桂芳,杨 爽,周勇军,陆永良,余柳青
(中国水稻研究所 水稻生物学国家重点实验室,浙江 杭州 310006)
微生物除草剂禾长蠕孢菌孢子助剂筛选
张建萍,段桂芳,杨 爽,周勇军,陆永良,余柳青
(中国水稻研究所 水稻生物学国家重点实验室,浙江 杭州 310006)
禾长蠕孢菌(Helminthosporiumgramineum)是一株杂草生防潜力菌,对稻田稗草有较强的致病作用,并对水稻等主要作物安全,其活性成分孢子有望开发成微生物除草剂产品。为此,文章以生物相容性、分散力和稳定性等评判指标开展了禾长蠕孢菌孢子助剂筛选研究。结果发现,SP-20为表面活性剂、大豆油为溶剂油、羧甲基纤维素钠为稳定剂时,与孢子的生物相容性较好,对菌丝生长和孢子萌发都没有显著抑制作用。且添加SP-20后,孢子悬浮液I值为0.094,对孢子粉的分散性最佳。添加羧甲基纤维素钠作为稳定剂时,拟合直线斜率最小,为0.232,因此稳定性最好。以上助剂筛选结果将为禾长蠕孢菌孢子制剂的开发及其应用奠定基础。
生物防治;稗草;真菌;表面活性剂;稳定剂;溶剂油
我国农田目前主要依赖化学除草剂进行杂草防控,在带来经济效益的同时,由于长期大量使用单一品种化学农药,已使生态平衡遭到严重破坏,还影响土壤中动物和微生物菌群的生长[1-3]。而微生物除草剂对生态系统相对安全,是一种比较好的补充和替代方式。
禾长蠕孢菌(Helminthosporiumgramineum)是从自然感病稗草上分离得到的杂草生防潜力菌,经研究发现,其对稗草、鸭舌草等稻田常见杂草有较强的致病性,并对水稻和环境安全,因而具有开发成优良微生物除草剂的潜力[4]。之前的主要利用方法是将有效成分真菌孢子直接释放到田间,通过病原菌感染杂草发病而达到除草效果,因此对环境的依赖度很高,容易受到外界环境,包括高温、紫外线、辐射等因子的影响而降低效率,甚至死亡[5-7]。
大部分化学除草剂都需要添加表面活性剂或其他助剂强化其田间应用效果和保存时间[8]。对微生物除草剂来说,添加助剂还能够降低孢子对结露期的依赖而提高其除草活性[9-11],有助于病原菌侵染叶片[12-14]。但是与化学农药制剂单一成分相比,微生物孢子类型众多,大小不一,且不溶于水,对助剂的相容性要求高。微生物孢子还会直接影响制剂的悬浮性、润湿性和分散性等物理性能,因此微生物孢子制剂加工难度更大。除此之外,还要考虑外界环境因素,诸如阳光、温度、湿度等,对微生物孢子活性的影响。因此,在筛选助剂时要考虑的因素很多,不仅包括与活体微生物的生物相容性、悬浮性、润湿性和分散性等物理性能,还要考虑添加某些特殊的助剂,如紫外防护剂、增效剂、促萌发剂等[15-17]。
本研究主要完成了表面活性剂、溶剂油、稳定剂的筛选研究,探讨了助剂对孢子活性的增效作用,为提高禾长蠕孢菌孢子的田间应用效果奠定基础。
1 材料与方法
1.1 供试菌株和种子
禾长蠕孢菌分离自自然感病稗草[4],保藏于中国水稻研究所。稗草种子和水稻秀水-09种子,采集于中国水稻研究所试验田,晒干后于-20 ℃冷冻保藏备用。
1.2 培养基
PDB培养基:去皮马铃薯20%,葡萄糖2%,蒸馏水。PDA培养基:PDB培养基添加1.7%琼脂粉。
1.3 菌种活化
将4 ℃斜面保存的禾长蠕孢菌转接到新鲜PDA培养基上,28 ℃黑暗培养7 d备用。
1.4 表面活性剂的筛选
1.4.1 不同表面活性剂对禾长蠕孢菌菌丝体生长及产孢量影响
分别配制含2%表面活性剂成分(蔗糖脂肪酸酯SE-11、脂肪醇聚氧乙烯醚MOA-7、烷基酚聚氧乙烯醚NP-9、烷基萘磺酸盐Morwet EFW、羟基聚环氧乙烷嵌段共聚物Ethylan NS-500LQ、Silwet L-77、山梨醇酐单月桂酸酯SP-20)的PDA筛选培养基。将直径5.5 mm活化禾长蠕孢菌菌块接种于培养基中央,28 ℃黑暗培养7 d后采用交叉测量法测定菌落直径,与不含表面活性剂成分的对照相比较,测定表面活性剂成分对真菌菌丝体生长的影响。继续培养至11 d,用血球计数板测定孢子产量,以不含表面活性剂的PDA为对照,比较不同表面活性剂对菌株产孢量的影响。每个处理重复3次,每个试验重复3次。
1.4.2 表面活性剂分散力的测定
将初筛获得对菌株生长和产孢量无明显抑制作用的3种表面活性剂,蔗糖脂肪酸酯SE-11、羟基聚环氧乙烷嵌段共聚物Ethylan NS-500LQ和山梨醇酐单月桂酸酯SP-20,分别配制成浓度为0.25%的溶液,称0.006 g真菌孢子粉置于其中充分混匀,立刻在上、中、下3层中取样,并于显微镜下计数孢子数量,测定表面活性剂的分散力。每个处理重复3次,每个试验重复3次。表面活性剂的分散力优良与否以分散指数(I)为指标进行评价。当I<1时,孢子均匀分布;当I=1时,孢子随机分布;当I>1时,孢子聚集分布。因此,当I<1时,I值越小,溶液的分散力越好。I值计算公式:
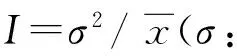
1.4.3 不同浓度SP-20对孢子萌发率的影响
分别称取0.03 g孢子粉与山梨醇酐单月桂酸酯SP-20,在研钵中轻轻研磨混合均匀,加水配制成浓度分别为0.01%,0.025%,0.05%,0.10%,0.25%和0.50%的SP-20溶液,室温保藏2周后,采用平板表面萌发法测定孢子萌发率。取1/3孢子粉混合物与10 mL无菌水混匀(孢子浓度约106mL-1),取样均匀涂布于PDA培养基上,4 h后取样镜检计算孢子萌发率,以不添加SP-20的孢子萌发率为对照。每个处理设3次重复。
1.5 溶剂油的筛选
1.5.1 溶剂油对真菌菌丝体生长及产孢量的影响
分别配制含5%溶剂油[大豆油(福临门一级大豆油,中粮东海粮油工业(张家港)有限公司)、菜籽油(金龙鱼精炼一级菜籽油,上海嘉里食品工业有限公司)、玉米油(金龙鱼植物甾醇玉米油,上海嘉里食品工业有限公司)、葵花籽油(鲁花浓香葵花籽油,内蒙古鲁花葵花籽油有限公司)]的PDA筛选培养基。以不含溶剂油的PDA培养基为空白对照。其余方法同表面活性剂测定1.4.1节。
1.5.2 溶剂油对孢子萌发率的影响
将0.03 g孢子粉分别与大豆油、玉米油、菜籽油和葵花籽油以2∶1(m/V)混匀,室温保藏2周后测定孢子萌发率。以不添加溶剂油的孢子萌发率为对照。测定方法同表面活性剂1.4.3节。
1.6 稳定剂的筛选
1.6.1 不同稳定剂对真菌菌丝体生长及产孢量的影响
在PDA培养基中分别添加0.5%的稳定剂:羧甲基纤维素钠、海藻酸钠、海藻酸钾,充分混匀,配制成含有不同稳定剂的筛选培养基。以不含稳定剂的PDA培养基为空白对照。其余方法同表面活性剂测定1.4.1节。
1.6.2 不同稳定剂的稳定性测定
将3种稳定剂羧甲基纤维素钠、海藻酸钠和海藻酸钾配制成浓度为0.2%的溶液,分别与0.03 g孢子粉混匀,放置0,1,5,15,30,45,60 min后,置于分光光度计中,在370 nm波长下,测定其透光度。分别以测定的透光度值拟合出一条直线,比较各稳定剂直线的斜率,筛选出稳定性最佳的稳定剂。
进而测定不同浓度下最佳稳定剂羧甲基纤维素钠对孢子悬浮率的影响。分别配制0.005%,0.01%,0.025%,0.05%,0.1%,0.25%的羧甲基纤维素钠溶液,参照《中华人民共和国国家标准——农药可湿性粉剂悬浮率测定方法》测定其孢子悬浮率。试验重复3次,每个处理重复3次。
1.6.3 不同浓度的羧甲基纤维素钠对孢子萌发率的影响
根据稳定剂的稳定性能,测试不同添加比率羧甲基纤维素钠对孢子萌发率的影响。分别称取0.03 g孢子粉与羧甲基纤维素钠混匀,配制成羧甲基纤维素钠浓度为0.005%,0.01%,0.025%,0.05%,0.10%,0.25%和0.50%的溶液,室温保藏2周,以不添加羧甲基纤维素钠处理作为对照,检测不同浓度稳定剂对孢子萌发率的影响,试验方法同1.4.3节。
1.7 数据统计
采用DPS数据处理系统进行统计分析[18]。
2 结果与分析
2.1 表面活性剂对菌丝体生长及孢子产量、分散力和萌发率的影响
真菌孢子大多数具有疏水特性,不易在水中润湿而漂浮于水面形成一层薄膜。因此,需要筛选分散性好且对孢子活性无抑制作用的表面活性剂,促进其在水溶液中的分散。在筛选的7种润湿性、分散性、乳化性均较好的非离子表面活性剂中,禾长蠕孢菌菌丝生长速率和产孢变化如图1所示。在SE-11和Ethylan NS-500LQ中,菌丝体生长速率与未处理对照无显著差异,而在Ethylan NS-500LQ和SP-20中孢子产量与未处理对照无差异,表明添加这些表面活性剂不会显著影响菌丝体的生长和产孢量。以此为依据,做了SE-11,Ethylan NS-500LQ和SP-20对孢子分散力的试验,结果表明:在0.25% Ethylan NS-500LQ溶液中孢子分散力(I值)大于1,达到3.94,孢子容易聚集成团分布,分散力较差。而在相同浓度的SP-20和SE-11溶液中,I值均小于1,且添加SP-20的I值为0.094,远小于添加SE-11的I值0.76,证明添加SP-20孢子粉的分散性最佳。不同浓度SP-20对孢子萌发率的影响实验发现,与不添加SP-20孢子萌发率33%相比,0.01%~0.50% SP-20添加量孢子萌发率在25%~36%之间,没有显著差异,表明添加0.01%~0.50% SP-20对孢子萌发没有显著影响。因此SP-20是较为理想的对孢子活性无显著负面影响的分散性能良好的表面活性剂。
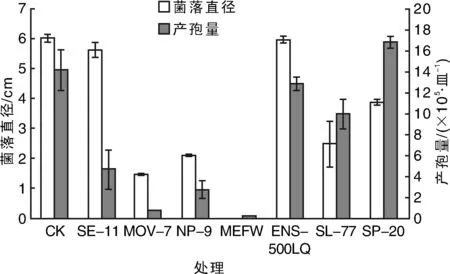
MEFW,ENS-500LQ和SL-77分别是MorwetEFW,EthylanNS-500LQ和SilwetL-77的缩写。图1 不同表面活性剂对禾长蠕孢菌菌丝生长及产孢的影响Fig.1 Effect of surfactant on mycelial growth and conidia production of Helminthosporium gramineum
2.2 溶剂油对禾长蠕孢菌菌丝生长、孢子产量和萌发率的影响
添加5%大豆油、菜籽油、玉米油和葵花籽油均对菌丝生长和产孢有显著促进作用(图2)。其中,添加大豆油处理菌丝生长和产孢量数值最高。室温条件下溶剂油对孢子萌发的影响研究发现:添加大豆油和菜籽油处理,孢子萌发率显著高于未处理对照CK(图3),表明大豆油和玉米油对孢子萌发有促进作用。而添加葵花籽油孢子几乎不萌发,表明葵花籽油会抑制孢子萌发。
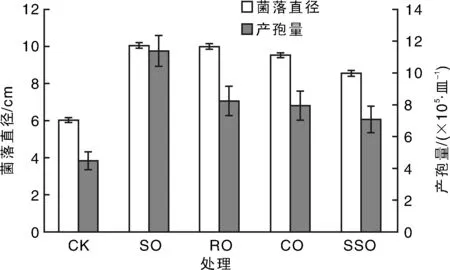
SO,RO,CO和SSO分别是大豆油、菜籽油、玉米油和葵花籽油的缩写。图3同。图2 不同溶剂油对禾长蠕孢菌菌丝生长及产孢的影响Fig.2 Effect of vegetable oil adjuvants on mycelial growth and conidia production of Helminthosporium gramineum
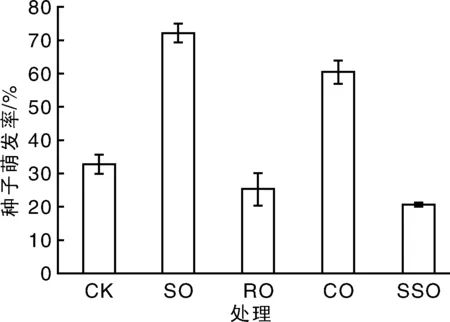
图3 不同溶剂油对孢子萌发率的影响Fig.3 Effects of vegetable oil adjuvant on germination rate of conidia
2.3 稳定剂对禾长蠕孢菌菌丝生长及孢子产量、悬浮率和萌发率的影响
由图4可见,3种稳定剂对菌丝生长影响均较小,但对产孢量影响有较大的波动。海藻酸钠能显著促进产孢,而海藻酸钾则对产孢有明显抑制作用,羧甲基纤维素钠与对照相比产孢量没有显著差异。对CK和3种稳定剂稳定性测试研究,拟合出4条直线:yCK=0.75x+33.41(R2=0.906),y海藻酸钾=0.499x+16.41(R2=0.974),y海藻酸钠=0.322x+7.149(R2=0.950),yCMC=0.232x+14.44(R2=0.976),其R值均大于0.9,表明拟合度均较好。其中,当羧甲基纤维素钠作为稳定剂时,直线斜率值最小,稳定性最好,其次为海藻酸钠和海藻酸钾。综合考虑对菌丝生长和产孢量的影响,选择羧甲基纤维素钠作为待试稳定剂。不同浓度羧甲基纤维素钠处理孢子后,悬浮率测定结果表明,随羧甲基纤维素钠浓度增加,孢子悬浮率逐渐升高。当羧甲基纤维素钠浓度大于0.05%时,孢子溶液的悬浮率均在60%以上(图5)。而不同浓度的羧甲基纤维素钠对孢子萌发率的影响研究发现,与不添加羧甲基纤维素钠处理孢子萌发率36%相比,添加0.005%~0.50%的羧甲基纤维素钠处理后对孢子萌发率在31%~49%之间,没有显著差异,表明添加羧甲基纤维素钠对孢子萌发率没有显著影响,其中0.05%羧甲基纤维素钠与孢子均匀混合2周后,孢子萌发率最高,达到49%。
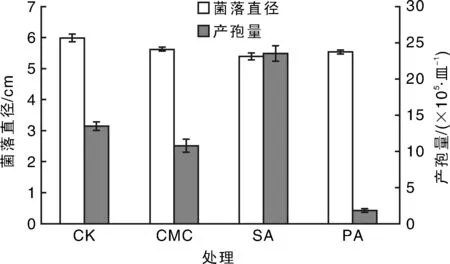
CMC,SA和PA分别是羧甲基纤维素钠、海藻酸钠和海藻酸钾的缩写。图4 不同稳定剂对禾长蠕孢菌菌丝生长及产孢的影响Fig.4 Effect of stabilizer on mycelial growth and conidia production of Helminthosporium gramineum
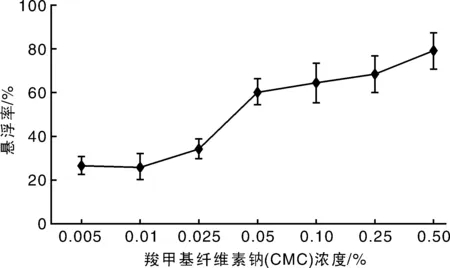
图5 不同浓度羧甲基纤维素钠(CMC)对孢子悬浮率的影响Fig.5 Effect of different concentrations of sodium salt of caboxy methyl cellulose (CMC) on suspension percentage rate of conidia
3 讨论
生物农药制剂化后可以降低活性成分对环境的依赖和使用剂量[19]。生物农药制剂通常由活性成分、惰性载体材料和助剂3部分组成[20]。而真菌作为生物除草剂时大多数是利用其孢子作为活性成分发挥效用[21-22]。禾长蠕孢菌孢子具有高除草活性[4],但是其孢子的大小为(15~17) μm×(11~23) μm,是一类体积较大的真菌孢子,因此在水中不易悬浮,且孢子具有强疏水性,不易在水中分散润湿,因此在田间应用时需要添加表面活性剂、稳定剂和一些惰性材料才能发挥高除草效率。与化学除草剂助剂不同,真菌孢子助剂筛选首要是看其是否能与活性成分有良好的生物相容性。因此,筛选过程中都测定了表面活性剂、溶剂油以及稳定剂对菌丝生长、产孢以及孢子萌发的影响。另外,考虑孢子在制剂中的分散性和稳定性以及田间喷施的效果,还评价了孢子在助剂中的分散性和稳定性。
由于大多数真菌孢子都具有疏水特性,因此表面活性剂是真菌孢子杀虫剂、杀菌剂以及除草剂的必选助剂[23]。有些表面活性剂能够显著促进孢子萌发和菌丝生长,但是有些会抑制孢子萌发。通常非离子表面活性剂与生物农药有效成分生物相容性更好。报道表明,添加Silwet L-77或 Silwet 408有效提高了丁香假单胞杆菌(Pseudomonassyringae)经由气孔或伤口感染靶标杂草的效率[24]。含有0.2% SilwetL-77的疣孢漆斑菌(Myrotheciumverrucaria)菌丝体制剂对外来入侵杂草野葛也有高除草效率[22]。本研究发现,Silwet L-77与禾长蠕孢菌生物相容性较差(图1),但是综合评价生物相容性试验和分散力数据,发现非离子型表面活性剂SP-20添加后不仅有利于孢子均匀分散于水中,而且对孢子生长和萌发都没有抑制作用,更适合用作禾长蠕孢菌的助剂。
溶剂油也常添加在农药中,以提高农药效率。综合考虑到安全性和除草效率,植物油或甲酯化植物油已成为重要的生物农药助剂。研究表明,添加植物油比矿物油更有利于提高烟嘧磺隆控草活性[25]。通常添加的植物油有未精炼玉米油、大豆油、菜籽油等。不同种类植物油与不同真菌孢子的生物相容性不同。Sandrin等[26]报道添加大豆油和玉米籽油能增加胶孢炭疽菌菟丝子专化型(C.gloeosporioidesf. sp.aeschynomene)对皂角(Aeschynomenevirginica)的防效。本研究发现,添加大豆油和玉米油都能促进孢子萌发,而添加葵花籽油则抑制孢子萌发,添加大豆油还能显著促进菌丝生长速度,因此选择大豆油作为禾长蠕孢菌的助剂。
稳定剂有助于孢子均一喷施至杂草叶片上。常用的生物农药稳定剂有海藻酸钠、黄原胶等[19]。本研究表明,海藻酸钠和羧甲基纤维素钠与禾长蠕孢菌孢子的生物相容性都较好,但通过稳定性测定发现,羧甲基纤维素钠的稳定性要优于海藻酸钠。
本文初步筛选出了几种助剂,并研究了其在短时间内与孢子的生物相容性,结果表明,SP-20、大豆油和羧甲基纤维素钠对孢子活性无显著负面影响。接下来还需对延长保存时间后孢子活性进行研究,以及试制出制剂配方和评价其除草效率等,如有必要,还可扩大助剂的筛选范围,为禾长蠕孢菌孢子制剂配方和田间防效试验提供参考。
[1] GAMMON D W, ALDOUS C N, CARR W C JR, et al. A risk assessment of atrazine use in California: human health and ecological aspects[J].PestManagementScience, 2005, 61(4): 331-355.
[2] 张奕强, 张海清, 钟创光, 等.14C-丁草胺、14C-毒死蜱和14C-DDT在日本林蛙中的生物学行为[J]. 核农学报, 2002, 16(3): 174-178.
[3] PAMPULHA M E, FERREIRA M A, OLIVEIRA A. Effects of a phosphinothricin based herbicide on selected groups of soil microorganisms[J].JournalofBasicMicrobiology, 2007, 47(4): 325-331.
[4] 余柳青, 陆永良, 周勇军, 等. 微生物除草剂潜力菌禾长蠕孢稗草专化型[J]. 中国生物防治, 2005, 21(S0): 22-27.
[5] 张建萍,李春光,耿锐梅,等. 除草微生物禾长蠕孢菌的紫外诱变改良[J]. 浙江农业学报, 2008, 20(5): 372-375.
[6] 张建萍, 李春光, 张正波, 等. 禾长蠕孢菌的紫外诱变改良和除草活性评价[J]. 农业生物技术学报, 2007, 15(3): 489-495.
[7] ZHANG J P, DUAN G F, ZHOU Y J, et al. Fungal phytotoxins for weed control[J].AllelopathyJournal, 2011, 27(1): 1-13.
[8] 凌世海, 温佳钧. 中国农药剂型加工工业60年发展之回顾与展望[J]. 安徽化工, 2009, 35(4):1-8.
[9] AULD B A, HETHERINGTON S D, SMITH H E, et al. Advances in bioherbicide formulation[J].WeedBiologyandManagement, 2003, 3(2): 61-67.
[10] WOMACK J G, ECCLESTON G M, BURGE M N. A vegetable oil-based invert emulsion for mycoherbicide delivery[J].BiologicalControl, 1996, 6(1): 23-28.
[11] LAWRIE J, DOWN V M, GREAVES M P. Factors influencing the efficacy of the potential microbial herbicideAlternariaalternata(Fr.) Keissler onAmaranthusretroflexus(L.)[J].BiocontrolScienceandTechnology, 2000, 10(1): 81-87.
[12] AULD B A, SAY M M, RIDINGS H I, et al. Field applications ofColletotrichum-orbiculareto controlXanthium-spinosum[J].AgricultureEcosystemsandEnvironment, 1990, 32(3-4): 315-323.
[13] COTHER E J, GILBERT R L. Pathogenicity ofRhynchosporiumalismatisand its potential as a mycoherbicide on several weed species in theAlismataceae[J].AustralianJournalofExperimentalAgriculture, 1994, 34(7): 1039-1042.
[14] JAHROMI F G, VAN DE VEN R J, COTHER E J, et al. The interaction betweenPlectosporiumalismatisand sublethal doses of bensulfuron-methyl reduces the growth of starfruit (Damasoniumminus) in rice[J].BiocontrolScienceandTechnology, 2006, 16(9): 929-940.
[15] 朱昌雄, 蒋细良, 姬军红, 等. 我国生物农药的研究进展及对未来发展建议[J]. 现代化工, 2003, 23(7): 1-4.
[16] COUCH T L, IGNOFFO C M. Formulation of insect pathogens in microbial control of pests and plant diseases 1970-1980[M]. London: Academic Press, 1981: 621-634.
[17] BURGES H D, JONES K A. Trends in formulation of microorganisms and future research requirements[M]// Formulation of Microbial Biopesticide. Dordrecht: Kluwer Academic Publishers, 1998: 311-332.
[18] 唐启义, 冯明光. DPS数据处理系统[M].2版. 北京:科学出版社, 2010.
[19] NETLAND J, DUTTON L C, GREAVES M P, et al. Biological control ofChenopodiumalbumL. in Europe[J].BioControl, 2001, 46(2): 175-196.
[20] HYNES R K, BOYETCHKO S M. Research initiatives in the art and science of biopesticide formulations[J].SoilBiologyandBiochemistry, 2006, 38(4): 845-849.
[21] CHARUDATTAN R. Biological control of weeds by means of plant pathogens: significance for integrated weed management in modern agro-ecology[J].BioControl, 2001, 46(2): 229-260.
[22] BOYETTE C D, WEAVER M A, HOAGLAND R E, et al. Submerged culture of a mycelial formulation of a bioherbicidal strain ofMyrotheciumverrucariawith mitigated mycotoxin production[J].WorldJournalofMicrobiologyandBiotechnology, 2008, 24(11): 2721-2726.
[23] BOYETTE C D, REDDY K N, HOAGLAND R E. Glyphosate and bioherbicide interaction for controlling kudzu (Puerarialobata), redvine (Brunnichiaovata), and trumpetcreeper (Campsisradicans)[J].BiocontrolScienceandTechnology, 2006, 16(10): 1067-1077.
[24] JOHNSON D R, WYSE D L, JONES K J. Controlling weeds with phytopathogenic bacteria[J].WeedTechnology, 1996, 10(3): 621-624.
[25] NALEWAJA J D, PRACZYK T, MATYSIAK R. Surfactants and oil adjuvants with nicousulfuron[J].WeedTechnology, 1995, 9(4): 689-695.
[26] SANDRIN T R, TEBEEST D O, WEIDEMANN G J. Soybean and sunflower oils increase the infectivity ofColleototrichumgloeosporioidesf. sp.aeschynomeneto northern jointvetch[J].BiologicalControl, 2003, 26(3): 244-252.
(责任编辑 张 韵)
Screening of adjuvants for bioherbicidal fungus Helminthosporium gramineum
ZHANG Jian-ping,DUAN Gui-fang, YANG Shuang, ZHOU Yong-jun, LU Yong-liang*, YU Liu-qing
(StateKeyLaboratoryofRiceBiology,ChinaNationalRiceResearchInstitute,Hangzhou310006,China)
Helminthosporiumgramineumwas isolated from infected barnyard grass and considered as a potential biocontrol candidate based on its epidemiological traits and crop safety. Its conidia showed great promise as a bioherbicidal agent for control of barnyard grass in rice fields. Thus, this study was conducted to screen conidia adjuvants for bioherbicidal fungusH.gramineumbased on the biological compatibility, dispersion force, stability and other evaluation indictors. The results showed that there was better biological compatibility when SP-20, soybean oil and CMC were considered as surfactants, vegetable oil adjuvant and stabilizer, respectively. They did not significantly inhibit the mycelia growth and conidia germination. The dispersion index (I) of conidia suspensions was 0.094 after addition of SP-20 as surfactants, which indicated higher dispersion force. The slope of linear fitting was minimal as 0.232 when CMC was used as stabilizer, which showed better stability. These results of adjuvants would be helpful for developingH.gramineumformulations.
biological control; barnyard grass; fungi; surfactant; stabilizer; vegetable oil adjuvant
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2016.01.16
2015-05-20
863计划子课题(2011AA10A206);国家科技支撑计划课题(2012BAD19B02);国家自然科学基金青年科学基金(31101454);国家水稻产业技术体系项目“杂草防控”(CARS-01);中国农科院创新工程团队项目
张建萍(1973—),女,山西原平人,博士,副研究员,主要从事杂草生物防治研究。E-mail: nkzhang_jp@163.com
*通信作者,陆永良,E-mail: luyongliang@caas.cn
S451.1
A
1004-1524(2016)01-0090-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2016,28(1):90-95
张建萍,段桂芳,杨爽,等. 微生物除草剂禾长蠕孢菌孢子助剂筛选[J].浙江农业学报,2016,28(1):90-95.

