白菜谷胱甘肽过氧化物酶基因GPX的鉴定与分析
齐增园,陶 鹏,李必元,王五宏,岳智臣,雷娟利,钟新民
(1. 浙江省农业科学院 蔬菜研究所,浙江 杭州 310021; 2. 南京农业大学 园艺学院,江苏 南京 210095)
白菜谷胱甘肽过氧化物酶基因GPX的鉴定与分析
齐增园,陶 鹏,李必元,王五宏,岳智臣,雷娟利,钟新民
(1. 浙江省农业科学院 蔬菜研究所,浙江 杭州 310021; 2. 南京农业大学 园艺学院,江苏 南京 210095)
为研究白菜谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)基因的生物学特征,从白菜全基因组数据库中筛选了10个GPX基因。基于公开的白菜转录组测序数据,分析了GPX基因在胚胎发育和器官中的表达情况,并且通过生物信息学手段对这10个GPX基因进行基因定位、启动子分析、基因结构、系统树构建和基因表达等研究。结果表明,BrGPX5基因的编码区中有6个内含子,其余基因均只有5个内含子,说明BrGPX5基因在进化过程中获得了一个内含子,导致氨基酸分子量增加;另外,每个GPX基因的启动子区都有2个及以上的E-box元件。
白菜;GPX基因;启动子;基因表达
谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)是抗氧化酶系的重要成员[1]。在长期进化过程中,植物形成了一套酶促和非酶促的活性氧基团(reactive oxygen species,ROS)清除机制来阻止膜脂过氧化,避免受到伤害[2]。谷胱甘肽过氧化物酶是酶促清除机制中的关键酶类之一,能催化谷胱甘肽(GSH)转化为氧化型谷胱甘肽(GSSG),使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害[3]。这种催化反应研究最早发现于动物,随后研究人员相继从柑橘(Citrussinensis)[4]、番茄(Lycopersiconesculentum)[5]、向日葵(Helianthusannuus)[6]和水稻(Oryzasativa)[7-8]等植物中陆续分离到此类基因。研究表明,植物GPX的氨基酸序列携带一个半胱氨酸残基,替代了动物基因组GPX核苷酸UGA终止密码子处插入的硒代半胱氨酸[9]。番茄LePHGPX基因的过量表达能显著提高转基因植株对盐、高温等非生物胁迫的耐受性[10]。近年来,对模式植物拟南芥GPX基因(AtGPX)的功能研究取得了重要进展。Milla等[11]通过分析拟南芥基因组序列和表达序列标签(expressed sequenced tags,ESTs)序列,推测拟南芥基因组中存在7个GPX基因,对不同的非生物胁迫均有应答反应。
白菜为十字花科芸薹属(Brassica)植物,其柔嫩的叶球、莲座叶或花茎可供食用,栽培面积和消费量在中国居各类蔬菜之首。白菜是研究植物多倍化的模式材料之一,多倍化的白菜家族基因成员的扩大和丢失是近年来研究的热点。十字花科中,拟南芥和白菜的亲缘关系较近,并且两者有大量的共线性基因。目前,白菜全基因组测序已完成[12],这为白菜的基因组研究提供了便利条件。虽然拟南芥GPX基因的研究已经有较多报道,但白菜GPX基因的功能还未见报道。因此,本研究从白菜全基因组中筛选了10个GPX基因,对其进行了基因定位,分析了启动子区的调控元件;并与拟南芥GPX基因进行序列比对分析,构建了系统树并分析了白菜GPX基因的表达模式。
1 材料与方法
1.1 GPX基因序列的获得
首先从NCBI数据库获得拟南芥的GPX基因序列,然后利用拟南芥的GPX基因序列在公共数据库Brassica Database(http://brassicadb.orgbradindex.php)中进行检索,获得了10个白菜GPX基因序列。使用Syntenic Genes软件分析这些白菜GPX基因的共线性关系,记录白菜每个GPX亚基因组(LF,MF1和MF2)的分布。
1.2 白菜GPX基因结构
首先从数据库中获得GPX基因序列,然后使用ClustalX进行比对,找出内含子的插入点,进行制图并分析氨基酸序列间的关系。
1.3 序列比对和系统树分析
使用ClustalX[13]比对分析白菜和拟南芥GPX蛋白的氨基酸序列。然后使用MEGA 5.2[13],基于Jones-Taylor-Thornton substitution matrix算法,采用邻接法构建系统发育进化树,运行重复次数为1 000。
1.4 白菜GPX基因启动子分析
从数据库下载每个GPX基因起始密码子上游2 000 bp的核苷酸序列,使用Softberry软件(http://linux1.softberry.com/berry.phtml)预测转录起始位点,用序列作为标准,找出E-box,ABRE,CBF和2SSEEDPROTBANAPA基序,然后记录每个GPX基因中E-box,ABRE,CBF和2SSEEDPROTBANAPA的定位信息,使用Excel进行作图。
1.5 白菜GPX基因表达水平的数据来源
芸薹属全基因组测序、芸薹属器官表达和胚胎发育的转录组测序工作已完成。白菜器官表达的RNA序列已公布[14],从NCBI网站获得了白菜器官的转录组测序的原始数据(http://www.ncbi.nlm.nih.gov/geo/)(收录号:GSE43245),从中获得10个白菜GPX基因在不同器官中的表达数据。白菜在胚胎发育阶段RNA序列数据也已公布[15],从中获得了白菜GPX基因在胚胎发育阶段的表达数据。然后使用Excel作图分析白菜GPX基因在不同时期的表达量。
2 结果与分析
2.1 白菜GPX基因的识别及定位
利用拟南芥的GPX基因序列,在公共数据库Brassica Database进行检索,结合共线性基因分析,找到了10个白菜GPX基因。基于拟南芥的GPX基因,对10个白菜GPX基因进行命名,名称以及基因编码等信息见表1。同时也分析了这些GPX蛋白的等电点和分子量。结果显示,大多数GPX蛋白的等电点在8.3~9.9之间,为碱性蛋白,分子量在18~27 ku之间;而AtGPX2,BrGPX2a和BrGPX2b是分子量相对较小的酸性蛋白。BrGPX4b和BrGPX6a的等电点和分子量与AtGPX4和AtGPX6存在差异,BrGPX5与AtGPX5在分子量上差异较明显。
2.2 白菜GPX基因的结构
表1 拟南芥和白菜的GPX基因详细信息
Fig.1 Detailed information ofGPXgenes in Chinese cabbage andArabidopsisthaliana
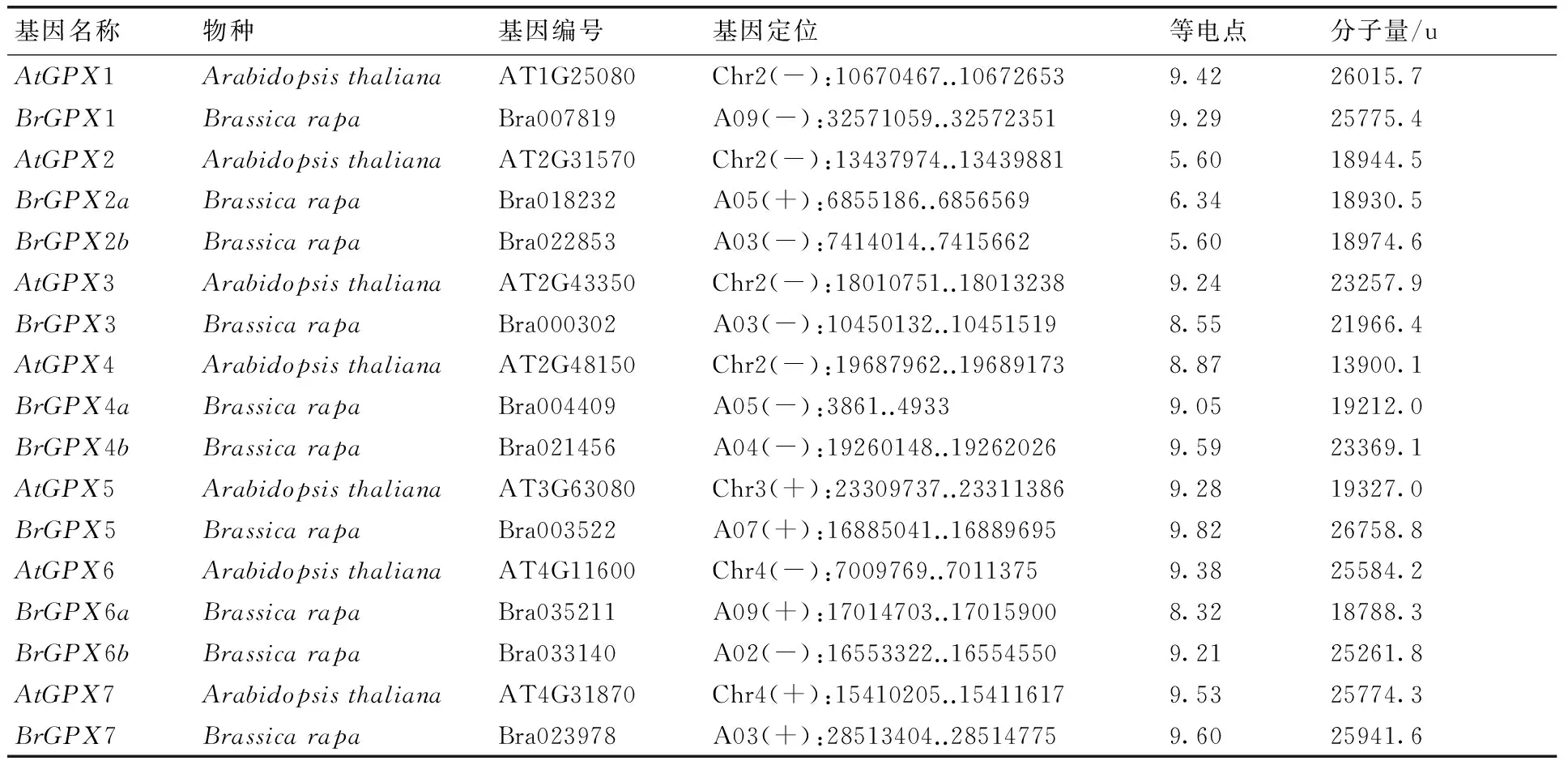
基因名称物种基因编号基因定位等电点分子量/uAtGPX1ArabidopsisthalianaAT1G25080Chr2(-):10670467..106726539.4226015.7BrGPX1BrassicarapaBra007819A09(-):32571059..325723519.2925775.4AtGPX2ArabidopsisthalianaAT2G31570Chr2(-):13437974..134398815.6018944.5BrGPX2aBrassicarapaBra018232A05(+):6855186..68565696.3418930.5BrGPX2bBrassicarapaBra022853A03(-):7414014..74156625.6018974.6AtGPX3ArabidopsisthalianaAT2G43350Chr2(-):18010751..180132389.2423257.9BrGPX3BrassicarapaBra000302A03(-):10450132..104515198.5521966.4AtGPX4ArabidopsisthalianaAT2G48150Chr2(-):19687962..196891738.8713900.1BrGPX4aBrassicarapaBra004409A05(-):3861..49339.0519212.0BrGPX4bBrassicarapaBra021456A04(-):19260148..192620269.5923369.1AtGPX5ArabidopsisthalianaAT3G63080Chr3(+):23309737..233113869.2819327.0BrGPX5BrassicarapaBra003522A07(+):16885041..168896959.8226758.8AtGPX6ArabidopsisthalianaAT4G11600Chr4(-):7009769..70113759.3825584.2BrGPX6aBrassicarapaBra035211A09(+):17014703..170159008.3218788.3BrGPX6bBrassicarapaBra033140A02(-):16553322..165545509.2125261.8AtGPX7ArabidopsisthalianaAT4G31870Chr4(+):15410205..154116179.5325774.3BrGPX7BrassicarapaBra023978A03(+):28513404..285147759.6025941.6
通过对GPX基因的各个成员进行比对,发现多个保守程度较高的特征结构,且序列差异一般都在起始端和末尾端出现,从第1个内含子到第5个内含子的插入位置高度保守。一般GPX基因都含有5个内含子,而且位点相似或相同,但BrGPX5基因有6个内含子,比其他基因多出1个内含子(图1)。
2.3 白菜GPX蛋白的进化分析
为了研究这些GPX蛋白的进化关系,运用MEGA 5.2[16]软件,采用邻接法构建了GPX蛋白的系统发育进化树。由于拟南芥和白菜是共线性关系,所以拟南芥与它共线性的白菜直系同源基因聚在一起。AtGPX2,BrGPX2a,BrGPX2b和AtGPX3,BrGPX3蛋白的亲缘关系较近,而AtGPX7,BrtGPX7和AtGPX1,BrGPX1蛋白的关系较近,AtGPX5,BrGPX5和AtGPX4,BrGPX4a,BrGPX4b蛋白的亲缘关系也较近(图2)。
2.4 白菜GPX基因结构启动子分析
从公共数据库中下载了白菜10个GPX基因起始密码子上游2 000 bp的DNA序列,分析了这些序列中E-box,ABRE,CBF和2SSEEDPROT-BANAPA的数量和分布。结果显示,所有GPX基因的起始密码子上游2 000 bp的启动子区域都存在E-box元件,而ABRE,CBF和2SSEEDPROT-BANAPA只部分存在于启动子区域,其中ABRE元件存在于BrGPX7,BrGPX6b,BrGPX6a,BrGPX5,BrGPX4b,BrGPX4a中,在1 700~1 900 bp区域相对集中,BrGPX6b基因上有位置很近、几乎重叠的2个ABRE元件;CBF元件存在于BrGPX7,BrGPX6b,BrGPX6a,BrGPX4b,BrGPX4a,BrGPX3,BrGPX2b,在BrGPX3基因上存在位置较近的CBF元件。只有BrGPX6b,BrGPX5,BrGPX3的2 000 bp启动子区域里存在2SSEEDPROTBA-NAPA元件,BrGPX6b启动子区有2个2SSEEDP-ROTBANAPA元件(图3)。
2.5 白菜GPX基因的表达模式
从NCBI数据库和已发表文献中获得白菜GPX基因的转录组测序数据,分析白菜GPX基因在不同组织器官的表达情况。如图4所示,在胚胎发育过程中,BrGPX1,BrGPX2a,BrGPX2b和BrGPX6a在早期子叶胚中的表达量较高,在成熟胚中表达较低;在子叶期,BrGPX1基因的表达量显著高于其他基因。BrGPX4a和BrGPX4b在胚胎发育过程中几乎不表达或表达量极少。2个旁系同源基因BrGPX2a和BrGPX2b的表达谱类似。与BrGPX6a相比,BrGPX6b基因在整个白菜胚胎发育过程中表达量明显上升,且表达量是BrGPX6a的3倍以上。BrGPX7基因在胚胎发育时期表达量较低,在子叶期相对较高。
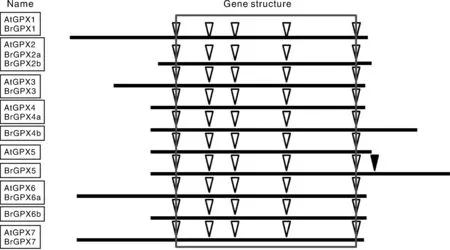
黑色三角所示为BrGPX5的第6个内含子插入位点。图1 拟南芥和白菜GPX基因的结构Fig.1 Structure of GPX genes in Chinese cabbage and Arabidopsis thaliana
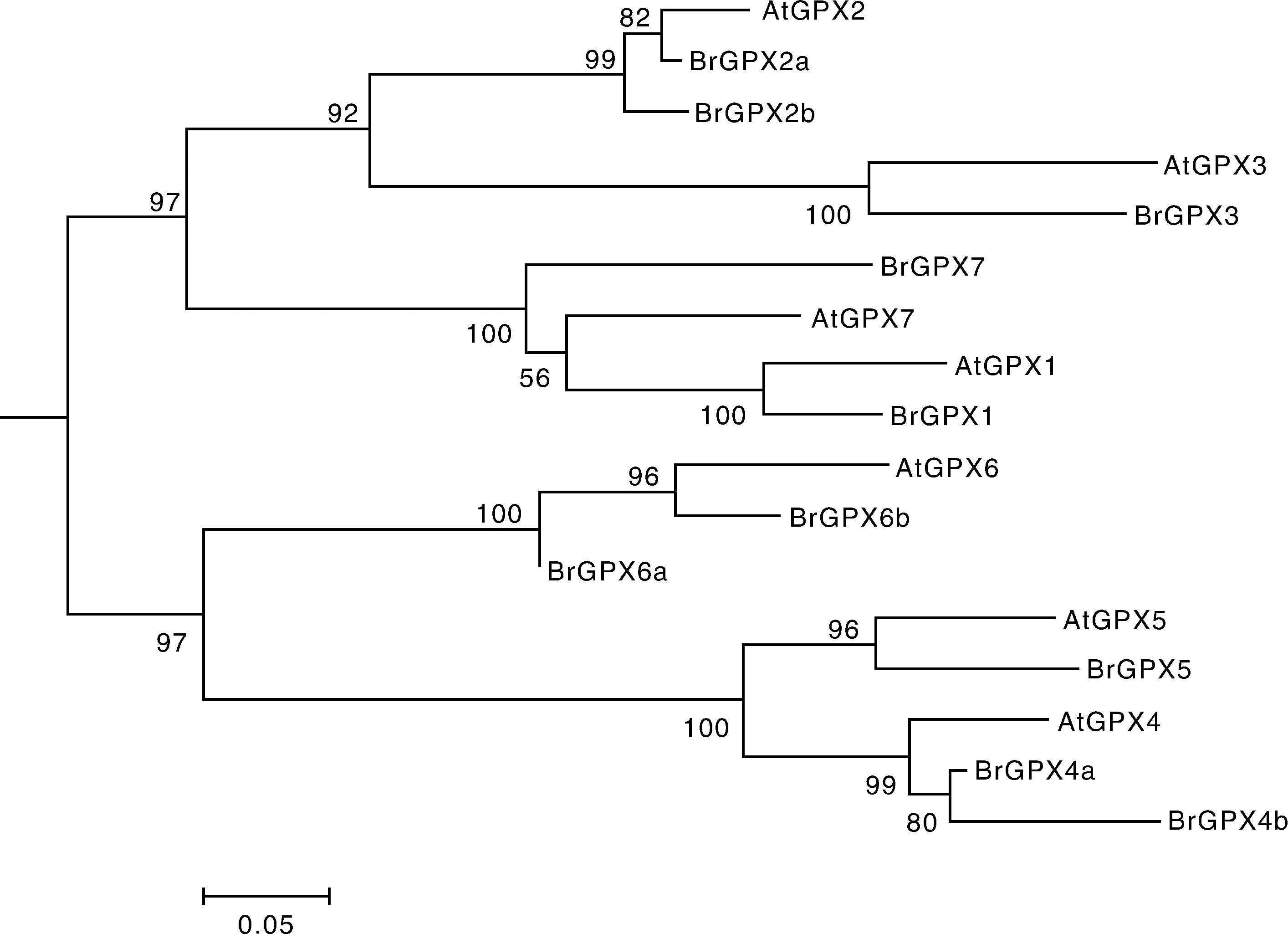
图2 拟南芥和白菜GPX蛋白的系统发育树Fig.2 Phylogenetic tree of GPX proteins in Chinese cabbage and Arabidopsis thaliana
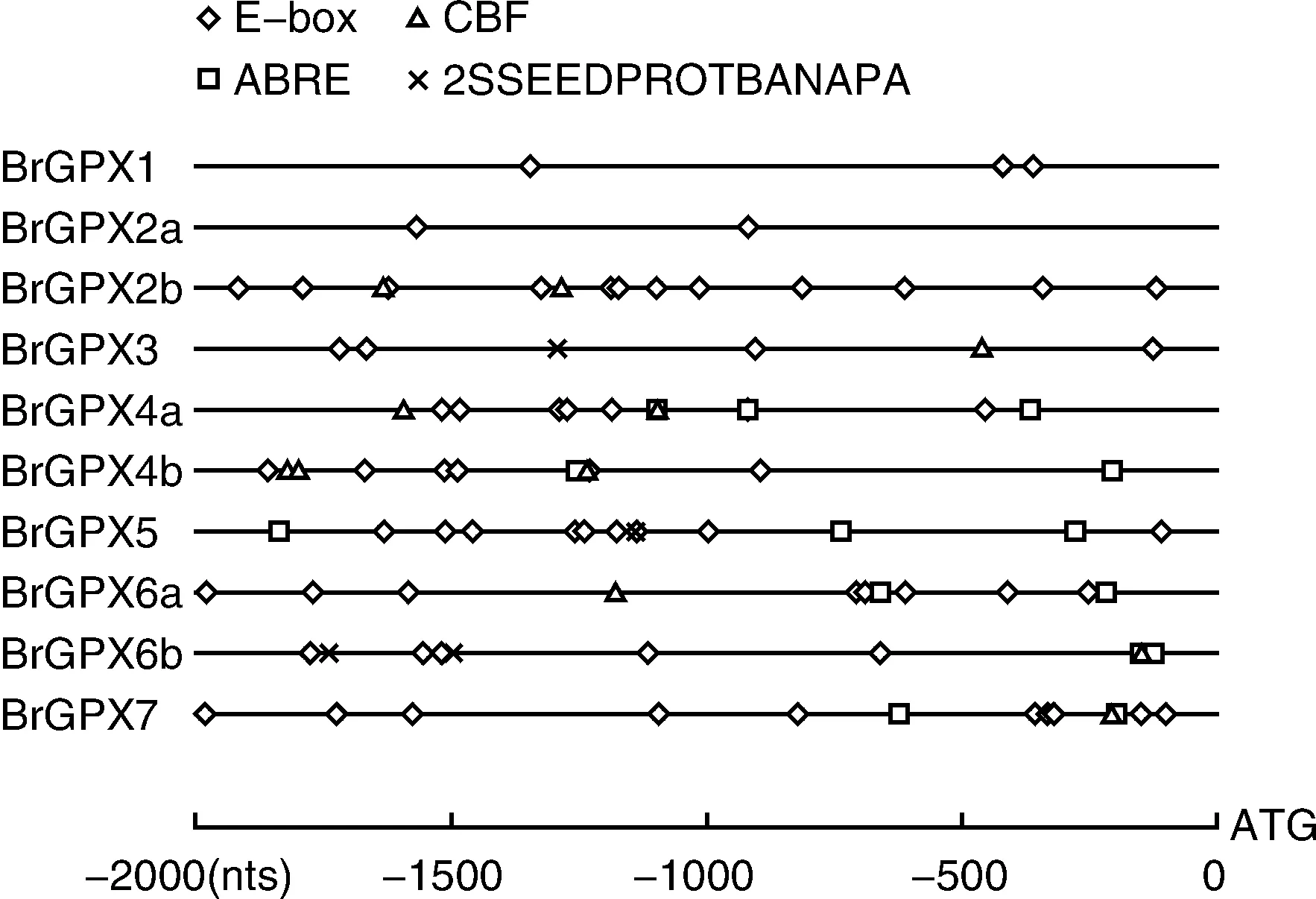
图3 白菜GPX基因启动子序列分析Fig.3 Promoter sequence analysis of GPX genes in Chinese cabbage
如图5所示,与其他器官中的表达水平相比,BrGPX1在愈伤组织中的表达量较高。2个旁系同源基因BrGPX2a和BrGPX2b表达差异明显。BrGPX2b在花和长角果中表达量较高,BrGPX2a在所有器官中均有表达,且器官之间的表达量差异不显著。BrGPX3和BrGPX5分别在角果和叶片表达量较高。而BrGPX6a和BrGPX6b在所有器官中表达量均较高,BrGPX6a在叶子和花中表达量较高,在愈伤组织的表达量也较高,而BrGPX6b在叶子、花和长角果中的表达量较高,BrGPX7在花器官中表达量较高。
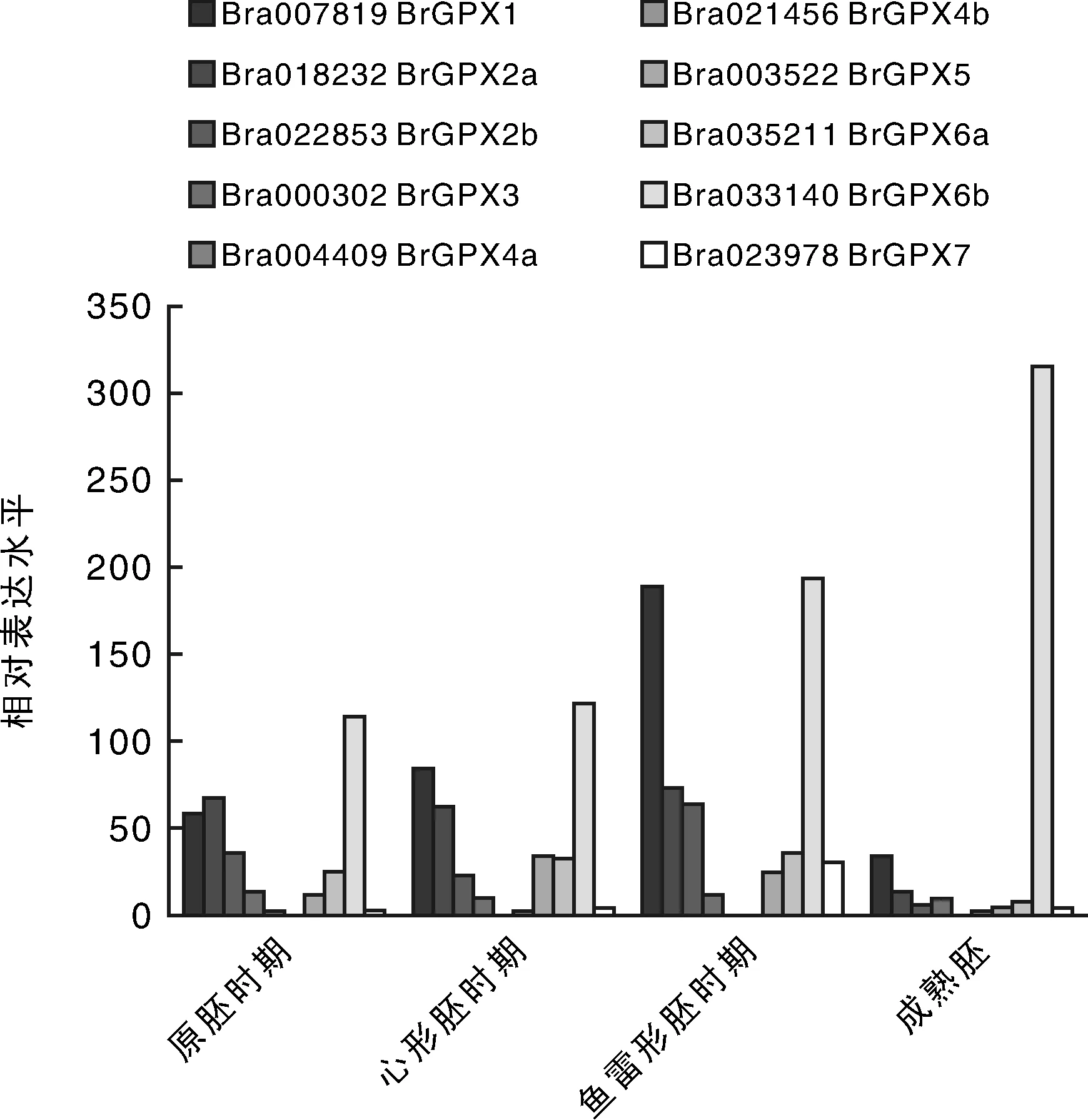
图4 白菜GPX基因在胚胎发育不同时期的表达Fig.4 Expression levels of GPX genes in Chinese cabbage at different stages of embryonic development
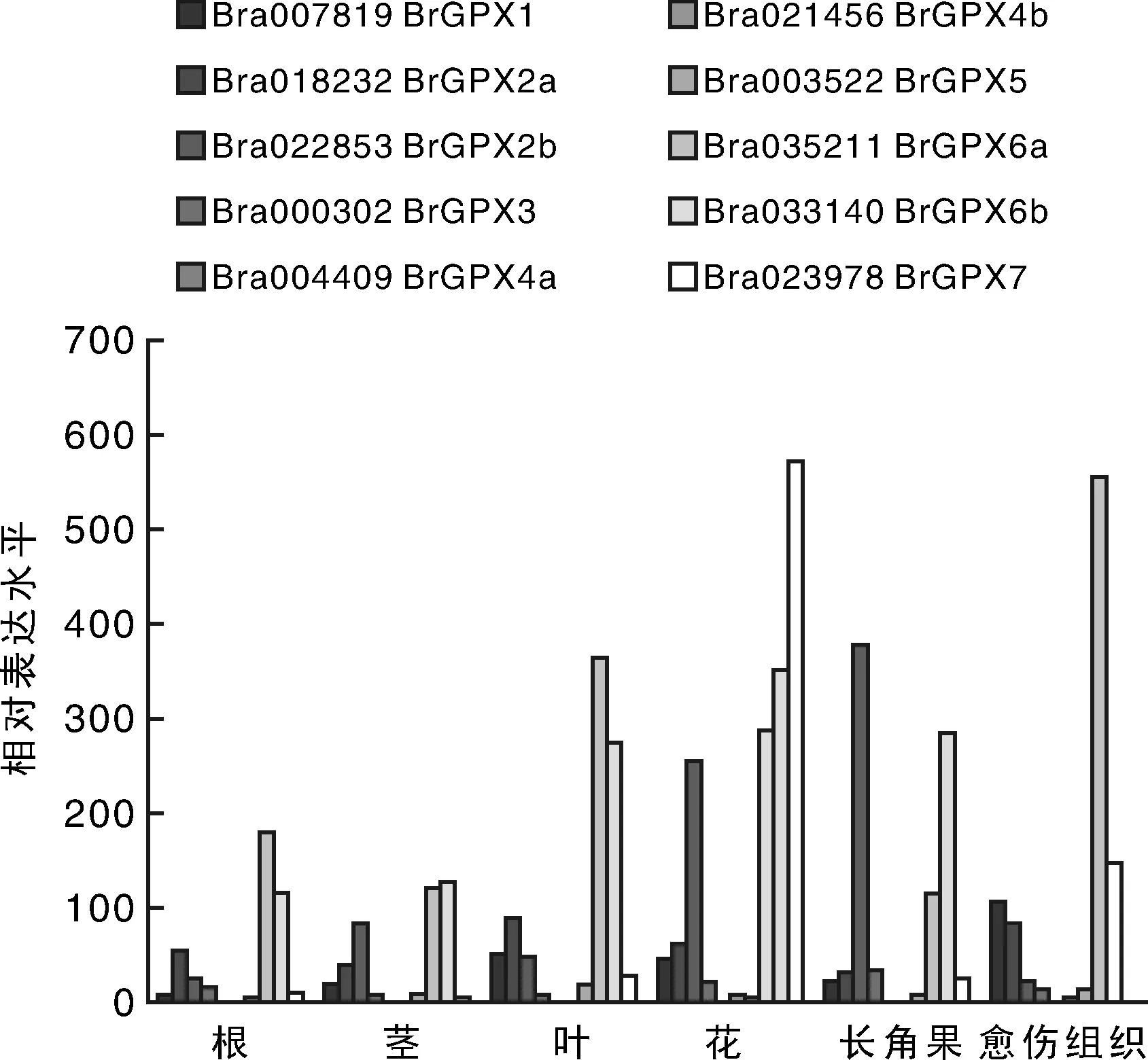
图5 白菜GPX基因在各个器官中的表达Fig.5 Expression levels of GPX genes in Chinese cabbage in different organs
3 讨论
拟南芥含有7个GPX基因,白菜在进化过程中发生了3倍化,因此白菜存在3个亚基因组(LF,MF1和MF2),但鉴定结果中只有10个GPX基因,说明白菜在进化过程中GPX基因存在丢失现象。在分析白菜GPX蛋白的等电点时,发现大部分GPX蛋白是碱性蛋白,而BrGPX6a的等电点和分子量相较于AtGPX6和BrGPX6b有所偏低,BrGPX4a的等电点和分子量相较于AtGPX4和BrGPX6b也有所偏低,说明在进化过程中很有可能发生了基因片段的丢失。在分析BrGPX5基因的内含子时,发现BrGPX5基因比其他GPX基因多了一个内含子,表明BrGPX5基因在进化过程中获得了新的内含子,导致一段新的序列插入到编码区中,从而使BrGPX5蛋白分子量大于AtGPX5。
目前,白菜基因组和转录组测序数据越来越多,能够从NCBI数据库和已发表的文献中下载获得转录组测序的原始数据,从而分析白菜GPX基因在转录水平的表达。旁系同源基因BrGPX6a和BrGPX6b在胚胎发育过程中的表达量上相差3倍以上,这可能与BrGPX6a和BrGPX6b启动子区的调控元件有关。BrGPX6b起始密码子上游1 500~2 000 bp存在2个2SSEEDPROTBA-NAPA元件,而BrGPX6a中不存在这种元件。2SSEEDPROTBANAPA元件(核心序列5’-CAAACAC-3’)大量存在于甘蓝型油菜种子储藏蛋白的启动子区,参与调控储藏蛋白在胚胎发育阶段的表达[17]。BrGPX6b基因在胚胎发育过程中转录表达明显上调,表明其表达与2SSEEDPROTB-ANAPA元件密切相关。Milla等[11]采用RT-PCR的方法对拟南芥GPX基因表达进行了分析,结果表明,AtGPX1基因编码一个叶绿体蛋白,在叶、茎和花中表达比较强,在根中几乎检测不到,这说明该蛋白的功能可能是抵御由光氧化胁迫造成的损伤[1]。拟南芥AtGPX1和AtGPX7表达量的下降,会降低拟南芥抵御光氧化胁迫的能力[18]。将拟南芥AtGPX3基因敲除后,拟南芥对干旱和氧化胁迫的抵抗能力都显著下降[19]。Gapinska等[20]的研究表明,番茄根部在受到150 mmol·L-1的NaCl处理时,GPX活性显著增强。GPX参与植物的抗氧化胁迫,在转基因植物中过量表达GPX基因可以提高植物对非生物胁迫的耐受力[21-22]。
[1] 赵丽. 油松GPX基因家族的分子特性研究[D]. 北京: 北京林业大学, 2014.
[2] SMIRNOF N. Environment and plant metabolism[M]. Oxford, UK: BioS Scientific Publishers, 1995: 217-243.
[3] ARTHUR J R. The glutathione peroxidases[J].CellMolecularLifeScience, 2000, 57(13/14): 1825-1835.
[4] HOLLAND D, BEN-HAYYIM G, FALTIN Z, et al. Molecular characterization of salt-stress-associated protein in citrus: protein and cDNA sequence homology to mammalian glutathione peroxidases[J].PlantMolecularBiology, 1993, 21(5): 923-927.
[5] DEPEGE N, DREVET J, BOYER N. Molecular cloning and characterization of tomato cDNA encoding glutathione peroxidase-like proteins[J].EuropeanJournalofBiochemistry, 1998, 253: 445-451.
[6] ROECKEL-DREVET P, GAGNE G, LABROUHE D T D, et al. Molecular characterization, organ distribution and stress-mediated induction of two glutathione peroxidase-encoding mRNAs in sunflower (Helianthusannuus)[J].PhysiologiaPlantarum, 1998, 103(3): 385-394.
[7] LI W J, FEN H, FAN J H, et al. Molecular cloning and expression of a phospholipid hydroperoxide glutathione peroxidase homolog inOryzasativa[J].BiochimicaEtBiophysicaActa, 2000, 1493(1): 225-230.
[8] 韦金池, 杨海灵. 水稻谷胱甘肽过氧化物酶基因OsGPX3和OsGPX4的分子特性研究[J]. 植物科学学报, 2013, 31(1): 64-72.
[9] 苗雨晨. 拟南芥AtGPX3在ABA和干旱信号转导中的作用[D]. 北京: 中国农业大学, 2005.
[10] CHEN S, VAGHCHHIPAWALA Z, LI W, et al. Tomato phospholipid hydroperoxide glutathione peroxidase inhibits cell death induced by Bax and oxidative stresses in yeast and plants[J].PlantPhysiology, 2004, 135(3): 1630-1641.
[11] MILLA M A R, MAURER A, HUETE A R, et al. Glutathione peroxidase genes inArabidopsisare ubiquitous and regulated by abiotic stresses through diverse signaling pathways[J].ThePlantJournal, 2003, 36(5): 602-615.
[12] WANG X, WANG H, WANG J, et al. The genome of the mesopolyploid crop speciesBrassicarapa[J].NatureGenetics, 2011, 43(10): 1035-1039.
[13] THOMPSON J D, GIBSON T J, PLEWIAK F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J].NucleicAcidsResearch, 1997, 25(24): 4876-4882.
[14] TONG C, WANG X, YU J, et al. Comprehensive analysis of RNA-seq data reveals the complexity of the transcriptome inBrassicarapa[J].BMCGenomics, 2013, 14(1): 689.
[15] ZHANG Y, PENG L, WU Y, et al. Analysis of global gene expression profiles to identify differentially expressed genes critical for embryo development inBrassicarapa[J].PlantMolecularBiology, 2014, 86(4-5): 425-442.
[16] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J].MolecularBiologyandEvolution, 2011, 28(10): 2731-2739.
[17] STALBERG K, ELLERSTOM M, EZCURRA I, et al. Disruption of an overlapping E-box/ABRE motif abolished high transcription of the napA storage-protein promoter in transgenicBrassicanapusseeds[J].Planta, 1996, 199(4): 515-519.
[19] MIAO Y, LV D, WANG P, et al. AnArabidopsisglutathione peroxidase functions as both a redox transducer and a scavenger in abscisic acid and drought stress responses[J].ThePlantCell, 2006, 18(10): 2749-2766.
[20] GAPINSKA M, SKLODOWSKA M, GABARA B. Effect of short-and long-term salinity on the activities of antioxidative enzymes and lipid peroxidation in tomato roots[J].ActaPhysiologiaePlantarum, 2008, 30(1): 11-18.
[21] YOSHIMURA K, MIYAO K, GABER A, et al. Enhancement of stress tolerance in transgenic tobacco plants overexpressing Chlamydomonas glutathione peroxidase in chloroplasts or cytosol[J].ThePlantJournal, 2004, 37(1): 21-33.
[22] GABER A, YOSHIMURA K, YAMAMOTO T, et al. Glutathione peroxidase-like protein ofSynechocystisPCC 6803 confers tolerance to oxidative and environmental stresses in transgenicArabidopsis[J].PhysiologiaPlantarum, 2006, 128(2): 251-262.
(责任编辑 侯春晓)
Identification and analysis of GPX genes in Chinese cabbage
QI Zeng-yuan1,2, TAO Peng1, LI Bi-yuan1, WANG Wu-hong1, YUE Zhi-chen1, LEI Juan-li1, ZHONG Xin-min1,*
(1.InstituteofVegetables,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China; 2.CollegeofHorticulture,NanjingAgriculturalUniversity,Nanjing210095,China)
To study the biological characteristics of glutathione peroxidase (GPX) genes in cabbage, 10GPXgenes were screened from the whole genome database of cabbage. Then expression levels of theseGPXgenes were analyzed based on cabbage transcriptome RNA-Seq data at embryonic development and in different organs. Meantime, gene mapping, promoter, gene structure, phylogenetic tree and expression level of these 10GPXgenes were studied using bioinformatics tools. The results showed that there were six introns in the coding region ofBrGPX5, while other genes only had five introns, which indicated thatBrGPX5 gene obtained an intron during evolution, resulting in increased molecular weight of the amino acid. In addition, there were two and above E-box elements in the promoter region of eachGPXgene in Chinese cabbage.
Chinese cabbage;GPXgenes; promoter; gene expression
http://www.zjnyxb.cn齐增园, 陶鹏, 李必元, 等. 白菜谷胱甘肽过氧化物酶基因GPX的鉴定与分析[J]. 浙江农业学报, 2016, 28(1): 64-69.
10.3969/j.issn.1004-1524.2016.01.11
2015-05-27
国家自然科学基金(31372058,31301788);浙江省重大科技专项(2012C12903-6-2,2012C12903-3-7)
齐增园(1990—),女,山东莱芜人,硕士,研究方向为大白菜甘蓝分子遗传育种。E-mail: qizengyuan1409@126.com
*通信作者,钟新民,E-mail: zhongxm@mail.zaas.ac.cn
S634
A
1004-1524(2016)01-0064-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2016,28(1):64-69

