西洋参三七黄芪胶囊提取工艺研究*
王贤英,王钧,谢香菊,李胜容
(重庆市中药研究院,重庆400065)
西洋参三七黄芪胶囊提取工艺研究*
王贤英,王钧,谢香菊,李胜容
(重庆市中药研究院,重庆400065)
目的优选西洋参三七黄芪胶囊中黄芪的提取工艺。方法采用L9(34)正交设计试验法,分别以黄芪多糖的含量和浸膏得率为指标,优选黄芪的提取工艺。结果黄芪的最佳提取工艺为以水为提取溶剂,加10倍药材量溶剂,加热回流提取2次,每次1.5 h。结论该正交试验为确定西洋参三七黄芪胶囊中黄芪的提取工艺提供了试验依据。
西洋参三七黄芪胶囊;提取工艺;黄芪多糖
黄芪为豆科植物膜夹黄芪Astragalus membranaceus(Fisch.)或蒙古黄芪Astragalus membranaceus(Fisch.)Bge.var.mongho-licus(Bge.)Hsiao的干燥根。黄芪味甘,性温,入脾、肺经,具有补中益气、升阳固表、托毒生肌、利水退肿之功效,主要化学成分为多糖、皂苷、黄酮、多种氨基酸及微量元素[1-3]。黄芪多糖是黄芪的有效成分之一,是从黄芪根中得到的一类大分子活性物质。现代药理学研究表明[4-6],其具有抗过氧化、增强免疫功能、改善心血管功能、抗菌抗病毒和抗肿瘤、预防衰老及抗辐射、双向调节血糖等作用,能增加机体的非特异性抵抗能力,增强机体免疫功能,在保健品中常用作免疫增强剂(如本研究中所用三七黄芪胶囊即为增强免疫功能的制剂)。故对黄芪的提取过程进行控制与优化非常重要。笔者参照文献[7-15],采用传统的水煎煮提取方式,选取影响水煎煮提取的主要因素,即加水量、提取时间、提取次数3个因素,各取3个水平进行L9(34)正交试验,以主要药效物质黄芪多糖的含量为指标,对黄芪的水提取过程工艺条件进行研究,以期找到最佳条件。现报道如下。
1 仪器与试药
1.1仪器
SK250LH型超声波清洗仪(上海科导超声仪器有限公司);KW型恒温水浴锅(上海必尔得实业有限公司);AB265-S型电子分析天平(瑞士梅特勒-托利多仪器有限公司);UV-2006型紫外-可见分光光度计(日本岛津仪器有限公司);LIM-40型低速大容量离心机(北京医用离心机厂)。
1.2试药
黄芪(四川皓博药业有限公司,批号为20151101),经重庆市中药研究院中药生药研究所舒抒(副高)鉴定,为黄芪的干燥根。葡萄糖对照品(广东光华科技股份有限公司,批号为20150505);浓硫酸、苯酚、丙酮、乙醚、无水乙醇等均为分析纯。
2 方法与结果
2.1黄芪多糖的含量测定[16-20]
2.1.1溶液制备
称取苯酚结晶5.0 g,置100 mL容量瓶中,加水溶解并用水稀释至刻度,摇匀,避光保存,得5%苯酚溶液。精密称取105℃干燥至恒重的无水葡萄糖10 mg,置100 mL容量瓶中,加水溶解并用水稀至刻度,摇匀,备用,即得对照品溶液。
2.1.2方法学考察
吸收光谱的绘制:取葡萄糖对照品溶液2.0 mL,用苯酚-硫酸法显色,以试剂空白为参比,在200~600 nm波长范围内扫描,结果见图1。可见,葡萄糖于490 nm波长处有最大吸收峰,故选择测定波长为490 nm。
线性关系考察:精密吸取对照品溶液0,0.20,0.40,0.60,0.80,1.00 mL,置10 mL容量瓶中,分别加水1.5 mL,再加5%苯酚溶液1.0 mL,摇匀,加浓硫酸5.0 mL,摇匀,置沸水浴中加热5 min,取出,自然冷却放置25 min,加水稀释至刻度,摇匀。以“0 mL”具塞刻度试管中的溶液为空白,于490 nm波长处测定吸光度,以吸光度(Y)为纵坐标、进样量(X)为横坐标进行线性回归,得回归方程Y=0.017 46 X+0.022 53(r=0.999 5)。结果显示,葡萄糖进样量在2.01~10.05 μg范围内与吸光度呈良好线性关系。
精密度试验:精密吸取葡萄糖对照品溶液6份,依法显色后测定吸光度。结果的RSD为1.15%(n=6),表明仪器精密度良好。
重复性试验:对同一批黄芪多糖样品独立测定吸光度6次。结果的RSD为2.95%(n=6),表明方法重复性好。
稳定性试验:取黄芪多糖样品溶液2 mL,依法显色后放置,分别在0,15,30,45,60 min测定吸光度。结果的RSD为2.62%(n=5),表明供试品溶液在显色后1 h内稳定。

图1 吸收光谱图
加样回收试验:取6份已知含量的黄芪浸膏粉约1 g,精密称定,精密加入适量葡萄糖对照品,依法制备供试品溶液,精密吸取供试品溶液2 mL置10 mL容量瓶中,依法测定吸光度,结果见表1。
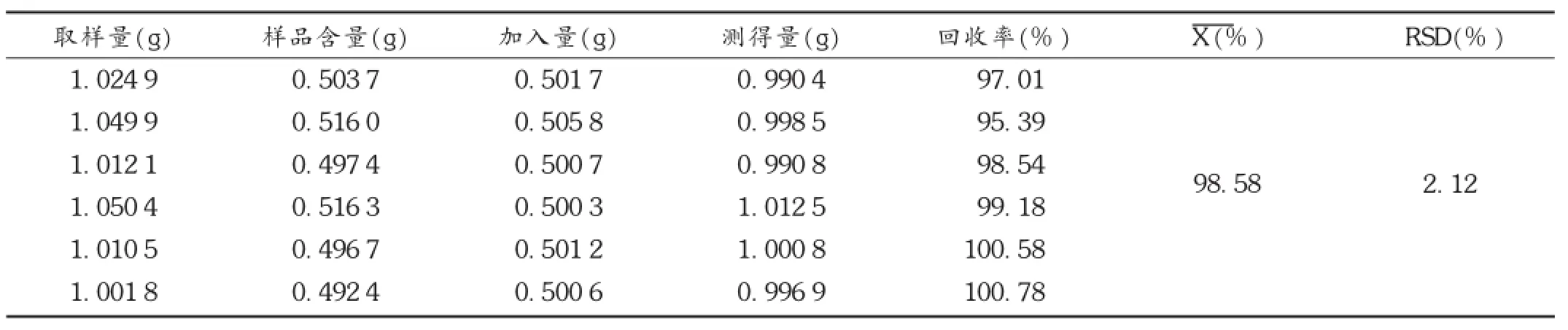
表1 黄芪多糖加样回收试验结果(n=6)
2.2正交试验设计
2.2.1正交试验因素水平考察
根据黄芪多糖理化性质和预试验结果,确定加水量(因素A)、提取时间(因素B)、提取次数(因素C)作为考察因素,以多糖测得值为评价指标,根据因素水平表,不考虑因素间的交互作用,应用L9(34)正交试验设计进行试验,确定最佳工艺。详见表2。
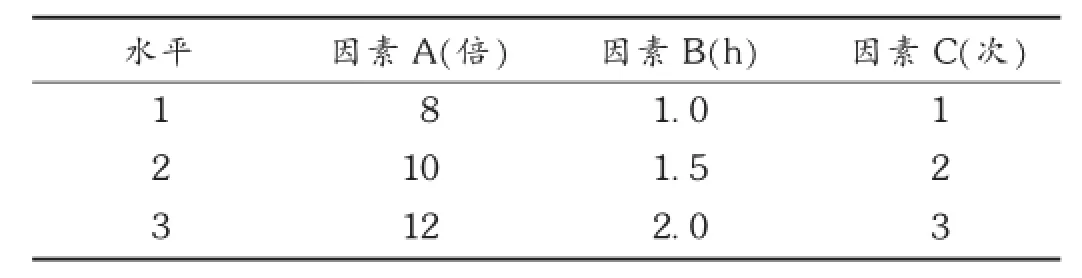
表2 正交试验因素水平表
2.2.2正交试验考察提取工艺
取本品约1 g,精密称定,置100 mL容量瓶中,加水80 mL,超声30 min,再用水定容至100 mL,摇匀,放置。精密吸取样品上清液2 mL,置15 mL离心管中,加无水乙醇10 mL,摇匀放置2 h。置离心机以3 000 r/min的速率离心20 min。弃去上清液,沉淀物用水溶解并洗入25 mL容量瓶中定容至刻度,作为供试品溶液。精密量取样品溶液0.5 mL置10 mL容量瓶中,加水1.5 mL,加5%苯酚溶液1.0 mL、硫酸5.0 mL,在沸水浴中加热5 min,取出,自然冷却放置25 min,加水稀释至刻度,摇匀,依法测定吸光度,计算样品中多糖的含量。称取药材,共9份,各100 g,按正交试验表进行试验,以每100 g样品中黄芪多糖测得值为考察指标。结果见表3。
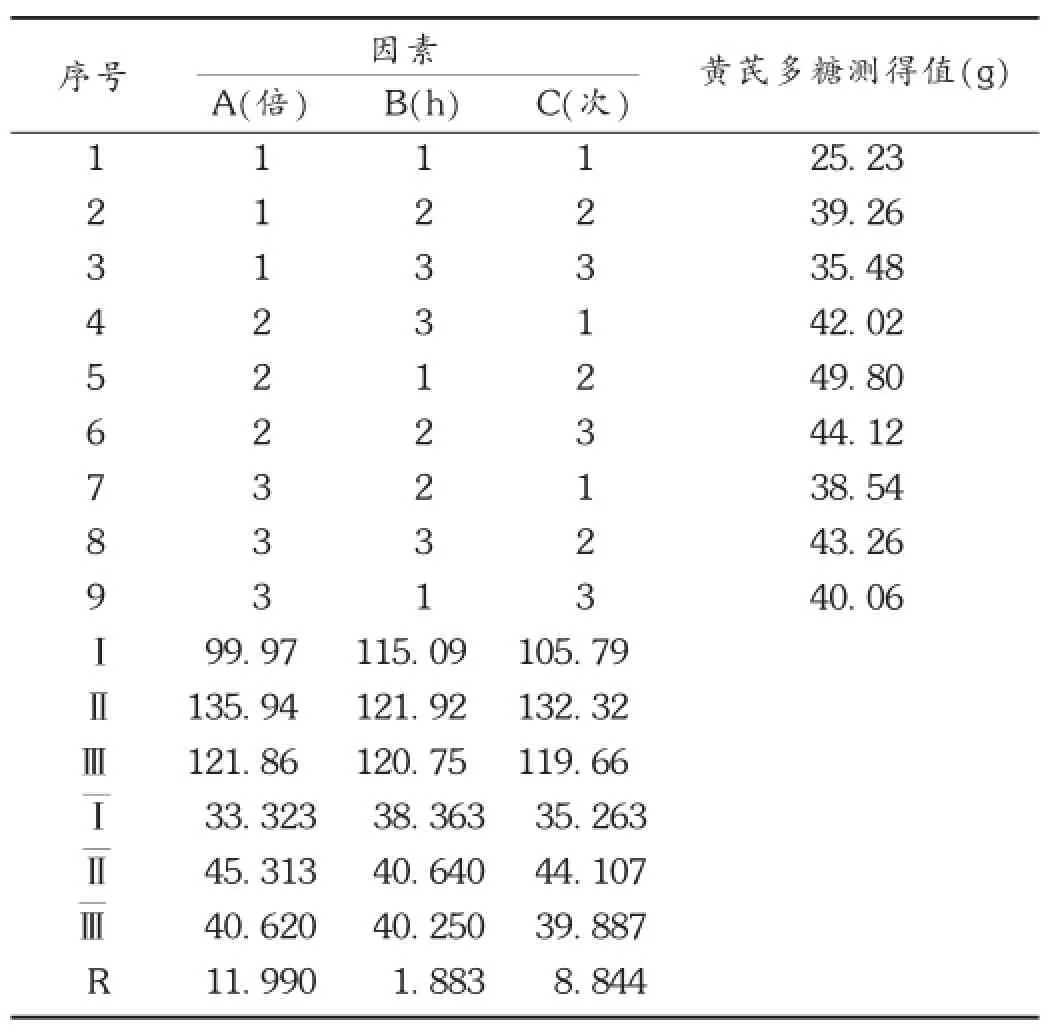
表3 正交试验结果
2.2.3方差分析
以黄芪多糖测得值为评价指标,在考察的影响因素中,重要性依次为A>B>C。A因素中A2>A3>A1,B因素中B2>B3>B1,C因素中C2>C1>C3。因此,确定黄芪最佳提取工艺为A2B2C2,即加10倍量水,提取2次,每次提取1.5 h。方差分析见表4。

表4 方差分析结果
2.3验证试验
按优化的工艺条件A2B2C2提取3批样品,测定黄芪多糖含量。结果黄芪多糖平均含量为49.15 g/100 g,验证试验结果与正交试验基本一致,从而证明这一工艺条件合理可行。
3 讨论
3.1提取溶剂选择
曾选用50%乙醇、80%乙醇、水作为提取溶剂,乙醇与水提取黄芪多糖的含量相比,差异不明显。考虑到大生产的经济性与安全性,故选用水作为提取溶剂。
3.2提取单因素试验
采用加水量、提取次数、提取时间等单因素水提的考察试验,是为了更好地确定各因素的最佳提取条件,为正交设计试验提供合理的因素范围,避免提取最佳条件产生误差。
3.3正交设计试验
采用正交试验考察加水量、提取次数、提取时间等提取工艺,采用苯酚-硫酸法考察对黄芪多糖含量的影响并优选提取工艺。根据提取次数考察结果,前2次提取中已把黄芪多糖提取完全,故提取次数确定为2次。由直观分析和方差分析可见,以黄芪多糖测得值为评价指标,主要因素依次为加水量、提取次数、提取时间,最佳工艺为A2B2C2,即加10倍量水,提取2次,每次提取1.5 h。由验证试验结果可知,该方法工艺合理,稳定可行,可用于黄芪中多糖的提取并用于工业化生产。
3.4苯酚-硫酸法
多糖在浓硫酸作用下,脱水生成的糠醛衍生物能与苯酚缩合成一种橙红色化合物,该化合物在10~100 mg范围内其颜色深浅与糖的含量成正比,且于490 nm波长处有最大吸收,故可用比色法在此波长下测定。主要用于甲基化的糖、戊糖、多聚糖的测定,方法简便,试剂便宜,灵敏度高,试验结果基本不受蛋白质的影响,且产生颜色可稳定160 min以上。
关于黄芪多糖提取工艺的文献较多,有报道用碱水提取,但对多糖的一级结构是否有影响尚待研究。有报道用超滤法、微波技术提取,提取效率均较高,但不利于工业化大生产。本试验对水提法提取黄芪多糖进行了系统研究,结果可有效降低生产成本,提高效率。
[1]孙政华,邵晶,郭玫.黄芪化学成分及药理作用研究进展[J].中医临床研究,2015,7(25):22-25.
[2]刘德丽,包华音,刘杨.近5年黄芪化学成分及药理作用研究进展[J].食品与药品,2014,16(1):68-70.
[3]邱勇波,刘锦,武飞.黄芪化学成分及药理作用研究进展[J].中国疗养医学,2011,20(5):435-436.
[4]姚金凤,王志新,张晓勇,等.黄芪多糖对小鼠腹腔巨噬细胞免疫功能的调节作用研究[J].河南大学学报:医学版,2005,24(1):34-36.
[5]卢炜,顾蓓蓓,卢劲晔,等.黄芪多糖对小鼠免疫功能影响的研究[J].中国畜牧兽医文摘,2014,30(11):202-203.
[6]李璞.黄芪及其制剂药理作用和临床应用[J].北方药学,2013,10(9):15.
[7]陈慧,陈吉生.复方金钱草胶囊中黄芪党参提取工艺研究[J].亚太传统医药,2014,10(6):26-28.
[8]陈寿妮.黄芪多糖的提取工艺研究[J].时珍国医国药,2014,25(4):845-846.
[9]钱琳,邓楠.黄芪提取工艺研究[J].中国现代医学杂志,2009,19(11):1 605-1 608.
[10]贺义恒,张红夏,赵晔,等.恒山黄芪中黄芪多糖提取工艺研究[J].中国中医药信息杂志,2013,20(3):52-54.
[11]孙英华,刘宗彬,徐丽娟,等.黄芪多糖的超声提取工艺的研究[J].白城师范学院学报,2015,29(2):5-8.
[12]张曼,韩飞,王晶钰.黄芪多糖微波提取工艺研究进展[J].陕西农业科学,2015,61(3):85-88.
[13]崔红花,赵英日,王淑美.黄芪中黄芪多糖的提取富集工艺研究[J].时珍国医国药,2013,24(9):2 075-2 078.
[14]白翠兰,王青虎,奥·乌力吉,等.正交实验法优化蒙古黄芪中多糖提取工艺的研究[J].时珍国医国药,2013,24(3):654-655.
[15]张明晶,迟云峰.正交试验法优选黄芪西洋参口服液提取工艺的研究[J].中国药物经济学,2012(4):24-25.
[16]蓝永锋,欧国灯.苯酚硫酸法测定黄芪中多糖含量[J].药物与人,2014,27(8):14.
[17]赵强强,韩丽,潘媛,等.黄芪中黄芪多糖含量的测定[J].中国现代中药,2011,13(7):29-30.
[18]涂波,汪志勇.当归补血汤颗粒中黄芪甲苷和黄芪多糖的含量测定[J].中国实验方剂学杂志,2011,17(18):115-117.
[19]田喜莲,牟学文.黄芪多糖含量提取及测定方法研究进展[J].中国民族民间医药,2010,19(24):13-15.
[20]郭吉蓉,吴琳琳,罗明生.黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定[J].中国药房,2004,15(11):692-694.
Study on Extraction Technology of Xiyangshen Sanqi Huangqi Capsules
Wang Xianying,Wang Jun,Xie Xiangju,Li Shengrong
(Chongqing Academy of Chinese Medicine,Chongqing,China400065)
ObjectiveTodeterminetheextractiontechnologyofastragalusmembranaceusinXiyangshenSanqiHuangqiCapsules.M ethodsWith the astragalus polysaccharide content and the extraction rate as the indexes,theL9(34)orthogonal design test method was adopted to optimize the extraction technology for astragalus membranaceus.ResultsThe optimum extraction technology of astragalus membranaceus was as follows,water as solvent,conducting percolation with 10 times amounts of medicinal materials volume,extracted twice and each time lasted 1.5 h.ConclusionThe test results provide the experimental basis for determining the extraction process of astragalus membranaceus in Xiyangshen Sanqi Huangqi Capsules.
Xiyangshen Sanqi Huangqi Capsules;extraction technology;astragalus polysaccharide
TQ461;R284.1
A
1006-4931(2016)14-0023-03
王贤英(1973-),女,大学本科,副主任中药师,研究方向为药品开发及质量标准,(电子信箱)wangxianying_315@163.com;李胜容(1964-),女,大学本科,主任中药师,研究方向为药品开发及工艺,本文通讯作者,(电话)023-89029162。
2016-02-06;
2016-03-25)
*重庆市科技计划项目,项目编号:cstc2013yykfA0239。

