低温处理下东农冬麦1号小麦根组织EXPA基因的表达分析
李 飞,王晓磊,徐永清,张俊峰,董佳敏,苗 宇,冯 旭,李凤兰,胡宝忠,
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030; 2.哈尔滨学院,黑龙江哈尔滨 150086)
低温处理下东农冬麦1号小麦根组织EXPA基因的表达分析
李 飞1,王晓磊2,徐永清1,张俊峰1,董佳敏1,苗 宇1,冯 旭1,李凤兰1,胡宝忠1,2
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030; 2.哈尔滨学院,黑龙江哈尔滨 150086)
寒地冬小麦膨胀素(Expansin)基因的表达特性同根系建成密切相关,而形成发达的根系是高寒地区冬小麦成功越冬返青的关键。为明确低温对高寒地区冬小麦膨胀素基因表达特性的影响,进而提高冬小麦对寒冷的适应性,以高抗寒冬小麦东农冬麦1号为试验材料,以正常冬小麦济麦22号为对照材料,运用实时荧光定量PCR技术对经不同低温处理的小麦幼苗根组织中编码α-expansin(EXPA)的基因 TaEXPA5、 TaEXPA6和 TaEXPA7的表达特性进行分析。结果表明,在4 ℃、-10 ℃和-20 ℃低温处理下,高抗寒冬小麦东农冬麦1号中 TaEXPA5、 TaEXPA6和 TaEXPA7基因的相对表达量与对照相比呈现显著性上升,其中,4 ℃处理条件下, TaEXPA6和 TaEXPA7基因的相对表达量变化幅度较明显,-10 ℃处理条件下, TaEXPA5基因的相对表达量变化幅度较明显,-20 ℃处理条件下, TaEXPA5和 TaEXPA7基因的相对表达量变化幅度较明显。说明低温影响小麦根组织中 TaEXPA5、 TaEXPA6和 TaEXPA7基因的表达,三个基因与抗御低温胁迫具有相关性,并且各基因表达存在一定的协作性。
低温;高抗寒冬小麦;EXPA;实时定量PCR
黑龙江省位于温带大陆性季风气候地带,一般1月份气温最低达-41~-33 ℃,严重制约着越冬性冬小麦的生长[1-2]。虽然冬小麦具有一定的抗寒能力,但返青期由于温度较低而生长变缓,会导致其抗寒能力减弱,加之在高寒地区倒春寒现象频繁发生,严重限制着冬小麦种植区域的扩大[3-5]。因此,研究冬小麦的抗寒性,对于丰富植物抗寒理论、扩大高寒地区土地复种指数具有重要意义。
东农冬麦1号是2007年黑龙江省农作物品种审定委员会命名的,由东北农业大学历经13年培育而成的高抗寒品种(I级)[6]。目前,对东农冬麦1号已有所研究,但大多是有关在生理和细胞超微结构等方面来适应高寒地区气候的研究。苍 晶等[7]研究表明,温度降低时,东农冬麦1号自身保护性物质的积累及抗寒基因的表达可耐-30 ℃的低温,在黑龙江省连续5年内种植其成功越冬返青率均高于85%。冯玉磊等[8-9]研究表明,东农冬麦1号的根系较发达,对低温等胁迫具有一定抵抗力,成为冬小麦在高寒地区成功越冬的关键。而有关其分子抗冻机理方面的研究尚未有明确报道。
近年来,植物根系生长发育的调控越来越受到大家的关注,植物根系的生长发育受多基因表达、激素合成与转运及外界环境等多种因素的共同调控和影响,不仅取决于细胞数量的增加,还与细胞的自身扩展密不可分,细胞壁会在一定程度上限制植物根系细胞生长,细胞壁的膨胀是植物根系细胞伸长的前提。膨胀素(Expansin)又称扩张素或扩张蛋白,由α-expansin(EXPA)、β-expansin(EXPB)、γ-expansin(EXLA)和δ-expansin(EXLB)四个亚家族组成,是植物生长过程中释放的一种细胞壁松弛因子,影响着细胞壁的伸展,广泛参与植物根系的形态建成及生长发育[12-14]。Li等[15]研究发现,当 TaEXPB23基因在烟草中过表达时,可改变烟草幼苗根系的生长状况;陈 琰等[16]发现 TaEXPB8基因在小麦初生根的伸长区表达量最高;林 展等[17]在小麦品种3338中,成功克隆了18个膨胀素基因,其中, TaEXPA4、 TaEXPA5、 TaEXPA6和 TaEXPA8基因在根中特异性表达。俞志明等[18]认为 EXPA7基因亚家族成员都含有根毛特异性元件,一般会在根毛细胞中特异性表达。当植物处于逆境时,会通过增加扩展蛋白的积累量调节细胞壁的柔韧性,进而适应胁迫[19]。虽然目前有关低温胁迫冬小麦生长的抗冻生理研究[20-22]及激素含量的变化影响冬小麦抗寒性的研究[21-25]已有不少进展,但有关冬小麦在极度低温和温度变化较快的环境下根系形态建成的调控机制还不清楚。因此,本研究以经不同低温处理的东农冬麦1号为试验材料,分析低温对该小麦中编码EXPA的 TaEXPA5、 TaEXPA6和 TaEXPA7基因相对表达量的影响,以期为后续研究与根系建成密切相关的膨胀素基因提供新的思路。
1 材料与方法
1.1试验材料及其处理
高抗寒的冬小麦东农冬麦1号(Ⅰ级)为试验材料,正常的冬小麦济麦22号 (Ⅳ级)为对照材料,均由东北农业大学农学院小麦育种研究室提供。
东农冬麦1号和济麦22的种子经温水浸泡露白后,以行距为3 cm、株距为3 cm播种于苗钵中,出苗前培养环境设置为:光照 12 h、20 ℃,黑暗12 h、18 ℃,相对湿度70%;出苗50%后培养环境设置为:光照12 h、25 ℃,黑暗12 h、18 ℃,相对湿度70%。待植株长至三叶一心期时,选取长势一致的幼苗,分别在4 ℃、-10 ℃和-20 ℃培养箱里培养48 h,再置于室温恢复0、6、12、24、36和48 h,而温度对照材料则一直置于25 ℃的培养箱中培养,培养环境也均设置为:光照12 h/黑暗12 h。待处理完后,参照关 涛等[26]的取样方法,每个处理随机选取15株幼苗,用双蒸水洗净后剪下小麦根,分别称量0.2 g,3次重复,用锡箔纸迅速包好,液氮迅速冷冻后于-80 ℃冰箱保存备用。
1.2RNA的提取及cDNA的合成
使用天泽基因工程有限公司的植物RNA试剂盒(CAT#3080)提取总RNA。参考王 杰等[27]和白云凤等[28]的研究方法,使用UV-240紫外分光光度计检测RNA的质量和浓度,OD260/OD280=1.8~2.1,且OD260/OD230>2.0,浓度不小于500 ng·μL-1。使用琼脂糖凝胶电泳检测RNA的完整性。将符合标准的RNA使用海基生物科技有限公司的RT-PCR反转录试剂盒(Cat.No.D0501)进行第一链cDNA的合成。
1.3实时定量PCR(Quantitative real-time PCR,qRT-PCR)分析
参照林 展等[17]的研究,应用Primer Premire 5.0设计EXPA家族 TaEXPA5、 TaEXPA6和 TaEXPA7基因的qRT-PCR引物(表1)。对1.2中得到的各处理cDNA进行梯度稀释,根据Ct值确定最佳反应浓度。以确定好的最佳浓度的cDNA为模板,以小麦肌动蛋白基因β-actin为内参,采用北京全式金生物技术有限公司的SYBR Green荧光定量PCR试剂盒(AQ131)进行qRT-PCR分析。3次重复。反应体系(20 μL):2×Trans Star○RTop Green qPCR Super Mix 10 μL,正反向引物各0.4 μL,cDNA 1.0 μL,ddH2O 8.2 μL。反应在实时定量PCR仪(FQD-9620)上进行,反应程序:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 30 s,60 ℃时进行荧光信号的采集,反应完成后绘制融解曲线。采用比较Ct法(△△Ct)对荧光定量PCR的扩增数据进行处理,用2-△△Ct法计算相对表达量,采用DPS 7.05数据处理系统软件进行方差及显著性分析。
2 结果与分析
2.1不同低温处理下 TaEXPA5基因的表达
采用不同低温处理三叶期小麦幼苗,对其升至室温后根中 TaEXPA5基因的相对表达量进行分析,结果(图1)发现,在不同低温处理下,东农冬麦1号的处理组与自身材料的对照组相比, TaEXPA5基因相对表达量都明显偏高,且东农冬麦1号的处理组与济麦22号的处理组相比,相对表达量呈现稳定性变化,在-20 ℃处理时,济麦22号 TaEXPA5基因的相对表达量逐渐降低,并且未出现稳定性恢复的状态,推测东农冬麦1号 可能因为 TaEXPA5基因的表达使其适应低温胁迫。东农冬麦1号在4 ℃处理时(图1a),升至室温后根中 TaEXPA5基因的相对表达上升幅度较小,推测 TaEXPA5基因表达受4 ℃低温处理的影响最小;而-10 ℃(图1b)和-20 ℃(图1c)处理时,升至室温后根中 TaEXPA5基因的相对表达量呈现显著性升高的趋势,分别在36 h、24 h时表达量达到最大值,推测 TaEXPA5基因可能会在-10 ℃和-20 ℃条件下被诱导,与其抗御低温具有相关性。
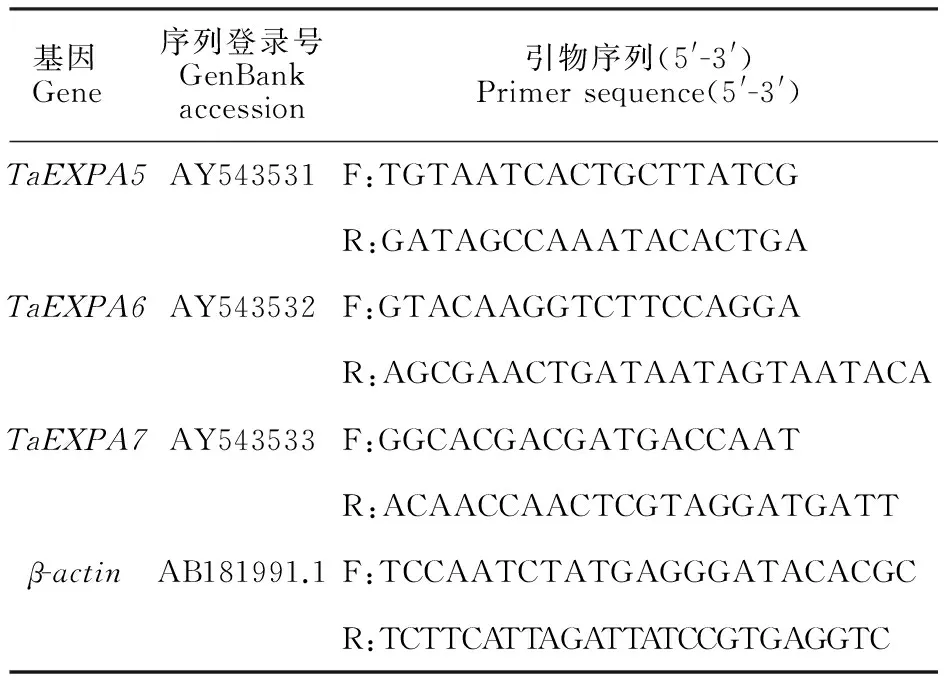
表1 qRT-PCR分析所用引物Table 1 Primers used for qRT-PCR
2.2不同低温处理下 TaEXPA6基因的表达
采用不同低温处理三叶期小麦幼苗,对其升至室温后根中 TaEXPA6基因的相对表达量进行分析,结果(图2)表明,在不同低温处理下,东农冬麦1号的处理组与自身材料的对照组相比, TaEXPA6基因相对表达量基本上都明显偏高,且东农冬麦1号的处理组与济麦22号的处理组相比,相对表达量呈现稳定性变化,在-20 ℃时,济麦22号中 TaEXPA6基因的相对表达量逐渐降低,并且未出现稳定性恢复的状态,推测东农冬麦1号能抵御低温的胁迫,可能与 TaEXPA6基因的表达有关。东农冬麦1号在4 ℃(图2a)处理时,升至室温后根中 TaEXPA6基因的相对表达量呈现显著性升高的趋势,在48 h表达量达到最大值,而-10 ℃(图2b)和-20 ℃(图2c)处理时,升至室温后根中 TaEXPA6基因的相对表达上升幅度较小,说明 TaEXPA6基因的表达可能受到4 ℃低温处理的诱导。
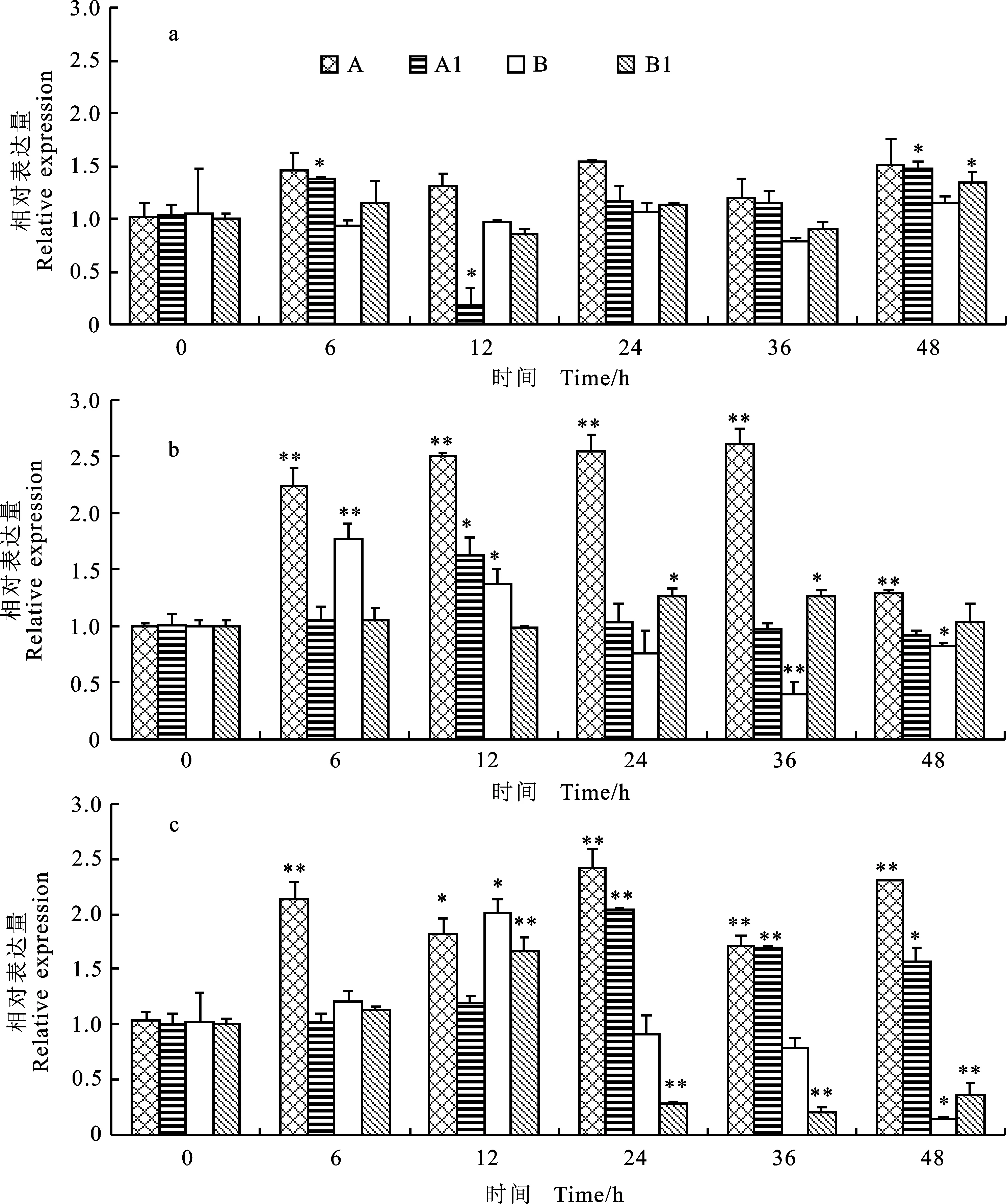
a:4 ℃处理;b:-10 ℃处理;c:-20 ℃处理;A:东农冬麦1号处理组;A1:东农冬麦1号对照组;B:济麦22号处理组;B1:济麦22对照组;*和**分别表示室温恢复一段时间后的相对表达量与室温恢复0 h的相对表达量在0.05和0.01水平上差异显著。下同。
a:Treatment under 4 ℃; b:Treatment under -10 ℃; c:Treatment under -20 ℃; A:Dongnongdongmai 1 under low temperature treatment; A1:Dongnongdongmai 1 without treatment; B:Jimai 22 under low temperature treatment; B1:Jimai 22 without treatment; * and ** indicate significant difference between the relative expression ofEXPAgene in the material recovering for a period at room temperature and the relative expression ofEXPAgene in the same material recovering for 0 h at room temperature at 0.05 and 0.01 levels,respectively.The same as below.
图1不同温度处理下 TaEXPA5基因的相对表达量
Fig.1Relative expression of TaEXPA5 gene under the treatments of different temperature
2.3不同低温处理下 TaEXPA7基因的表达
采用不同低温处理三叶期小麦幼苗,对其升至室温后根中 TaEXPA7基因的相对表达量进行分析,结果(图3)表明,在不同低温处理下,东农冬麦1号的处理组与自身材料的对照组相比, TaEXPA7基因相对表达量基本上都明显偏高,且东农冬麦1号的处理组与济麦22号的处理组相比,相对表达量呈现稳定性变化,在-20 ℃时,济麦22号 TaEXPA7基因的相对表达量逐渐降低,并且未出现稳定性恢复的状态,推测可能由于 TaEXPA7基因的存在使东农冬麦1号具有较强的抗寒性。东农冬麦1号在-10 ℃(图1b)处理时,升至室温后根中 TaEXPA7基因的相对表达上升幅度较小,随恢复期时间的延长,变化量几乎不变趋于平稳状态,而4 ℃(图1a)和-20 ℃(图1c)处理时,升至室温后根中 TaEXPA7基因的相对表达量呈现显著性升高的趋势,分别在24 h、48 h表达量达到最大值,说明 TaEXPA7基因的表达受到-10 ℃低温处理的影响最小,而4 ℃和-20 ℃的温度处理会诱导 TaEXPA7基因的表达。
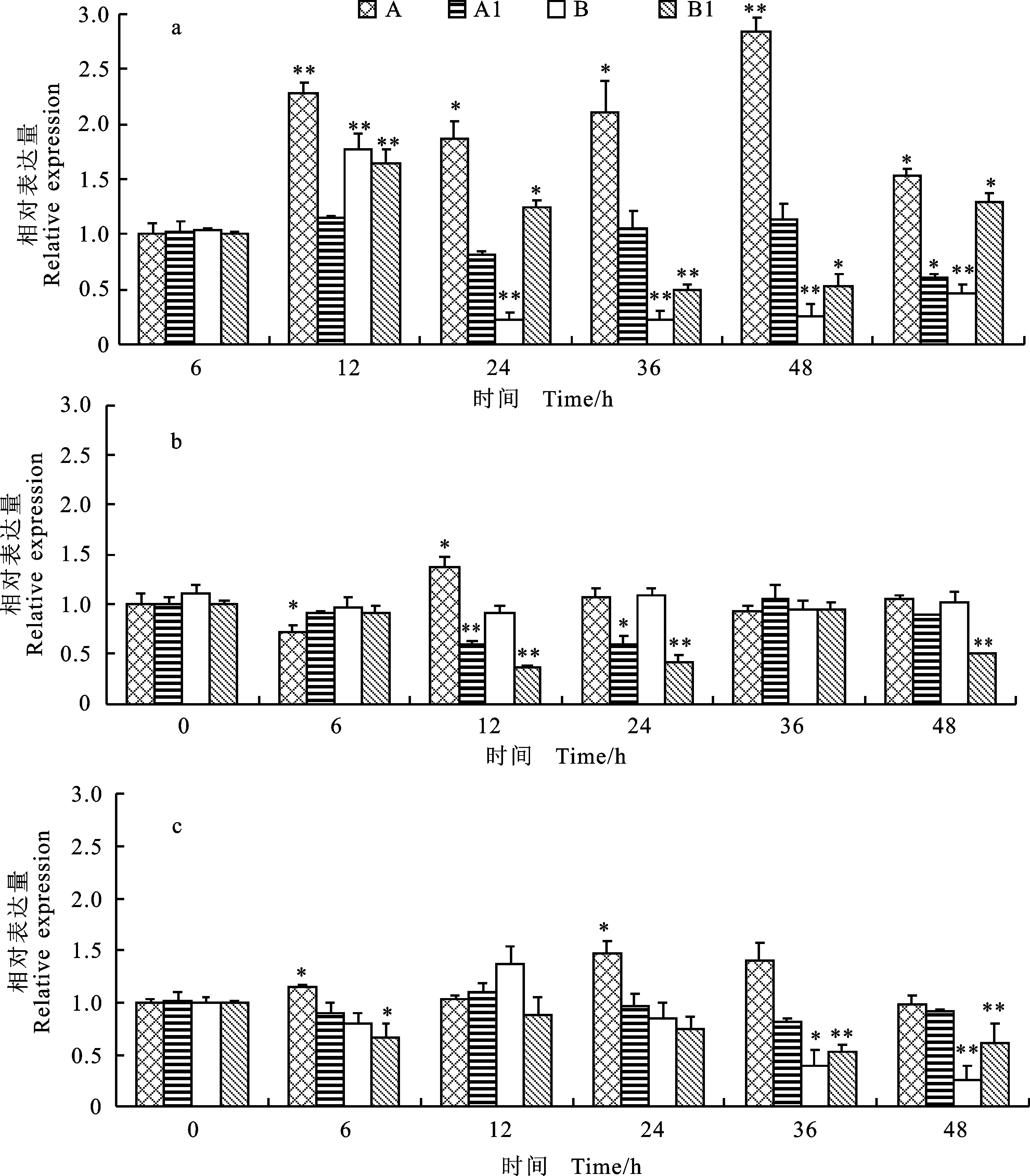
图2 不同温度处理下 TaEXPA6基因的相对表达量
3 讨 论
寒害是影响高寒地区冬小麦种植的主要因素,因此研究抗寒基因的表达对高寒地区尤为重要。研究表明,低温胁迫促使植物体内积累或合成大量蛋白及参与应激耐受性相关的小分子来抵御低温,但不同品种的冬小麦抗寒性差异显著[29-30]。本研究通过对冬小麦不同品种的三个基因研究显示,不同低温处理下,高抗寒冬小麦东农冬麦1号的处理组与自身材料的对照组及正常冬小麦济麦22号的对照组相比,基因相对表达量呈明显上升趋势,推测高抗寒冬小麦东农冬麦1号可在黑龙江地区种植与该植物中存在 TaEXPA5、 TaEXPA6和 TaEXPA7基因密切相关,三个基因相对表量的大小可能与其抗御低温胁迫的能力呈 现正相关。同时,发现三个基因相对表达量达到最高值时时间点不同,推测各基因间的表达存在一定的协作性,与Liu等[31]、Wu等[32]和Palapol等[33]有关基因之间共同发挥作用调控植物生长发育的研究进程一致。
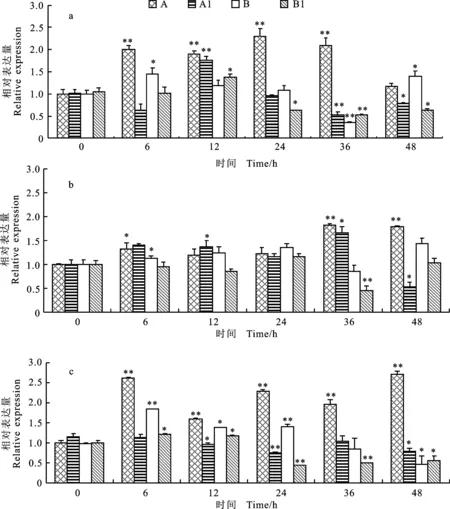
图3 不同温度处理下 TaEXPA7基因的相对表达量
本研究还得知,不同低温处理,在相同抗寒性品种中相同膨胀素基因的相对表达量会存在差异;相同低温处理,在不同抗寒性品种中相同膨胀素基因的相对表达量也不同,推测可能与 TaEXPA5、 TaEXPA6和 TaEXPA7基因所行使的功能不同有关。但当植物伴随着在室温中恢复时间的延长,高抗寒冬小麦东农冬麦1号基因的相对表达量均发生稳定性恢复。陈儒钢等[34]研究也表明,在基因表达受到胁迫时,基因表达量会升高,但当低温胁迫时间延长时,基因的表达量会急剧下降,在恢复期逐渐恢复正常。但在-20 ℃处理条件下,在对照材料正常冬小麦济麦22号中发现当室温恢复48 h时, TaEXPA5、 TaEXPA6和 TaEXPA7基因的相对表达量会突然下降,且并未表现恢复生长的状态,推测可能在极度低温条件下,高抗寒冬小麦可能因为 TaEXPA5、 TaEXPA6和 TaEXPA7基因的快速表达从而抵御低温的胁迫而成功越冬;正常冬小麦在受到低温胁迫时,EXPA基因尚未快速表达,从而影响正常冬小麦的生长机制导致不能成功完成越冬返青。
王晓楠等[22]研究发现,分蘖节和根系的损害程度决定冬小麦能否成功越冬返青,发达的根系和健壮的分蘖节有利于冬小麦成功越冬。在研究激素处理拟南芥根系实验中,Cho等[35]和Lin等[36]发现,当在根中 AtEXP7基因转录水平提高7倍时,根毛生长区表皮细胞所占总表皮细胞数的比例增加了约38%。而生长区是根系生长的主要区域,对高寒地区冬小麦的成活有着重要影响。本实验中,当低温处理冬小麦时,高抗寒冬小麦东农冬麦1号中编码EXPA的三个基因的相对表达量与自身材料的对照组及正常冬小麦济麦22号的对照组相比呈现显著性上升,猜测在低温处理下,根中编码EXPA的三个基因相对表达量的提高,可能会使根毛生长区表皮细胞增多,从而降低根系在寒冷情况下的受损情况。高抗寒的冬小麦东农冬麦1号在高寒地区能够成功越冬,猜测离不开 TaEXPA5、 TaEXPA6和 TaEXPA7基因的相互作用,三个基因可能参与低温胁迫下植物根系的形态建成,成功完成冬小麦在高寒地区的越冬返青。但是,目前对于EXPA基因表达是如何调控根系生长的,以及与冬小麦抗寒之间的作用机理还有待于进一步研究。
[1]佟明耀,郑家兰,李卓夫,等.高寒地区超强抗寒新品种“东农冬麦1号”的选育[J].东北农业大学学报,2010,41(7):1-4.
TONG M Y,ZHENG J L,LI Z F,etal.Research on breeding new winter wheat cultivar “Dongnongdongmai 1”of super-freezing tolerance in frigid region [J].JournalofNortheastAgriculturalUniversity,2010,41(7):1-4.
[2]祖世亨,曲成军,高英姿,等.黑龙江省冬小麦气候区划研究[J].中国生态农业学报,2001,9(4):85-88.
ZU S H,QU C J,GAO Y Z,etal.Division of winter wheat planting area based on climate in Heilongjiang province [J].ChineesJournalofEeo-Agrieultue,2001,9(4):85-88.
[3]肖世和.优质高产小麦育种术研究及新品种培育 [M].北京:中国农业科学技术出版社,2011:47-58.
XIAO S H.Study on the Breeding Technique and Cultivate New Varieties of High-yielding Wheat [M].Beijing:China Agricultural Science and Technology Press,2011:47-58.
[4]杨建辉,巨 伟,杨学举.冬小麦冻害成因及其抗寒机理与对策[J].河南农业科学,2011,15(1):33-36,40.
YANG J H,JU W,YANG X J.Cold resistance mechanism and countermeasures of winter wheat [J].JournalofHenanAgriculturalSciences,2011,15(1):33-36,40.
[5]于 晶,张 林,崔 红,等.高寒地区冬小麦东农冬麦1号越冬前的生理生化变化[J].作物学报,2008,34(11):2019-2025.
YU J,ZHANG L,CUI H,etal.Physiological and biochemical characteristics of Dongnongdongmai 1 before wintering in high-cold area [J].ActaAgronomicaSinica,2008,34(11):2019-2025.
[6]李卓夫,晁美丽,王晓楠,等.寒地冬小麦CBF转录因子的克隆与表达分析[J].东北农业大学,2013,44(4):30-35.
LI Z F,CHAO M L,WANG X N,etal.Cloning and expression analysis of CBF transcription factor gene in winter wheat in frigid region [J].JournalofNortheastAgriculturalUniversity,2013,44(4):30-35.
[7]苍 晶,于 晶,崔 红,等.寒地冬小麦对低温逆境的生理适应[J].核农学报,2011,25(5):1017-1022.
CANG J,YU J,CUI H,etal.Physiological adaptability of Dongnongdongmai 1 to low temperature stress of high-cold area [J].JournalofNuclearAgriculturalSciences,2011,25 (5):1017-1022 .
[8]冯玉磊.寒地冬小麦返青期低温响应的生理特性与蛋白质组分析[D].哈尔滨:东北农业大学,2012:2-5.
FENG Y L,Analysis on physiological characters and proteomics in response to cold during spring regrowing period in winter wheat in frigid region [D].Harbin:Northeast Agricultural University,2012:2-5.
[9]王晓楠,付连双,李卓夫,等.低温驯化及封冻后不同抗寒性小麦品种的形态建成及生理基础分析[J].作物学报,2009,35(7):1313-1319.
WANG X N,FU L S,LI Z F,etal.Morphogenesis and physiological basis in wheat cultivars with different levels of cold-resistance during cold acclimation and freezing period [J].ActaAgronomicaSinica,2009,35(7):1313-1319.
[10]CARSON E W.The Plant Root and Environment [M].Charlottesville:The University Press of Virginia,1974:293-234.
[11]WON S K,CHOI S B,KUMARI S,etal.Root hair-specific EXPANSIN B genes have been selected for graminaceae root hairs [J].MoleculesandCells,2010,30(4):369-376.
[12]YU Z M,KANG B,HE X W,etal.Root hair-specific expansins modulate root hair elongation in rice [J].ThePlantJournal,2011,66(5):725-734.
[13]赵运军,李来庚.植物细胞壁松弛因子[J].植物生理学报,2011,47(10):925-935.
ZHAO Y J,LI L G.Plant cell wall loosening factors [J].PlantPhysiologyJournal,2011,47(10):925-935.
[14]施 杨,徐 筱,李昊阳,等.水稻扩展蛋白家族的生物信息学分析[J].遗传,2014,36(8):809-820.
SHI Y,XU Y,LI H Y,etal.Bioinformatics analysis of the expansin gene family in rice [J].Hereditas,2014,36(8):809-820.
[15]LI F,XING S C,GAO Q,etal.Drought tolerance through over-expression of expansin gene TaEXPB23 in transgenic tobacco [J].JournalofPlantPhysiology,2011,168(9):960-966.
[16]陈 琰,钟伶桃,姚颖垠,等.小麦膨胀素基因 TaEXPA8 部分同源cDNA序列的克隆、定位及表达分析[J].农业生物技术学报,2010,18(4):645-653.
CHEN Y,ZHONG L T,YAO Y Y,etal.cDNA cloning,chromosome location and expression analysis of TaEXPB8 homeologous gene in wheat [J].JournalofAgriculturalBiotechnology,2010,18(4):645-653.
[17]林 展.小麦膨胀素基因的分离、克隆与功能鉴定[D].北京:中国农业大学,2005:72-75.
LIN Z.Identification and functional characterization of wheat expansin genes [D].Beijing:China Agricultural University,2005:72-75.
[18]俞志明.EXPA7亚家族调控水稻根苗伸长机制研究[D].杭州:浙江大学,2010:46-48.
YU Z M.Regulated mechanism of EXPA7subclade members on rice root hair elongation [D].Hangzhou:Zhejiang University,2005:46-48.
[19]赵美荣,李永春,王 玮.扩展蛋白与植物抗逆性关系研究进展[J].植物生理学报,2012,48(7):637-642.
ZHAO M R,LI Y C,WANG W.Research progress on relationship between expansin and plant resistance [J].PlantPhysiologyJournal,2012,48(7):637-642.
[20]孙苗苗,王志强,高 翔,等.河南主推小麦品种对低温胁迫的生理响应及耐寒性分析[J].麦类作物学报,2016,36(3):1-9.
SUN M M,WANG Z Q,GAO X,etal.Cold tolerance evaluation of wheat varieties in Henan based on their physiological response to low temperature stress [J].JournalofTriticeaeCrops,2016,36(3):1-9.
[21]杨春玲,宋志均,陈玉香,等.小麦抗寒性机理研究[J].山西农业科学,2008,36(1):49-52.
YANG C L,SONG Z J,CHEN Y X,etal.Study on mechanism of cold resistance in wheat [J].JournalofShanxiAgricultureSciences,2008,36(1):49-52.
[22]王晓楠,谢冬微,付连双,等.不同抗寒性冬小麦叶鞘质膜的稳定性表现[J].麦类作物学报,2013,33(3):477-482.
WANG X N,XIE D W,FU L S,etal.Plasma membrane stability in leaf sheath of cold-area winter wheat with different cold resistance [J].JournalofTriticeaeCrops,2013,33(3):477-482 .
[23]TAYLOR I B,BURBIDAGE Q,THOMPSON A J,etal.Control of abscisic acid synthesis [J].JournalofExperimentalBotany,2000,51(350):1563-1574.
[24]赵浡彤,徐庆华,李 速,等.外源ABA及其合成抑制剂对冬小麦叶片抗寒指标的影响[J].麦类作物学报,2015,35(8):1176-1181.
ZHAO B T,XU Q H,LI S,etal.Effects of exogenous ABA and synthesis inhibitor on cold resistance indicators of winter wheat leaves [J].JournalofTriticeaeCrops,2015,35(8):1176-1181.
[25]王 兴,徐 琛,苍 晶,等.外源6-BA对小麦种子萌发及越冬期植株冻害的缓解作用[J].麦类作物学报,2013,33(2):357-363.
WANG X,XU C,CANG J,etal.Exogenous 6-BA affects seed germination and mitigates the frost damage of plants in wheat [J].JournalofTriticeaeCrops,2013,33(2):357-363.
[26]关 涛,李卓夫,王晓楠,等.冷驯化和冷冻条件下不同抗寒性冬小麦品种三个COR基因表达差异的实时荧光定量分析[J].麦类作物学报,2013,33(2):230-235.
GUAN T,LI Z F,WANG X N,etal.qRT-PCR expression analysis of threeCORgenes in two winter wheat varieties with different cold resistance under cold acclimation and fresszing conditions [J].JournalofTriticeaeCrops,2013,33(2):230-235.
[27]王 杰,王 全,田 娜,等.不同植物织RNA提取方法的比较分析[J].北京农学院学报,2015,30(1):76-80.
WANG J,WANG Q,TIAN N,etal.Comparison and analysis of RNA extracting method from different plant tissues [J].JournalofBeijingUniversityofAgriculture,2015,30(1):76-80.
[28]白云凤,郭志华,白冬梅,等.马铃薯总RNA提取和鉴定方法的改进[J].园艺学报,2007,34(4):1059-1062.
BAI Y F,GUO Z H,BAI D M,etal.An improved method for extraction and identification of potato RNAs [J].ActaHorticulturaeSinica,2007,34(4):1059-1062.
[29]MASTRANGELO A M,BELLONI S,BARILLI S,etal.Low temperature promotes intron retentionin twoe-corgenes of durum wheat [J].Planta,2005(5),221:705-715.
[30]彭筱娜,易自力,蒋建雄.植物抗寒性研究进展[J].生物技术通报,2007(4):15-18.
PENG X N,YI Z L,JIANG J X.Progress in the study of cold resistance in plant [J].BiotechnologyBulletin,2007(4):15-18.
[31]LIU X W,MA Y Y,ZHANG M H,etal.Research advances in expansins and expansion-like proteins involved in lignocellulose degradation [J].BiotechnologyLetters,2015,37:1541-1551.
[32]WU Y J,SHARP R E,DURACHKO D M,etal.Growth maintenance of the maize primary root at low water potentials involves increases in cell-wall extension properties,expansin activity,and wall susceptibility to expansins [J].PlantPhysiology,1996,111:765-772.
[33]PALAPOL Y,KUNYAMEE S,THONGKHUM M,etal.Expression of expansin genes in the pulp and the dehiscence zone of ripening durian (Duriozibethinus) fruit [J].JournalofPlantPhysiology,2015,182(15):33-39.
[34]陈儒钢,朱文超,巩振辉,等.辣椒水通道蛋白基因CaAQP的克隆与序列分析[J].中国农业科学,2010,43(20):4323-4329.
CHEN R G,ZHU W C,GONG Z H,etal.Cloning and sequence analysis of the aquaporins geneCaAQPin pepper [J].ScientiaAgriculturaSinica,2010,43(20):4323-4329.
[35]CHO H T,COSGROVE D J.Regulation of root hrir initiation and expansin gene expression inArabidopsis[J].ThePlantCell,2002,14:3237-3253.
[36]LIN C F,CHOI H S,CHO H T.Root hair-specific EXPANSIN A7 is required for root hair elongation inArabidopsis[J].MoleculesandCells,2011,31(4):393-397.
Expression Analysis ofEXPAGene in Root Tissues of Winter Wheat Dongnongdongmai 1 under Low Temperature Treatment
LI Fei1,WANG Xiaolei2,XU Yongqing1,ZHANG Junfeng1,DONG Jiamin1,MIAO Yu1,FENG Xu1,LI Fenglan1,HU Baozhong1,2
(1.College of Life Sciences,Northeast Agricultural University,Harbin,Heilongjiang 150030,China;2.Harbin University,Harbin,Heilongjiang 150086,China)
The expression characteristics of expansin genes in winter wheat in cold region are closely associated with the establishment of root system. Thus,forming developed root system is crucial for winter wheat to overwinter and return green successfully in cold region. In order to investigate the effect of low temperature on the expression characteristics of expansin genes in winter wheat and enhance its adaptation in chilling condition,in this study,the expression characteristics of seedling root tissues TaEXPA5, TaEXPA6 and TaEXPA7 genes were analyzed in different low temperature by quantitative real-time PCR with the cold-resistance variety Dongnongdongmai 1 as experiment material and cold-sensitive variety Jimai 22 as control. The results showed that compared with control sample,the expression of TaEXPA5, TaEXPA6 and TaEXPA7 genes in Dongnongdongmai 1 was significantly higher under 4 ℃,-10 ℃ and -20 ℃,respectively. The relative expression of TaEXPA6 and TaEXPA7 genes changed distinctly under 4 ℃. Similarly,under the treatment of -10 ℃,the variation of TaEXPA5 expression was definitely large. At the meanwhile,the relative expression of TaEXPA5 and TaEXPA7 genes changed significantly under the treatment of -20 ℃. It indicates that low temperature has effect on the expression of TaEXPA5, TaEXPA6 and TaEXPA7 genes in root tissues of winter wheat. These three genes are correlated to resist the low temperature stress and there exists certain cooperation among the expression of the three genes.
Low temperature; Winter wheat with high cold resistance; EXPA; Quantitative real-time PCR
2016-02-26
2016-05-25
国家基础科学人才培养基金项目(J1210069);中俄国际合作项目(2013DFR30270)
E-mail:1083660391@qq.com
李凤兰(E-mail:lifenglan@neau.edu.cn);胡宝忠(E-mail:bzhu@neau.edu.cn)
S512.1;S330
A
1009-1041(2016)09-1159-08
网络出版时间:2016-08-31
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160831.1649.012.html

