添加糖化酶和酵母菌对24.0℃条件下启动豆粕固体发酵的影响
陈雷,李杰*,张刘运,王立群,齐虹,李马成,徐长跃
(1.东北农业大学动物科学技术学院,黑龙江哈尔滨150030;2.黑龙江省华森畜牧科技有限公司,黑龙江哈尔滨150030)
添加糖化酶和酵母菌对24.0℃条件下启动豆粕固体发酵的影响
陈雷1,李杰1*,张刘运2,王立群2,齐虹2,李马成1,徐长跃1
(1.东北农业大学动物科学技术学院,黑龙江哈尔滨150030;2.黑龙江省华森畜牧科技有限公司,黑龙江哈尔滨150030)
本试验选用枯草芽孢杆菌发酵豆粕,研究24.0℃条件下添加糖化酶和酵母菌对启动豆粕固体发酵的影响。试验分为A(对照)、B、C、D组,A组启动发酵温度为32.0℃,B、C、D组启动发酵温度分别为23.7、24.4、24.0℃,其中B组不添加升温物质,C组添加2‰糖化酶,D组添加2‰糖化酶+1‰酵母菌。测定发酵过程中温度、pH值的变化,以及发酵后豆粕的营养成分和抗营养因子变化。结果表明:D组发酵过程中升温速度比B、C组快,但低于对照组;D组发酵后粗蛋白质含量较对照组提高1.14%(P>0.05);小肽含量降低1.72%(P>0.05),抗营养因子中脲酶和胰蛋白酶抑制因子含量分别降低48.67%(P<0.05)和27.71%(P>0.05)。试验表明,在24.0℃条件下启动豆粕固体发酵,通过添加2‰糖化酶+1‰酵母菌,可以使发酵温度得到较快提升,能够节约一定的能源。
发酵豆粕;温度;营养成分;抗营养因子
发酵豆粕是一种优质的植物性蛋白饲料,与未发酵的豆粕相比,具有抗营养因子明显降低、常规营养成分得到改善、富含多种活性因子、适口性好、抗菌能力强等营养特性。戚薇和唐翔宇(2008)采用固体发酵法发酵豆粕,菌种为纳豆芽孢杆菌和凝结芽孢杆菌,两种菌的比例为1∶1,发酵后豆粕的蛋白水解度为20.14%,胰蛋白酶抑制因子比发酵前降低了95%,发酵后豆粕中含有蛋白酶、乳酸、小肽等活性因子。发酵豆粕在畜禽生产中应用广泛,可以提高畜禽生产性能,改善肠道功能,降低仔猪腹泻率等。冯杰等(2007)研究发现,在仔猪日粮中添加发酵豆粕,饲料增重比、腹泻指数、血清尿素氮分别降低8.39%(P<0.05)、39.96%(P<0.01)、39.47%(P<0.01)。
菌种生长繁殖的适宜温度在35℃左右,所以豆粕发酵的启动温度应该在30℃以上,在北方地区由于气候寒冷,想要达到与南方相同的发酵启动温度,就需要消耗更多的能源。本试验根据北方地区寒冷的气候特点,用枯草芽孢杆菌启动豆粕固体发酵,通过在豆粕培养基中添加糖化酶和酵母菌,研究其对24.0℃条件下启动豆粕固体发酵的影响。
1 材料与方法
1.1试验材料菌种:枯草芽孢杆菌、酿酒酵母菌。豆粕、米糠、糖蜜、菌体蛋白等由黑龙江华森畜牧科技有限公司提供。
液体种子培养基:蛋白胨10 g,牛肉膏5 g,酵母膏5 g,氯化钠5 g,葡萄糖5 g,水1000 mL,121℃灭菌15 min。
豆粕培养基:豆粕870 kg,米糠60 kg,菌体蛋白80 kg,尿素15 kg,糖蜜40 L,水400 L。
1.2试验方法固体发酵选择枯草芽孢杆菌为发酵菌种,糖化酶和酵母菌作为升温物质。试验共分为4组(A、B、C、D),每组分别添加2‰的芽孢杆菌,A组选择32.0℃作为发酵启动温度,即对照组,B、C、D组发酵启动温度分别为23.7、24.4、24.0℃,对照组的启动温度为较高温度水混合豆粕培养基后的温度,试验组的启动温度为较低温度水混合豆粕培养基后的温度,其中B组不添加升温物质,C组在豆粕培养基中添加2‰糖化酶,D组在添加糖化酶基础上额外添加1‰的酵母菌。每组进行3个重复,每个重复发酵1 t豆粕。
本试验先将豆粕、米糠、菌体蛋白、尿素等培养基铺于地面,培养好的菌种加到水中活化0.5 h,待菌种活化后,将糖蜜、糖化酶加到水中溶解,最后和豆粕培养基混匀。每吨豆粕培养基混匀后分别为长3 m、上宽1 m、下宽1.5 m、高0.8 m的梯形体。每隔4 h测定一次发酵过程中温度变化,每隔8 h取一次样,测定发酵过程中pH值的变化。分别于豆粕培养基的正中间取样,以及距离中间各0.75 m共三个点取三次样,然后混匀。由于枯草芽孢杆菌属于好氧菌种,待发酵温度上升到50℃以上,对豆粕培养基翻一次料,给芽孢杆菌补充氧气,当发酵温度再次上升到50℃以上,发酵结束。发酵结束后,测定湿样的菌数和pH值,然后将湿样放入烘箱中65℃烘干,粉碎过60目筛,分别测得各组豆粕发酵后的营养成分和抗营养因子的变化。
1.3测定指标及方法粗蛋白质测定方法为采用国家标准GB/T 6432-1994的凯氏定氮法。小肽测定方法为国家饲料大豆肽粉标准QB/T 2653-2004。粗灰分测定方法为采用国家标准GB/T 6438-1992的灼烧法。粗纤维测定方法为采用国家标准GB/T 6434-1994的酸碱法。氨基酸测定方法采用国家标准GB/T 18246-2000。有益菌活菌数采用涂平板法。温度采用电子温度计测定。pH值用pH计测定。胰蛋白酶抑制因子采用BAPNA法测定。脲酶活性采用滴定法测定。
1.4数据统计试验数据采用SPSS 17.0软件进行单因素方差分析,测定结果以“平均值±标准差”表示。
2 结果
2.1豆粕发酵过程中温度的变化由图1可知,对照组启动温度较高为32.0℃,试验组启动温度较低,分别为23.7、24.4、24.0℃。发酵开始后由于室温低于20℃,所以发酵温度有小幅的降低,发酵8 h以后,温度开始逐渐升高,对照组由于启动温度较高,24 h后温度达到51.4℃,比试验组提前16 h进行翻料,翻料之后发酵温度降低到45.2℃,40 h后温度上升到53.0℃,之后温度保持稳定;C、D组发酵24 h后温度到达30℃以上,到达30℃以后,D组比B、C组升温较快,发酵40 h后D组温度达到51.2℃,64 h之后发酵温度上升到56.0℃,发酵时间多于对照组24 h。
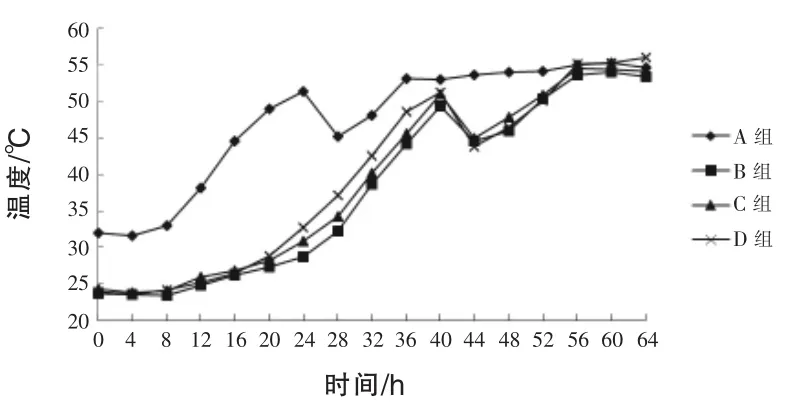
图1 豆粕发酵过程中的温度变化
2.2豆粕发酵过程中pH值的变化由图2可知,对照组和试验组起始pH值分别为6.34、6.20、6.46、6.72。在发酵的开始阶段,pH值上升,到16 h之后D组pH值上升到最高,为8.40,B、C组和对照组pH值在32 h后上升到最大,分别为8.06、7.42、7.68。随着发酵的进行,各组pH值开始下降,其中对照组pH值下降的最快,发酵结束之后pH值分别为5.86、5.78、5.56、5.70,各组之间差异不大。
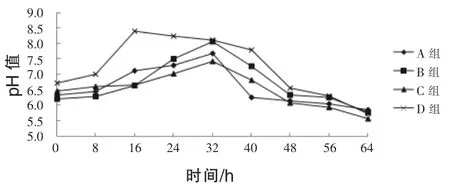
图2 豆粕发酵过程中pH值的变化
2.3豆粕发酵后营养成分的变化由表1可知,豆粕发酵后粗蛋白质、小肽含量均极显著高于发酵前含量(P<0.01)。D组粗蛋白质含量与对照组相比,提高1.14%(P>0.05);各试验组小肽含量分别较对照组降低6.24%、2.90%、1.72%,其中D组小肽含量高于B组4.82%(P<0.05);发酵后各组菌数、粗灰分、粗纤维、水分含量差异均不显著(P>0.05)。
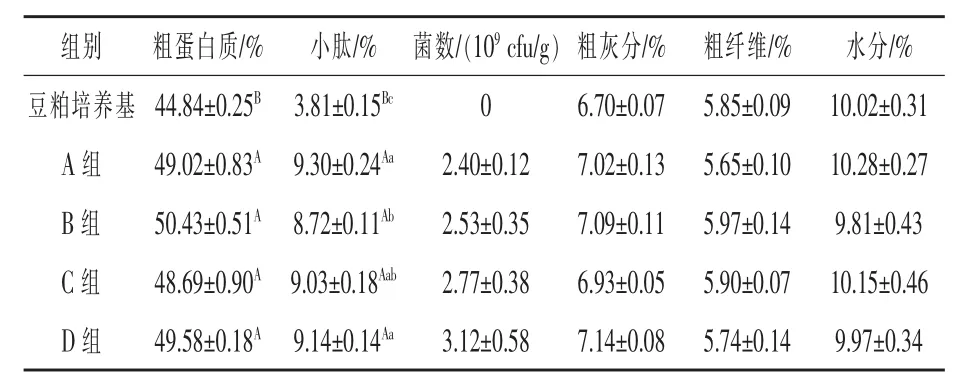
表1 豆粕发酵后营养成分的变化
2.4豆粕发酵后氨基酸含量的变化由表2可知,发酵后大部分氨基酸含量均有所提高,其中提高较多的有谷氨酸、蛋氨酸和丙氨酸,而胱氨酸、精氨酸等有小幅降低。发酵后各组氨基酸总量分别提高了5.41%、8.06%、0.72%、4.58%。试验组和对照组相比,C组氨基酸总量分别低于其他三组4.44%、6.79%、3.69%,B组氨基酸总量最高,高于对照组2.52%,D组低于对照组0.78%。
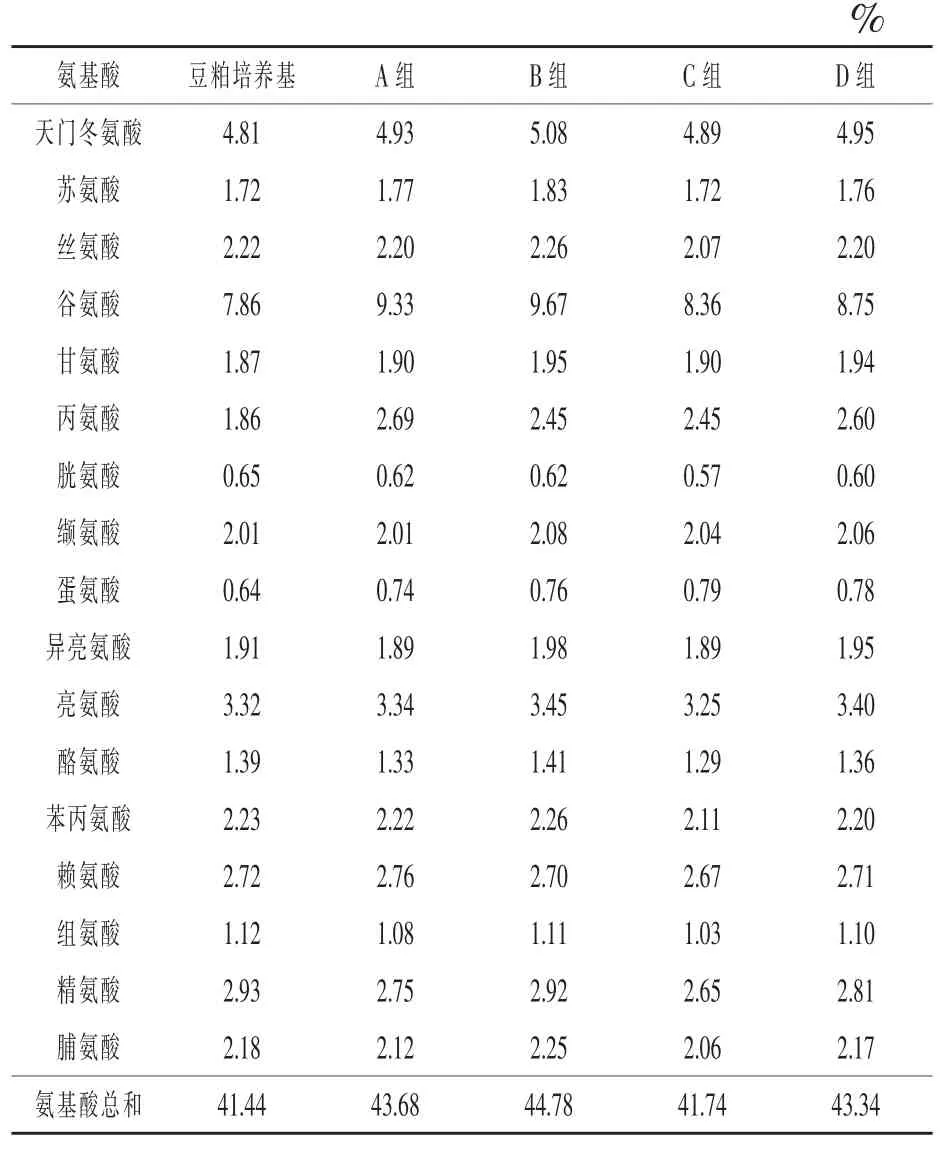
表2 豆粕发酵后氨基酸含量的变化
2.5豆粕发酵后抗营养因子的变化由表3可知,发酵后豆粕中的脲酶和胰蛋白酶抑制因子的含量均极显著低于发酵前(P<0.01)。发酵后各组相比,D组中脲酶含量降低最多,分别低于其他三组48.67%、40.82%、53.23%;发酵后各组中胰蛋白酶抑制因子比发酵前分别降低了32.46%、56.24%、47.95%、51.17%,D组和对照组相比,降低27.71%(P>0.05)。
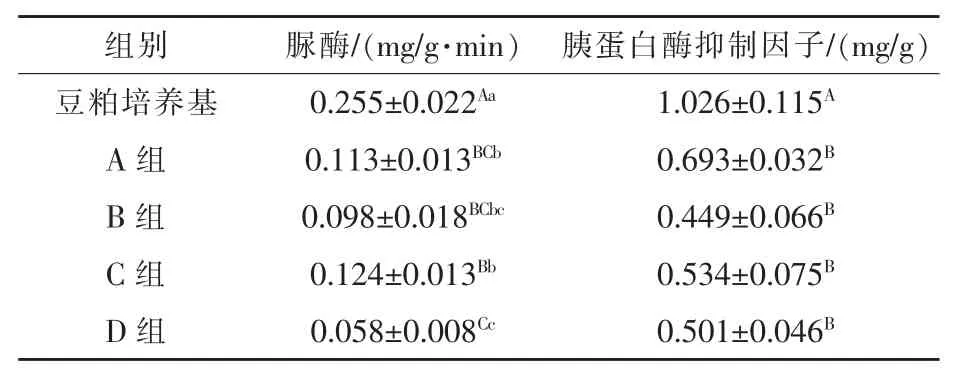
表3 豆粕发酵后抗营养因子的变化
3 讨论
3.1发酵过程中温度、pH值的变化本试验结果表明,对照组的发酵温度上升速度快于各试验组,这主要由于对照组启动发酵的温度为32.0℃,适于菌种生长和繁殖,各试验组之间在发酵开始阶段升温变化不大,当发酵温度上升到30℃以后,C组比B组升温快,这主要是由于30℃之后,糖化酶将豆粕中的碳水化合物分解为葡萄糖等单糖,释放能量,从而使发酵温度升高。王卫国等(1996)研究表明,糖化酶的最适温度为32℃,加酶量为0.2%,主要发酵周期能够缩短2~3 d。本试验D组升温比B、C组快,这主要是由于酵母菌在呼吸过程中产热。张红和褚西宁(1996)认为,由于酵母菌进行呼吸作用,消耗了部分有机物而产生热量,从而使温度升高。发酵结束后,D组发酵温度上升到56.0℃,试验组的发酵时间多于对照组24 h。豆粕发酵开始阶段各组pH值都有所上升,有可能是因为菌体在繁殖代谢过程中产生了一些使pH值升高的物质,随着发酵的进行pH值开始降低,这是因为芽孢杆菌在繁殖过程中产生有机酸类物质,使发酵豆粕的pH值降低。发酵结束后,各组pH值差异不大。
3.2发酵过程中营养成分的变化发酵豆粕与普通豆粕相比,营养成分得到改善,并且富含多种活性因子。蔡国林等(2008)发现,用酵母菌和乳酸菌发酵豆粕,发酵后粗蛋白质的含量为49.7%,比发酵前提高了3.5%。吴胜华等(2009)用酵母菌发酵豆粕,小肽含量由1.6%上升到8.7%。Hong等(2004)研究发现,发酵后豆粕中的大分子蛋白有一部分降解为小于20 kDa的小分子肽类。本试验结果表明,豆粕发酵后各组粗蛋白质含量均显著高于发酵前(P<0.01),这主要是由于微生物在繁殖代谢过程中利用了豆粕中的碳水化合物,出现了蛋白质的“浓缩效应”(汤红武等,2003)。试验组和对照组相比,粗蛋白质含量差异不显著(P>0.05);发酵后各组小肽含量均显著高于发酵前(P<0.01),主要是由于在发酵过程中菌体产生蛋白酶,将豆粕中的一部分大分子蛋白分解为小分子肽类,从而提高了发酵豆粕中小肽含量,发酵后各组间相比,试验D组小肽含量低于对照组1.72%(P>0.05);发酵后各组粗纤维、菌数、粗灰分和水分含量相比,并没有显著差异(P>0.05)。
3.3发酵过程中氨基酸含量的变化由于微生物在发酵过程中会产生降解大分子蛋白的酶类,不仅蛋白质含量提高,也增加了氨基酸含量。杨旭等(2008)发现豆粕发酵后,赖氨酸、苏氨酸、蛋氨酸含量分别增加了16.28%、17.01%、56.41%,17种氨基酸总量比发酵前增加了6.58%。马文强等(2008)研究发现,用枯草芽孢杆菌发酵豆粕后大部分氨基酸含量有所增加,氨基酸总量增加了11.49%。Refstie等(2001)发现,用乳酸菌发酵豆粕,发酵后蛋氨酸、苏氨酸和缬氨酸含量有所提高,亮氨酸、苯丙氨酸等含量有所下降。本试验结果表明,发酵后大部分氨基酸含量有所提高,氨基酸总量比发酵前分别提高了5.41%、8.06%、0.72%、4.58%;发酵后各组相比,C组氨基酸总量提高较少,D组低于对照组0.78%,但差异不大。
3.4发酵过程中抗营养因子的变化大量研究表明,豆粕经过微生物发酵后,其中的抗营养因子如胰蛋白酶抑制因子、大豆抗原蛋白、植酸等含量大大降低或完全消除。抗营养因子通过微生物降解的途径主要有两种:(1)微生物在生长繁殖过程中,消耗利用了一些非蛋白类抗营养因子,如植酸、低聚糖等;(2)微生物自身分泌的蛋白酶可分解豆粕中的蛋白类抗营养因子,如大豆抗原蛋白、胰蛋白酶抑制因子、脲酶等。张丽靖等(2008)研究发现,在适宜的条件下发酵豆粕,脲酶活性比发酵前降低了93%。郑裴等(2009)用乳酸菌发酵豆粕,测得抗营养因子中脲酶活性由发酵前的0.373 U/g降到发酵后的0.166 U/g,胰蛋白酶抑制因子含量由40.42 mg/g降到18.01 mg/g。本试验结果表明,发酵后豆粕中的脲酶和胰蛋白酶抑制因子含量均显著低于发酵前(P<0.01);发酵后各组相比,D组脲酶含量低于对照组48.67%(P<0.05),低于C组53.23%(P<0.05);发酵后各组胰蛋白酶抑制因子含量相比,差异不显著(P>0.05)。
4 结论
本试验结果表明,在24.0℃条件下通过添加2‰糖化酶和1‰酵母菌,能使豆粕发酵温度较快提升,虽然发酵时间多于对照组,但能够节约一定的能源。
[1]蔡国林,杨旭,曹钰,等.微生物发酵对豆粕营养价值的影响[J].中国油脂,2008,33(10):21~25.
[2]冯杰,刘欣,卢亚萍,等.微生物发酵豆粕对断奶仔猪生长、血清指标及肠道形态的影响[J].动物营养学报,2007,19(1):40~43.
[3]马文强,冯杰,刘欣.微生物发酵豆粕营养特性的研究[J].中国粮油学报,2008,23(1):121~124.
[4]戚薇,唐翔宇.益生菌发酵豆粕制备生物活性饲料的研究.饲料工业[J]. 2008,5:21~24.
[5]汤红武,薛智秀,钱红,等.酵母固体发酵对物料营养成分及生物活性的影响[J].浙江农业大学,2003,5:274~276.
[6]王卫国,张广林,曾明.糖化酶在黄酒酿造中的应用探讨[J].酿酒科技,1996,1:52~53
[7]吴胜华,李吕木,张邦辉,等.酵母菌单菌固态发酵豆粕的研究[J].中国粮油学报,2009,24(7),41~44.
[8]杨旭,蔡国林,曹钰,等.固态发酵提高豆粕蛋白含量的条件优化研究[J].中国酿造,2008,5:17~18.
[9]张红,褚西宁.固态发酵饲料酵母对非蛋白氮转化能力的研究[J].饲料工业,1996,17(2):17~19.
[10]张丽靖,齐莉莉,杨郁.纳豆菌发酵对豆粕脲酶活性的影响[J].大豆科学,2008,27(4):670~672.
[11]郑裴,吕峰,徐玉霞.植物乳杆菌发酵豆粕及其抗营养因子的研究[J].安徽农学通报,2009,15(10):63~64.
[12]Hong K J,Lee C H,Kim S W.Aspergillus oryzae GB-107 fermentation improves nutritional quality of food soybeans and soybean meal[J].Journal of Medical Food,2004,7(4):430~436.
[13]Refstie S,Storebakken T,Baeverfjord G,et a1.Long-term protein and lipid growth of Atlantic salmon(Salmo salar)fed diets with partial replacement of fish meal by soy protein products at medium or high lipid level[J].Aquaculture,2001,193:91~106.
This experiment was conducted to study the effects of adding glucoamylase and yeast on starting the soybean meal solid fermentation by bacillus subtilis in the condition of 24.0℃.The temperature for starting the fermentation of group A(the control)was 32.0℃,the temperatures of groups B,C,D were 23.7,24.4,24.0℃,group B wasn’t added heating substance,group C was added 2‰glucoamylase,group D was added 2‰glucoamylase+1‰yeast.The changes of temperature and pH during the fermentation process,nutrient contents and anti-nutritional factors after fermentation were measured.The results showed as follows:The heating rise of group D during the fermentation was faster than group B,C,but lower than the control group;after fermentation,compared with the control group,the crude protein content of group D was increased by 1.14%(P>0.05),the small peptide content was reduced by 1.72%(P>0.05);the urease and trypsin inhibitor content were reduced by 48.67%(P<0.05)and 27.71%(P>0.05).The results indicated that:To start the soybean meal solid fermentation in the condition of 24.0℃,the fermentation temperature had been rapidly increased by adding 2‰glucoamylase+1‰yeast,it could save some energy.
fermented soybean meal;temperature;nutrient contents;anti-nutritional factors
S816.7
A
1004-3314(2016)05-0021-04
10.15906/j.cnki.cn11-2975/s.20160505
提高北方寒区优质蛋白饲料(发酵豆粕)产能关键技术和产品开发(2013G0173)

