营养物质消化率和能量摄入的变化是引起仔猪断奶后生长性能差异的主要原因
C.K.Jones,J.F.Patience
(爱荷华州立大学,动物科技学院,美国埃姆斯50011)
中国·猪营养国际论坛
营养物质消化率和能量摄入的变化是引起仔猪断奶后生长性能差异的主要原因
C.K.Jones,J.F.Patience
(爱荷华州立大学,动物科技学院,美国埃姆斯50011)
为研究不同断奶体重(WW)和平均日增重(ADG)对仔猪能量、营养物质消化率和能量利用的影响,本试验从960头18~22日龄的去势小公猪中按照10%最低体重组(LWW),10%中体重组(MWW)和10%最高体重组(HWW)比例选取96头进行试验。每组32头。猪只饲养在代谢笼中,预试期5 d,试验期27 d,自由采食,饲喂含有二氧化钛作为标记物的基础日粮。于试验开始和结束时,定时收集3 d的粪便和全尿样。试验结束后,每个断奶体重组别的猪分别按照平均日增重以约33%比例分为最慢、中间和最快三组,从而形成了9个处理的嵌套试验设计。结果表明,试验开始和结束时,不同体重猪的营养物质表观全肠道消化率(ATTD)无差异,试验开始时,同一断奶重组猪的日增重也无明显差异。然而,试验结束时,中间日增重组猪的干物质、能量、氮、灰分的ATTD,以及相对消化能、代谢能和净能均最高(P<0.01)。随着体重增加,能量摄入增加(P<0.001;LWW、MWW、HWW组猪的净能分别为1.40、1.60、1.89 Mcal/d)。然而LWW组实际代谢能比HWW组低(P=0.04;分别为1.04和1.10)。ADG嵌套在WW组中,随着WW和ADG增加,能量摄入量和利用率、饲料转化率、组织能量沉积和生长能沉积均明显增加(P<0.001)。计算的实际代谢能摄入比例有明显差异(P<0.03),可能是由于热环境的差异造成维持需要的不同。断奶后日增重降低可能是由营养物质消化率差、能量摄入和冷应激等因素共同导致,试验结果可为将来猪管理策略中最小化组内差异提供指导。
消化率;能量;营养;猪;差异
中国猪营养国际论坛是由美国动物科学学会、上海亘泰实业集团和上海优久生物科技有限公司联合主办,以“凝聚全球科研力量,驱动猪业创新思维”为宗旨,力邀全球一流的机构、专家和学者,倾力打造一个动物营养领域具有国际性、前沿性和权威性的论坛。该论坛每两年举办一届,聚焦行业发展中的热点、难点,通过专家学者和企业领导者之间进行开放建设性的学术探讨、理论研究和实践经验交流,整合全球动物营养领域最新的技术和研究成果,推动行业发展,创造和提升产业价值。
www.asaschina.org
猪体重差异是导致现代养猪生产经济效益不同的主要因素之一。胎儿宫内发育迟缓导致幼仔的生长能力减弱(Gondret等,2006、2005)。比如,“节约表型假说”解释了缺乏足够胎儿营养的哺乳动物发育为生理缺陷或不足,最终导致幼仔生长能力减弱(Hales和Barker,1992)。早期体重对后期仔猪生长发育尤为重要,但是关于断奶重的极端变化或不同断奶重仔猪的早期生长性能的研究较少。因此,本试验旨在评估不同断奶重和平均日增重对仔猪表观能量和营养物质消化率和能量利用率的影响。
1 材料与方法
1.1试验设计从商业猪场购买960头断奶日龄为18~22 d的仔猪,体重为(5.77±3.92)kg,运送到爱荷华州立大学猪营养研究试验农场进行试验。本试验由爱荷华州立大学动物保护和使用协会批准(#9-09-6807-S)。将所有仔猪称重并记录(WW),每头标记单独的识别码,并去除身体畸形或健康状况不佳的仔猪。从960头猪中,从10%体重最轻、10%中间体重、10%最高体重中分别选择40头组成低体重组(LWW)、中体重组(MWW)和高体重组(HWW)。按照Jones等(2012)报道的方法选取24头猪屠宰测定其脂肪沉积率。剩余96头猪用于27 d的消化率和能量利用率试验。代谢试验中96头断奶仔猪,分24个栏,每栏4头。
预试期5 d,试验期27 d。自由采食和饮水。基础日粮组成及营养水平见表1。试验日粮含有0.4%的二氧化钛作为标记物,以测定营养物质消化率。日粮抗生素包含38.6 mg/kg泰妙菌素和440.9 mg/kg金霉素。试验中,中体重组中1头猪由于感染了副猪嗜血杆菌被处死,其他各组猪均无被淘汰或表现其他疾病症状。

表1 日粮组成(饲喂基础)
每周称重和记录耗料量。完成此试验后,不同体重类别的猪进一步根据日增重分为最慢(1)、中间(2)和最快(3)3个组别。这样就形成了一个拉丁方试验,3个日增重组(1、2、3)×3个断奶重组(LWW、MWW、HWW),共9个处理。
1.2样品收集与分析代谢试验总共27 d,分别在试验第1(即断奶后5 d)、2、3天和第25、26、27天(即断奶后32 d)收集全尿和粪便样品,每天2次。尿样用6N的HCL酸化,使其pH低于3,再用纱布过滤,将滤液保存在-20°C。尿样经过解冻,再次过滤,在干燥前分析其氮含量。收集的粪样保存在-20°C,冻干后,过0.5 mm孔径筛,分析其干物质(DM)、粗灰分、中性洗涤纤维(ADF)、粗脂肪(乙醚提取物)、总能(GE)、氮(N)和钛含量。27 d(断奶后32 d)的代谢试验完成后,屠宰仔猪。除食糜外,取血液、器官、头部和蹄部样品,匀浆、二次取样、冻干。过1 mm筛,分析GE。
1.3数据统计使用SAS统计软件中混合线性模式进行数据分析。每个猪作为一个试验单位。此模型以断奶重(低、中、高)和平均日增重(慢、中、快)为固定因子,以重复数和栏为随机因子。计算最小二乘方,使用SLICE和SLICEDIFF程序比较各处理。Tukey-Kramer检验用于矫正处理间的多重比较和最小化可能出现的误差。“P<0.05”表示差异显著,“0.05<P<0.10”表示有差异趋势。使用SAS中CORR程序Pearson相关系数,测定生长性能和胴体品质与断奶重和平均日增重相关程度。
2 结果和讨论
2.1断奶重和日增重对断奶仔猪营养物质表观全肠道消化率的影响由表2和表3可知,各收集阶段营养物质和日粮能量的表观全肠道消化率均不随着断奶重而变化(P>0.35)。在第一收集阶段(断奶后5 d),也不随平均日增重而变化(P>0.20)。然而,试验结束时,干物质、总能、氮、灰分以及日粮消化能、代谢能和净能的表观全肠道消化率,明显受不同体重和不同平均日增重的影响(P<0.01),中等ADG的仔猪营养物质消化率和能量利用率最高。消化率和能量系数的差异可能直接归因于猪有最快的ADG。Beaulieu等(2010)和Bérard等(2008)也报道,中等ADG组日增重组变化最大。

表2 断奶重对断奶仔猪营养物质表观全肠道消化率的影响
除了在消化率上的差异,需要注意的是消化能实测值在断奶后5~32 d有增加。27 d的试验期后,平均代谢能增加280 kcal/kg或8.4%。尽管这是短时间内急剧增加,此结果验证了先前Noblet和van Milgen(2004)得的结论,猪体重影响营养物质的能值。同时,这一时期猪只所发生的生理改变也需被考虑在内。甚至在5 d的断奶适应期内,猪也可能会遇到断奶过程中的不利影响,例如断奶相关的绒毛萎缩(van Beers等,1998)和吸收能力降低(Nabuurs等,1993)。这一阶段消化系统发育改变,乳糖酶活性降低,而蛋白酶、淀粉酶、麦芽糖酶和蔗糖酶活性增加(Manners和Stevens,1972)。因此,断奶后5~32 d能量消化率被期望有所增加。然而,值得注意的是差异幅度(17%)。

表3 断奶重和日增重对断奶仔猪营养物质表观全肠道消化率的影响
2.2断奶重和日增重对断奶仔猪能量效率的影响猪的平均日采食量随着断奶重增加而增加(Jones等,2012)。平均日采食量的增加与表4中描述的消化能、代谢能和净能摄入增加直接相关(P<0.001)。另外,高断奶重组能量利用率和能量用于增重的效率明显高于低断奶重组(P<0.001)。维持净能公式是由体重确定的[维持净能/(Mcal)=0.078×BW0.75]。该公式可推导用于生长的净能及用于增重的净能利用效率。这些值都依赖于维持能量需求的假设,Just(1982)将维持净能定义为“在热中性环境下用于维持猪能量平衡的能量值”,也就是说猪即不损失也不用于生长的能量。并认为维持需要受其他因素的影响,比如性别、动物日龄或体重、遗传、日粮、活跃性和外界环境,在不同的年龄用其他幂函数来表示可能更合适。Just(1982)将维持需求方程指数定在0.75,来源于各类育肥动物的空腹产热(Kleiber,1975)。然而,对于生长猪,指数为0.63或0.60可能更合适(Noblet等,1999;Brown和Mount,1982)。尽管Just(1982)提出的方程是目前最常用的维持净能方程,但使用0.75为指数用于评估幼猪的维持需要的合理性需深入研究。值得注意的是,一个指数似乎不可能代表不同体重猪的真实维持需要值。例如,van Milgen和Noblet(2003)证明令60 kg的猪MEm为常量,使用0.60为指数代替0.75导致20 kg猪的维持能量需要超过预测的18%,120 kg的猪低于预测的10%。因此,Just(1982)制定的维持能量方程能否用于本试验中也被质疑。预测维持能量需要的最精确指数是至关重要的,因为它不仅评估了维持需要,也从本质上影响蛋白和脂质沉积的能量效率预测(van Milgen和Noblet,2003;Noblet等,1999)。目前试验中净能的方程为Just(1982)报道提出的,但是结果中的偏差表明有必要重新考虑方程中的假设。需要更多的研究来验证是否Just(1982)提出的方程仍适用于现代基因型的幼猪。
Kielanowski(1965)提出的方程证明了维持能量精确值的重要性:能量摄入=能量维持+蛋白沉积能量+脂肪沉积能量。蛋白沉积能量和脂肪沉积能量可以由组织沉积速率除以组织沉积效率(k)得到。Kielanowski(1965)提出的方程中所有值(MEm、ME蛋白沉积、ME脂肪沉积)均随着断奶重增加而增加(P<0.001)。然而,各不同断奶重组ME摄入计算值/实测值有明显差异(P=0.04)。LWW组猪比值明显比HWW组低(P<0.05;分别为1.03和1.10)。本试验中个体能量摄入量是已知的和被认为是准确的。另外,本试验测定的每头猪的蛋白和脂肪沉积率结果与Jones等(2012)发表的一致。有3个不是直接测定的变量:维持能、Kp、Kl。我们使用NRC(1998)建立的标准方程计算,维持代谢能(MEm)=0.106 Mcal ME×BW0.75。猪的Kp和Kl分别被定为每克蛋白或脂肪沉积所需代谢能分别为10.03和11.65 kcal ME(Patience,2012)。但这3个数值或计算值没有一个可以被假定为随着不同断奶重或日增重变化保持不变。

表4 断奶重对断奶仔猪能量效率的影响1
鉴于MEm、Kp和Kl都可能是造成LWW组和HWW组能量计算值/实测值差异的原因,因此将3个因素中2个保持不变以确定第3个变量。如果调整为相同的体重,与其他同类相比,生长慢的猪通常胃肠道重量较大(Jones等2012)。然而,生长慢的猪胴体化学组成与健康猪不同,甚至组织沉积率也不同。由于这些因素,LWW组和HWW组猪的代谢能计算值与实测值比例的差异,可能归因于MEm的变化,而不是Kp和Kl的差异。
很多关于维持能量的定义都是基于Just(1982)年提出的理论。Kotarbińska和Kielanowski(1969)提出维持能量不是用于蛋白和脂肪增重的全部能量,而van Milgen和Noblet(2003)将其定义为空腹产热和活动所需的能量总和。空腹产热假设是以能量摄入相同和热中性环境下为前提。然而,Knap(2009)阐明维持能量可能包括蛋白质周转、免疫功能和体温调节等代谢活动。van Milgen等(2001)认为代谢活动能量占维持需要的8%~15%。这一范围包括热中性环境下,可能引起LWW组和HWW组猪的代谢能计算值与实测值比值间的差异。本试验推测LWW组和HWW组猪代谢能摄入计算值与实测值比值的差异可能是由于热中性环境造成。本试验中,蛋白或脂肪沉积的能量无论是氧弹式量计测定值还是计算值均相似。
使用不同断奶重下不同日增重分析能量方程的结果与仅使用断奶重分析结果相似(表5)。随着断奶重和日增重增加,能量摄入量、利用率、增重效率,组织沉积能量和沉积总能均明显增加(P<0.001)。如Jones等(2012)所述,LMM1组和MWW1组猪和其他组别的猪均存在明显差异。因此,这2个处理的猪均可以被归类为真正的“掉膘”猪,而其他7个处理的猪可被归类为“平均水平”猪。掉膘猪包括LWW1和MWW1组,因为其平均日增重相似(均为378 g),明显比其他7个组慢(P<0.05)。HWW1组的猪不是掉膘猪,因为其平均日增重明显比慢ADG组向(分别为543 g和378 g;P<0.05)。因此,LWW3、MWW2、MWW3、HWW1、HWW2和HWW3组的猪为典型的“平均水平”。与平均水平猪相比,掉膘猪的能量摄入、利用率、增重效率,组织沉积能量和沉积总能均明显降低(P<0.05)。同时,ME计算值与实测值比值有明显差异(P=0.03),这一数值验证了本试验的假设,比值的差异归因于热中性环境的变化。LWW1、MWW1、HWW2和HWW3组的代谢能摄入估计过高。上述LWW1组和MWW1组被归为掉膘猪,可能处于冷应激,而与其他组相比,HWW2组和HWW3组可能轻微热应激。

表5 不同断奶重和日增重对断奶仔猪能量效率的影响
猪舍热中性环境通常适于平均体重的猪。但这对体重轻的猪则是处于接近他们热中性区最低底线环境,对体重高的猪则是处于接近其热中性区最高限的环境(Kyriazakis和Whittemore,2006)。本试验中,维持Kyriazakis和Whittemore(2006)所述舍温,平均体重的猪维持最适温度。第0天,MWW组猪平均体重为6.15 kg,室温维持在30℃。然而,LWW组和HWW组猪体重分别为4.58 kg和8.09 kg。对LWW组和HWW组的猪热中性环境状态下,室温需分别维持在32.8℃和28.9℃(Kyriazakis和Whittemore,2006)。因为,分别饲养时,室温为30.0℃,低于LWW组猪的最低临界温度(30.8℃),接近HWW组猪的最高临界温度(30.4℃)(Close和Stanier,1984)。热中性区随着猪体重增加而扩大,这样试验结束时所有的猪都会在热适中环境。
通常,能量摄入随着冷应激而增加(Herpin等1987)。然而,研究发现掉膘猪与其他较重猪相比,能量摄入降低。因此,掉膘猪不仅开始时可能会冷,同时也可能减少其消化热(van Milgen等1997)。由于能量摄入低,与饲养在热中性区的猪相比,冷应激猪需要更高的维持代谢能以维持机体温度(Ewan,1982;LeDividich,1980)。随着接近热中性区最低限,猪的维持需要增加(Campbell和Taverner,1988;Close和Stanier,1984)。另外,Campbell和Taverner(1988)研究表明,在相同能量摄入下,与热中性区猪相比,冷应激猪生长变慢,并且使用维持能量的效率变低。由于冷应激,掉膘猪表现出能量摄入降低,将加剧生长缓慢和能量利用效率降低,导致其生长性能进一步降低。与此相反的是HWW2组和HWW3组猪,临床上看,这些猪明显不是热应激,它们仍有较高的能量摄入。然而,它们接近热中性区上限,这样将会分配更多的能量用于维持需要,以防止到达热中性区上限而降低采食量。热应激动物的维持需要增加,由于呼吸率和血液再分配增加。这些代谢过程所需的ATP导致用于组织沉积的能量减少,至少部分解释了HWW2和HWW3组ME计算值与实测值这一比值的差异。
2.3断奶重和日增重与营养物质消化率和能量利用率的相关性表6试验结果反映了受WW和ADG影响的方向和大小的相关性。WW或ADG与32 d ATTD或日粮能量含量存在显著相关性。WW或ADG与能量摄入、利用率、增重效率和组织沉积能量存在较高相关系数(P<0.001)。
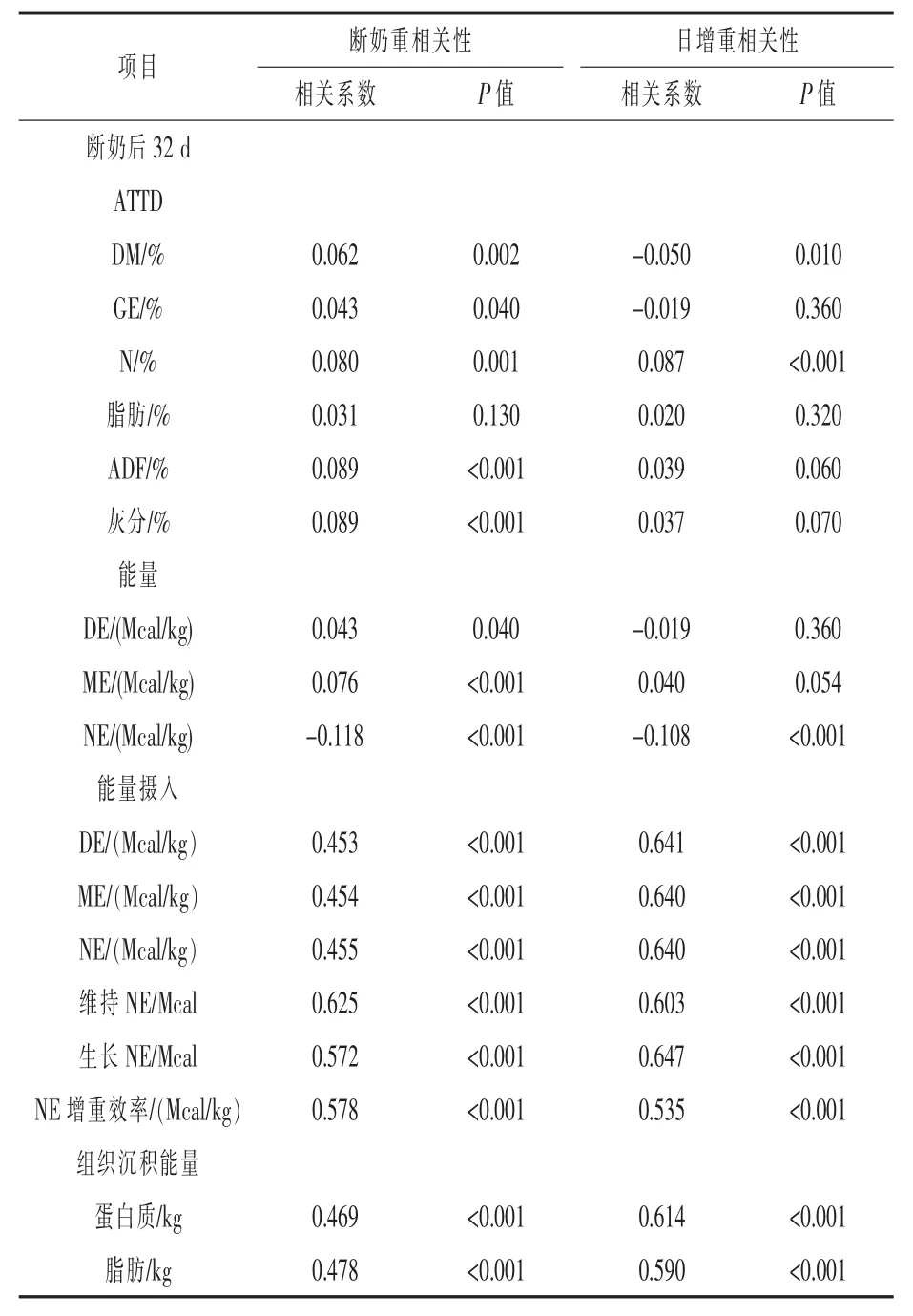
表6 断奶重或日增重与营养物质消化率或能量利用率的相关性
结合Jones等(2012)结果,从生长性能降低的根本原因可归因于采食量低和营养吸收利用率低。尽管掉膘猪NE增重效率计算值较高,但没有涉及增重组成或维持需要的变化。掉膘猪的结果明显不同,并对这些计算结果的精确性表示怀疑。因此,采食量和营养吸收降低似乎与猪掉膘息息相关。与此同时,对代谢或生理原因的观察结果几乎未做解释。本试验中提到的消化率和能量代谢率的不同可能是蛋白质代谢不同基因表达的错误调节导致的表型结果(Wang等,2008;Peterside等,2004;Selak等,2003),肠道完整性和吸收能力降低(Zhong等2010),内分泌功能受损(Chen等2011),以及产后应激相关的肠道疾病(Moeser和Blikslager,2007)。目前尚未找到关于猪或其他物种关于生产性能降低(掉膘)的相关报道,因此本文采用最相近的宫内生长发育缓慢哺乳动物的相关研究来解释本试验所观察到的结果。然而,要想完全解释营养利用障碍和宫内发育迟缓的关系,需要做更多的研究。尽管本研究可以作为引起不同WW和ADG猪变化差异原因的推测,但仍未确定具体的联系。需要做其他关于健康状况、免疫功能、代谢功能和小肠吸收能力的研究,以进一步解释我们所发现的关于营养消化率和能量利用率的结果。
本试验结果表明,生长性能的降低是由于采食量低和营养消化率差所导致,这两个结果都值得进行进一步深入研究。不同断奶重或断奶后生长性能的猪维持能量需要不同。这些差异可能由于热中性环境的变化造成。
[1]Beaulieu A D,Aalhus J L,Williams N H,et al.Impact of piglet birth weight,birth order,and litter size on subsequent growth performance,carcass quality,muscle composition,and eating quality of pork[J].Journal of Animal Science,2010,88(8):2767~2778.
[2]Bérard J,Kreuzer M,Bee G.Effect of litter size and birth weight on growth,carcass and pork quality,and their relationship to postmortem proteolysis[J].Journal of Animal Science,2008,86(9):2357~2368.
[3]Brown D,Mount L E.The metabolic body size of the growing pig[J].Livestock Production Science,1982,9(3):389~398.
[4]Campbell R G,Taverner M R.Relationships between energy intake and protein and energy metabolism,growth and body composition of pigs kept at 14 or 32°C from 9 to 20 kg[J].Livestock Production Science,1988,18(3-4):289~303.
[5]Chen R,Yin Y,Pan J,et al.Expression profiling of IGFs and IGF receptors in piglets with intrauterine growth restriction[J].Livestock Science,2011,136(2-3):72~75.
[6]Close W H,Stanier M W.Effects of plane of nutrition and environmental temperature on the growth and development of the early-weaned piglet 2. Energy metabolism[J].Animal Production,1984,38(2):221~231.
[7]Ewan R C.Energy metabolism in young pigs.In:A.Ekern and F.Sundstol,editors,Energy metabolism of farm animals.1982.Publication No.29.Eur.Assoc. Anim.Prod,Rome,Italy.
[8]Herpin P R,Mcbride B W,Bayley H S.Effect of cold exposure on energy metabolism in the young pig[J].Canadian Journal of Physiology&Pharmacology,1987,65(2):236~245.
[9]Jones C K,Gabler N K,Main RG,et al.Characterizing growth and carcass composition differences in pigs with varying weaning weights and postweaning performance[J].Journal of Animal Science,2012,90(11):4072~4080.
[10]Just A.The net energy value of balanced diets for growing pigs[J].Livestock Production Science,1982,8(6):541~555.
[11]Kielanowski J.Estimates of the energy cost of protein deposition in growing pigs.In:K.L.Blaxter,editor,Proc.3rd Symp.Energy Metabolism.Academic Press,London,UK.1965:13~20.
[12]Knap P W.Allocation of resources to maintenance.In:W.M.Rauw,editor,Resource allocation theory applied to farm animal production.CAB Int,Cambridge,MA.2009:110~129.
[13]Kotarbińska M,Kielanowski J.Energy balance studies with growing pigs by the comparative slaughter technique.In:K.L.Blaxter,J.Kielanowski,and G. Thorbek,editors,Energy metabolism in farm animals.Oriel Press Ltd.,Newcastle Upon Tyne,UK.1969:299~310.
[14]Kyriazakis,Whittemore C T.Whittemore’s science and practice of pig production.2006.3rd ed.Blackwell Publishing,Ames,IA.
[15]Le Dividich J,Vermorel M,Noblet J,et al.Effects of environmental temperature on heat production,energy retention,protein and fat gain in early weaned piglets[J].British Journal of Nutrition,1980,44(3):313~323.
[16]Manners M J,Stevens J A.Changes from birth to maturity in the pattern of distribution of lactase and sucrase activity in the mucosa of the small intestine of pigs[J].British Journal of Nutrition,1972,28(28):113~127.
[17]Nabuurs M J,Hoogendoorn A,Molen E J,et al.Villus height and crypt depth in weaned and unweaned pigs,reared under various circumstances in The Netherlands[J].Research in Veterinary Science,1993,55(1):78~84.
[18]Noblet J,Karege C,Dubois S,et al.Metabolic utilization of energy and maintenance requirements in growing pigs:effects of sex and genotype[J].Journal of Animal Science,1999,77(5):1208~1216.
[19]Noblet J,Van Milgen J.Energy value of pig feeds:effect of pig body weight and energy evaluation system[J].Journal of Animal Science,2004,82:229~238.
[20]Patience J F.The influence of dietary energy on feed efficiency in growfinish swine[M].Wageningen Academic Publishers,2012.
[21]Peterside I E,Selak M A,Simmons R A.Impaired oxidative phosphorylation in hepatic mitochondria in growth~retarded rats[J].Ajp Endocrinology& Metabolism,2004,285(6):1258~1266.
[22]Rowell L B,Brengelmann G L,Blackmon J R,et al.Splanchnic blood flow and metabolism in heat~stressed man[J].Journal of Applied Physiology,1968,24(4):475~484.
[23]Selak M A,Storey B T,Iyalla P,et al.Impaired oxidative phosphorylation in skeletal muscle of intrauterine growth~retarded rats[J].Ajp Endocrinology &Metabolism,2003,285(285):130~137.
[24]van Beers,Nabuurs MJ,Vellenga L,et al.Weaning and the weanling diet influence the villous height and crypt depth in the small intestine of pigs and after the concentrations of short~chain fatty acids in the large intestine and blood[J].Journal of Nutrition,1998,128(6):947~953.
[25]van Milgen J,Noblet J,Dubois S,et al.Dynamic aspects of oxygen consumption and carbon dioxide production in swine[J].British Journal of Nutrition,1997,78(3):397~410.
[26]van Milgen J,Noblet J,Dubois S.Energetic efficiency of starch,protein and lipid utilization in growing pigs[J].Journal of Nutrition,2001,131(131):1309~1318.
[27]van Milgen J V,Noblet J.Partitioning of energy intake to heat,protein,and fat in growing pigs[J].Partitioning of energy intake to heat,protein,and fat in growing pigs.ResearchGate,2003,81(2):86~93.
[28]Wang J,Chen L D,Yin Y,et al.Intrauterine growth restriction affects the proteomes of the small intestine,liver,and skeletal muscle in newborn pigs[J]. Journal of Nutrition,2008,138(1):60~66.
招聘
坤达包装始创于2003年,是一家多元化的现代企业。公司现拥有浙江坤达、江西坤达等四家分公司,员工800多人,年产值创5亿元,公司引进国内先进的塑编、印刷高新设备,专注产品质量和技术,提高供应链运转效率,形成了研发、设计、拉丝、编织、彩印、复合、盖光、制袋、检测高标准的生产体系。公司拥有白色、黄色、红色、绿色、蓝色等主导编织产品,广泛应用于饲料、化工、粮油、食品等农牧行业。公司实施塑编行业ERP模式创新,完善产供销一体化的经营模式,产品直接面向终端客户。坤达致力于打造一个具有品牌价值的企业。
片区总经理
1、有较强的事业心,富有业务开拓能力;
2、具有组织、沟通、策划、整合资源能力,执行力强;
3、能够独立开发大客户、领导所辖团队
4、组建销售队伍,培训销售人员
5、制定销售业绩,建设销售团队。
区域经理
1、具有规划意识、分析能力,思维敏捷,有较高协调能力和语言表达能力;
2、收集市场信息及需求,能够在上级的协助下开发大客户
3、较强的自我学习能力;
4、对工作有激情,办事讲原则,为人勤快,有上进心
浙江事业部
电话:0577-58107986传真:0577-63572951
邮箱:196328979@qq.com联系人:林丽力
江西事业部
电话:0796-8400258传真:0796-8400658
邮箱:1962364732@qq.com联系人:王灵卿
S816
A
1004-3314(2016)05-0038-07
10.15906/j.cnki.cn11-2975/s.20160509

