KSHV RTA 通过GC/Sp1和p53顺式元件上调survivin表达*
高建明, Erle S. ROBERTSON
(1三峡大学医学院生理与病理生理学系, 湖北 宜昌 443002;2宾夕法尼亚大学医学院微生物学系, 美国 宾夕法尼亚州 费城 19104)
KSHV RTA 通过GC/Sp1和p53顺式元件上调survivin表达*
高建明1, Erle S. ROBERTSON2△
(1三峡大学医学院生理与病理生理学系, 湖北 宜昌 443002;2宾夕法尼亚大学医学院微生物学系, 美国 宾夕法尼亚州 费城 19104)
目的: 定位survivin基因启动子中参与卡波西肉瘤相关疱疹病毒(Kaposi’s sarcoma-associated herpesvirus,KSHV)复制转录激活因子(replication and transcription activator,RTA)上调survivin表达的重要元件。方法: 构建survivin基因启动子的突变报告质粒,采用萤光素酶报告基因检测和染色质免疫共沉淀技术,定位survivin基因启动子区域能与 RTA相互作用的顺式元件。结果: 突变GC/Sp1和p53两个结合位点启动子活性几乎完全关闭,p53顺式作用元件对RTA上调survivin基因启动子活性具有协同作用。结论: KSHV RTA能够与survivin基因启动子中的GC/Sp1和p53顺式元件相互作用,特异性地增强survivin基因启动子活性。
卡波西肉瘤相关疱疹病毒; 复制转录激活因子; Survivin; GC/Sp1; p53; 启动子活性
Survivin是哺乳动物凋亡抑制蛋白(inhibitor of apoptosis,IAP)家族中分子量最小的一个蛋白,仅由142个氨基酸组成,是迄今发现的最强凋亡抑制因子[1]。Survivin结构上含有一个杆状病毒IAP重复序列(baculoviral IAP repeat,BIR)和一个较长的羧基端α螺旋。由于其组织分布存在特异性,并具有参与细胞凋亡及细胞有丝分裂调节双重的重要功能[2],逐渐为肿瘤发病机制和分子治疗研究所关注[3-5]。卡波西肉瘤相关疱疹病毒(Kaposi’s sarcoma-associated herpesvirus, KSHV)编码的复制转录激活因子(replication and transcription activator,RTA)能够特异性地增强survivin基因启动子活性,上调宿主细胞的survivin表达[6]。本研究旨在进一步定位survivin基因启动子中能与RTA相互作用,在转录水平上调控survivin表达的核心序列,以期全面阐明KSHV RTA调控宿主细胞survivin表达的分子机制。
材 料 和 方 法
1 质粒
pcDNA-RTA编码全长RTA的真核表达载体。pGL3-SurP为含survivin基因全长启动子的萤光素酶报告质粒。SurPΔNkx、SurP-269/+1、 SurP-269/+1ΔGC/Sp1、SurP-269/+1Δp53、SurPΔGC/Sp1、SurPΔGC/Sp1+Δp53 和SurPΔp53为一系列包含survivin基因启动子不同结构域的萤光素酶报告质粒[7]。以上质粒均为Robertson实验室研究人员构建并保存。
2 抗体与细胞
RTA抗体用杂交瘤技术制备,由上海巴斯德研究所蓝柯实验室提供;GAPDH抗体为Novus Biologicals产品;HEK 293是原代人胚肾细胞转染腺病毒DNA的永生化细胞,Saos-2是p53低表达的人骨肉瘤细胞株,BCBL1是感染KSHV的人体腔淋巴瘤细胞系。
3 方法
3.1 细胞转染及KSHV的诱导 采用Bio-Rad公司的Gene Pulser 电穿孔仪进行细胞转染,用20 μg/L佛波酯、1.5 mmol/L丁酸钠诱导KSHV,未经处理的细胞作为对照组。所有细胞均在诱导后培养48 h收集。
3.2 萤光素酶报告基因实验 107个HEK 293细胞、Saos-2细胞共转染10 μg全长或突变的启动子萤光素酶报告质粒和10 μg RTA表达质粒。转染后24 h收获细胞,制备细胞裂解液。向40 μL细胞裂解液中加入25 μL萤光素酶实验底物,使用LMax II 384荧光光度计(Molecular Devices)检测荧光水平。结果以3次实验值的均数与标准差表示。用Western blot 实验验证转染的蛋白质表达。
3.3 Western blot 实验 细胞收集后加入RIPA 缓冲液裂解,用Bradford 比色法测定蛋白质浓度。取相同质量的细胞裂解液上样,聚丙烯胺凝胶电泳结束后,转移蛋白样品至PVDF膜,分别用RTA抗体、GAPDH抗体及耦联IR Dye 800的羊抗鼠IgG抗体进行免疫印迹。用Odyssey红外线成像系统(LI-COR)观察结果。
3.4 染色质免疫共沉淀(chromatin Immunoprecipitation,ChIP)实验 BCBL1细胞于佛波酯诱导48 h后向培养液中加入甲醛,终浓度为1%,37 ℃ 固定细胞10 min,使蛋白质和DNA 发生交联。加入甘氨酸使其终浓度为0.125 mol/L,在室温晃动孵育5 min以终止交联反应。使用预冷的PBS清洗细胞2次,加入含1% SDS的裂解液裂解细胞,超声裂解细胞悬液将DNA均一地打断成500~1 000 bp的片段。用ChIP 稀释缓冲液将超声剪切后的DNA稀释10倍,取20 μL 稀释液保存,这时的样品标记为INPUT,作为PCR的空白对照。其余稀释液加入蛋白A 琼脂糖磁珠,4 ℃ 孵育2 h,分为2组,一组加入RTA抗体,4 ℃振荡过夜,另一组加入鼠IgG抗体作为阴性对照。将免疫复合物用磁珠沉淀,将沉淀物分别经低盐、高盐和氯化锂溶液3次系列冲洗,然后用TE 缓冲液洗2 次,每次冲洗5 min。用新配制的洗脱缓冲液将蛋白/DNA 复合物从磁珠上洗脱,加氯化钠(Na+浓度为200 mmol/L)与2 μL RNaseA(0.5 g/L),65 ℃过夜,松解蛋白/DNA 交联;加入5 μL蛋白酶K(20 g/L),于 55 ℃水浴2 h。用酚/氯仿抽提DNA。以回收的DNA 片段为模板,进行PCR 反应,DNA的数量水平可通过定量PCR来检测,引物序列为5’-CGTTCTTTGAAAGCAGTCGAG-3’和5’-TCAAATCTGGCGGTTAATGG-3’,扩增产物覆盖GC/Sp1与p53区域,片段长度为200 bp。同时做RT-qPCR,用2-ΔΔCt值的方法对DNA丰度进行相对定量。
4 统计学分析
采用 SPSS 16.0 软件的t检验进行统计学分析,以P<0.05为差异有统计学意义。
结 果
1 GC/Sp1和p53结合位点对RTA 上调survivin启动子活性具有重要作用
野生型survivin基因启动子全长为649 bp。用在线软件(http://motif.genome.jp/)分析其转录因子结合区域,结果发现survivin基因启动子含有4个主要转录因子结合位点,从起动子上游向起始密码子处依次为Sp1、NKx2.5、GC/Sp1和p53。野生型和突变型survivin基因启动子报告质粒的构建示意图如图1所示[7]。
用RTA质粒、野生型和突变型survivin基因启动子报告质粒分别转染HEK 293细胞进行萤光素酶报告基因检测。结果显示突变NKx2.5导致RTA激活survivin启动子活性轻度增强,RTA激活的野生型survivin启动子活性是未有RTA转染时的基底活性的3倍,而RTA介导的突变报告质粒SurPΔNkx活性是野生型survivin启动子基底活性的3.5倍;突变Sp1和NKx2.5元件(SurP-269/+1)对启动子活性没有明显影响,因此Sp1和NKx2.5元件对RTA介导的survivin启动子活性并不重要。然而,突变GC/Sp1结合位点(SurP-269/+1ΔGC/Sp1和SurPΔGC/Sp1)导致启动子活性显著降低(P<0.05);突变p53时,在RTA表达时突变报告质粒SurP-269/+1Δp53和SurPΔp53的活性只有野生型survivin启动子活性的1/4(P<0.05);当GC/Sp1和p53两个结合位点均突变后启动子活性几乎完全关闭(P<0.05)。上述结果证实GC/Sp1和p53结合位点对RTA 上调survivin启动子活性不可或缺,具有重要作用,见图2A。

Figure 1.Schematic showing of the wild-type and mutant survivin promoters[7].
图1 野生型和突变型survivin启动子结构示意图
2 p53 顺式作用元件对RTA介导的survivin表达上调具有协同作用
为阐明p53顺式作用元件对RTA介导的survivin表达上调具有何种作用,我们应用p53低表达的Saos-2细胞做了萤光素酶报告基因检测。突变p53结合位点导致survivin基因启动子活性相比野生型全长启动子的活性降低一半(P<0.05)。然而,一旦突变在p53结合位点上游52 bp的GC/Sp1元件,启动子活性会显著降低(P<0.05);如果将GC/Sp1 和 p53 两个结合位点一起突变,与转染了RTA质粒的Saos-2细胞野生型survivin基因启动子活性相比,启动子活性急剧降低,几乎完全关闭(P<0.05)。萤光素酶报告基因检测表明Saos-2细胞弱表达的p53蛋白与survivin基因启动子序列中的顺式作用元件结合后,能够与RTA-GC/Sp1复合物协同作用,在转录水平上调survivin表达,见图2B。
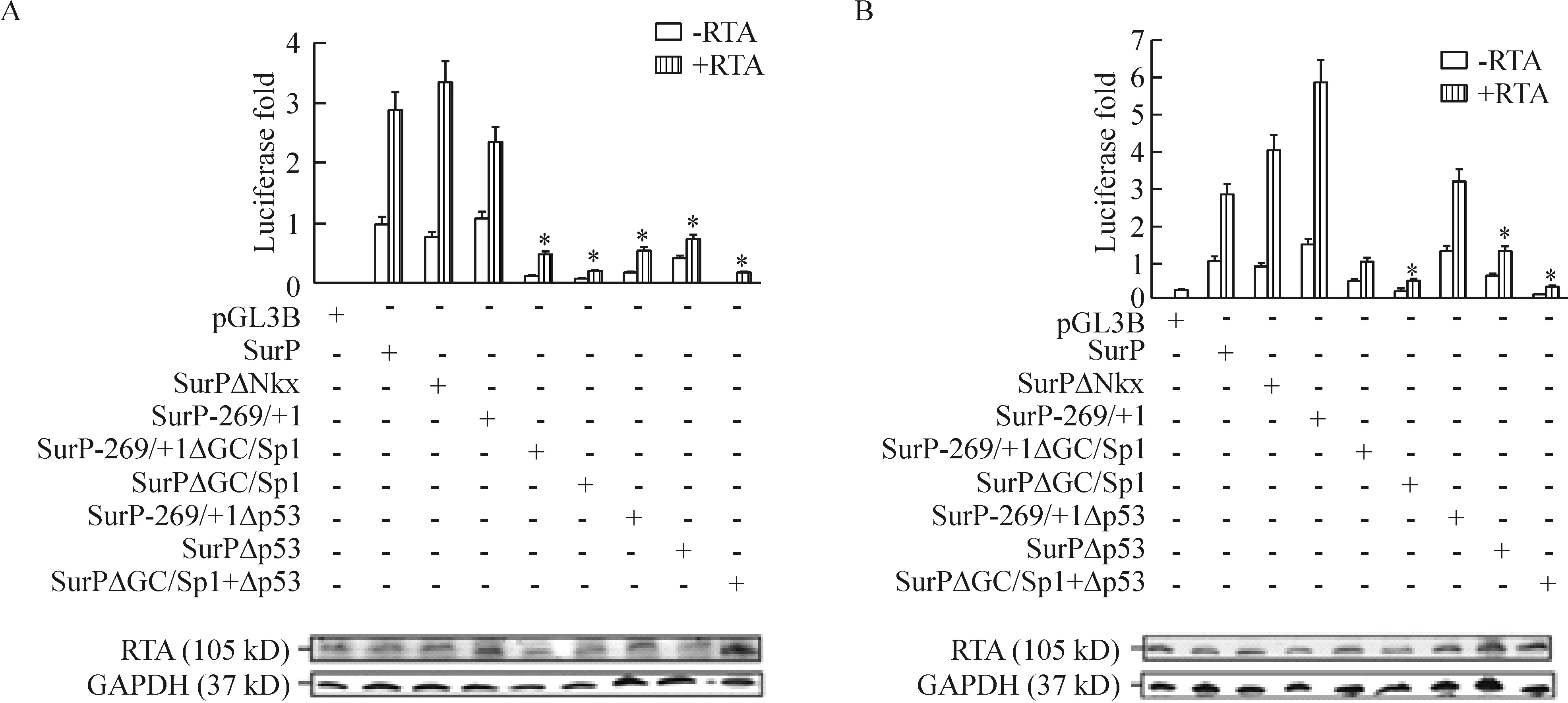
Figure 2.RTA activated the expression of survivin through interacting with GC/Sp1 and p53 cis elements. Reporter assay for the wild type and mutant survivin promoters in 293 (A) and p53 null Saos-2 cells (B). Western blot showed the expression of RTA in the cotransfected cells and GAPDH was used as control.*P<0.05vs-RTA.
图2 RTA通过GC/Sp1和p53顺式元件上调survivin的表达。
3 ChIP实验证实RTA蛋白与GC/Sp1和p53结合位点存在直接相互作用
用佛波酯、丁酸钠诱导的BCBL1细胞进行免疫共沉淀试验,结果表明了RTA蛋白与GC/Sp1和p53结合位点存在直接相互作用。PCR扩增证实免疫复合物中存在跨越GC/Sp1和p53结合位点的DNA片段。经诱导细胞的核DNA组经RTA抗体沉淀后可见清晰的目的片段,未经诱导细胞的核DNA组经RTA抗体沉淀后无阳性信号,2个IgG抗体阴性对照组亦均无目的片段。RT-qPCR用来相对定量沉淀下来的DNA的丰度,RTA抗体沉淀下来的经诱导BCBL1细胞的核DNA量比对照组高25倍,见图3。
讨 论
RTA是促使KSHV从潜伏性感染向裂解性感染转变的关键调控因子[8]。病毒的反复感染或者建立潜伏感染/再激活,使宿主细胞的DNA损害不断累积,继而发生遗传不稳定、细胞永生化、肿瘤等一系列效应[9]。近年来的研究揭示,survivin属于凋亡抑制蛋白家族,与细胞分裂、凋亡、应激和基因组完整性的检测点机制调控密切相关[10]。我们的前期研究已提示RTA能够增强survivin基因启动子的活性,进而上调宿主细胞的survivin表达[6]。
Figure 3.RTA protein interacted with the GC/Sp1 and p53 binding sites. The DNA fragments covering the GC/Sp1 and p53 binding sites were detected within the RTA antibody/DNA comlex by PCR (A). Real-time PCR was used to relatively quantitate the precipitated DNA (B). UN: the cells were not induced with TPA and sodium butyrate; IN: the cells were induced with TPA and sodium butyrate.
图3 RTA蛋白与GC/Sp1和p53结合位点存在直接相互作用
既往有文献报道survivin基因启动子区域存在Sp1、类Sp1和p53等转录因子的结合位点[11],因此Sp1和p53很可能在RTA介导的survivin表达上调机制中发挥重要的作用。本研究发现survivin基因启动子区域的GC/Sp1和p53顺式元件对RTA上调survivin启动子活性具有重要作用,并且染色质免疫共沉淀实验结果证实了RTA与GC/Sp1和p53顺式元件之间存在直接相互作用。
既往研究报道KSHV潜伏相关核抗原(latency-associated nuclear antigen, LANA)通过GC/Sp1和p53元件上调survivin表达,并促进细胞增殖[7]。本研究提示RTA通过相同机制下调细胞凋亡,这与在病毒转向裂解性感染过程后细胞凋亡、病毒子释放并不相悖。事实上LANA 与RTA在调控病毒生活周期上存在互相的反馈性调节机制[12]。RTA介导的survivin表达上调可以延缓进入裂解性复制期的宿主细胞的凋亡,理论上应导致宿主细胞在裂解性复制过程中会释放出更多的病毒子,促进病毒传播。少部分宿主细胞经历潜伏感染/再激活后得以存活,但DNA损害不断累积。后续的研究将围绕KSHV RTA介导的survivin表达上调在宿主细胞增殖与凋亡、病毒子的产生、病毒宿主细胞相互作用等方面的生物学意义而展开。
[1] 李璐蓉,黄晓丹,季国忠.Survivin 在肝癌中的临床应用研究进展[J].医学综述,2015,21(14):2549-2552.
[2] Altieri DC. Survivin and IAP proteins in cell-death mechanisms[J]. Biochem J, 2010, 430(2):199-205.
[3] Li G, Chang H, Zhai YP, et al. Targeted silencing of inhibitors of apoptosis proteins with siRNAs: a potential anti-cancer strategy for hepatocellular carcinoma[J]. Asian Pac J Cancer Prev, 2013, 14(9):4943-4952.
[4] Shen H, Shao HW, Chen XH, et al. Identification of a novel HLA-A2-restricted mutated Survivin epitope and induction of specific anti-HCC CTLs that could effectively cross-recognize wild-type survivin antigen[J]. Cancer Immunol Immunother, 2013, 62(2):393-403.
[5] Ryan BM, O’Donovan N, Duffy MJ. Survivin: a new target for anti-cancer therapy[J]. Cancer Treat Rev, 2009, 35(7):553-562.
[6] 高建明, Robertson ES. 卡泼氏肉瘤病毒复制转录激活因子上调宿主细胞survivin表达的机制[J]. 湖北民族学院学报:医学版, 2015, 32(3):1-3.
[7] Lu J, Verma SC, Murakami M, et al. Latency-associated nuclear antigen of Kaposi’s sarcoma-associated herpesvirus (KSHV) upregulates survivin expression in KSHV-associated B-lymphoma cells and contributes to their proliferation[J]. J Virol, 2009, 83(14): 7129-7141.
[8] Lan K, Kuppers DA, Verma SC, et al. Induction of Kaposi’s sarcoma-associated herpesvirus latency-associated nuclear antigen by the lytic transactivator RTA: a novel mechanism for establishment of latency[J]. J Virol, 2005, 79(12): 7453-7465.
[9] Avanzi S, Alvisi G, Ripalti A. How virus persistence can initiate the tumorigenesis process [J]. World J Virol, 2013, 2(2):102-109.
[10]Ai ZH, Yin L, Zhou X, et al. Inhibition of survivin reduces cell proliferation and induces apoptosis in human endometrial cancer[J]. Cancer, 2006, 107(4):746-756.
[11]Esteve PO, Chin HG, Pradhan S. Molecular mechanisms of transactivation and doxorubicin-mediated repression of survivin gene in cancer cells[J]. J Biol Chem, 2007, 282(4):2615-2625.
[12]Jin Y, He Z, Liang D, et al. Carboxyl-terminal amino acids 1052 to 1082 of the latency-associated nuclear antigen (LANA) interact with RBP-Jκ and are responsible for LANA-mediated RTA repression[J]. J Virol, 2012, 86(9):4956-4969.
(责任编辑: 卢 萍, 罗 森)
KSHV RTA upregulates expression of survivin through interacting with GC/Sp1 and p53 cis-acting elements
GAO Jian-ming1, Erle S. ROBERTSON2
(1DepartmentofPhysiologyandPathophysiology,ThreeGorgesUniversitySchoolofMedicine,Yichang443002,China;2DepartmentofMicrobiology,UniversityofPennsylvaniaSchoolofMedicine,Philadelphia,Pennsylvania19104,USA.E-mail:erle@mail.med.upenn.edu)
AIM: To identify the potential elements within the survivin promoter indispensable for the upregulation of survivin by Kaposi’s sarcoma-associated herpesvirus encoded replication and transcription activator (KSHV RTA). METHODS: A series of truncated survivin promoter luciferase constructs were generated. Reporter assay and chromatin immunoprecipitation were performed to detect the interaction between RTA and the importantcis-acting elements. RESULTS: Deletion of the GC/Sp1 and p53 binding sites within the survivin promoter almost completely shut down the survivin promoter activity and the p53cis-acting element synergistically contributes to survivin promoter activation by RTA. CONCLUSION: KSHV RTA interacts with the GC/Sp1 and p53cis-acting elements and regulates the expression of cellular survivin by specifically increasing the activity of survivin promoter.
Kaposi’s sarcoma-associated herpesvirus; Replication and transcription activator; Survivin; GC/Sp1; p53; Promoter activity
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1666- 04
2016- 04- 06
2016- 05- 25
National Cancer Institute 5R01CA091792-08, 5R01CA108461-05, 1R01CA137894-01 and 1R01CA138434-01A209; National Institute of Allergy and Infectious Diseases 5R01AI067037-04;National Institute of Dental and Craniofacial Research 5R01DE017338-03 (to ESR)
△ 通讯作者 Tel: (215)746-0114; E-mail: erle@mail.med.upenn.edu
R363
A
10.3969/j.issn.1000- 4718.2016.09.022

