GSTP1上调对奥沙利铂诱导人肝癌细胞株HepG2凋亡的影响*
刘润田, 安聪静, 白 云, 郑建兴
(河北医科大学第二医院 1肝胆外科, 2体检中心, 河北 石家庄 050000; 3河北省人民医院消化内科, 河北 石家庄 050057; 4唐山市工人医院肝胆外科, 河北 唐山 063000)
GSTP1上调对奥沙利铂诱导人肝癌细胞株HepG2凋亡的影响*
刘润田1△, 安聪静2, 白 云3, 郑建兴4
(河北医科大学第二医院1肝胆外科,2体检中心, 河北 石家庄 050000;3河北省人民医院消化内科, 河北 石家庄 050057;4唐山市工人医院肝胆外科, 河北 唐山 063000)
目的: 探讨过表达GSTP1后HepG2细胞对奥沙利铂(oxaliplatin,OXA)敏感性的影响及其相关机制。方法: 采用腺病毒载体转染人肝癌细胞株HepG2,获得过表达GSTP1的HepG2细胞;实验分为空白对照组(control组)、载体组(vehicle组)、过表达GSTP1组(Ad-GSTP1组)、OXA组、OXA+vehicle组和Ad-GSTP1+OXA组;MTT法和流式细胞术检测HepG2细胞的存活率和凋亡率;Western blot法检测HepG2细胞中GSTP1、Akt、mTOR、p-Akt和p-mTOR的蛋白水平。结果: OXA剂量依赖性地降低HepG2细胞的存活率(P<0.05);腺病毒转染后HepG2细胞的GSTP1蛋白表达增加;基础状态下,过表达GSTP1可降低HepG2细胞的存活率,促进细胞凋亡,抑制Akt和mTOR磷酸化水平(P<0.05);给予OXA处理后,上调GSTP1表达增强了OXA降低HepG2细胞存活率的作用,凋亡率进一步增加,Akt和mTOR蛋白的磷酸化水平进一步下降,与加药组相比差异有统计学显著性(P<0.05)。结论: 上调GSTP1表达可增强OXA促进HepG2细胞凋亡的作用,其机制可能与Akt/mTOR通路有关。
GSTP1; 奥沙利铂; 细胞凋亡的作用; HepG2细胞
原发性肝癌是临床上常见的恶性肿瘤,由于起病位置隐匿,早期诊断困难,且生长迅速,具有高度侵袭性,大部分患者在临床上确诊时已发展到局部晚期,或已发生转移,只有约20%的患者适合手术切除[1]。全球肝癌致死率仅次于肺癌和胃癌,位居第3位[2]。而我国肝癌的发病人数占全球的55%,居全球第1[3],严重地威胁人民的健康和生命。
奥沙利铂(oxaliplatin,OXA)是在顺铂和卡铂之后的第3代铂类抗癌药,疗效良好,不良反应和毒性反应更低,其作用机理是通过以DNA为靶作用部位,阻断其复制和转运,以及抑制RNA的合成[4]。Wang等[5]研究发现,奥沙利铂具有抑制人肝癌细胞系Hep3B和HCCLM3的增殖,主要是通过诱导细胞凋亡而发挥作用。2010年,国内报道[6]指出奥沙利铂与复方苦参注射液联用可抑制SMMC-7721细胞的增殖,通过将细胞阻滞于G0/G1期诱导细胞凋亡,两药联用起协同增效的作用。近年来大量样本研究结果表明,许多肿瘤的发病危险性与谷胱甘肽S-转移酶(glutathioneS-transferases,GSTs)多态性明显相关。GSTs 的基因多态性可引起酶分子结构、功能和水平的改变,从而影响细胞的解毒能力。本实验建立过表达GSTP1的HepG2细胞,观察其对奥沙利铂敏感性的变化。
材 料 和 方 法
1 材料
人肝癌细胞株HepG2购自中南大学湘雅医院细胞中心;过表达GSTP1腺病毒(Ad-GSTP1)及病毒载体购自上海和元生物有限公司;RPMI-1640培养基、MTT试剂购自Sigma;抗Akt、p-Akt、mTOR和p-mTOR抗体购自Santa Cruz;胎牛血清购自上海澳赛尔斯公司;MTT溶液购自森贝伽生物公司;其它试剂为国产分析纯。
2 方法
2.1 细胞培养与分组 将人肝癌细胞株HepG2常规培养于含10%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养,待细胞生长至密度为80%~90%时,采用0.25%胰蛋白酶消化传代。实验分为空白对照组(control组)、载体组(vehicle组)、过表达GSTP1组(Ad-GSTP1组)、OXA组、OXA+vehicle组和Ad-GSTP1+OXA组。
2.2 腺病毒载体转染 腺病毒转染前18 h,将HepG2细胞以每孔1×105铺到96孔板中;待转染时培养至约每孔2×105。更换含6 mg/L聚凝胺的新鲜培养基(2 mL),加入适量病毒悬液,于37 ℃孵育24 h,用新鲜培养基更换含病毒的培养基,继续培养,48 h后可见明显荧光表达。
2.3 MTT法检测细胞存活率 将处于对数期的HepG2细胞接种于96孔板,分别加入奥沙利铂1、5、10、20和40 μmol/L,培养24 h后加入5 g/L MTT溶液20 μL,继续孵育4~6 h后,离心去上清,加入DMSO 100 μL,轻轻振荡5 min,以570 nm为测试波长,630 nm为参考波长,在酶标仪下读取吸光度(A)值。每组设3个复孔。另收集经相应处理各组细胞检测存活率。
2.4 流式细胞术检测细胞凋亡 收集经相应处理的各组细胞,1 000 r/min离心5 min,弃去培养液,PBS洗涤2次,制备单细胞悬液,用75%冰乙醇固定,4 ℃过夜。PBS洗涤,离心,去除乙醇,加入1% RNA酶Tri-HCl缓冲液,100 mg/L碘化丙啶(propi-dium iodide,PI)染色液染色,4 ℃避光反应30 min,采用流式细胞仪进行检测。
2.5 Western blot法检测蛋白表达 收集经相应处理各组细胞,用裂解液裂解,Bardford法进行蛋白定量。在10% SDS-聚丙烯凝胶中电泳2 h,电转至PVDF膜上,用5%脱脂牛奶封闭1 h,加入相应 I 抗,4 ℃过夜,TBST洗涤3次,再加入相应 II 抗,室温孵育30 min,化学发光法显色,成像扫描分析系统扫描并保存图像。
3 统计学处理
所有数据均在SPSS 15.0统计软件中进行统计,实验结果以均数±标准差(mean±SD)表示,多组数据的比较用单因素方差分析,各组均数间的两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 MTT法测定HepG2细胞存活率的变化
浓度为1、5、10、20和40 μmol/L的奥沙利铂处理HepG2细胞24 h后,MTT实验结果显示奥沙利铂呈浓度依赖性降低HepG2细胞的存活率。如图1所示,20 μmol/L与40 μmol/L奥沙利铂对HepG2细胞的存活率差异没有统计学显著性,由此在后续实验中均采用20 μmol/L的浓度。
2 腺病毒转染后各组细胞的存活率
如图2所示,Ad-GSTP1 HepG2细胞的存活率显著低于control组(P<0.05);OXA组与OXA+vehicle组细胞的存活率低于Ad-GSTP1组和control组(P<0.05);过表达GSTP1同时给予20 μmol/L奥沙利铂处理24 h,HepG2细胞的存活率显著低于其它各组(P<0.05)。这提示上调GSTP1表达可增强奥沙利铂对HepG2细胞存活率的抑制作用。
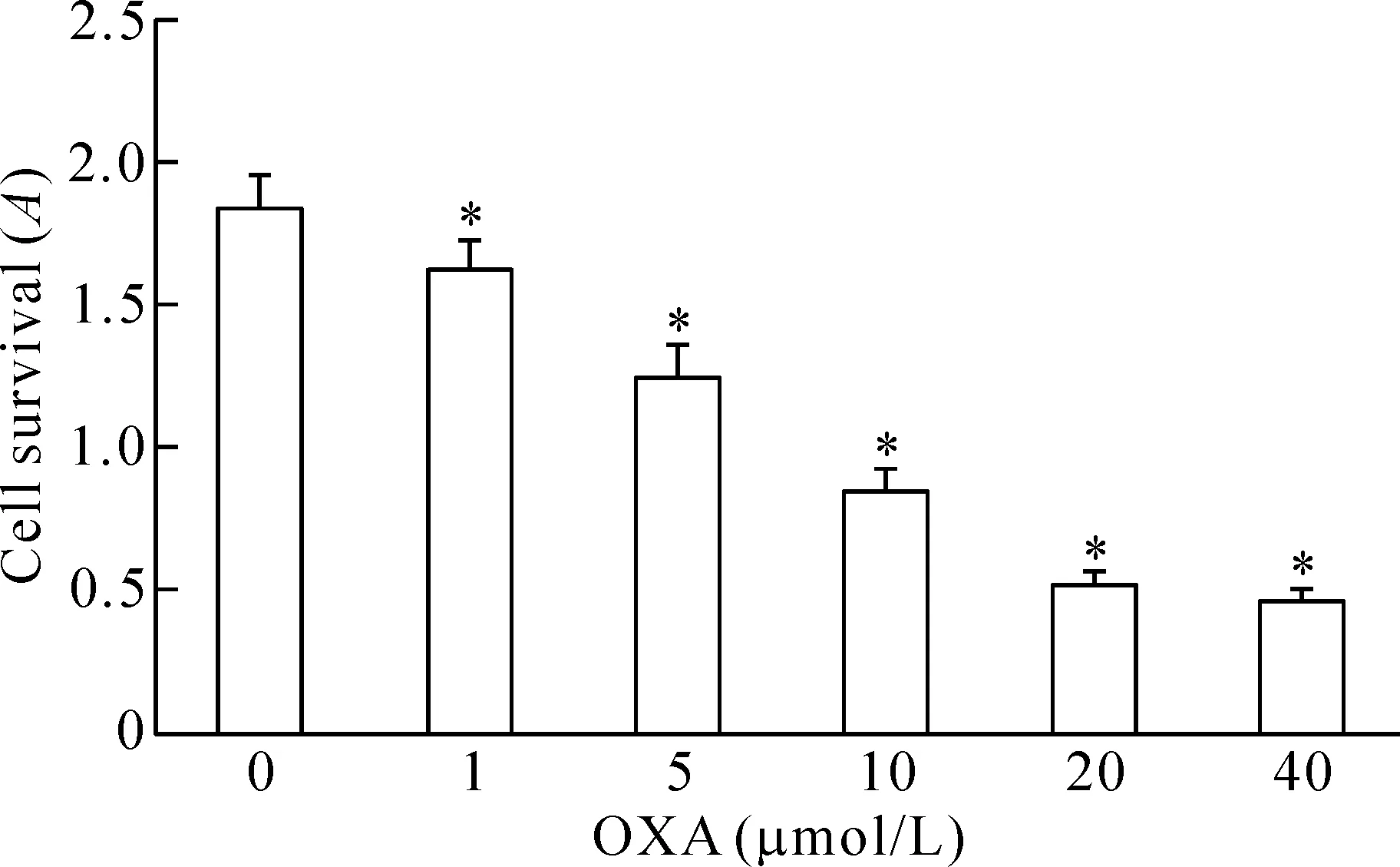
Figure 1.The effect of oxaliplatin (OXA) on the survival rate of HepG2 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图1 不同浓度奥沙利铂对HepG2细胞存活率的影响
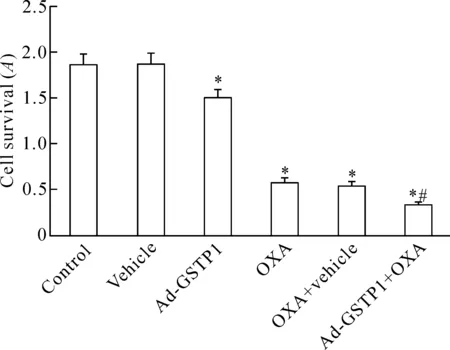
Figure 2.The changes of survival rates in the HepG2 cells with different treatments. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsOXA group.
图2 各组HepG2细胞存活率变化的比较
3 转染后GSTP1蛋白的表达
与空白对照组相比,Ad-GSTP1组的GSTP1蛋白表达显著升高(P<0.05),见图3。
4 流式细胞术检测细胞凋亡
如图4所示,Ad-GSTP1组HepG2细胞的凋亡率显著高于空白对照组(P<0.05);OXA组和OXA+vehicle组HepG2细胞的凋亡率显著高于空白对照组和Ad-GSTP1组(P<0.05);过表达GSTP1同时给予同时给予20 μmol/L奥沙利铂处理后,HepG2细胞的凋亡率显著高于其它各组(P<0.05)。这提示过表达GSTP1可增强奥沙利铂促进HepG2细胞凋亡的作用。

Figure 3.The protein expression of GSTP1 in the HepG2 cells after transfection.Mean±SD.n=3.*P<0.05vscontrol group.
图3 转染Ad-GSTP1后HepG2细胞中GSTP1的蛋白表达
表达GSTP1可增强奥沙利铂促进HepG2细胞凋亡的作用。
5 Western blot法检测Akt、mTOR、p-Akt和p-mTOR的蛋白水平
Ad-GSTP1组、OXA组和OXA+vehicle组的HepG2细胞中Akt和mTOR的蛋白水平无明显变化,但p-Akt和p-mTOR的蛋白水平显著低于空白对照组(P<0.05);其中OXA组和OXA+vehicle组间差异无统计学显著性;Ad-GSTP1+OXA组细胞中的Akt和mTOR的蛋白表达水平也无显著变化,p-Akt和p-mTOR的蛋白水平显著低于其它各组(P<0.05),见图5。
讨 论
谷胱甘肽硫转移酶广泛存在于细胞液中,具有抗氧化、防癌、清除体内自由基及超氧阴离子的作用[7]。近年来大量样本研究结果表明,许多肿瘤的发病危险度与GSTs多态性明显相关。GSTs 的基因多态性可引起酶分子结构、功能和水平的改变,从而影响细胞的解毒能力,因此被认为与肿瘤易感性有关。GSTM3、GSTM1、GSTT1和GSTP1是GSTs的4种亚型,已被广泛证明具有多态性,可引起酶活性的改变[8-9]。
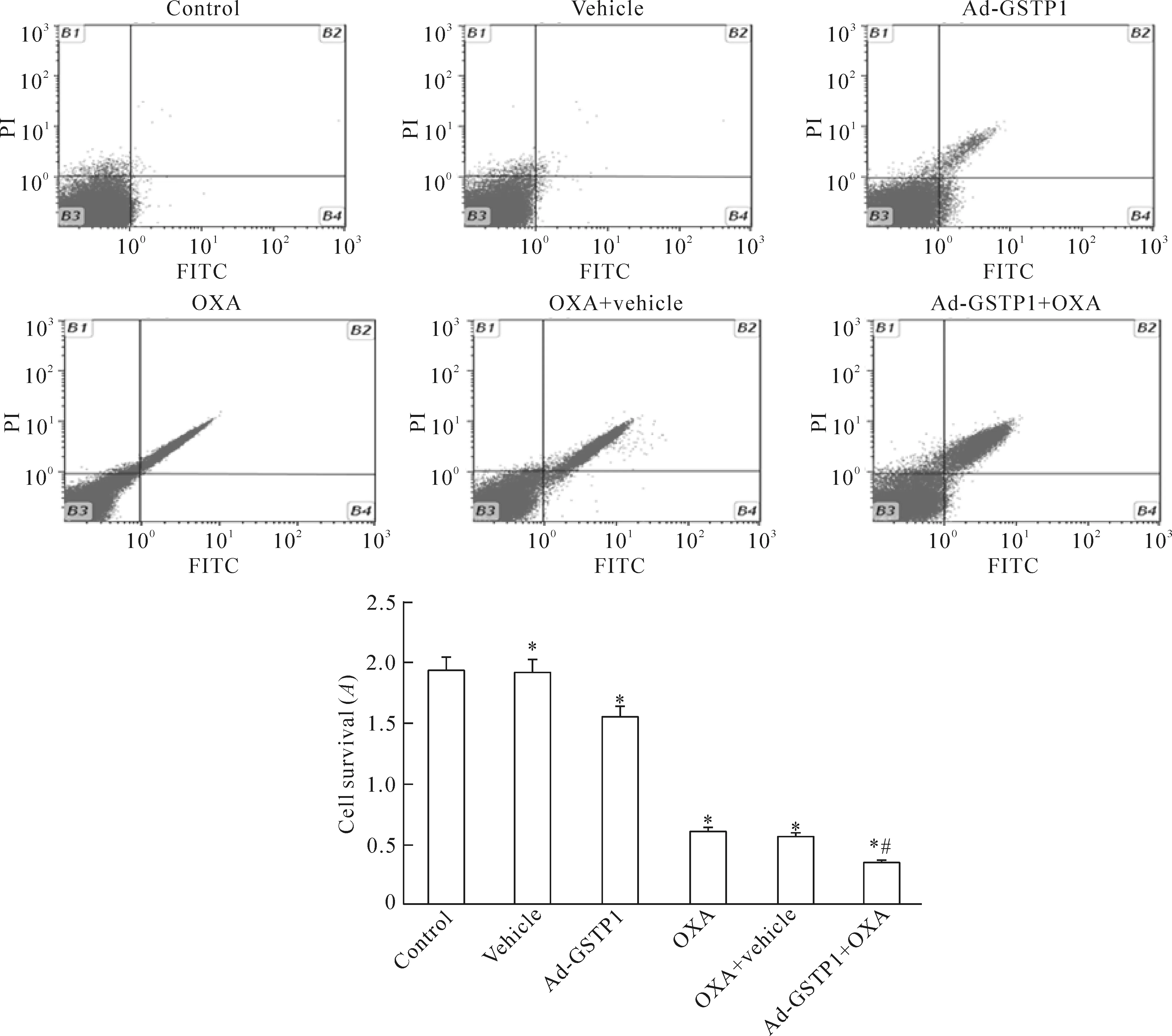
Figure 4.The changes of apoptotic rate in the HepG2 cells with different treatments.Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsOXA group.
图4 经相应处理后各组HepG2细胞凋亡的变化
奥沙利铂作为第3代铂类抗肿瘤药物,体内外研究表明其具有广泛抗肿瘤活性,对晚期或转移性肝癌有良好的临床疗效[10]。其中央铂原子被一草酸和1、2-二胺环己烷包围,呈反式构象,是一个立体异构体。与其它铂类衍生物一样,奥沙利铂通过产生烷化结合物作用于DNA,形成链内和链间交联,从而抑制DNA的合成及复制,而且它与DNA结合速度,最多需要15 min[11]。以奥沙利铂为主,联合5-FU和亚叶酸钙的化学治疗是目前晚期肝癌的重要治疗方法。但是对于奥沙利铂对肝癌的机制研究尚未深入,本实验观察奥沙利铂对肝癌细胞存活率与凋亡率的影响,通过免疫印迹法检测相关蛋白的表达,发现奥沙利铂对肝癌细胞增殖的抑制作用可能与Akt/mTOR信号通路有关。
Akt/mTOR信号通路作为细胞内重要信号转导通路之一,在维持肿瘤细胞增殖、存活和凋亡中发挥关键作用。当上游的PI3K激活后,会导致Akt的磷酸化,通过抑制TSC-1/TSC-2复合物的形成,使mTOR被激活,从而加快细胞周期[12]。本实验研究结果发现与单独采用奥沙利铂处理相比,过表达GSTP1能够加强奥沙利铂对HepG2细胞存活率的抑制作用和细胞凋亡的加速作用。且发现对p-Akt和p-mTOR的蛋白水平有显著的影响,推测GSTP1可能通过影响Akt/mTOR信号通路,通过抑制Akt的磷酸化,进一步抑制下游因子mTOR的激活,从而阻断Akt/mTOR信号通路,进而抑制HepG2细胞的增殖,影响HepG2细胞对奥沙利铂的敏感性,其具体机制需后续进一步研究。本实验的意义在于提高以奥沙利铂治疗为主的临床方案的有效率,从而提高患者总体的生存率。
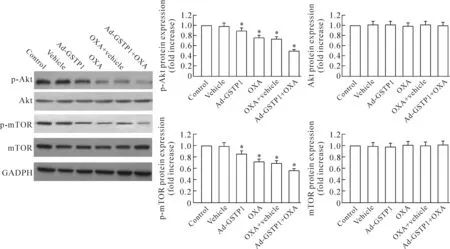
Figure 5.The protein levels of Akt, mTOR, p-Akt and p-mTOR in each group.Mean±SD.n=3.*P<0.05vscontrol group.
图5 各组HepG2细胞中Akt、mTOR、p-Akt和p-mTOR的蛋白水平
[1] Ingle PV, Samsudin SZ, Chan PQ, et al. Development and novel therapeutics in hepatocellular carcinoma: a review [J]. Ther Clin Risk Manag, 2016, 12:445-455.
[2] Chen W, Zheng R, Zuo T, et al. National cancer incidence and mortality in China, 2012[J]. Chin J Cancer Res, 2016, 28(1):1-11.
[3] Yang JD, Roberts LR. Hepatocellular carcinoma: a global view[J]. Nat Rev Gastroenterol Hepatol, 2010,7(8):448-458.
[4] Lin S, Lei K, Du W, et al. Enhancement of oxaliplatin sensitivity in human colorectal cancer by hypericin mediated photodynamic therapy via ROS-related mechanism[J]. Int J Biochem Cell Biol, 2016, 71:24-34.
[5] Wang Z, Zhou J, Fan J, et al. Oxaliplatin induces apoptosis in hepatocellular carcinoma cells and inhibit stumor growth[J]. Expert Opin Invest Drugs, 2009, 18 (11):1595-1604.
[6] 华海清,姜子瑜,杨爱珍,等. 复方苦参注射液联合奥沙利铂对人肝癌细胞株SMMC-7721增殖与凋亡的影响[J]. 临床肿瘤学杂志, 2010, 15(1):10-15.
[7] 高雅琼,王彩丽. 谷胱甘肽硫转移酶基因多态性与疾病关系的研究进展[J].医学综述, 2013, 19(1):29-31.
[8] Li CG, Zhao ZM, Hu MG, et al. Predictive role of glutathione-S transferase gene polymorphisms in risk and prognosis of hepatocellular carcinoma[J]. Asian Pac J Cancer Prev, 2012, 13(7):3247-3252.
[9] Sun N, Sun X, Chen B, et al. MRP2 and GSTP1 polymorphisms and chemotherapy response in advanced non-small cell lung cancer[J]. Cancer Chemother Pharmacol, 2010, 65(3):437-446.
[10]Yen Y, Lim DW, Chung V, et al. Phase II study of oxaliplatin in patients with unresectable, metastatic, or recurrent hepatocellular cancer: a California Cancer Consortium Trial[J]. Am J Clin Oncol, 2008, 31(4):317-322.
[11]Varela M, Real MI, Burrel M, et al. Chemoembolization of hepatocellular carcinoma with drug eluting beads: efficacy and doxorubicin pharmacokinetics[J]. J Hepatol, 2007, 46(3):474-481.
[12]Barone I, Cui Y, Herynk MH, et al. Expression of the K303R estrogen receptor-α breast cancer mutation induces resistance to an aromatase inhibitor via addiction to the PI3K/Akt kinase pathway[J]. Cancer Res,2009, 69(11): 4724 - 4732.
(责任编辑: 陈妙玲, 罗 森)
Over-expression of GSTP1 increases oxaliplatin-induced apoptosis in human hepatoma HepG2 cells
LIU Run-tian1, AN Cong-jing2, BAI Yun3, ZHENG Jian-xing4
(1DepartmentofHepatobiliarySurgery,2PhysicalExaminationCenter,TheSecondAffiliatedHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China;3DepartmentofGastroenterology,HebeiGeneralHospital,Shijiazhuang050057,China;4DepartmentofHepatobiliarySurgery,TangshanGongrenHospital,Tangshan063000,China.E-mail:liuyuntianmed@126.com)
AIM: To investigate the effect of GSTP1 over-expression on the sensitivity of human hepatoma HepG2 cells to oxaliplatin (OXA). METHODS: Adenovirus carrying GSTP1 (Ad-GSTP1) was used to infect HepG2 cells for establishing the cell line over-expressing GSTP1. The cells were randomly divided into 6 groups: control, vehicle, Ad-GSTP1, OXA, OXA+vehicle and OXA+Ad-GSTP1. The cell survival rates were examined by CCK-8 assay, and the apoptotic rates were analyzed by flow cytometry. The protein levels of GSTP1, Akt, mTOR, p-Akt and p-mTOR were determined by Western blot. RESULTS: OXA decreased the cell survival rate in a dose-dependent manner (P<0.05). The protein expression of GSTP1 increased after transfection with adenovirus. At basal level, up-regulation of GSTP1 significantly decreased the cell survival rate, increased the cell apoptosis, and inhibited the phosphorylation levels of Akt and mTOR (P<0.05). Moreover, GSTP1 over-expression enhanced the effect of OXA on the cell viability, cell apoptosis, and further inhibited the phosphorylation levels of Akt and mTOR (P<0.05). CONCLUSION: Over-expression of GSTP1 augments the enhanced effect of OXA on HepG2 cell apoptosis, which may be related to the inactivation of Akt/mTOR signaling pathway.
GSTP1; Oxaliplatin; Apoptosis; HepG2 cells
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1579- 05
2016- 03- 28
2016- 05- 31
河北省医学科学研究重点课题计划(No.ZD20140110);河北省卫生厅指令性课题(No.20090085)
△通讯作者 Tel: 0311-66002981; E-mail: liuyuntianmed@126.com
R735.7; R363
A
10.3969/j.issn.1000- 4718.2016.09.008

