AFT024-SCF细胞系的构建及其生物学功能鉴定*
李 陈, 陆 英, 杨 丹, 汪 颖, 薛 淼, 张祥忠△
(1中山大学附属第三医院血液内科,广东 广州 510630; 2安徽大学,安徽 合肥 230000)
AFT024-SCF细胞系的构建及其生物学功能鉴定*
李陈1,陆英1,杨丹1,汪颖2,薛淼1,张祥忠1△
(1中山大学附属第三医院血液内科,广东 广州 510630;2安徽大学,安徽 合肥 230000)
目的: 构建AFT024-SCF和HPC-Lhx2细胞系,并用HPC-Lhx2细胞系鉴定AFT024-SCF细胞系的生物学功能。方法: 采用逆转录病毒感染法构建干细胞因子(stem cell factor, SCF)依赖的永生化造血干/祖细胞(hematopoietic stem/progenitor cell, HPC)-Lhx2细胞系和小鼠胎肝基质细胞系AFT024-SCF及其不含目的基因的对照组细胞系AFT024-GFP。采用real-time PCR法及Western blot法鉴定此AFT024-SCF细胞系中SCF的表达。ELISA法鉴定AFT024-SCF上清液中SCF的表达。收集AFT024-SCF及AFT024-GFP细胞培养上清液并以1∶10与IMDM基础培养基混合备用。以AFT024-SCF组上清液为实验组,AFT024-GFP组上清液为内源性阴性对照组,无任何添加的IMDM基础培养基为外源性阴性对照组,添加重组SCF的IMDM培养基为阳性对照组,分别与HPC-Lhx2 细胞系共培养72 h。MTT法检测各组HPC-Lhx2细胞增殖活性,集落形成实验鉴定HPC-Lhx2细胞系扩增后的细胞干性。结果: 构建的AFT024-SCF细胞系表达SCF;HPC-Lhx2细胞系体外培养72 h后,外源性及内源性阴性对照组未能维持HPC-Lhx2细胞增殖;而阳性对照组及实验组均可促进HPC-Lhx2细胞增殖;阳性对照组及实验组细胞均有集落形成单位,且差异无统计学意义,阴性对照组无集落形成单位。结论: 成功构建表达SCF的AFT024-SCF细胞系,其培养上清液能够替代重组SCF用于HPC-Lhx2细胞系的体外扩增。
AFT024-SCF细胞系; 干细胞因子; 造血干/祖细胞; HPC-Lhx2细胞系
造血干细胞(hematopoietic stem cells, HSCs)是一群具有自我更新和定向分化潜能的多能干细胞,HSC移植已被广泛地应用于血液系统恶性肿瘤、骨髓衰竭性疾病及一些先天性疾病等的临床治疗[1]。进行体外扩增培养HSC是目前重要的基础研究热点之一[2]。大量实验数据表明,造血干/祖细胞(hematopoietic stem/progenitor cell, HPC)的体外扩增主要依赖细胞因子[3]。而在这些细胞因子中,干细胞因子(stem cell factor, SCF)起着至关重要的作用。目前体外培养HSC的所有细胞因子组合几乎都包含SCF[4]。SCF是迄今为止发现的作用于HSC最早期阶段的细胞因子。SCF能通过与c-Kit结合向细胞内传递信号,启动早期HPC的分裂和增殖,使细胞进入细胞周期,开始扩增[5]。另外,SCF还可以与其它细胞因子协同作用促进造血各系前体细胞的增殖与分化[6]。因此,研究优化HSC体外扩增体系,细胞因子SCF必不可少。
AFT024是一种来源于小鼠胎肝的基质细胞系,与HSC共培养时能够在体外较长时间维持HSC干性[7],说明其在HSC的体外干性维持中发挥着一定的作用。AFT024能够体外维持小鼠HSC干性达 4~7周之久,并且此体外培养的HSC在移植后能够重建受体小鼠的造血系统,与未经体外培养的新鲜HSC移植效果相似[8]。基于以上理论,我们利用实验室现有条件,以小鼠细胞系为模型,将小鼠SCF基因导入AFT024中,构建出可分泌SCF的AFT024-SCF细胞系。Lhx2基因为LIM同源框基因家族的一员,在小鼠多能干细胞或骨髓中过表达Lhx2基因可建立SCF依赖的永生化细胞系HPC-Lhx2, HPC-Lhx2细胞系生物学特性与HSC十分相似,是体外研究HSC生物学特性较理想的细胞模型[9]。因此,本实验中我们建立HPC-Lhx2细胞系,并收集AFT024-SCF细胞系上清液用于培养HPC-Lhx2,观察后者扩增情况,以评估新构建的AFT024-SCF细胞系生物学功能。并为后续建立和优化体外扩增HSC的体系奠定基础。
材 料 和 方 法
1细胞系及主要试剂
1.1动物C57BL/6小鼠,6~8周龄,购自北京维通利华公司。
1.2细胞、菌株及质粒AFT024细胞系购自ATCC;兔抗小鼠多克隆抗体、羊抗兔IgG购自Santa Cruz;ExTaq热启动DNA聚合酶、限制性内切酶均购自TaKaRa;连接酶和质粒小量提取试剂盒购自天根生化科技有限公司;Reverse Transciptase、TRIzol试剂均购自Invitrogen;重组小鼠SCF、IL-6均购自PeproTech;胎牛血清(fetal bovine serum, FBS)、2-巯基乙醇(MTG)购自Gibco;高糖DMEM、IMDM、含丙酮酸钠的高糖DMEM、MTG、青/链霉素(P/S)混合液、胰酶均购自Life Technologies。小鼠集落形成单位(colony forming unit, CFU)半固体培养基购自Stem Cell。MTT试剂盒购自碧云天公司。SCF/MGF ELISA试剂盒购自CUSABIO。
2方法
2.1pMYs-Lhx2-GFP、pMYs-SCF-GFP载体的构建由于小鼠SCF、Lhx2分别高表达于小鼠肺、胚胎组织中。故我们分离出小鼠肺、胚胎组织,以TRIzol法提取其RNA并逆转录后获得SCF及Lhx2的cDNA模板。PCR扩增获得带有酶切序列的目的基因片段,将PCR产物和逆转录病毒载体pMYs-IRES-GFP分别双酶切后进行连接,转化DH5α感受态细胞,最后提取质粒进行测序鉴定。
2.2AFT024-SCF细胞系构建Plat-E细胞包装病毒,收集处于对数生长期的AFT024细胞,按每孔3.5×104个接种于6孔板中,培养24 h进行病毒感染。感染后继续培养12 h更换新鲜培养基。24 h后进行二次感染。
2.3Real-time PCR检测SCF mRNA的表达水平细胞二次感染48 h后,荧光显微镜下观察GFP阳性细胞比例。收集106个AFT024-GFP及AFT024-SCF细胞分别置于TRIzol中裂解并提取总RNA,经逆转录合成cDNA。Real-time PCR检测SCF mRNA的相对表达量。反应条件为:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,共40个循环。依据公式2-ΔΔCt计算出SCF的相对表达量,其中GAPDH作为内参照。具体引物序列见表1。

表1 引物序列
2.4Western blot检测SCF蛋白表达水平收集AFT024-GFP及AFT024-SCF细胞,细胞裂解液中裂解并提取上清液,加SDS上样缓冲液98 ℃煮样变性以制备蛋白。上样后经SDS-PAGE分离,接着转移至PVDF膜。将目的条带置于含5%BSA的TBST溶液中室温封闭1 h。弃去封闭液后分别加入SCF(1∶1 000)和GAPDH(1∶5 000)Ⅰ抗, 4 ℃孵育12 h。TBST溶液洗涤3次,加入Ⅱ抗(1∶5 000)室温孵育90 min,TBST溶液洗涤3次后,X光片压片、显影、定影。最后分光光度仪分析蛋白含量。
2.5ELISA实验测定AFT024-SCF上清中SCF浓度收集AFT024-SCF及AFT024细胞约80%~90% 密度时的上清液,准备未曾使用的新鲜AFT024培养基作为空白对照。分别设空白对照组(AFT024培养基稀释1×104倍),阴性对照组(AFT024上清液稀释1×104倍),阳性对照组(添加1 mg/L SCF 的AFT024培养基稀释1×104倍),实验组(AFT024-SCF上清液稀释1×104倍)。按CUASIBIO SCF/MGF ELISA试剂盒操作说明进行检测,最终分别测定各组在450 nm波长处的吸光度(A)值,从而获得各组的SCF浓度。
2.6建立HPC-Lhx2细胞系方法参照Pinto等[10]实验中HPC-Lhx2细胞系的构建方法。将5-氟尿嘧啶注入C57BL/6小鼠腹腔内,富集小鼠骨髓HPC。3 d后处死小鼠,收集HPC按每孔5×106个接种于6孔板,使用IMDM基础培养基(IMDM+10% FBS+1.5×10-4mol/L MTG )+100 μg/L SCF+10 μg/L IL-6预刺激24 h。Plat-E细胞包装病毒,获得Lhx2组及GFP对照组逆转录病毒上清。将细胞按每孔2×106个加入6孔板进行病毒感染,后吸去病毒上清并添加新鲜预热培养基(IMDM +5% FBS+1.5×10-4mol/L MTG +100 μg/L SCF)接着培养24 h,重复感染1次。二次感染后,细胞继续培养6 周。
2.7不同培养基培养HPC-Lhx2细胞系将AFT024-SCF及AFT024-GFP接种于100 mm盘,待细胞密度至80%~90% 时收集上清液。将所得上清液分别与IMDM基础培养基以1∶10混合。收集培养的HPC-Lhx2细胞,以1×108/L分别重悬于4组培养基培养(IMDM基础培养基、IMDM基础培养基+100 μg/L SCF、IMDM基础培养基+ AFT024-GFP上清、IDMI基础培养基+ AFT024-SCF上清)。将4组细胞混悬液分别置于96 孔板和24 孔板培养。96 孔板每组5 个重复孔,每孔加入200 μL细胞悬液,即每孔2×104个细胞,培养72 h后评估细胞增殖活性。24孔板每组3 个复孔,每孔加入2 mL细胞混悬液,即每孔2×105个细胞,培养72 h后收集细胞并进行细胞计数。
2.8MTT法评估细胞增殖活性96孔板细胞体外培养72 h后,每孔加入20 μL MTT溶液,孵育4 h后离心弃上清液。接着每孔加入200 μL DMSO,后用酶标仪测定490 nm波长处的A值。
2.9集落形成实验评估扩增HPC-Lhx2细胞干性24孔板细胞收集计数后以3×107/L重悬。重悬后细胞每孔用1 mL注射器取100 μL,即约3 000个细胞置于1 mL CFU半固体培养基中,涡旋振荡器振荡混匀后置于35 mm盘中培养7~14 d后观察集落形成情况,进行总集落的计数及各系集落计数。
3统计学处理
用SPSS 20.0及GraphPad 5.0对数据进行统计学处理,计量资料用均数±标准差(mean±SD)表示,两组独立样本比较采用t检验,多组比较采用单因素方差分析,组间两两比较采用Bonferroni法,以P<0.05为差异有统计学意义。
结 果
1pMYs-SCF-IRES-GFP和pMYs-Lhx2-IRES-GFP逆转录病毒载体的构建
pMYs-SCF-IRES-GFP载体经EcoR I和XhoI酶切,pMYs-Lhx2-IRES-GFP载体经EcoR I和BamH I酶切后,琼脂糖凝胶电泳显示载体中重组目的片段被分离,且片段大小与基因大小符合。SCF大小为822 bp,Lhx2大小为1 098 bp,见图1。挑选质粒测序完全匹配,实验结果表明逆转录载体构建成功。
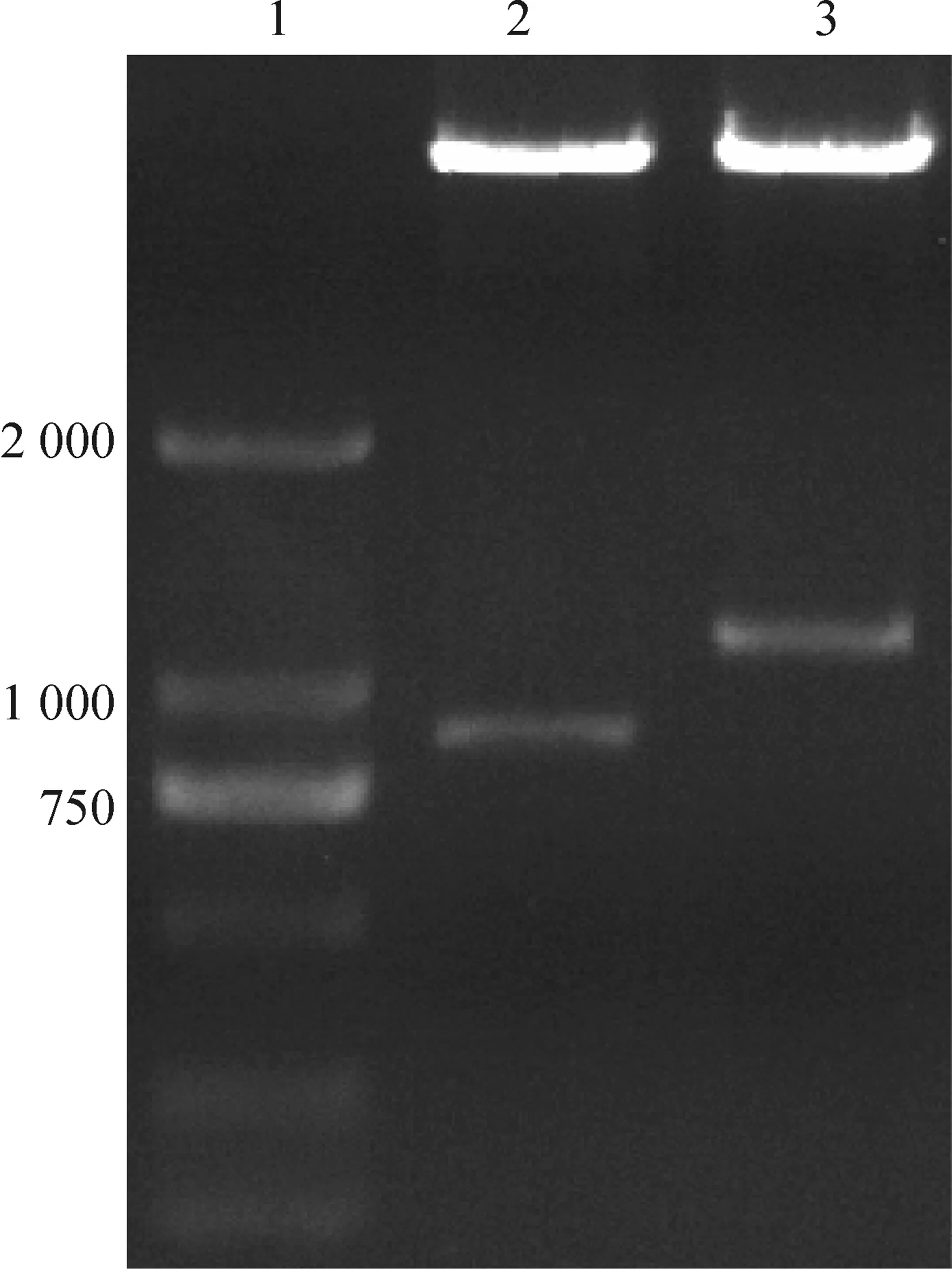
Figure 1.Constructed retrovirus vectors identified by double enzyme digestion. 1: marker (2 000 bp); 2: pMYs-SCF-IRES-EGFP plasmid was digested byEcoR I andXhoI; 3: pMYs-Lhx2-IRES-GFP plasmid was digested byEcoR I andBamH I.
图1逆转录病毒载体的双酶切鉴定
2AFT024-SCF细胞系建立及其上清液中SCF检测
pMYs-SCF-IRES-GFP逆转录病毒载体含有绿色荧光报告基因GFP,可用以观察、评估感染效率。荧光倒置显微镜观察感染24 h后的细胞,可以观察到绿色荧光。感染48 h时GFP表达最理想,为100%。带有目的基因载体组和空载对照组GFP感染率没有明显差异。以real-time PCR法检测SCF在AFT024细胞系中的mRNA表达,结果表明AFT024-SCF中SCF的表达量明显比对照组AT024-GFP组高(P<0.01)。以Western blot法检测SCF在AFT024-SCF细胞系中的蛋白表达, 结果显示只在AFT024-SCF细胞中检测到SCF。以ELISA实验检测AFT024-SCF上清中SCF的蛋白表达,减去空白孔A值后可见实验组与阳性对照组A值接近,阴性对照组A值极低,可忽略不计。测得阳性对照组SCF浓度约为(99.49±6.93) ng/L, 实验组SCF浓度约为(101.50±6.18) ng/L,两组差异无统计学意义。ELISA实验结果证明AFT024-SCF能够分泌SCF至上清液中,见图2。
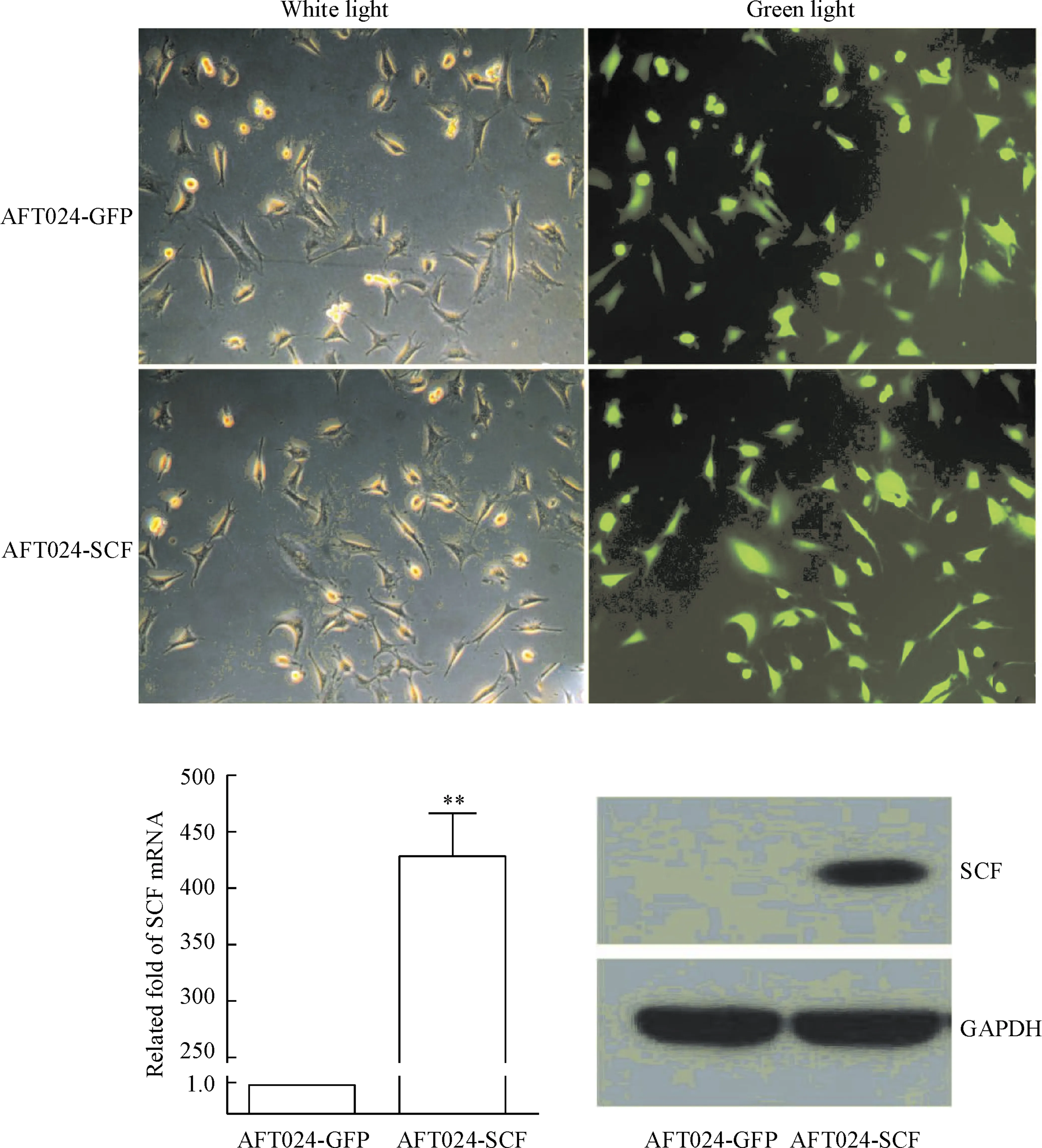
Figure 2.Construction and identification of AFT024-SCF cell line(×100).Mean±SD.n=3.**P<0.01vsAFT024-GFP group.
图2AFT024-SCF细胞系构建及鉴定
3HPC-Lhx2细胞系的建立
pMYs-Lhx2-IRES-GFP逆转录病毒载体同样含有GFP,感染细胞48 h后用荧光倒置显微镜观察可见部分细胞发绿色荧光。Lhx2组和GFP对照组的GFP感染率没有明显差异。经过体外培养6 周,GFP对照组只有贴壁细胞生长,HPC-Lhx2组仍然有大量悬浮生长的血细胞,表明HPC-Lhx2细胞系建立成功,见图3。

Figure 3.Construction of SCF-dependent HPC-Lhx2 cell line (×100). A: enriched bone marrow (BM) cells infected with GFP (white light); B: enriched BM cells infected with GFP (green light); C: enriched BM cells infected with Lhx2 (white light); D: enriched BM cells infected with Lhx2 (green light); E: BM-GFP cells were failed cultured for 6 weeksinvitro(white light); F: HPC-Lhx2 cells were successfully cultured for 6 weeksinvitro(white light).
图3构建依赖SCF的HPC-Lhx2细胞系
4MTT法测定体外培养HPC-Lhx2的细胞增殖活力,集落形成实验鉴定所扩增HPC-Lhx2细胞的干性
阳性对照组及AFT024-SCF上清培养组与IMDM对照组的MTT结果比较均有差异(P<0.05),而AFT024-GFP上清培养组与IMDM对照组的MTT结果比较无显著差异,见图4。阳性对照组及实验组培养基培养72 h的HPC-Lhx2均能形成克隆,阳性对照组共约90个,实验组共约86个,以粒细胞-巨噬细胞集落占大多数,且2组各系集落数差异均无统计学意义,两组阴性对照均无克隆形成,见图5、表2。实验结果表明以1∶10稀释AFT024-SCF上清配制的培养基完全可以代替IMDM添加100 μg/L SCF的培养基。
讨 论
1构建的AFT024-SCF细胞系能够表达SCF
在小鼠造血发育过程中,造血生成的位置是不断变化的,由最初的卵黄囊(yolk sac, YS)造血,到主动脉-中肾-性腺区(aorta-gonad-mesonephros region,
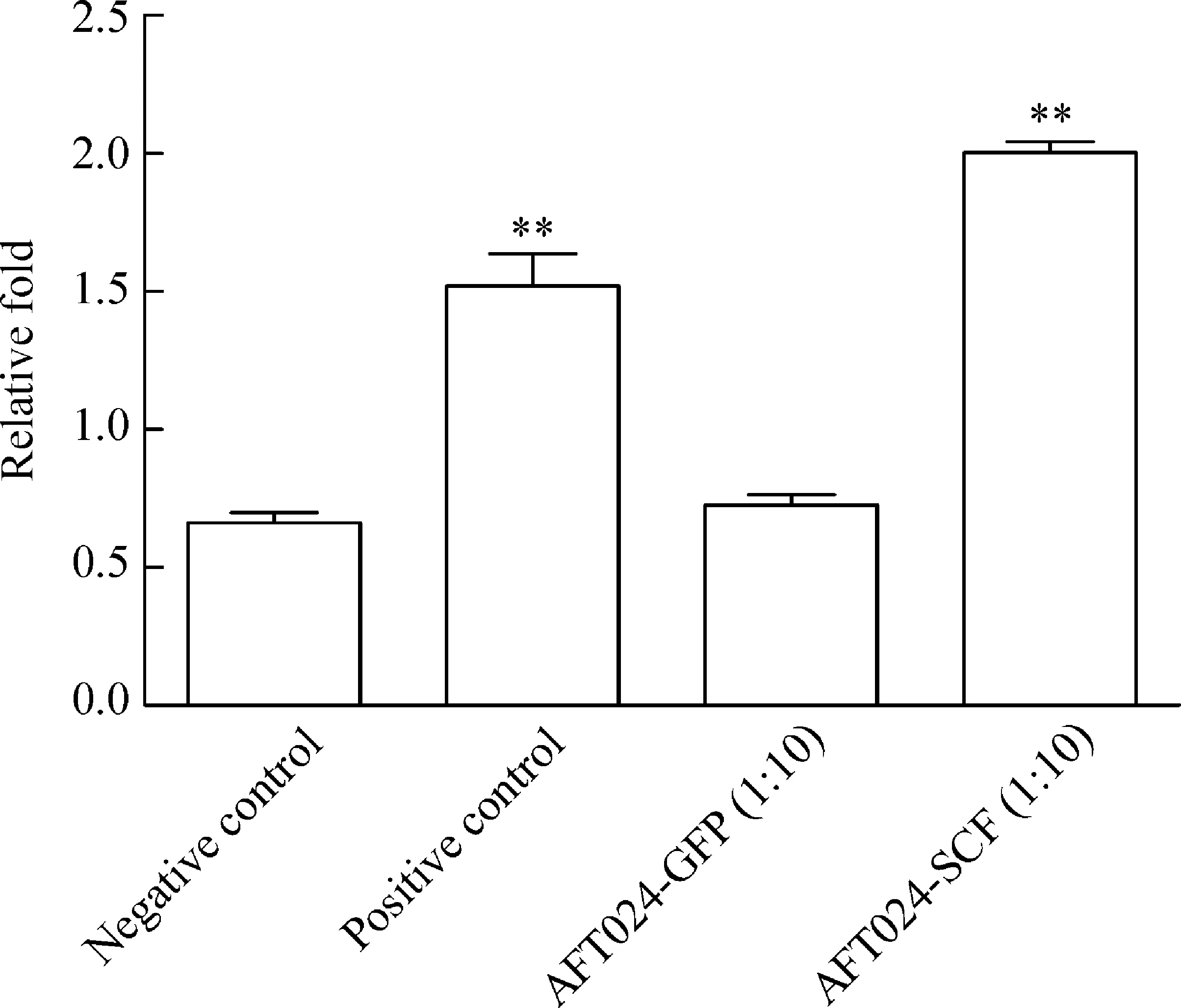
Figure 4.The proliferation of HPC-Lhx2 cells in different medium. Negative control: IMDM basic medium; positive control: IMDM basic medium with 100 μg/L SCF; AFT024-GFP(1∶10): IMDM basic medium with 10% AFT024-GFP supernatant; AFT024-SCF(1∶10): IMDM basic medium with 10% AFT024-SCF supernatant.Mean±SD.n=3.**P<0.01vsnegative control).
图4HPC-Lhx2细胞在不同培养基中的增殖情况
AGM)造血,再到胎肝造血以及出生后的骨髓造血[11]。胎肝中的HSC大量扩增以提供足够数量的HSC储备。但在此时期之前的AGM区及之后的骨髓中HSC通常情况下均处于一个休眠状态。因此要研究HSC扩增,我们聚焦于胎肝期HSC。胎肝期HSC的扩增可能受两方面因素影响,即HSC本身的细胞自主机制及胎肝微环境细胞的非自主机制。而研究表明促进其自我更新及扩增的分子信号主要可能源于胎肝微环境[12]。有学者将胎肝微环境中的基质细胞分离出来建立成基质细胞系并进行体外扩增HSC实验,结果发现分离出的200多种基质细胞系中,命名为AFT024的细胞系体外维持小鼠HSC的能力最强。其能够体外维持HSC达 4~7 周之久,在移植后其仍然能够重建受体造血系统,并且与未经培养的新鲜HSC移植效果相似[8]。目前研究表明,AFT024细胞系用于体外扩增HSC主要有以下优点:(1)能够为HSC的自我更新和定向分化提供均衡的细胞微环境;(2)在不依赖其它微环境因素情况下,来自AFT024的单独信号已经足以体外维持HSC干性一段时间;(3)这种维持HSC干性的机制具有进化保守性,不仅可以体外维持鼠的HSC干性较长时间,还能体外维持人的HSC干性[13-14]。综上所述,AFT024是体内外扩增HSC微环境中一个重要的细胞组成部分,目前,对于HSC维持其干细胞特性的机制以及造血微环境对HSC的影响仍有待进一步研究,而小鼠胎肝基质细胞AFT024细胞系正是研究后者比较理想的实验材料之一。据文献[15]报道,将SCF导入小鼠骨髓基质细胞,可在骨髓基质细胞及其上清液中检测到SCF表达,且其上清液可协同GM-CSF刺激骨髓细胞集落生长,证明其具有生物学活性。目前并未有将SCF导入AFT024细胞系的报道,而AFT024作为具有相似于骨髓基质细胞的细胞系,构建AFT024-SCF对于体外培养HSC有着一定意义。因此,本实验以上述文献报道为理论基础,将SCF导入AFT024,构建成为新的AFT024-SCF细胞系。用real-time PCR和Western blot分别在mRNA及蛋白水平证明此细胞系可表达SCF基因。并用ELISA实验证明AFT024-SCF可分泌SCF至上清液中。为今后进一步研究基质细胞与细胞因子对于HSC体外干性维持的作用提供了较好的实验材料,避免了长期培养时外源性添加SCF所造成的SCF浓度的较大幅度波动。
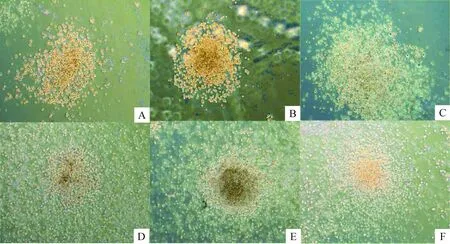
Figure 5.The morphology of CFU of HPC-Lhx2 cells in different medium(×50). A: granulocyte colony of AFT024-SCF group; B: macrophage colony of AFT024-SCF group ; C: granulocyte-macrophage colony of AFT024-SCF group; D: granulocyte colony of control group; E: macrophage colony of control group ; F: granulocyte-macrophage colony of control group.
图5不同培养基培养的HPC-Lhx2形成的CFU形态无明显差异
表2培养后的HPC-Lhx2在CFU实验中形成的克隆数
Table 2.Colony numbers formed by cultured HPC-Lhx2 cells in colony forming experiment (Mean±SD.n=3)
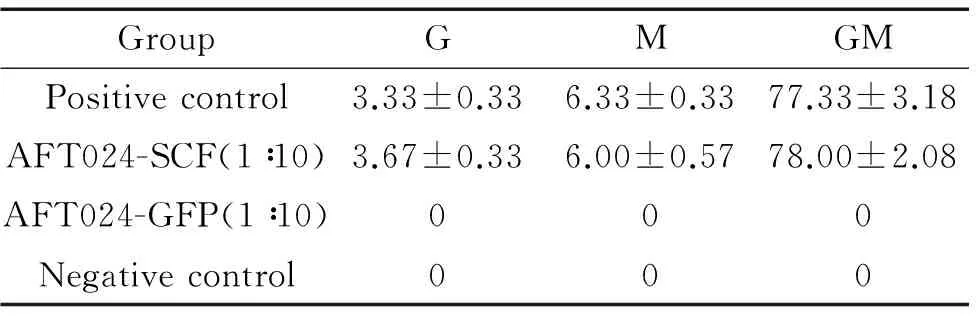
GroupGMGMPositivecontrol3.33±0.336.33±0.3377.33±3.18AFT024-SCF(1∶10)3.67±0.336.00±0.5778.00±2.08AFT024-GFP(1∶10)000Negativecontrol000
G: granulocyte colony; M: macrophage colony; GM: granulocyte-macrophage colony.
2采用HPC-Lhx2细胞系证明了AFT024-SCF所分泌上清液中含有生物活性的SCF
HPC-Lhx2是一种SCF依赖的造血干/祖细胞系,生物学特性与正常的HSC相似。HPC-Lhx2细胞系能够在SCF存在的情况下持续扩增,并且培养7 个月以上不发生明显分化。在基质细胞的支持下可形成鹅卵石区域,具有长期培养起始细胞(long-term culture-initiating cells,LTC-IC)的特点[10]。研究表明使用特定细胞因子及细胞因子组合的体外培养体系培养HPC-Lhx2细胞系与培养HSC效果相似[16]。鉴于它易于获得及培养,可以作为HSC的细胞模型用于基础实验研究。我们利用构建的HPC-Lhx2细胞系鉴定AFT024-SCF的上清液中是否具有类似SCF作用的生物活性物质。收集AFT024-SCF及AFT024-GFP细胞培养上清液并以1∶10与IMDM基础培养基混合备用。以AFT024-SCF组上清液为实验组,AFT024-GFP组上清液为内源性阴性对照组,无任何添加的IMDM基础培养基为外源性阴性对照组,添加重组SCF的IMDM培养基为阳性对照组,分别与HPC-Lhx2 细胞系培养72 h。结果显示:外源性及内源性阴性对照组未能维持HPC-Lhx2细胞增殖,而阳性对照组及实验组均可促进HPC-Lhx2细胞增殖。且集落形成实验中培养72 h的实验组HPC-Lhx2所形成的各系克隆数与阳性对照组相似,差异无统计学意义,而2组阴性对照均无克隆形成。由此我们认为AFT024-SCF上清液可以替代昂贵的商业化基因工程重组SCF。这为体外扩增HSC、研究其功能及调控机制提供了非常好的实验支持材料。另外,结果显示实验组较阳性对照组扩增效果稍优,而我们阳性对照组所添加的SCF浓度100 μg/L是据文献报道所使用的扩增HPC-Lhx2较为理想的浓度[9],这可能是其中SCF浓度更为合适,或者是AFT024-SCF细胞生成的其它物质与SCF产生了协同作用。现在已有实验提示AFT024细胞的Dlk/pref-1基因表达产物对维持扩增HSC具有重要影响[17]。后续我们将检测AFT024-SCF上清液的SCF蛋白含量及分析其它细胞因子组成以进一步阐明其维持扩增HSC的机制,并可进行AFT024-SCF与HSC共培养实验,观察基质细胞系与细胞因子共同作用是否更有利于HSC的体外培养。
综上所述,本研究采用逆转录病毒感染技术,成功建立了小鼠HPC-Lhx2细胞系和AFT024-SCF细胞系。以HPC-Lhx2细胞系作为HSC细胞模型,我们证实了AFT024-SCF细胞系不仅能够表达SCF,而且还可能分泌释放有生物学活性的SCF到培养上清液中。这为后续体外扩增HSC及HSC功能和调控机制的研究奠定了实验基础。
[1]Copelan EA. Hematopoietic stem-cell transplantation[J]. N Engl J Med,2006,354(17):1813-1826.
[2]Abraham A, Kim YS, Zhao H, et al. Increased engraftment of human short term repopulating hematopoietic cells in NOD/SCID/IL2rγnullmice by lentiviral expression of NUP98-HOXA10HD[J]. PLoS One,2016,11(1):e147059.
[3]Zhang CC, Lodish HF. Cytokines regulating hematopoietic stem cell function[J]. Curr Opin Hematol,2008,15(4):307-311.
[4]Bowie MB, Kent DG, Copley MR, et al. Steel factor responsiveness regulates the high self-renewal phenotype of fetal hematopoietic stem cells[J]. Blood,2007,109(11):5043-5048.
[5]Broudy VC. Stem cell factor and hematopoiesis[J].Blood,1997,90(4):1345-1364.
[6]林旭滨,陈运贤. 脐血细胞因子的研究进展[J]. 中国病理生理杂志,1999,15(7):669-672.
[7]Thiemann FT, Moore KA, Smogorzewska EM, et al. The murine stromal cell line AFT024 acts specifically on human CD34+CD38-progenitors to maintain primitive function and immunophenotypeinvitro[J]. Exp Hematol,1998,26(7):612-619.
[8]Hackney JA, Charbord P, Brunk BP, et al. A molecular profile of a hematopoietic stem cell niche[J]. Proc Natl Acad Sci U S A,2002,99(20):13061-13066.
[9]Pinto do O P, Richter K, Carlsson L. Hematopoietic progenitor/stem cells immortalized by Lhx2 generate functional hematopoietic cellsinvivo[J]. Blood,2002,99(11):3939-3946.
[10]Pinto do O P, Kolterud A, Carlsson L. Expression of the LIM-homeobox geneLH2 generates immortalized steel factor-dependent multipotent hematopoietic precursors[J]. EMBO J,1998,17(19):5744-5756.
[11]Palis J, Yoder MC. Yolk-sac hematopoiesis: the first blood cells of mouse and man[J]. Exp Hematol,2001,29(8):927-936.
[12]Ema H, Nakauchi H. Expansion of hematopoietic stem cells in the developing liver of a mouse embryo[J]. Blood,2000,95(7):2284-2288.
[13]Miller JS, Mccullar V, Punzel M, et al. Single adult human CD34+/Lin-/CD38-progenitors give rise to natural killer cells, B-lineage cells, dendritic cells, and myeloid cells[J]. Blood,1999,93(1):96-106.
[14]Punzel M, Wissink SD, Miller JS, et al. The myeloid-lymphoid initiating cell (ML-IC) assay assesses the fate of multipotent human progenitorsinvitro[J]. Blood,1999,93(11):3750-3756.
[15]张红梅,陈玉丙,朱迅. 小鼠干细胞因子基因以脂质体介导转染骨髓基质细胞[J]. 中国老年学杂志,2004,24(2):153-154.
[16]Pinto do O P, Wandzioch E, Kolterud A, et al. Multipotent hematopoietic progenitor cells immortalized by Lhx2 self-renew by a cell nonautonomous mechanism[J]. Exp Hematol,2001,29(8):1019-1028.
[17]Hackney JA, Charbord P, Brunk BP, et al. A molecular profile of a hematopoietic stem cell niche[J]. Proc Natl Acad Sci U S A,2002,99(20):13061-13066.
(责任编辑: 林白霜, 余小慧)
AFT024-SCF construction and functional identification
LI Chen1, LU Ying1, YANG Dan1, WANG Ying2, XUE Miao1, ZHANG Xiang-zhong1
(1DepartmentofHematology,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China;2AnhuiUniversity,Hefei230000,China.E-mail:bradzxz@126.com)
AIM: To construct AFT024-SCF cell line and HPC-Lhx2 cell line for confirming the biological function of AFT024-SCF.METHODS: The HPC-Lhx2 cell line, AFT024-SCF cell line and AFT024-GFP cell line were constructed by retro-viral infection. The expression of stem cell factor(SCF) in AFT024-SCF cells was detected by real-time PCR and Western blot. SCF in the supernatant of AFT024-SCF was detected with ELISA. The supernatant of AFT024-SCF and AFT024-GFP were collected and then diluted (1∶10) with basic IMDM medium. So we made 4 culture medium: AFT024-SCF medium was used for experiment group, AFT024-GFP medium was used for endogenous negative control, IMDM basic medium was used for exogenous negative control, and IMDM basic medium with SCF was used for positive control. SCF-dependent HPC-Lhx2 cell line was cultured in these 4 different medium for 72 h. According to MTT method and colony forming experiment, the biological function of AFT024-SCF was confirmed by the proliferation ability of SCF-dependent HPC-Lhx2 cell line.RESULTS: SCF was highly expressed in AFT024-SCF cells. After cultured for 72 h, neither IMDM basic medium nor GFP-AFT024 medium support HPC-Lhx2 cell line proliferation. However, AFT024-SCF medium supported HPC-Lhx2 cell line expansion as well as the positive control medium.CONCLUSION: AFT024-SCF cells express SCF successfully and recombinant SCF can be replaced by the supernatant of AFT024-SCF culture medium for expanding HPC-Lhx2 cell lineinvitro.
AFT024-SCF cell line; Stem cell factor; Hematopoietic stem/progenitor cells; HPC-Lhx2 cell line
1000- 4718(2016)04- 0745- 07
2015- 06- 30
2016- 02- 04
广东省自然科学基金资助项目(No.S2013010016559; No.2014A030313138)
Tel:020-82179779; E-mail:bradzxz@126.com
R551
A
10.3969/j.issn.1000- 4718.2016.04.027
杂志网址: http://www.cjpp.net

