HIL-6和HGF双基因重组腺病毒增强对慢加急性肝衰竭大鼠的治疗效果*
高丹丹, 付 佳, 秦 波, 黄文祥, 杨 春, 贾 蓓
(重庆医科大学附属第一医院感染科,重庆市传染病寄生虫病学重点实验室,重庆 400016)
HIL-6和HGF双基因重组腺病毒增强对慢加急性肝衰竭大鼠的治疗效果*
高丹丹,付佳,秦波,黄文祥,杨春△,贾蓓△
(重庆医科大学附属第一医院感染科,重庆市传染病寄生虫病学重点实验室,重庆 400016)
目的: 比较超级白细胞介素6(HIL-6)和肝细胞生长因子(HGF)双基因重组腺病毒(Ad-HGF-HIL-6)与HIL-6或HGF重组腺病毒(Ad-HIL-6或Ad-HGF)对慢加急性肝衰竭(ACLF)大鼠的治疗效果。方法: 将ACLF大鼠随机分为:未感染(model)组、空载体(Ad0)组、Ad-HGF组、Ad-HIL-6组和Ad-HGF-HIL-6组。收集血清及肝组织进行生物化学、病理学及分子生物学检测。结果: Ad-HGF、Ad-HIL-6或Ad-HGF-HIL-6组与Ad0组比较,凝血酶原时间(PT)、血清丙氨酸氨基转移酶(ALT)、肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)、高迁移率族蛋白B1(HMGB1)、凋亡指数及Bax蛋白明显降低且肝组织病变减轻,Bcl-2和Ki67蛋白的表达明显增高;以上各项变化均以Ad-HGF-HIL-6组更显著。结论: Ad-HGF-HIL-6比Ad-HGF或Ad-HIL-6对ACLF大鼠有更显著的治疗效果且无明显毒副作用。
慢加急性肝衰竭; 超级白细胞介素6; 肝细胞生长因子; 重组腺病毒; 细胞凋亡
慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)是指慢性肝病基础上短期内发生的肝功能失代偿,我国肝衰竭病例中慢加急/亚急性肝衰竭占90%以上,目前尚缺乏特效治疗方法,如何促进肝细胞的再生是提高肝衰竭患者生存率的关键。肝细胞的再生是多细胞和多因子共同参与调控的一个复杂过程,而静止期肝细胞进入细胞周期(启动)及越过G1期是其中的2个关键步骤。目前认为肝再生启动受肿瘤坏死因子(tumor necrosis factor,TNF)家族和白细胞介素6(interleukin-6,IL-6)的控制,而细胞周期则受我们熟知的促肝细胞增殖的细胞因子肝细胞生长因子(hepatocyte growth factor,HGF)和转化生长因子β(transforming growth factor β,TGF-β)的控制[1]。超级白细胞介素6(hyper-IL-6,HIL-6)是将IL-6与截短形式的可溶性白细胞介素6受体(soluble interleukin-6 receptor,sIL-6R)通过基因操作共价连接的一种细胞因子。它是一种稳定的蛋白质,在体内或体外的生物学活性比IL-6/sIL-6R可溶性络合物高10~1 000倍[2]。Ohira等[3]报道IL-6皮下注射能促进大鼠肝细胞增殖,并发现注射IL-6后1 d血及肝组织中的HGF增高,说明IL-6的促肝细胞增殖作用是由IL-6引发的HGF增高所介导的。对鼠门静脉进行分支结扎实验显示,单用HGF或IL-6处理,未结扎肝叶的净重量明显增加,HGF和IL-6联用组肝净重量显著高于单用HGF或IL-6组[4]。基于以上的研究成果,为了进一步开拓细胞因子和基因治疗肝衰竭的前景,为临床应用奠定实验基础,我们构建了HIL-6联合HGF双基因重组腺病毒,观察这2个基因协同对实验性肝衰竭的治疗作用。
材 料 和 方 法
1材料
腺病毒表达载体GV314及辅助包装质粒(pBHG lox ΔE1, 3 Cre)均由上海吉凯基因化学技术有限公司提供;质粒抽提试剂盒和无RNA酶污染的DNA酶RQ1(Promega);限制性内切酶(NEB);Lipofectamine 2000、TRIzol试剂和RNA抽提试剂盒(Invitrogen);人肾胚细胞HEK293细胞购自ATCC;大肠杆菌菌株DH5α由重庆市传染病寄生虫病学重点实验室保存;人血清白蛋白(human serum albumin,HSA)购自Octapharma;D-氨基半乳糖(D-galactosamine,D-GalN)和脂多糖(lipopolysaccharide,LPS)均购自Sigma;TNF-α和干扰素γ(interferon-γ,IFN-γ) ELISA试剂盒(eBioscience);高迁移率族蛋白B1(high-mobility group box-1,HMGB1) ELISA试剂盒(Westang);Ki67单克隆抗体(Roche Ventana);TUNEL试剂盒(Roche);PrimeScript RT试剂盒、引物和SYBR Premix Ex TaqTM(TaKaRa);Bcl-2和Bax单克隆抗体(CST)。
2主要方法
2.1重组腺病毒根据Genbank中HGF基因的mRNA序列(NM_000601)及文献[5]中HIL-6基因序列分别设计HGF、HIL-6及HGF-IRES-HIL-6(IRES为连接HGF和HIL-6基因的短链,重组腺病毒在体内表达时IRES断裂)的相关引物(由上海吉凯基因化学技术有限公司合成),分别进行目的基因的PCR扩增,并行电泳鉴定。将获得的目的基因同源重组分别转入表达载体(线性化的GV314),后转化入DH5α感受态细胞。经鉴定后,接种阳性克隆,保种,分装100 μL进行DNA测序(由上海吉凯基因化学技术有限公司完成)。转染前2 h将细胞培养基更换为无血清Opti-MEM培养基。按照等摩尔比条件配置病毒质粒的复合物,配置稳定的质粒DNA和Lipofectamine 2000稀释液转染复合体,将复合体移入HEK293细胞培养瓶中继续培养。10~15 d出现病毒空斑。收获后得到HGF重组腺病毒、HIL-6重组腺病毒及HGF和HIL-6双基因重组腺病毒(即Ad-HGF、Ad-HIL-6及Ad-HGF-HIL-6),在HEK293细胞中进行大量扩增后用氯化铯密度梯度离心法进行纯化,以吸光度(A)测定估算病毒浓度(浓度约5×1015VP/L,VP即病毒颗粒)。采用终点稀释法进行腺病毒滴度测定。
2.2慢加急性肝衰竭模型的建立参照文献[6]方法制备大鼠慢加急性肝衰竭模型:SD大鼠用HSA致敏后予尾静脉攻击注射HSA 2.5~4 mg,每周2次,共6周后腹腔注射D-GalN 400 mg/kg+LPS 100 μg/kg,于给药后3 h随机分为未感染组(model组,8只)、Ad0组、Ad-HGF组、Ad-HIL-6组和Ad-HGF-HIL-6组(感染腺病毒组每组各21只),另取8只同周龄正常大鼠作为对照(control)组。分组后各组每只大鼠立即分别给予尾静脉注射100 μL相应的腺病毒1×1010VP或等体积生理盐水,24 h后随机麻醉(0.6%戊巴比妥30 mg/kg)采血后处死所有大鼠,取各组大鼠肝右叶部分组织置于4%中性甲醛固定,其余新鲜肝组织尽量除尽残留血液后切成(1~5) mm×1 mm×1 mm小块,用冻存管装好,于液氮中保存。
2.3生化指标及细胞因子动态变化制备枸橼酸钠(1∶9)抗凝血浆用于凝血酶原时间(prothrombin time,PT)测定;剩余血液离心取部分血清检测丙氨酸氨基转移酶(alanine aminotransferase,ALT),余血清存放-80 ℃冰箱待测细胞因子。TNF-α、IFN-γ和HMGB1应用酶联免疫吸附实验方法进行检测,每份标本加2复孔,检测结果取两者均值。
2.4病理学检查取右肝叶组织,石蜡包埋固定后切片,作常规HE染色,光镜下观察;Ki67免疫组织化学染色:石蜡切片脱蜡,以0.3% H2O2-甲醇溶液处理后,滴加Ki67单克隆抗体4 ℃过夜,经生物素标记的第 II 抗体及辣根酶标记链霉卵白素各孵育15 min,DAB显色,苏木素复染。每只大鼠3张切片,每张切片随机选取5个视野(×200)进行细胞计数,计算Ki67阳性细胞百分比(%)=同一视野下阳性细胞数/细胞总数×100%。
2.5原位细胞凋亡检测(TUNEL法)石蜡切片脱蜡、水化,按TUNEL检测试剂盒说明书步骤进行。DAB显色,苏木素复染。每只大鼠5张切片,每张切片随机选取5个高倍视野(×400)进行细胞计数,计算凋亡细胞百分比,即凋亡指数(apoptotic index,AI)。
2.6RNA提取、反转录和实时荧光定量PCR肝组织总RNA提取按照TRIzol试剂使用说明进行。总RNA经RQ1处理去除可能的基因组DNA污染。使用随机引物进行反转录,反应实验步骤严格按照PrimeScript RT试剂盒说明书进行。所得cDNA运用特异性引物(表1)及SYBR Premix Ex TaqTM进行实时定量PCR扩增,反应条件为95 ℃10 min;94 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;94 ℃ 15 s。以β-actin作为内参照,各组的目的基因相对值使用2-ΔΔCt方法[7]测定。

表1 实时荧光定量PCR的引物序列
2.7Western blot实验取100 mg肝组织置于1 mL RIPA裂解液,充分匀浆并裂解30 min后,4 ℃ 12 000 r/min离心10 min,取其上清。蛋白样品经15% SDS-聚丙烯酰胺凝胶电泳后,300 mA恒压半干转膜70 min,以5%脱脂奶粉TTBS封闭,室温振荡1 h,Bcl-2(1∶700)、Bax(1∶1 000)和GAPDH(1∶5 000) I 抗4 ℃孵育过夜,再以HRP偶联的第II抗体(1∶2 500)作用,室温振荡1 h。ECL显色。结果用软件对条带的灰度值进行分析。各目标蛋白的条带灰度值与相应的GAPDH条带灰度值的比值来反映该蛋白的相对表达量。
3统计学处理
数据采用统计软件SPSS 19.0进行统计分析,各组大鼠间AI和Ki67阳性细胞百分比的比较运用Kruskal-Wallis检验,其余各数据多组间的比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Tukey HSD检验法,以P<0.05为差异有统计学意义。
结 果
1生化检测结果及细胞因子含量测定
与control组相比,model组的血浆PT和血清ALT、TNF-α、IFN-γ及HMGB1水平在检测时点显著升高,而Ad0组与model组相比差异没有统计学显著性。与Ad0组相比,ALT、PT、TNF-α、IFN-γ及HMGB1水平在Ad-HGF组、Ad-HIL-6组及Ad-HGF-HIL-6组呈明显下降趋势,其中ALT、PT、IFN-γ及HMGB1水平以Ad-HGF-HIL-6组下降最为显著。Ad-HGF-HIL-6组的血清TNF-α水平与Ad-HIL-6组相比下降趋势更为明显,而Ad-HGF-HIL-6组与Ad-HGF组相比差异无统计学显著性,见表2。
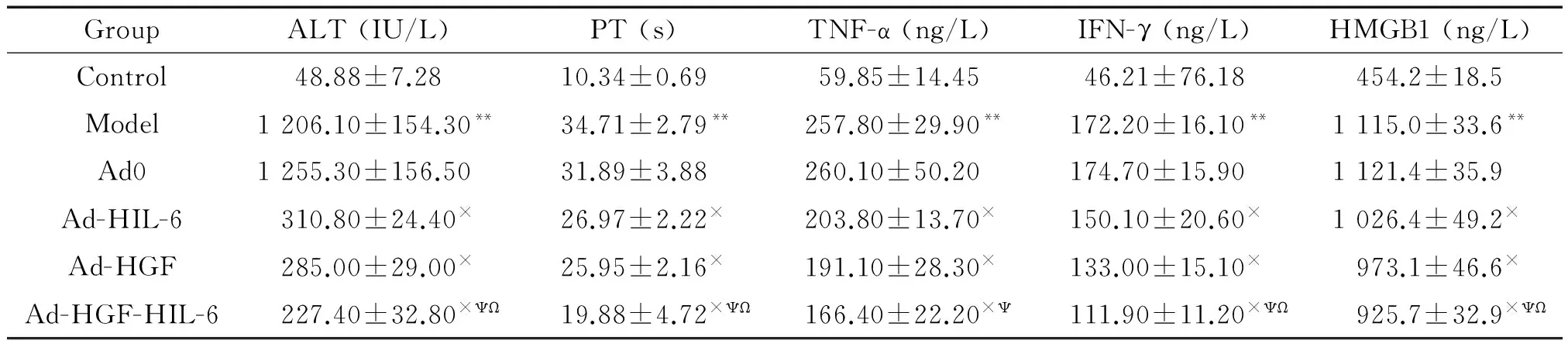
表2 各组大鼠生化指标及血清细胞因子含量的检测结果
**P<0.01vscontrol;×P<0.05vsAd0;ΨP<0.05vsAd-HIL-6;ΩP<0.05vsAd-HGF.
2肝组织学变化
光镜下,model组及Ad0组均见肝组织坏死严重,肝索解离,小叶结构不能辨认, 肝细胞大片坏死,残存少量肝细胞,凋亡细胞易见,汇管区可见大量淋巴细胞及中性粒细胞等炎性细胞浸润。Ad-HGF组及Ad-HIL-6组肝组织病变稍轻,肝索部分解离,肝组织呈片状或小灶状坏死,肝窦扩张,炎细胞浸润仍明显可见。Ad-HGF-HIL-6组肝小叶结构基本正常,肝窦轻度扩张,肝细胞以变性为主,小叶内仍可见少量点状坏死及散在的炎性细胞,见图1。

Figure 1.The histopathological changes of liver tissues in the rats with different treatments (HE staining,×100).
图1各组大鼠肝脏组织学改变
3Ki67免疫组织化学染色结果的比较
Ki67定位于细胞核呈棕黄色,在model组及Ad0组有少量表达,散在分布于肝小叶内。Ad-HGF组、Ad-HIL-6组及Ad-HGF-HIL-6组的阳性细胞显著增多,在肝小叶内呈弥漫性分布,其强度与肝脏增殖程度一致,其中以Ad-HGF-HIL-6组的表达最为强烈;而Ad0组与model组间的表达差异没有统计学显著性,见图2、表3。

Figure 2.Ki67 antigen expression in the liver tissues of the rats with different treatments (immunohistochemistry,×200).
图2各组大鼠肝脏Ki67抗原的表达
4肝组织TUNEL检测结果的比较
光镜下,control组大鼠肝脏切片偶见肝细胞凋亡,model组及Ad0组阳性着色的凋亡肝细胞明显增多,胞核呈均匀棕褐色,部分阳性着色肝细胞仍可见胞浆。凋亡的肝细胞散在于结节内无分布规律,大小不完全相等。Ad-HGF组、Ad-HIL-6组及Ad-HGF-HIL-6组的阳性着色凋亡肝细胞较Ad0组明显减少,以Ad-HGF-HIL-6组的变化最为显著;而Ad0组与model组相比差异没有统计学显著性见图3、表3。

Figure 3.TUNEL positive staining was showed in the liver tissues of the rats with different treatments (×400).
图3各组大鼠肝脏的TUNEL检测
表3不同处理对大鼠凋亡指数及Ki67+肝细胞百分比的影响
Table 3.Comparison of apoptotic index (AI) and percentage of Ki67+hepatocytes in the liver tissues of the rats with different treatments (Mean±SD.n=8)

Treatment AI(%)Ki67+hepatocytes(%)Control0.14±0.0110.37±5.24Model16.83±3.80**0.13±0.06**Ad015.97±3.530.17±0.07Ad-HIL-66.88±2.37×5.94±2.19×Ad-HGF7.60±1.99×6.27±2.40×Ad-HGF-HIL-62.18±0.86×ΨΩ11.95±3.38×ΨΩ
**P<0.01vscontrol;×P<0.05vsAd0;ΨP<0.05vsAd-HIL-6;ΩP<0.05vsAd-HGF.
5实时荧光定量PCR的结果
与Ad0组相比,Ad-HIL-6组及Ad-HGF-HIL-6组大鼠肝组织HIL-6的mRNA相对表达量显著升高;Ad0组与model组或Ad-HGF组比较组间差异无统计学显著性。与Ad0组相比,Ad-HGF组及Ad-HGF-HIL-6组大鼠肝组织HGF的mRNA相对表达量显著升高,Ad0组与model组或Ad-HIL-6组相比,组间差异无统计学显著性,见表4。
6Western blot结果
Model组的Bcl-2蛋白的相对表达量比control组明显降低;Ad-HGF组、Ad-HIL-6组、Ad-HGF-HIL-6组的Bcl-2比Ad0组明显升高,且以Ad-HGF-HIL-6组升高最为显著;model组的Bax相比control组明显升高;Ad-HGF组、Ad-HIL-6组和Ad-HGF-HIL-6组的Bax相比Ad0组明显降低,且以Ad-HGF-HIL-6组降低最为显著;以上2种凋亡相关蛋白在Ad0组与mo-del组间比较,差异均无统计学显著性,见图4、表4。

Figure 4.The protein levels of Bcl-2 and Bax detected by Western blot.
图4Western blot检测Bcl-2和Bax蛋白表达水平
表4实时荧光定量PCR和Western blot表达相对值
Table 4.Protein levels of Bcl-2 and Bax detected by Western blot and mRNA levels of HIL-6 and HGF detected by real-time PCR (Mean±SD.n=6)
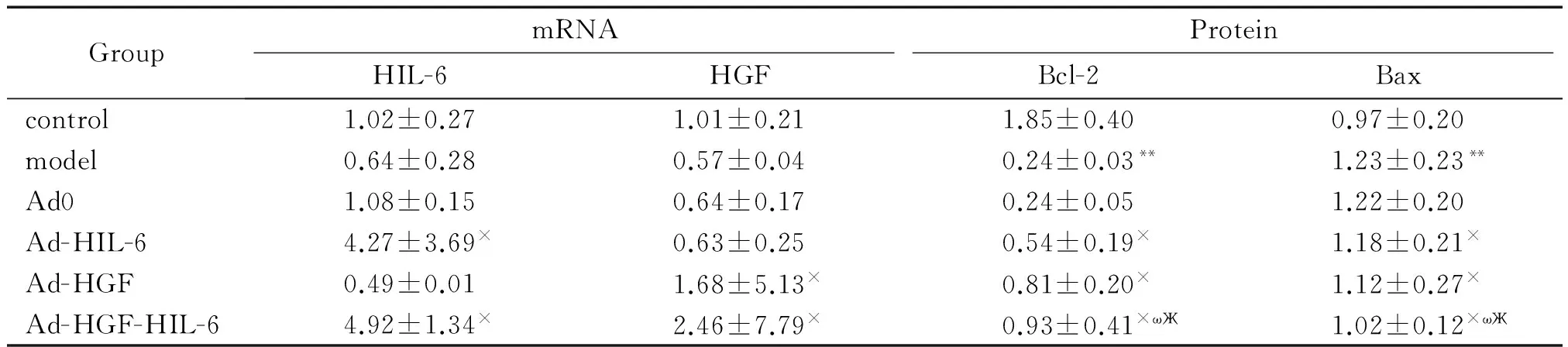
GroupmRNAProteinHIL-6HGFBcl-2Baxcontrol1.02±0.271.01±0.211.85±0.400.97±0.20model0.64±0.280.57±0.040.24±0.03**1.23±0.23**Ad01.08±0.150.64±0.170.24±0.051.22±0.20Ad-HIL-64.27±3.69×0.63±0.250.54±0.19×1.18±0.21×Ad-HGF0.49±0.011.68±5.13×0.81±0.20×1.12±0.27×Ad-HGF-HIL-64.92±1.34×2.46±7.79×0.93±0.41×ωЖ1.02±0.12×ωЖ
**P<0.01vscontrol;×P<0.05vsAd0;ωP<0.05vsAd-HIL-6;ЖP<0.05vsAd-HGF.
讨 论
HIL-6能显著增强肝细胞的再生能力。Zvibel等[8]用一种重组分子IL-6c (即HIL-6)刺激培养的E14大鼠胎肝细胞,发现它能刺激胎肝细胞增殖且呈剂量依赖性效应,并影响相关基因的表达。Peters等[9]发现给予HIL-6能使用缺乏胆碱而添加乙硫氨酸(choline-deficient ethionine-supplemented,CDE)的饮食处理小鼠的受损肝脏卵圆细胞数目显著增加,表明HIL-6可通过增加潜能肝细胞的增殖而影响肝细胞再生。HGF是最有效的肝丝裂原,对肝切除或化学损伤后的肝再生起着重要作用[10-11]。本实验采用腺病毒载体将Hyper IL-6和HGF同时转染大鼠ACLF模型,使两者同时在模型大鼠体内发挥积极作用而不相互干扰,避免了因增加腺病毒载体的剂量而可能产生的毒副作用。
肝组织病理学检查及TUNEL染色结果表明Ad-HGF-HIL-6相比Ad-HIL-6或Ad-HGF能更好地促进肝细胞再生、减少凋亡及抑制炎症反应。在ACLF发生发展过程中,系统性的炎症反应与疾病的转归和预后息息相关[12]。TNF-α及IFN-γ是我们所熟知的炎症细胞因子,先前的研究表明高表达的HMGB1在肝衰竭的发病机理中起着重要作用[13],阻断HMGB1能对ACLF模型大鼠产生保护作用[14]。本实验中Ad-HGF-HIL-6组大鼠的血清ALT、IFN-γ及HMGB1和血浆PT水平明显低于Ad-HIL-6或Ad-HGF组,血清TNF-α水平显著低于Ad-HIL-6组,说明Ad-HGF-HIL-6相比Ad-HIL-6或Ad-HGF具有更强的抗炎和逆转凝血障碍的能力。Western blot结果中Ad-HGF-HIL-6相比Ad-HIL-6或Ad-HGF能更有效地提高抗凋亡蛋白Bcl-2和降低促凋亡蛋白Bax水平,这些结果都为Ad-HGF-HIL-6相比Ad-HIL-6或Ad-HGF能更有效地抑制凋亡提供了证据。Real-time PCR检测结果证明Ad-HGF-HIL-6、Ad-HIL-6和Ad-HGF这3种重组腺病毒构建成功并能在ACLF模型大鼠的肝脏组织中靶向表达,而HIL-6和HGF这2种基因的表达并没有产生相互干扰。
基因治疗是目前医学研究的重要内容,如何建立一个安全、高效、实用及可重复的基因转移系统是基因治疗用于临床所面临的重大问题。腺病毒载体由于它的嗜肝性而成为治疗肝脏疾病的一种理想载体[15]。本实验通过把HIL-6和HGF双基因同时整合到重组腺病毒载体而证实了它们的相互协同作用,表明Ad-HGF-HIL-6比Ad-HIL-6或Ad-HGF能更好地促进慢加急性肝衰竭大鼠肝细胞的再生、减少凋亡及抑制炎症反应而并不增加毒副作用。本实验进一步开拓了基因治疗促进肝再生和治疗肝衰竭的前景,为慢加急性肝衰竭的基因治疗提供了可靠的实验室依据,其作用机制可能与炎症因子及凋亡蛋白等相关,具体的信号通路还需要我们在以后的研究中进一步深入探讨。Ad-HGF-HIL-6具有潜在的临床应用前景,有望成为治疗慢加急性肝衰竭的一种新型基因药物。
[1]Ramadori G, Armbrust T. Cytokines in the liver[J] . Eur J Gastroenterol Hepatol, 2001, 13(7):777-784.
[2]Peters M, Blinn G, Solem F, et al.Invivoandinvitroactivities of the gp130-stimulating designer cytokine Hyper-IL-6[J]. J Immunol, 1998, 161(7):3575-3581.
[3]Ohira H, Miyata M, Kuroda M, et al. Interleukin-6 induces proliferation of rat hepatocytesinvivo[J]. J Hepatol, 1996, 25(6):944-947.
[4]Kaido T, Oe H, Imamura M. Interleukin-6 augments he-patocyte growth factor induced liver regeneration; involvement of STAT3 activation[J]. Hepatogastroenterology, 2004, 51(60):1667-1670.
[5]Boulanger MJ, Chow DC, Brevnova EE, et al. Hexameric structure and assembly of the interleukin-6/IL-6 alpha-receptor/gp130 complex[J]. Science, 2003, 300(5628):2101-2104.
[6]刘旭华,陈煜,王泰龄,等. 人血白蛋白及D-氨基半乳糖、脂多糖联合诱导建立大鼠慢加急性肝衰竭模型[J]. 中华肝脏病杂志, 2007, 15(10):771-775.
[7]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod[J].methods, 2001, 25(4):402-408.
[8]Zvibel I, Brill S, Kevital R, et al. Chimeric molecule IL-6/soluble receptor is a potent mitogen for fetal hepatocytes[J]. J Cell Physiol, 2004, 200(2):245-252.
[9]Peters M, Blinn G, Jostock T, et al. Combined interleukin 6 and soluble interleukin 6 receptor accelerates murine liver regeneration[J]. Gastroenterology, 2000, 119(6):1163-1171.
[10]Makino H, Shimizu H, Ito H, et al. Changes in growth factor and cytokine expression in biliary obstructed rat liver and their relationship with delayed liver regeneration after partial hepatectomy[J]. World J Gastroenterol, 2006, 12(13): 2053-2059.
[11]Hamada T, Eguchi S, Takatsuki M, et al. Low-dose recombinant human hepatocyte growth factor enhances effect of hepatocyte transplantation in rats treated with retrorsine[J]. Hepatogastroenterology, 2009, 56(94-95): 1466-1470.
[12]Cazzaniga M, Dionigi E, Gobbo G,et al. The systemic inflammatory response syndrome in cirrhotic patients: relationship with their in-hospital outcome[J]. J Hepatol, 2009, 51(3):475-482.
[13]Wang LW, Chen H, Gong ZJ. High mobility group box-1 protein inhibits regulatory T cell immune activity in liver failure in patients with chronic hepatitis B[J]. Hepatobi-liary Pancreat Dis Int, 2010, 9(5):499-507.
[14]Li X, Wang LK, Wang LW, et al. Blockade of high-mo-bility group box-1 ameliorates acute on chronic liver failure in rats[J].Inflamm Res, 2013, 62(7):703-709.
[15]Kato H, Shimomura T, Murai R, et al. Regulation of hepatic oval cell proliferation by adenoviral mediated hepatocyte growth factor gene transfer and signal transduction inhibitors[J]. Hepatogastroenterology, 2007, 54(75): 821-825.
(责任编辑: 林白霜, 罗森)
Recombinant adenovirus containing hyper-interleukin-6 and hepatocyte growth factor enhances therapeutic efficacy on acute-on-chronic liver fai-lure in rats
GAO Dan-dan, FU Jia, QIN Bo, HUANG Wen-xiang, YANG Chun, JIA Bei
(DepartmentofInfectiousDiseases,TheFirstAffiliatedHospitalofChongqingMedicalUniversity,ChongqingKeyLaboratoryofInfectiousDiseasesandParasiticDiseases,Chongqing400016,China.E-mail:beijia7410@163.com)
AIM: To determine the therapeutic efficacy of recombinant adenovirus containing hyper-interleukin-6 (HIL-6) and hepatocyte growth factor (HGF) (Ad-HGF-HIL-6) on acute-on-chronic liver failure (ACLF) in rats using that of recombinant adenovirusHIL-6 orHGF(Ad-HIL-6 or Ad-HGF) for comparison. METHODS: The rat model of ACLF was established and the model rats were randomly divided into model group, Ad0 group, Ad-HGF group, Ad-HIL-6 group and Ad-HGF-HIL-6 group. The sera and liver tissues were collected for biochemical, pathological and molecular biological examinations.RESULTS: Compared with Ad0 group, prothrombin time (PT) and the serum levels of alanine aminotransferase (ALT), tumor necrosis factor-α (TNF-α), interferon-γ (IFN-γ) and high-mobility group box-1 (HMGB1) were markedly reduced in the ACLF rats treated with Ad-HGF, Ad-HIL-6 and Ad-HGF-HIL-6, and similarly, reduced hepatic damages and apoptotic activity, reduced Bax at protein level, and increased expression of Ki67 and Bcl-2 at protein levels were observed. Among them, treatment with Ad-HGF-HIL-6 showed the most significant therapeutic efficacy without obvious side effects.CONCLUSION: The therapeutic efficacy of Ad-HGF-HIL-6 is more potent than that of Ad-HGF or Ad-HIL-6 alone on ACLF rats with no significant side effects.
Acute-on-chronic liver failure; Hyper-interleukin-6; Hepatocyte growth factor; Recombinant adenovirus; Apoptosis
1000- 4718(2016)04- 0707- 06
2015- 11- 04
2016- 03- 02
重庆市自然科学基金资助项目(No. cstc2012jjA10052);重庆市中青年医学高端后备人才培养计划
Tel: 023-89012427; E-mail: beijia7410@163.com
R363
A
10.3969/j.issn.1000- 4718.2016.04.021
杂志网址: http://www.cjpp.net

