胰岛素抵抗小鼠血清微小RNA的芯片及信息学分析*
徐志伟, 王文栋, 常晓彤
(河北北方学院医学检验学院生化教研室,河北 张家口 075000)
胰岛素抵抗小鼠血清微小RNA的芯片及信息学分析*
徐志伟,王文栋,常晓彤△
(河北北方学院医学检验学院生化教研室,河北 张家口 075000)
目的: 探讨胰岛素抵抗小鼠血清水平微小RNA(microRNAs)变化图谱及相关microRNAs的可能作用机制。方法: 以高脂饲料喂养昆明小鼠,制备胰岛素抵抗模型;以微阵列芯片技术分析胰岛素抵抗小鼠及正常小鼠血清水平microRNAs变化图谱并以实时荧光定量PCR进行验证;以miRanda数据库对差异microRNAs进行靶点基因预测;以miRBase数据库获得与胰岛素抵抗相关的microRNAs序列;基于microRNAs序列,应用STRING在线分析工具(http://string.embl.de/)预测蛋白质相互作用关系。结果: 胰岛素抵抗小鼠血清中miR-125、miR-126、miR-143、miR-30a、miR-199a、miR-127、miR-184、miR-30e、miR-134、miR-195、miR-206、miR-429、miR-212、miR-362、miR-382、miR-154和miR-466h表达显著上调,miR-211、miR-504、miR-877和miR-1930显著下调。与胰岛素抵抗密切相关的miR-143可以结合脂肪量及肥胖相关蛋白(FTO)的3’-UTR,并且FTO与Rpgrip1l、Tmem18、Mc4r、Npy、Hhex、Tcf712、Cdkal1、Slc30a8、Igf2bp2和 Thada相互作用。结论: 在高脂饮食诱导的胰岛素抵抗小鼠血清中有21种microRNAs相比正常小鼠出现了显著变化,表达显著上调的有17个。应用在线分析工具发现与胰岛素抵抗密切相关的miR-143可以调节FTO蛋白表达,并且FTO与另外10种与糖尿病发生发展相关的蛋白相互作用,这将有助于对胰岛素抵抗机制的全面了解。
胰岛素抵抗; 微小RNA; 芯片; 信息学
胰岛素抵抗(insulin resistance,IR)是机体靶组织对胰岛素反应低下的一种病理状态,它与高胰岛素血症、糖耐量异常、脂代谢紊乱、高血压和冠心病等疾病相关,是这些疾病的病理学基础。编码胰岛素级联信号中相关蛋白的基因多态性、基因失调、转录后修饰及相关蛋白质合成的调节参与了IR的发生[1]。
微小RNA(microRNAs)作为一类广泛参与多种生理及病理过程的小分子非编码RNA,通过结合mRNA 3’端非翻译区(3’-untranslated region,3’-UTR)在转录后水平抑制蛋白的合成,是基因表达调控的重要成分,其显著特点是具有高度的保守性、时序性和组织特异性。研究显示,microRNAs与IR的发生密切相关,一些小组对胰岛素作用的主要靶组织如肝脏、骨骼肌和脂肪组织中microRNAs变化图谱进行了广泛研究。Gallagher等[2]通过基因芯片技术发现2型糖尿病患者骨骼肌中有11个microRNAs异常表达;Ling等[3]在IR的3T3-L1脂肪细胞中发现表达水平降低50%以上的microRNAs共29个。
2008年以来,一系列研究报告了血浆或血清中microRNAs的稳定存在,并且表明,血浆或血清中microRNAs改变可以反映机体组织的生理或病理性改变[4]。多项研究均显示了2型糖尿病患者血清或血浆microRNAs谱显著不同于健康对照组[5-7]。但是,这些文献没有明确2型糖尿病患者是胰岛素抵抗还是胰岛功能低下,患病时间多长,也无法排除潜在的并发症。为此,我们以高脂喂食的小鼠胰岛素抵抗模型为研究对象,用微阵列芯片法分析了单纯胰岛素抵抗的小鼠血清microRNAs变化图谱,并对显著改变的microRNAs进行了生物信息学分析。
材 料 和 方 法
1动物和主要试剂
健康4周龄雄性昆明小鼠,体重(20±2)g,由首都医科大学提供,生产许可证号为SCXK(京2014-0004)。
葡萄糖测定试剂盒(中生北控生物科技股份有限公司);胰岛素ELISA测定试剂盒(上海酶联生物科技有限公司); RNeasy Mini Kit、RNase-free DNase I、miScript Reverse Transcription反转录试剂盒和mi-Script SYBR Green PCR试剂盒(QIAGEN); Flash-Tag® Biotin HSR RNA Labeling Kit、GeneChip WT Terminal Labeling Kit and Control Kit 和GeneChip Hybridization, Wash and Stain Kit(Affymetrix)。
2方法
2.1胰岛素抵抗小鼠模型的建立实验小鼠以高脂饲料(每100 g基础饲料加入奶粉10 g,猪油10 g,白糖10 g,鸡蛋1/3个,新鲜黄豆芽250 g)饲养3月后,按稳态模型评价法计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR),以HOMA-IR>2.15的小鼠为胰岛素抵抗实验动物[8]。以正常饲料喂养3个月的小鼠(n=10)作为正常对照小鼠,与胰岛素抵抗模型小鼠(n=10)分别采集血清,进行microRNAs的芯片和信息学分析。
2.2血液收集及空腹血糖和血清胰岛素水平的测定各实验组小鼠空腹8 h后, 断尾法采集小鼠尾血,离心(1 088×g/min,5 min)制备血清,用于血糖测定或-80 ℃保存用于胰岛素测定及microRNAs分析。血糖测定用葡萄糖氧化酶法试剂盒,20 μL血清加3 mL 酶酚混合试剂,37 ℃保温15 min, 以722分光光度计在505 nm处测定吸光度,按公式计算血糖浓度。胰岛素测定采用小鼠胰岛素酶联免疫分析试剂盒,按试剂盒说明进行,分别在空白孔、标准孔、样品孔加样50 μL,37 ℃温育30 min,洗涤拍干后,加入酶标液50 μL,空白孔除外,37 ℃温育30 min,洗涤拍干。每孔加入显色剂A、B各50 μL,37 ℃避光显色10 min,每孔加终止液50 μL,酶标仪450 nm波长测定各孔的吸光度。
2.3采用Turner的稳态模型(HOMA-IR)[9]评价胰岛素抵抗HOMA-IR=空腹血糖(mmol/L)×空腹血清水平胰岛素(mIU/L)/22.5。
2.4血清microRNAs 芯片分析血清样本送北京康普森生物技术有限公司对血清中microRNA进行芯片分析。(1)采用TRIzol法提取血清水平总RNA,并进一步对总RNA 进行过柱纯化;(2)微量分光光度计检测RNA的浓度和纯度,1.5% 的甲醛变性凝胶检测总RNA完整性;(3)Poly(A)加尾; (4)Flash Tag Biotin HSR 连接;(5)生物素标记;(6)芯片杂交(芯片规格为Affymetrix GeneChip miRNA 3.0 Array);(7)芯片洗脱和扫描(GeneChip Scanner 3000 7G);(8)应用GCOS 1.4软件及miRNAQC tool进行数据处理和分析。
2.5实时荧光定量PCR验证芯片结果针对芯片结果中显著上调的mmu-miR-143和显著下调的mmu-miR-877,应用miScript Reverse Transcription反转录试剂盒将其反转录为cDNA,37 ℃ 1 h, 95 ℃ 5 min, 应用miScript SYBR Green PCR 试剂盒在7300定量PCR仪(Applied Biosystem)检测,每个样本设3个复孔,所有反应重复3次。以Primer 5.0软件设计引物,由上海生工生物工程有限公司合成。miR-30a的上游引物序列为5’-AGCCGTGTAAACATCCTCGAC-3’,下游引物序列为5’-CGCAGGGTCCGAGGTATTC-3’; miR-125的上游引物序列为5’-AGCGTCCCTGAGACCCTTTA-3’,下游引物序列为5’-CGCAGGGTCCGAGGTATTC-3’; miR-126的上游引物序列为5’-AGCGGGCATTATTACTTTTGGT-3’, 下游引物序列为5’-CGCAGGGTCCGAGGTATTC-3’; miR-143的上游引物序列为5’-TGAGATGAAGCACTGTAGCTC-3’, 下游引物序列为5’-GCGAGCACAGAATTAATACGAC-3’;miR-199a的上游引物序列为5’-AGCACCCAGTGTTCAGACTACCT-3’,下游引物序列为5’-CGCAGGGTCCGAGGTATTC-3’;miR-877的上游引物序列为5’-ACCGTAGAGGAGATGGCG-3’, 下游引物序列为5’-GCAGGGTCCGAGGTATTC-3’;以U6作为内参照,其上游引物序列为5’-CGCTTCGGCAGCACATATAC-3’, 下游引物序列为5’-TTCACGAATTTGCGTGTCAT-3’。反应条件为95 ℃ 5 min;95 ℃ 10 s,60 ℃ 15 s,72 ℃ 20 s,40个循环。按照公式2-ΔΔCt计算microRNAs相对表达量。
2.6相关microRNAs的生物信息学分析应用miRanda(http://www.microrna.org/)数据库对差异microRNAs进行靶点基因预测,选取每条 microRNA 相对的3′-UTR中排名前10位的基因作为候选靶点基因[10],利用miRBase数据库(http://www.mirbase.org/index.shtml)获得相关microRNAs序列[11]。应用STRING在线分析工具(http://string.embl.de/)预测蛋白质相互作用关系[12]。
3统计学处理
应用微阵列数据显著差异分析软件(Significance Analysis of Microarray, SAM;http://www-stat.stanford.edu/~tibs/SAM/)配对分析两种组织间的microRNAs 表达差异, 中位假基因检出率(false disco-very rate, FDR)<0.05为有显著差异。
结 果
1正常和胰岛素抵抗小鼠血清水平microRNAs 差异分析
芯片分析结果表明,与正常对照小鼠相比,胰岛素抵抗小鼠血清水平有21个microRNAs 表达呈显著差异,其中表达显著上调者17个(表1),显著下调者4个(表2)。
表1胰岛素抵抗小鼠血清中表达显著上调的microRNAs
Table 1.Significantly up-regulated microRNAs in the serum of mice with insulin resistance (IR)

MicroRNAsExpressionquantityinIRmice Expressionquantityinnormalmicemmu-miR-466h4.085642.04419mmu-miR-30a3.671671.50237mmu-miR-1268.011443.92011mmu-miR-125a8.089223.67056mmu-miR-1438.648684.16767mmu-miR-1543.749911.35067mmu-miR-3824.576512.02187mmu-miR-3624.183501.46703mmu-miR-2124.551091.70931mmu-miR-4293.938741.04031mmu-miR-2066.085743.09831mmu-miR-1956.070512.94784mmu-miR-1346.255083.06701mmu-miR-30e7.382293.65052mmu-miR-1845.801861.41851mmu-miR-1277.203372.78526mmu-miR-199a6.992972.56691
表2胰岛素抵抗小鼠血清中表达显著下调的microRNAs
Table 2.Significantly down-regulated microRNAs in the serum of mice with insulin resistance (IR)

MicroRNAsExpressionquantityinIRmice Expressionquantityinnormalmicemmu-miR-5043.232687.33194mmu-miR-8772.894666.17390mmu-miR-19301.458993.68222mmu-miR-2114.434519.54351
2实时荧光定量PCR结果
进一步使用实时荧光定量PCR对与胰岛素抵抗相关的血清水平miR-30a、miR-125、miR-126、miR-143、miR-199a及miR-877进行验证。胰岛素抵抗组miR-30a、miR-125、miR-126、miR-143和miR-199a的相对表达量分别为2.57±0.46、2.18±0.40、2.22±0.51、2.78±0.43和2.82±0.58,与健康组相比均显著上调;miR-877的相对表达量为0.42±0.08,与健康组相比显著下调。各种microRNAs实时荧光定量分析结果与芯片分析结果一致,见图1。
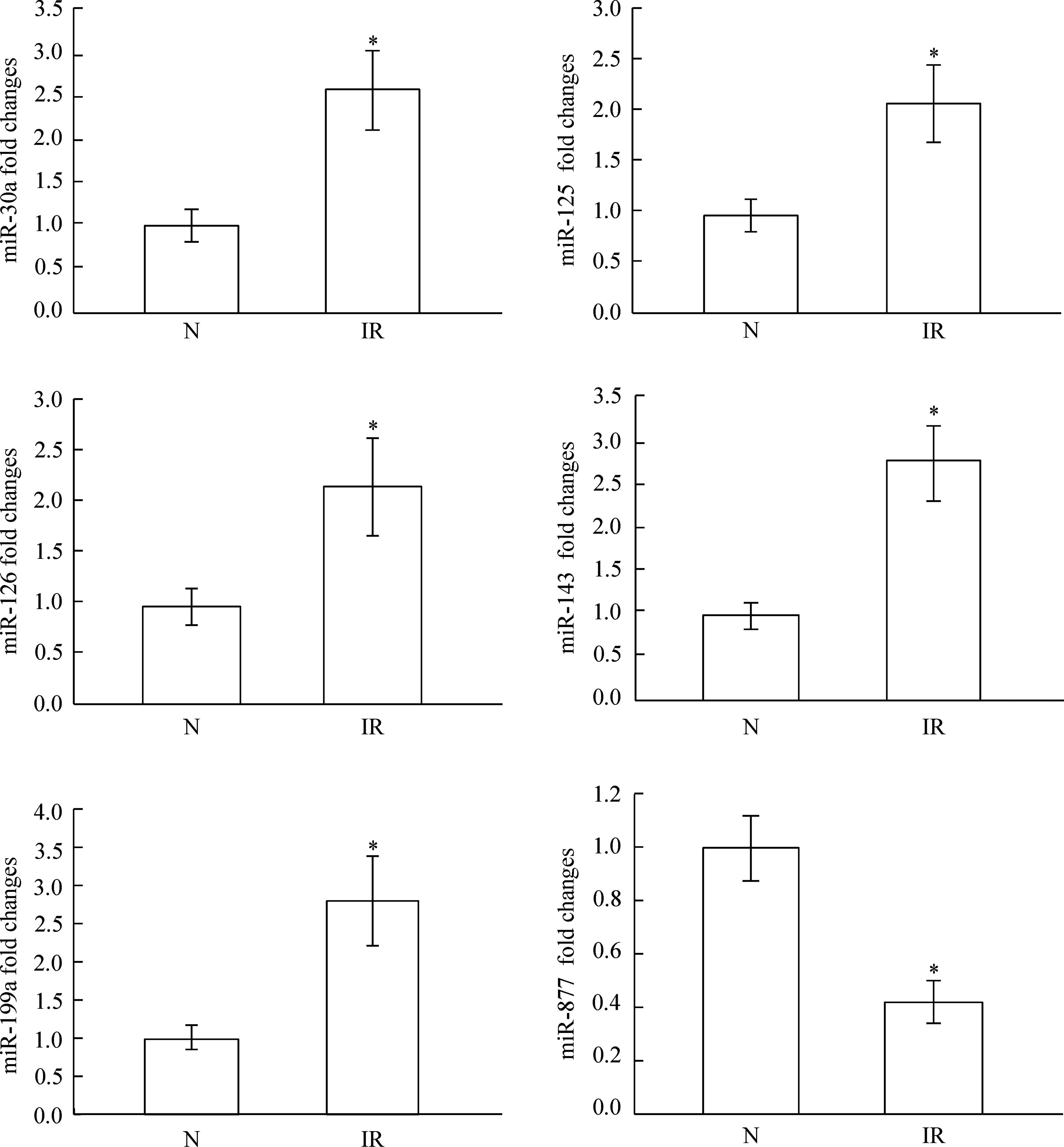
Figure 1.Real-time PCR results of miR-30a, miR-125, miR-126, miR-143, miR-199a and miR-877 expression in the serum of mice.IR: insulin resistance. Mean±SD.n=10.*P<0.05vsnormal (N).
图1小鼠血清miR-30a、miR-125、miR-126、miR-143、miR-199a、miR-877表达量的实时荧光定量PCR验证结果
3相关靶点基因预测
采用miRanda数据库对差异表达microRNAs进行靶基因预测,结果见表3。由于目前已经确定的microRNAs靶基因数量有限,mmu-miR-126、mmu-miR-125a、mmu-miR-127、mmu-miR-199a和mmu-miR-362 未预测到其靶基因。
4MicroRNAs序列
应用miRBase数据库获取相关microRNAs序列,见表4。
5MicroRNAs调节蛋白及蛋白相互作用的预测
应用在线分析工具STRING发现miR-143可以结合脂肪量及肥胖相关蛋白(fat mass and obesity-associated protein,FTO)的3’-UTR,FTO是一个与脂肪量和肥胖相关的酶[13],它与另外10个蛋白Rpgrip1l、Tmem18、Mc4r、Npy、Hhex、Tcf712、Cdkal1、Slc30a8、Igf2bp2和Thada相关,这些蛋白增加了糖尿病发生和发展的风险。以FTO为中心预测的这些蛋白的相互作用关系见图2。

表3 差异表达microRNAs的主要靶基因
表4血清胰岛素抵抗相关microRNAs的序列
Table 4.Sequences of serum microRNAs associated with insulin resistance

MicroRNAsSequences(5’-3’)mmu-miR-466hUGUGUGCAUGUGCUUGUGUGUAmmu-miR-30aUGUAAACAUCCUCGACUGGAAGmmu-miR-126CAUUAUUACUUUUGGUACGCGmmu-miR-125aUCCCUGAGACCCUUUAACCUGUGAmmu-miR-143GGUGCAGUGCUGCAUCUCUGGUmmu-miR-154AAUCAUACACGGUUGACCUAUUmmu-miR-382AAGUUGUUCGUGGUGGAUUCGmmu-miR-362AAUCCUUGGAACCUAGGUGUGAGUmmu-miR-212ACCUUGGCUCUAGACUGCUUACUmmu-miR-429UAAUACUGUCUGGUAAAACCGUmmu-miR-206UGGAAUGUAAGGAAGUGUGUGGmmu-miR-195UAGCAGCACAGAAAUAUUGGCmmu-miR-134UGUGACUGGUUGACCAGAGGGGmmu-miR-30eUGUAAACAUCCUUGACUGGAAGmmu-miR-184UGGACGGAGAACUGAUAAGGGUmmu-miR-127CUGAAGCUCAGAGGGCUCUGAUmmu-miR-199aCCCAGUGUUCAGACUACCUGUUCmmu-miR-504AGACCCUGGUCUGCACUCUAUCmmu-miR-877GUAGAGGAGAUGGCGCAGGGmmu-miR-1930ACCUCCAUAGUACCUGCAGCGUmmu-miR-211UUCCCUUUGUCAUCCUUUGCCU
讨 论
Chen等[5]通过比较健康个体和糖尿病患者,发现糖尿病患者血清存在42种表达有差异的microRNAs。Zampetaki 等[7]在一个大型前瞻性研究中,基于比较受试者的血浆microRNAs,发现糖尿病患者有13种microRNAs 的表达与健康人不同。我们以Affymetrix的GeneChip miRNA 3.0 Array芯片分析显示,胰岛素抵抗小鼠血清中有21种microRNAs 显著不同于正常对照小鼠,其中17种显著上调,4种显著下调。在显著差异的21种microRNAs中,没有红细胞特有的miR-16 和 miR-451[14],提示本研究中小鼠血清21种显著差异的microRNAs 没有受到溶血的影响。
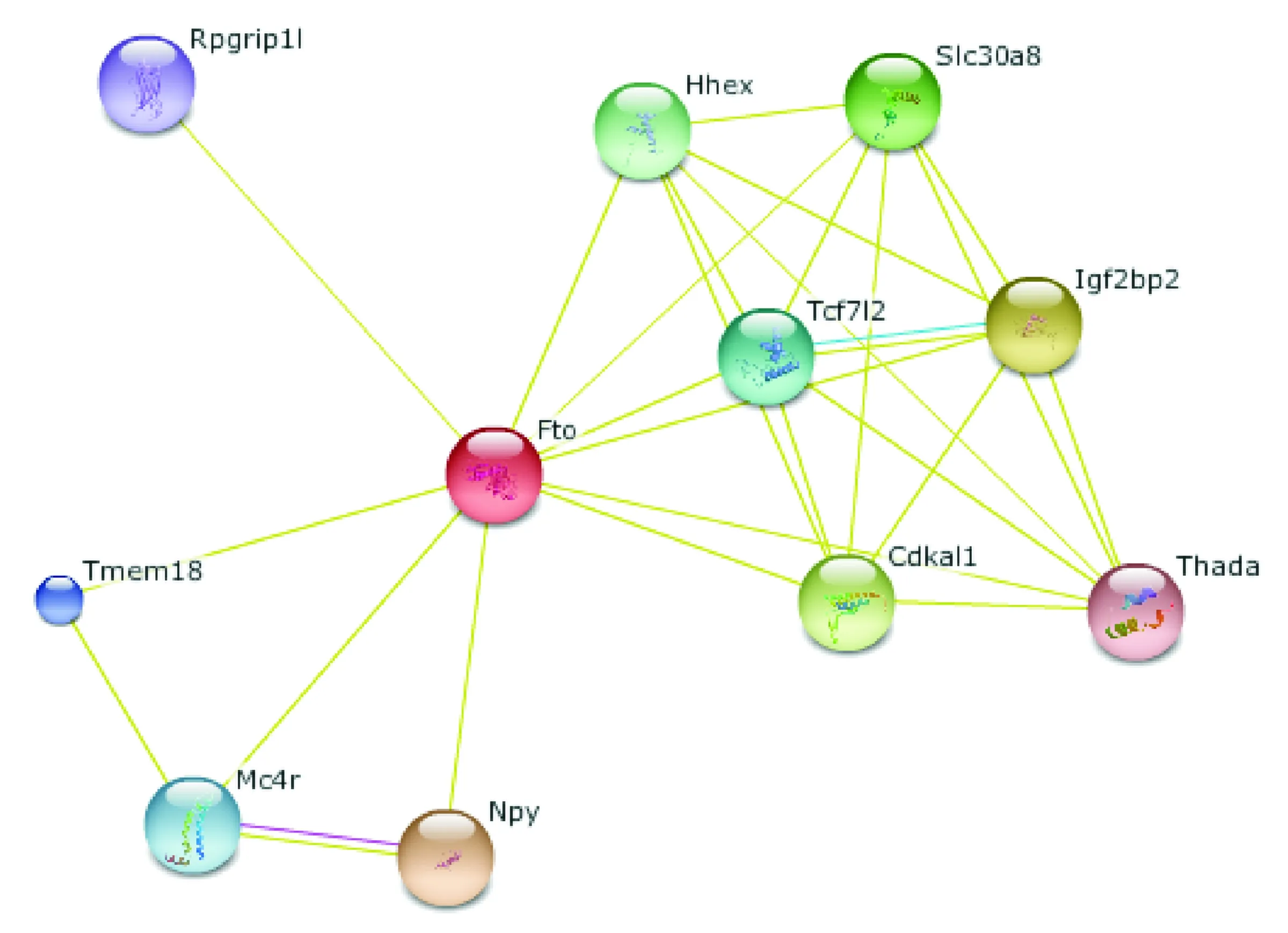
Figure 2.FTO interaction network
图2FTO及相关蛋白的相互作用
目前,与胰岛素抵抗相关的microRNAs 已报道多种,主要基于对某组织的研究结果,与肝脏胰岛素抵抗相关的有miR-29、miR-96、miR-33a/b、miR-181a、miR-122、miR-125、miR-126、miR-143、miR-802,与脂肪组织相关的有miR-93、miR-143、miR-221和miR- 223,与骨骼肌相关的有miR-135[15-16]。在2型糖尿病患者血浆的miR-199a[16]、miR-9、miR-29a、miR-30d、miR34a、miR-124a、miR-146a[6]、miR-28-3p[7]也显著上调,miR-15a、miR-29b和miR-223下调[7]。
本研究中,未发现miR-9、miR-29、miR-30d、miR-122、miR-96、miR-181a、miR34a、miR-124a、miR-146a、miR-28-3p、miR-802和miR-135在胰岛素抵抗小鼠血清中存在显著差异,但是,本研究中miR-125、miR-126、miR-143、miR-30a和miR-199a 显著上调。另外12种显著上调的和4种显著下调的microRNAs 未见与胰岛素抵抗相关的报道,原因不清,或许与研究对象、临床患者的其它并发症、胰岛素抵抗的病理学机制及病程的不同有关。
关于microRNAs引起胰岛素抵抗的作用机制,相关报道有限。有文献报道,miR-126通过下调胰岛素受体底物1(insulin receptor substrate-1,IRS-1)蛋白表达诱导胰岛素抵抗,IRS-1将胰岛素信号从胰岛素受体传至细胞内的磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K),是胰岛素信号传导通路上的关键分子[16]。miR-199a可以结合广泛分布于脂肪细胞和肌肉细胞的胰岛素敏感的葡萄糖转运体4(glucose transporter 4,GLUT4)的3’-UTR,降低GLUT4表达,参与了胰岛素抵抗[17]。
miR-143是与胰岛素抵抗关系密切的micro-RNAs之一,在高脂饮食的肥胖小鼠肠系膜和肝脏高表达,与体重及肠系膜脂肪重量相关,利用转基因技术将miR-143过表达,小鼠表现为糖耐量异常和胰岛素抵抗,进一步的研究指出 miR-143通过作用于IRS-1-PI3K-PKB/Akt信号通路中的某些分子,参与小鼠肝细胞的胰岛素抵抗[18-20]。在我们的研究中,应用在线分析工具STRING发现miR-143可以结合FTO的3’-UTR。FTO蛋白是一种核酸修复酶,有研究发现FTO在骨骼肌等外周组织高表达[21],可以通过多种途径参与肥胖及2型糖尿病等相关疾病的发生[22-23]。以FTO为中心预测了它与另外10个与糖尿病发生和发展相关的蛋白Rpgrip1l、Tmem 18、Mc4r、Npy、Hhex、Tcf712、Cdkal1、Slc30a8、Igf2bp2和 Thada的相互作用,对这些蛋白的研究将有助于胰岛素抵抗机制的全面了解。
本文基于miRanda数据库对另外一些差异表达microRNAs的靶基因预测表明这些microRNAs也存在多个靶基因位点。多靶位点存在有助于一个microRNA经济地调控多个基因的表达[24]。
总之,本研究以微阵列芯片方法表明,在高脂饮食诱导的胰岛素抵抗小鼠血清中有21种microRNAs相比正常小鼠出现了显著变化,17种显著上调,4种显著下调。其中,有报道与胰岛素抵抗相关的microRNAs包括miR-125、miR-126、miR-143、miR-30a和miR-199a。应用miRBase 数据库获取了相关microRNAs的序列;基于这些microRNAs的序列,应用在线分析工具发现与胰岛素抵抗密切相关的miR-143可以结合FTO,并且预测了FTO与另外10种相关蛋白的相互作用,这将有助于对胰岛素抵抗机制的全面了解。
[1]Højlund K. Metabolism and insulin signaling in common metabolic disorders and inherited insulin resistance[J]. Dan Med J, 2014, 61(7):B4890.
[2]Gallagher IJ,Scheele C,Keller P,et al. Integration of microRNA changesinvivoidentifies novel molecular features of muscle insulin resistance in type 2 diabetes[J]. Genome Med, 2010, 2(2):9.
[3]Ling HY, Ou HS, Feng SD, et al. Changes in microRNA (miR) profile and effects of miR-320 in insulin-resistant 3T3-L1 adipocytes[J]. Clin Exp Pharmacol Physiol, 2009, 36(9):e32-e39.
[4]Tung J. Exploring microRNA biomarkers for disease monitoring and response to therapy[J]. Bioanalysis, 2012, 4(18):2204.
[5]Chen X, Ba Y, Ma L, et al. Characterization of micro-RNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res,2008, 18(10): 997-1006.
[6]孔磊, 韩文霞, 姜秀云,等. 2型糖尿病发病过程中外周血miR-34a 的表达水平及其临床意义[J]. 山东大学学报:医学版, 2010, 48(10):1-3.
[7]Zampetaki A, Kiechi S, Drozdov I, et al. Plasma micro-RNA profiling reveals loss of endothelial miR-126 and other microRNAs in 2 type diabetes[J]. Circ Res, 2010, 107(6):810-817.
[8]陈丽, 兰珍, 张丹. 不同肥胖标准在评估多囊卵巢综合征胰岛素抵抗中的价值[J]. 四川大学学报:医学版, 2013, 44(6):945-949.
[9]Haffner SM, Kennedy E, Gonzalez C, et al. A prospective analysis of the HOMA model. The Mexico City Diabetes Study[J]. Diabetes Care, 1996, 19(10):1138-1141.
[10]夏伟, 曹国军, 邵宁生. MicroRNA靶基因的寻找及鉴定方法研究进展[J].中国科学C辑:生命科学, 2009, 39(1):121-128.
[11]Kozomara A, Griffiths-Jones S. miRBase: annotating high confidence microRNAs using deep sequencing data[J]. Nucleic Acids Res, 2014, 42(Database issue):D68-D73.
[12]Franceschini A, Szklarczyk D, Frankild S, et al. STRING v9.1: protein-protein interaction networks, with increased coverage and integration [J]. Nucleic Acids Res, 2013, 41(Database issue):D808-D815.
[13]Loos RJ, Yeo GS. The bigger picture of FTO:the first GWAS-identified obesity gene[J]. Nat Rev Endocrino, 2014, 10(1):51-61.
[14]Kirschner MB, Kao SC, Edelman JJ, et al. Haemolysis during sample preparation alters microRNA content of plasma[J]. PLoS One, 2011, 6(9):e24145.
[15]薛慧良,王晓梅. miRNAs在糖尿病发病机制中的研究进展[J]. 实用糖尿病杂志, 2013, 9(2):59-60.
[16]王晓晶,聂敏,孙梅励. MicroRNAs与葡萄糖稳态的研究进展[J]. 基础医学与临床,2014, 34(9):1272-1276.
[17]Yan ST, Li CL, Tian H,et al. MiR-199a is overexpressed in plasma of type 2 diabetes patients which contributes to type 2 diabetes by targeting GLUT4[J]. Mol Cell Biochem, 2014, 397(1-2):45-51.
[18]张向君. MicroRNA-143在肥胖及胰岛素抵抗中的研究进展[J]. 医学研究生学报,2013, 26(6):666-668.
[19]Takanabe R, Ono K, Abe Y, et al. Up-regulated expression of microRNA-143 in association with obesity in adipose tissue of mice fed high-fat diet[J]. Biochem Biophys Res Commun, 2008, 376(4):728-732.
[20]Esau C, Kang X, Peralta E, et al. MicroRNA-143 regulates adipocyte differentiation [J]. J Biol Chem, 2004, 279(50):52361-52365.
[21]Fredriksson R, Hagglund M, Olszewski PK, et al. The obesity gene, FTO, is of ancient origin, up-regulated during food deprivation and expressed in neurons of feeding-related nuclei of the brain[J]. Endocrinology, 2008, 149(5): 2062-2071.
[22]Zdrojowy-Welna A, Tupikowska M, Kolackov K, et al. The role of fat mass and obesity-associated gene (FTO) in obesity:an overview[J]. Endokrynol Pol, 2014, 65(3): 224-231.
[23]肖志华,郭武华,张吉翔.FTO基因与肥胖关系的研究进展[J]. 中国病理生理杂志, 2010, 26(5): 1025-1028.
[24]王清兰,李俊霞,吕靖,等. CCl4诱导的小鼠纤维化肝组织微小RNA差异表达谱及初步功能分析[J]. 中国病理生理杂志, 2013, 29(12):2201-2211.
(责任编辑: 卢萍, 罗森)
Chip and informatic analysis of serum microRNA levels in insulin-resis-tant mice
XU Zhi-wei, WANG Wen-dong, CHANG Xiao-tong
(DepartmentofBiochemistry,CollegeofLabMedicine,NorthUniversityofHebei,Zhangjiakou075000,China.E-mail:changxt1212@vip.sina.com)
AIM: To study the microRNA profiling in the serum of insulin-resistant mice and the mechanism of insulin resistance induced by related microRNAs. METHODS: A high-fat diet was used to induce insulin resistance model in KM mice. The microRNA profiling in serum of insulin-resistant and normal mice was analyzed by microarray chip and were validated by real-time PCR. miRanda data base was used to forecast target genes. miRBase was used to obtain the sequences of related microRNAs, based on which protein interactions were predicted using the online analytical tool STRING. RESULTS: In serum of insulin-resistant mice, the expression of miR-125, miR-126, miR-143, miR-30a, miR-199a, miR-127, miR-184, miR-30e, miR-134, miR-195, miR-206, miR-429, miR-212, miR-362, miR-382, miR-154 and miR-466h was significantly up-regulated. miR-211, miR-504, miR-877 and miR-1930 were significantly down-regulated. miR-143 associated with insulin resistance was able to bind to 3’-UTR of fat mass and obesity-associated protein (FTO), and FTO was found to interact with Rpgrip1l, Tmem18, Mc4r, Npy, Hhex, Tcf712, Cdkal1, Slc30a8, Igf2bp2 and Thada. CONCLUSION: Twenty-one microRNAs in the serum of insulin-resistant mice induced by a high-fat diet are significantly different from those of normal mice, in which 17 kinds were significantly up-regulated. miR-143 closely related to insulin resistance is able to regulate FTO protein expression, which interacts with other 10 proteins associated with the occurrence and development of diabetes. The results are also useful for further study of the molecular mechanisms in insulin resistance.
Insulin resistance; MicroRNAs; Chip; Informatics
1000- 4718(2016)04- 0738- 07
2015- 08- 07
2016- 02- 29
张家口市科技局项目(No. 12110065G-5);河北省教育厅项目(No.QN2016175)
Tel: 0303-4029270; E-mail: changxt1212@vip.sina.com
R363.1+4
A
10.3969/j.issn.1000- 4718.2016.04.026
杂志网址: http://www.cjpp.net

