脑出血大鼠血肿周围脑组织PN-1、thrombin、PAR-1的表达变化及其相关性
贾文志
(石家庄市第三医院,石家庄050011)
脑出血大鼠血肿周围脑组织PN-1、thrombin、PAR-1的表达变化及其相关性
贾文志
(石家庄市第三医院,石家庄050011)
目的观察脑出血大鼠血肿周围脑组织中凝血酶(thrombin)抑制剂(PN-1)、thrombin、thrombin受体(PAR-1)的表达变化,并探讨PN-1与thrombin、PAR-1的相关性。方法 选取成年健康雄性SD大鼠80只,编号后随机分为假手术组、脑出血组各40只,脑出血组于右侧尾状核部注射自体动脉血方法制作脑出血实验大鼠模型,采用神经功能障碍评分评价神经功能障碍程度,采用Western blotting法于造模后3、6、10、12、24、48、120 h检测两组脑组织中PN-1、thrombin、PAR-1,并分析其相关性。结果 脑出血组神经功能障碍评分在造模后12、48、120 h均低于假手术组(P均<0.05);脑出血组造模后不同时间脑组织中PN-1、thrombin、PAR-1较假手术组均增高(P均<0.05),脑出血组脑组织中PN-1、thrombin、PAR-1在造模后12 h或24 h出现逐渐下降的趋势(P均<0.05);脑出血组血肿周围脑组织PN-1与thrombin、PAR-1均呈负相关关系(r分别为-0.872、-0.698,P均<0.05)。结论 脑出血大鼠血肿周围脑组织中PN-1、thrombin及PAR-1均升高,PN-1与thrombin及PAR-1呈负相关关系。
脑出血;凝血酶抑制剂;凝血酶;凝血酶受体;大鼠
动脉粥样硬化、糖尿病以及高血压等基础疾病增加了脑出血的发生风险,近五年来相关临床统计分析结果显示脑出血导致的病死率明显增高。颅内出血同时可引起患者出现认知功能、语言功能以及中枢神经系统功能障碍,严重降低了脑出血患者的生存质量。目前临床上对于脑出血的内科治疗尚无特效疗法,主要通过脱水等对症处理,但外科治疗的整体临床获益情况仍存在争议[1, 2]。脑出血患者急性期主要表现为脑组织水肿,而出血部分脑组织的水肿程度对于内、外科治疗效果有重要的意义。部分研究发现在脑水肿组织周边存在凝血酶(thrombin)的异常表达[3]。本研究重在探讨thrombin抑制剂(PN-1)、thrombin、thrombin受体(PAR-1)在脑出血周边水肿组织内的表达情况,进而揭示thrombin对于脑出血的诊治意义。
1 材料与方法
1.1材料实验动物:选取成年健康雄性SD大鼠80只,体质量250~300 (272.4±13.9)g,购自河北医科大学动物实验研究中心(SCXK(冀)2014-00002),喂养于23~25 ℃、湿度40%~60%、光照12 h、自由进食进水的环境中。实验试剂:羊抗thrombin抗体、羊抗PN-1抗体、鼠抗PAR-1抗体、HRP标记的羊和鼠的二抗均购于武汉博士德生物技术有限公司,Hybond-C硝酸纤维素膜购于Amersham公司。实验仪器:立体定向仪(MA-1型,日木NARISHIGE公司),微量注射泵(Miero4型,World Preeision Instruments),电泳仪(Bio-Rad公司),光学显微镜(DP700型,Olympos公司),低温离心机(LXJ-H型,上海医用分析仪器厂)。
1.2分组及建模80只大鼠编号后随机分为假手术组、脑出血组各40只。脑出血组大鼠以10%水合氯醛(330 mg/kg)腹腔麻醉后,剪尾取50 μL自体新鲜不凝血,于前囟前0.22 mm、中线向左旁开3 mm处钻孔,在立体定向仪引导下缓慢进针注血。进针深约5 mm(此为左侧尾状核位置),进针时间3~5 min,留针时间10 min,之后缓慢退针。实验前后各组大鼠均可自由进食水。假手术组除脑内不注入血液外.其余操作同脑出血组。模型成功的判定标准为术后见明显肢体瘫痪,沿针道冠状面切开脑组织可见血肿形成。
1.3神经功能障碍程度的评价分别于术后第12、24、120小时采用Garica等[4]制定的大鼠神经功能障碍评分标准对两组神经功能障碍程度进行评价。最高18分、最低3分,分数越低表示神经功能障碍越严重。
1.4脑组织病理学特征的观察采用石蜡脱水,微波修复,枸橼酸缓冲液98 ℃、5 min,之后采用3%的过氧化氢抑制10 min,在50%的石蜡二甲苯液中浸蜡10 min,100%的石蜡液中浸蜡10 min,DAB显色,苏木素复染、脱水(85%1次、95%2次、无水乙醇2次、无水乙醇和二甲苯各半1次、纯二甲苯2次),封片、40倍物镜下镜检。
1.5大鼠脑组织中PN-1、thrombin、PAR-1的检测分别于造模后第3、6、10、12、24、48、120小时采用Western blotting法检测。冰上分离出血肿周边脑组织(假手术组为左侧尾状核),置于预冷的研钵中液氮研磨至粉末状。冰上静置l h,4 ℃、14 000 r/min离心30 min,去沉淀组织留上清,考马斯亮蓝显色法测定蛋白浓度,分装。-70 ℃冻存。按总蛋白80 μg计算上样体积,4∶1的比例加上样缓冲液,每条泳道加20 μL样品缓冲液,于60 V电压下电泳,脱脂蛋白封闭2 h后加入羊抗PN-1抗体(1∶200)、羊抗thrombin抗体(1∶500)、鼠抗PAR-1抗体(1∶150),2 h后加入二抗。Image proplus 4.01版本的专业图像分析软件对蛋白条带进行灰度扫描,测定其灰度值。
2 结果
2.1两组病理学特征比较在400倍的光镜下观察脑出血组、假手术组大鼠脑出血周围脑组织,可见假手术组大鼠脑组织结构清晰完整,神经细胞排列整齐,未发现明显的细胞肿胀、细胞核固缩及溶解。脑出血组在造模第12、48、120小时可见明显的细胞排列紊乱、核溶解、固缩,炎症细胞浸润,可见部分脑组织出现液化坏死、呈空腔隙状。
2.2各组不同时间点神经功能障碍评分比较 见表1。
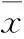
表1 各组不同时间点的神经功能障碍评分比较(分,±s)
注:与假手术组比较,*P<0.01。
2.3各组不同时间点脑组织PN-1、thrombin、PAR-1水平比较见表2。
2.4脑出血组血肿周围脑组织PN-1、thrombin、PAR-1的相关分析脑出血组血肿周围脑组织中PN-1与thrombin、PAR-1均呈负相关关系(r分别为-0.872、-0.698,P均<0.05)。

表2 各组PN-1、thrombin、PAR-1水平比较
注:与假手术组比较,△P<0.05;与造模后10 h或12 h比较,▲P<0.05。
3 讨论
脑出血患者经内科治疗或者外科清除血肿后,部分会合并神经系统功能损伤,言语、听写以及运动功能损伤较为突出[5]。除了颅内血管出血部位及出血程度的影响,对于脑出血患者脑组织周边水肿程度的分析也有利于揭示患者术后出现不同并发症的原因,并有利于预后判断。thrombin为内源性以及外源性凝血途径的共同作用通路,thrombin活性或者量的异常对于维持血管内凝血机制具有重要意义。thrombin的异常表达可能预示弥漫性血管内凝血的凝血状态、疾病转归以及病情程度,而其在脑出血中的研究较少。近年部分学者发现,在基底节脑出血周边组织中存在thrombin的异常激活和上调,其受体PAR-1表达也异常增高[6]。正常脑组织中,中枢神经系统的神经元包括大脑皮层扣带回、皮质、下丘脑核团、丘脑腹侧、中脑、海马和小脑的神经元,均存在一定程度的PAR-1表达,但HE染色多数较弱,蛋白水平表达程度较低,而血管内皮细胞中PAR-1的表达情况不明[7,8]。PN-1通过阻断thrombin与细胞膜表面PAR-1的结合,进而降低细胞内三磷酸尿苷以及酪氨酸激酶的活性,下调在Xa因子的作用下通过蛋白裂解方式产生的凝血活酶,抑制thrombin对于脑水肿组织的损伤作用[9]。本次研究重在探讨thrombin、PN-1以及PAR-1在大鼠脑出血模型中的表达情况。
本研究结果显示,两组造模后,脑出血组神经功能障碍评分明显降低,HE染色可以发现假手术组脑组织结构清晰完整,神经细胞排列整齐,而脑出血组脑细胞水肿以及坏死较为严重,细胞核崩解、碎裂,周边神经胶质细胞可见部分腔隙样以及液化性坏死,提示本次造模成功。本研究发现,PN-1、thrombin、PAR-1在脑出血大鼠脑组织中异常表达,其表达水平明显高于假手术组,考虑脑出血对于脑组织的损伤不仅通过局部压迫、血液凝固机化的损伤以及牵拉等作用,还有thrombin以及PAR-1的表达异常上升,促进神经纤维的细胞毒性损伤作用。时间特异度分析可见,在脑出血大鼠水肿吸收恢复期,thrombin以及PAR-1、PN-1等呈现了下降趋势。脑出血后12 h内,thrombin促进脑血管通透性改变,引起PAR-1对于水肿部位脑组织的损伤;而造模后12 h,由于脑水肿部位部分水通道的关闭,thrombin以及PAR-1对于受损部位神经纤维的水通道开放作用减弱,表达水平降低。PN-1通过特异性抑制thrombin对于炎症因子以及小胶质细胞的富集作用,进而降低脑水肿程度[10,11]。本研究结果显示,脑出血组血肿周围脑组织中PN-1与thrombin、PAR-1均呈负相关关系。考虑PN-1作为神经系统内存在的特异性较高的thrombin抑制剂,可以与thrombin的非催化中心位点结合,形成十二烷基磺酸盐复合物,与损伤的神经纤维表面糖蛋白结合,通过脂蛋白受体相关蛋白或者细胞膜的胞饮作用进入细胞内被降解或清除,减轻了thrombin以及PAR-1对于脑水肿细胞的损伤。
综上所述,脑出血大鼠血肿周围脑组织中PN-1与thrombin、PAR-1异常表达,PN-1与thrombin、PAR-1表达呈负相关关系。其中thrombin、PAR-1与脑水肿损伤有关,而PN-1可减轻thrombin对于脑出血周边神经细胞的损伤作用,提示其可以作为脑出血患者内科治疗的新途径,通过在脑出血急性期外源性注射PN-1细胞因子,进而减轻脑出血水肿细胞损伤,改善临床预后。
[1] 杨启胜,张入川.小骨窗开颅皮层小切口手术治疗高血压脑出血疗效[J].现代仪器与医疗,2014,22(4):87-88.
[2] 杨瑞玲,吴成翰,王开宇.脑出血中风闭、脱证患者血浆及血肿引流液凝血酶-抗凝血酶复合物表达临床观察[J].中国中西医结合杂志,2012,25(3):338-342.
[3] 王亮,张建富,刘海珠.凝血酶在脑出血中的作用研究现状[J].山东医药,2014,54(15):95-97.
[4] Garcia JH, Liu KF, Yoshida Y, et al. Influx of leukocytes and platelets in an evolving brain infarct (Wistar rat)[J]. Am J Pathol, 1994,144(1):188-199.
[5] 李萍,赵树明,胡亚男,等.脑出血发病机制研究进展[J].中华老年心脑血管病杂志,2015,26(2):214-215.
[6] 刘宝华,白光辉,邬伟,等.大鼠脑出血后IL-1β和CD163/HO-1信号通路表达及其与脑水肿的相关性[J].浙江创伤外科,2014,32(3):348-350.
[7] 何志义.microRNA与脑出血后脑水肿机制研究进展[J].中国医科大学学报,2014,43(11):961-964.
[8] 尹泽黎,刘育进,许宏伟.高血压脑出血凝血酶与脑水肿的临床研究[J].中风与神经疾病杂志,2010,27(3):244-247.
[9] 于垚,吴俊,赵伟,等.自动校正凝血酶曲线法监测脑出血患者凝血功能的初步研究[J].中华老年心脑血管病杂志,2015,27(1):70-72.
[10] 周庆博,贾青,张媛,等.黄芩苷对脑出血大鼠脑组织凝血酶受体-1表达及细胞凋亡的影响[J].中国中西医结合杂志,2010,33(12):1302-1305.
[11] D′Audigier C, Delassasseigne C, Robert A, et al. Underestimation of plasma level of factor V coagulant activity and fibrinogen concentration together with prolonged prothrombin time, activated partial thromboplastin time and thrombin time can result from pre-analytical very low calcium level in citrated sample tube[J]. Int J Lab Hematol, 2015,27(3):237-246.
10.3969/j.issn.1002-266X.2016.29.012
R722.15
A
1002-266X(2016)29-0036-03
2015-10-09)

