PD-L1在乳腺癌中的表达及其临床意义
李 菲,芦敏华,卓 静,时 瑶,任 毅
1.徐州市肿瘤医院病理科(江苏 徐州 221000) 2.徐州市肿瘤医院乳腺科(江苏 徐州 221000)
PD-L1在乳腺癌中的表达及其临床意义
李菲1,芦敏华1,卓静1,时瑶1,任毅2
1.徐州市肿瘤医院病理科(江苏 徐州 221000) 2.徐州市肿瘤医院乳腺科(江苏 徐州 221000)
目的探讨程序性死亡分子1配体-1(programmed cell death ligand 1,PD-L1)在乳腺浸润性导管癌中的表达水平,分析其与临床病理特征之间的关系。方法收集96例乳腺浸润性导管癌标本及30例癌旁正常乳腺组织,用免疫组化SP法及实时定量PCR(Real time PCR)检测标本中PD-L1的表达,分析其表达差异及与临床病理特征之间的关系。结果免疫组化法检测PD-L1主要表达于细胞浆,在浸润性导管癌中PD-L1的表达阳性率为35.42%(34/96),癌旁正常组织中的表达阳性率为3.33%(1/30),差异有统计学意义(P<0.05),PD-L1的表达与患者年龄、绝经史、家族史、肿块大小、淋巴结转移和肿瘤发生部位无统计学差异(P>0.05),与临床分期、组织病理学分级之间有统计学差异(P<0.05)。实时定量PCR检测乳腺浸润性导管癌中PD-L1高表达,平均ΔCt值为8.84±1.99,而在癌旁正常组织为低表达,平均ΔCt值为14.2±2.68,差异有统计学意义(P<0.05)。结论PD-L1在乳腺浸润性导管癌中的表达增加,且与乳腺癌的组织学分级和临床分期呈正相关。在临床病理中检测PD-L1的表达,可选择化疗药物,判断患者预后,及有望成为乳腺癌分子靶向治疗的新靶点。
PD-L1;乳腺癌;淋巴结转移
乳腺癌是女性最常见的恶性肿瘤,是世界范围内妇女癌症死亡的第二大原因[1]。在西方国家,由于早期检测技术的开展,大多数乳腺癌在发病初期即被诊断[2]。但在其他一些欠发达国家,超过40%的入院病例是在肿瘤的晚期阶段[3]。尽管有效的化学治疗、内分泌治疗及曲妥珠单抗靶向治疗已应用于乳腺癌的临床治疗,但肿瘤转移仍然无法治愈,1/3的进展期乳腺癌患者发生转移和死亡[1]。因此,乳腺癌的早期诊断,早期治疗对乳腺癌的预后至关重要。
程序性死亡分子1配体-1(programmed cell death ligand 1,PD-L1)是免疫球蛋白超家族单体型Ⅰ型跨膜糖蛋白,其与细胞凋亡程序相关而被命名为程序性细胞死亡-1受体。人的PD-L1基因也称CD279,位于染色体2q37.35,相对分子量为55 kDa,由细胞外区、跨膜区、胞内区组成[4]。PD-L1广泛表达于B淋巴细胞、单核细胞、自然杀伤细胞、巨噬细胞、血管内皮细胞表面,在卵巢癌、淋巴瘤和恶性黑色素瘤等人类肿瘤细胞株中表达也上调,提示其与肿瘤的发生、发展有紧密的关系[5]。PD-L1在喉癌、结肠癌,恶性黑色素瘤、非小细胞肺癌、肾细胞癌及食管癌等多种组织标本中的表达情况已被研究[6-7],而PD-L1在乳腺癌组织标本中的报道比较少,本研究旨在应用临床病理工作中比较常用的免疫组织化学技术和实时定量PCR技术讨论PD-L1在乳腺癌中的表达情况,为乳腺癌的靶向治疗提供参考依据,现报道如下。
1 材料与方法
1.1材料搜集2003年1月—2005年3月在徐州市肿瘤医院病理科,有完整病例资料的乳腺癌手术切除组织的石蜡包埋标本96例,组织学类型均为浸润性导管癌,及其癌旁正常乳腺组织(均取自距乳腺癌肿瘤边缘5 cm以外的正常乳腺组织)30例,所有病例标本均为女性,病例术前均未行放疗和化疗,临床病例资料完整,肿瘤直径<2 cm 42例,≥2 cm 54例;根据组织病理学分级,Ⅰ级25例,Ⅱ级、Ⅲ级71例;按照AJCC(2002)乳腺癌TNM 分期标准,Ⅰ期、Ⅱ期61例,Ⅲ期35例。
1.2试剂和仪器设备兔抗人PD-L1多克隆抗体(Abcam 公司,1∶200稀释)、免疫组化染色SP试剂盒及DAB试剂盒(北京中杉金桥生物有限公司),固定组织基因组RNA(离心柱)提取试剂盒(北京百泰克生物技术有限公司),反转录酶(M-MLV RT),DEPC水(Promega),2×SYBR Green Mix kit(天根生化科技),ABI 7500型实时荧光定量PCR仪。
1.3方法
1.3.1免疫组织化学检测石蜡包埋标本制成4 μm切片,经脱蜡、脱苯、水化后,采用链菌素抗生物素蛋白-过氧化物酶免疫组化法(SP法)检测,具体步骤参见试剂盒说明书进行,所有标本均检测PD-L1蛋白的表达,每次染色均设立阳性对照,以PBS代替一抗做阴性对照。
1.3.2实时定量PCR检测将10片10 μm厚的石蜡切片放入1.5 mL离心管,经脱蜡、组织破碎、分层、沉淀、干燥、溶解等步骤提取RNA,具体操作步骤参见说明书进行,总RNA纯度和浓度使用紫外分光光度计测定,逆转录过程按说明书操作。GAPDH引物序列:上游5′-GTGAAGGTCGGAGTCAACG-3′,下游5′-TGAGGTCAATGAAGGGGTC-3′,PD-L1引物序列:上游5′-CTGCATGATCAGCTATGGTGGTG-3′,下游5′-CAGTTCATGTTCAGAGGTGACTGGA-3′。循环条件为:95℃预变性10 s;95℃变性5 s,58℃退火并延伸31 s,40个循环;每个反应均设置熔解曲线。
1.4结果判定
1.4.1免疫组织化学结果判定PD-L1以细胞浆出现黄色至棕黄色颗粒为阳性显色。PD-L1的表达采取半定量积分法,结合染色强度和阳性细胞百分比来评定阳性表达的病例(immunohistochemical scores,IHS),IHS =a×b[8]。先在低倍镜下观察切片整个视野,分别在癌细胞及癌间质随机选择5个高倍视野(×400),a代表染色强度,分级如下:无着色,a=0分;浅黄色,a=1分;棕黄色,a=2分;棕褐色,a=3分;b代表阳性细胞百分比,分级如下:阳性细胞数≤10%,b=1分;10%~50%,b=2分;>50%,b=3分,两项得分相乘结果≥3分为阳性表达。
1.4.2实时定量PCR结果判定为减小样本误差,对所得待测基因的Ct 值进行校正,分别用待测基因PD- L1的Ct 值减去内参基因GAPDH 的Ct值,代表待测基因的相对拷贝数,ΔCt=Ct待测基因-CtGAPDH;算出每组ΔCt 的平均值。
1.5统计学处理采用SPSS 18.0统计学软件,PD-L1的表达,及其与乳腺癌临床病理特征关系分析采用χ2检验,q-RT PCR结果采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1PD-L1在乳腺浸润性导管癌组织中的表达免疫组织化学结果显示,浸润性导管癌组织中PD-L1蛋白高表达,阳性率为35.42%(34/96),主要定位在癌细胞和癌间质淋巴细胞的细胞浆(见图1),30例癌旁组织中PD-L1蛋白低表达,阳性率为3.33%(1/30),差异有统计学意义(χ2=7.73,P<0.05)。
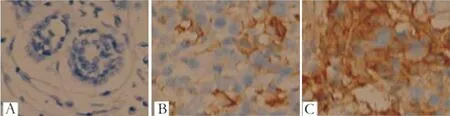
A:PD-L1在正常乳腺组织呈阴性表达;B:PD-L1在浸润性导管癌中低表达状态;C:PD-L1在浸润性导管癌中高表达状态。图1 PD-L1在乳腺癌及癌旁正常组织中的表达(×40)
2.2PD-L1表达与患者临床病理特征PD-L1表达与乳腺癌临床分期(χ2=2.95,P<0.05)和组织分级(χ2=5.57,P<0.05)存在明显的相关性,见表1。
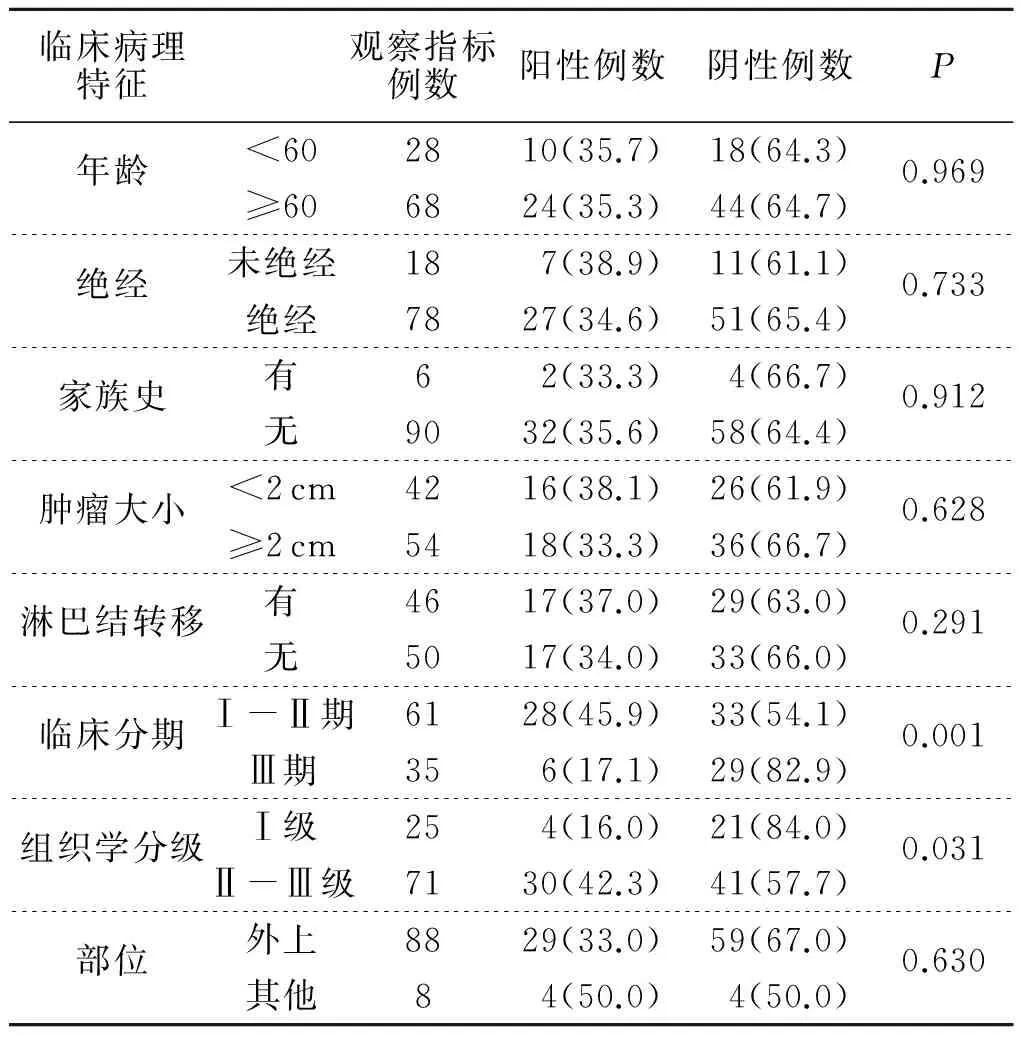
表1 PD-L1表达与浸润性导管癌临床病理特征的关系[n(%)]
2.3PD-L1 mRNA在浸润性导管癌中的表达水平
实时定量PCR结果显示乳腺浸润性导管癌中PD-L1高表达,平均ΔCt值为8.84±1.99,而在癌旁正常乳腺癌组织中PD-L1呈低表达,平均ΔCt值为14.2±2.68,差异有统计学意义(P<0.05),见图2。
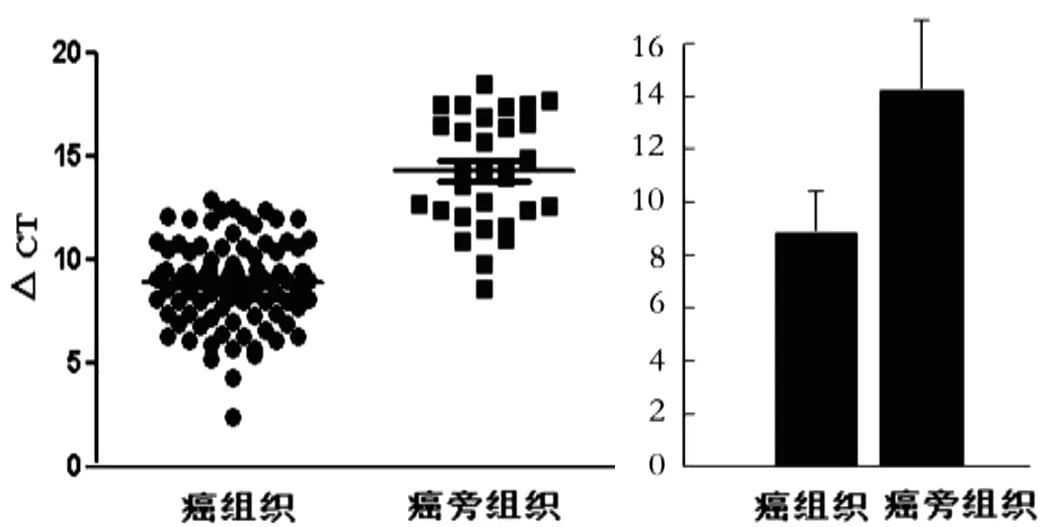
图2 PD-L1 mRNA在癌组织与癌旁组织中的表达
3 讨论
国外有研究应用免疫组织化学方法对乳腺癌标本进行PD-L1表达检测,检测结果显示[9-10]PD-L1的表达与ER阴性,PR阴性,病理组织学Ⅲ级的乳腺癌有相关性,在有淋巴结转移的乳腺癌中研究发现PD-L1的表达与淋巴结体积较大以及人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性的肿瘤有正相关性。本研究结果显示PD-L1在乳腺浸润性导管癌组织中高表达,且与病理组织学分级、临床分期呈正相关。抗PD-Ll单抗治疗荷瘤小鼠模型显示肿瘤生长受到明显抑制,肿瘤细胞被清除,部分出现完全缓解[11],联合应用细胞毒性T淋巴细胞,相比较于单纯的细胞毒性T淋巴细胞治疗,能有效提高荷瘤小鼠的生存率[12],所以PD-1/PD-L1途径可能参与乳腺癌亚型,如三阴性(ER、PR、HER2表达均为阴性)乳腺癌的复发转移[13]。
化学治疗是利用化学药物阻止癌细胞的增殖、浸润、转移,直至最终杀灭癌细胞的一种治疗方式,蒽环类的化疗药在乳腺癌的治疗中应用广泛,有研究表明阿霉素能有效降低乳腺癌细胞表面PD-L1的表达,减少PD-L1与T细胞表面PD-1的结合,最终促进T细胞特异性杀伤肿瘤细胞[14]。研究证实[15]阿霉素虽能有效减少乳癌细胞表面PD-L1的表达,但在乳腺癌细胞核内,PD-L1的表达则上调,原因可能是阿霉素促使肿瘤细胞膜上的PD-L1发生核迁移,从而增加癌细胞核内PD-L1的表达增加,这也是化学药物治疗肿瘤时,肿瘤细胞抗击凋亡的一种自我保护方式。尼美舒利,其药理机制为选择性抑制环氧合酶Ⅱ,通过干扰素诱导PD-L1在乳腺癌细胞表面的表达,进而促进癌细胞凋亡,抑制癌细胞的转移和扩散[16]。但化疗药物的选择性不强,在杀灭癌细胞的同时也会不可避免地损伤人体正常的细胞,从而出现药物的不良反应。
应用RNA干扰技术,在人类肿瘤细胞系中转染协同刺激分子CD80,活化CD8+效应T细胞功能,从而抑制肿瘤细胞表面PD-L1的表达, 促进肿瘤细胞凋亡,这表明协同刺激分子CD80在抗肿瘤治疗中有可能成为新的药物靶点。以协同刺激分子作为治疗药物,既对肿瘤的治疗有针对性,同时也可减少传统化疗药物带来的不良反应[17]。
近年来放疗、化疗以及生物治疗在临床中的广泛应用,使得乳腺癌的治疗效果明显提高,但三阴乳腺癌及已发生转移的乳腺癌,仍然是治疗的难点,PD-L1的检测可以指导临床化疗药物的选择,作为判断患者预后的独立因子,同时特异性抗PD-L1单抗为乳腺癌的肿瘤免疫治疗提供了新思路。
[1]Desantis C,Siegel R,Bandi P,et al.Breast cancer statistics[J].CA Cancer J Clin, 2011,61(6):409-418.
[2]Cianfrocca M,Goldstein LJ.Prognostic and predictive factors in early-stage breast cancer[J]. Oncologist,2004,9(6):606-616.
[3]Ezzat AA,Ibrahim EM, Raja MA,et al.Locally advanced breast cancer in Saudi Arabia: high frequency of stage III in a young population[J].Medical oncology (Northwood,London,England),1999,16(2):95-103.
[4]Gianchecchi E,Delfino DV,Fierabracci A.Recent insights into the role of the PD-1/PD-L1 pathway in immunological tolerance and autoimmunity[J].Autoimmun Rev,2013,12(11):1 091-1 100.
[5]Pedoeem A,Azoulay-Alfaguter I,Strazza M,et al. Programmed death-1 pathway in cancer and autoimmunity[J].Clinical immunology (Orlando,Fla),2014,153(1):145-152.
[6]Dong H,Strome SE,Salomao DR,et al.Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion[J].Nat Med,2002,8(8):793-800.
[7]Konishi J,Yamazaki K,Azuma M,et al.B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytes and their PD-1 expression[J].Clinical cancer research,2004,10(15):5 094-5 100.
[8]Mu CY,Huang JA,Chen Y,et al.High expression of PD-L1 in lung cancer may contribute to poor prognosis and tumor cells immune escape through suppressing tumor infiltrating dendritic cells maturation[J].Medical oncology (Northwood,London,England),2011,28(3):682-888.
[9]Janakiram M,Abadi YM,Sparano JA, et al.T cell coinhibition and immunotherapy in human breast cancer[J].Discov Med,2012,14(77):229-236.
[10]Sendur MA,Aksoy S,Demirci S,et al.Can targeted programmed death-1 antibody be a new treatment approach in breast cancer[J].J BUON,2014,19(2):584.
[11]Wang J,Jensen M,Lin Y,et al.Optimizing adoptive polyclonal T cell immunotherapy of lymphomas, using a chimeric T cell receptor possessing CD28 and CD137 costimulatory domains[J].Hum Gene Ther,2007,18(8):712-725.
[12]Charo J,Finkelstein SE,Grewal N,et al.Bcl-2 overexpression enhances tumor-specific T-cell survival[J].Cancer Res,2005,65(5):2 001-2 008.
[13]Mittendorf EA,Philips AV,Meric-Bernstam F,et al.PD-L1 expression in triple-negative breast cancer[J].Cancer immunology research,2014,2(4):361-370.
[14]Hasan A,Ghebeh H, Lehe C,et al.Therapeutic targeting of B7-H1 in breast cancer[J]. Expert Opin Ther Targets,2011,15(10):1 211-1 225.
[15]Ghebeh H,Lehe C,Barhoush E,et al.Doxorubicin downregulates cell surface B7-H1 expression and upregulates its nuclear expression in breast cancer cells: role of B7-H1 as an anti-apoptotic molecule[J].Breast Cancer Res,2010,12(4):48.
[16]Liang M,Yang H,Fu J.Nimesulide inhibits IFN-gamma-induced programmed death-1-ligand 1 surface expression in breast cancer cells by COX-2 and PGE2 independent mechanisms[J].Cancer Lett,2009,276(1):47-52.
[17]Haile ST,Bosch JJ,Agu NI,et al.Tumor cell programmed death ligand 1-mediated T cell suppression is overcome by coexpression of CD80[J].Journal of immunology (Baltimore, Md),2011,186(12):6 822-6 829.
责任编辑:艾茜
Expression and Clinical Significance of PD-L1 in Breast Carcinoma
Li Fei1,Lu Minhua1,Zhuo Jing1,Shi Yao1,Ren Yi2
(1.DepartmentofPathology,theXuzhouCancerHospital,Xuzhou221000,China;2.DepartmentofGalactophore,theXuzhouCancerHospital,Xuzhou221000,China)
Objective To study the expression of PD-L1 (programmed death 1 ligand 1) in the invasive ductal carcinoma (IDC) and analyze the relationship between it and clinical pathological characteristics.Methods The tumor samples from 96 cases of breast IDC and 30 cases of normal breast tissue adjacent to cancer were collected.The expression of PD-L1 was assayed by SP and real time PCR. Its correlations with patients clinical pathological characteristics were analyzed.Results The PD-L1 was mainly expressed in the cytoplasm by SP.The PD-L1 was found to be over-expressed in 34 of 96 (35.42%) breast IDC samples,while in 1 of 30(3.33%) normal breast tissue adjacent to tumor.The difference was statistically significant (P<0.05).There was no statistical difference in the expression of PD-L1 of patients with age,menopausal history,family history,tumor size,lymph node metastasis and tumor location (P>0.05).There was a statistical difference between it and clinical stage and histopathological grading (P<0.05).For the real time PCR,the expression of PD-L1 was higher in breast IDC samples(the average ΔCt 8.84+1.99),but the expression of the normal breast tissue adjacent to tumor was low (the average ΔCt 14.2±2.68). The difference was statistically significant (P<0.05).Conclusion The expression of PD-L1 in breast IDC was increased and positively correlated with the histological grading and clinical stage of breast carcinoma.The expression of PD-L1 was detected in the clinical pathology,which was useful for choosing chemotherapy and judging prognosis.It is expected to be a new target for the treatment of breast carcinoma.
PD-L1;breast carcinoma:lymph node metastasis
李菲(1984- ),女,山东枣庄人,硕士,主治医师,研究方向:肿瘤临床病理学。
R737.9
A
1008-8164(2016)03-0004-04
2016-07-22

