响应面法优化油脂酵母发酵产油的影响因子
钟 琦,吴慧昊,代军飞,牛 锋*
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学 实验中心,甘肃 兰州 730124)
响应面法优化油脂酵母发酵产油的影响因子
钟琦1,吴慧昊2,代军飞1,牛锋1*
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学 实验中心,甘肃 兰州 730124)
微生物油脂作为一种新型油料资源,研究其发酵条件具有重要意义.以实验室保存菌株EAM-AC16为出发菌,通过单因素试验和响应面法优化菌株EAM-AC16的发酵条件.确定最优发酵条件为:葡萄糖浓度82.37 g/L,接种量9.45%,培养时间为146.4 h,pH6.0,培养温度30 ℃,空气量(装液量mL/三角瓶mL)70mL/250mL和(NH4)2SO4浓度1 g/L时,菌株EAM-AC16的油脂产量达5.204 g/L.利用气相色谱分析菌株EAM-AC16合成油脂的主要成分为:棕榈酸(C16:0)、亚油酸(C18:2)、γ-亚麻酸(C18:3)和反油酸(C18:3)等.
油脂酵母;微生物油脂;发酵条件;气相色谱
传统油脂主要从动植物中提取,但因产量不稳定、生长周期长且经济成本高等原因,严重制约着其大规模工业化生产.因此,世界各国开始致力于开发可替代的再生资源.
微生物油脂(microbial oils),又称为单细胞油脂 (single cell oil,SCO),即酵母菌、霉菌、细菌和藻类等油脂微生物在一定培养条件下,利用碳水化合物、碳氢化合物和氨基酸等营养物质分别作为碳源和氮源,辅以无机盐,在菌体内产生的大量油脂[1].利用油脂微生物生产油脂的优势[2~4]:①微生物生长周期短、适应性强、代谢旺盛、培养条件和操作简单.②微生物易于遗传物质的改良,能大幅度提高产量的同时,还能得到符合人类需要的功能性脂肪酸.③微生物可利用农副产品、食品加工的废弃物作为培养基原料,有利于废弃物的再利用和环境保护.④微生物油脂生物安全性好,不易被氧化,毒副作用小.⑤微生物生产油脂不受场地和季节限制,能够连续大规模工业化生产.⑥微生物比高等植物更能有效地积累油脂.⑦利用微生物生产油脂所需的劳动力比动植物生产油脂少.
微生物油脂不仅能作为功能性脂肪酸添加到食品中,具有抗高血压、抗粥样动脉硬化、预防心血管和肿瘤的发生,同时还具有健脑明目和延缓衰老等功能[5~8],且其主要成分与植物油脂相似,还能作为生物柴油和生物汽油的理想原料[9].因此,微生物油脂作为绿色环保的新型可再生资源,具有良好的应用前景.
本研究以实验室保存的油脂酵母菌株为出发菌,通过优化培养条件,进一步提高油脂产量,为该菌株的综合利用提供参考.
1 材料与方法
1.1材料
1.1.1菌种
EAM-AC16为粘性丝孢酵母,实验室保存菌种.
1.1.2培养基
麦氏培养基(g/L):葡萄糖1,酵母浸粉2.5,醋酸钠8,氯化钾1.8,pH自然.
种子培养基(g/L):葡萄糖20,酵母浸粉10,蛋白胨10,pH自然.
发酵产脂培养基(g/L):葡萄糖80,酵母浸粉5,蛋白胨2,磷酸二氢钾5,硫酸镁1,pH自然.
1.1.3试剂
葡萄糖、酵母浸粉和蛋白胨为生物试剂;正己烷、氢氧化钾和甲醇为色谱纯;其他试剂均为国产分析纯.
1.2方法
1.2.1菌种的活化
将实验室保存的油脂酵母菌株EAM-AC16接种到麦氏培养基,35 ℃培养36 h,活化待用.
1.2.2菌种的扩大培养
将活化后的菌株以5%的接种量接种至种子培养基,35 ℃,120 r/min培养36 h.
1.2.3影响油脂酵母发酵产油的单因素试验
分别考察培养时间、培养温度、初始pH、接种量、空气量、葡萄糖浓度和硫酸铵浓度对油脂酵母的生物量和油脂产量的影响.
1.2.4响应面法优化培养条件
从单因素中选取对生物量和油脂产量影响较大的因素,进行响应面法优化试验.
1.3分析方法
1.3.1生物量的测定
采用干重法测定生物量[10].
1.3.2油脂提取及脂肪酸成分分析
采用索氏抽提法提取菌体内的油脂[11].参照文献方法[12],油脂进行碱法甲酯化后进气相色谱分析.
1.3.3数据处理与分析
每组试验设置3次重复,用EXCEL、SPSS和Design-Expect软件对数据进行分析.
2 结果与分析
2.1生长曲线
酵母菌的生长一般会经过4个时期,即迟缓期、对数生长期、稳定期和衰亡期.由图1所示,0~8 h时,菌株EAM-AC16刚接种到发酵产脂培养基,需要适应新培养基,如果菌体数量维持恒定,说明细胞正处于迟缓期.8~60 h时,菌体浓度急剧增加,说明菌株EAM-AC16处于对数生长期.到60 h后,细胞生长减慢,逐渐进入稳定期,此时油脂开始大量积累.在180 h时进入衰亡期,菌体逐渐衰亡.选择合适的接种时间,可以保证种子液的浓度和活性,因此确定菌株EAM-AC16在种子培养基中的发酵周期为36 h.

图1 菌株EAM-AC16的生长曲线
2.2发酵条件优化——单因素试验
2.2.1培养时间对菌株EAM-AC16产油的影响

图2培养时间对菌株EAM-AC16发酵结果的影响
培养时间对菌株EAM-AC16生物量和油脂产量的影响较大(图2).培养时间从96 h增加到144 h.随着培养时间的增加,其生物量和油脂产量显著增加(P<0.05).在培养时间为144 h时,生物量和油脂产量均达到最大值;培养时间超过144 h时,生物量和油脂产量随培养时间增加而显著下降.因此,菌株EAM-AC16的最佳培养时间为144 h.
2.2.2培养温度对菌株EAM-AC16产油的影响

图3培养温度对菌株EAM-AC16发酵结果的影响
温度通过酶的活性影响微生物的生长和油脂积累[13~14].不同培养温度对菌株EAM-AC16生物量和油脂产量的影响较大(图3).随着温度增加,生物量和油脂产量呈现先增加后下降的趋势.在30 ℃,EAM-AC16生物量和油脂产量显著高于其他处理水平(P<0.05).因此,选择30 ℃作为菌株EAM-AC16生长和油脂积累的最适温度.
2.2.3初始pH对菌株EAM-AC16产油的影响

图4pH对菌株EAM-AC16发酵结果的影响
初始pH通过改变酶的活性、细胞质膜通透性、膜结构稳定性和物质溶解性等方面来影响微生物的生长和油脂积累[15].初始pH对生物量和油脂产量的影响较大(图4).pH从5.22增加到6.0时,生物量和油脂产量没有显著变化.在pH大于6.0时,生物量和油脂产量均显著下降(P<0.05).说明菌株EAM-AC16适合在pH6.0的弱酸性培养基中生长和合成油脂.
2.2.4接种量对菌株EAM-AC16产油的影响

图5接种量对菌株EAM-AC16发酵结果的影响
接种量过少,迟缓期较长;接种量过高,种内竞争增加,因此,合适的接种量有利于油脂合成[16].随着接种量的增加,菌株EAM-AC16的生物量呈现上升趋势,而油脂产量呈现逐渐下降的趋势(图5).当接种量为10%时,其生物量相对低于接种量为20%的生物量,但油脂产量远高于接种量为20%的油脂产量.综合考虑,确定菌株EAM-AC16的最佳接种量为10%.
2.2.5空气量(装液量mL/三角瓶mL)对菌株EAM-AC16产油的影响

图6空气量对菌株EAM-AC16发酵结果的影响
酵母菌利用糖类生长和合成油脂的过程是好氧发酵[17],且酵母菌厌氧发酵产物对细胞生长具有一定毒害作用[18],因此选择合适的空气量对油脂酵母的生长和油脂合成具有重要的作用.空气量对菌株EAM-AC16生物量的影响较大,而对油脂产量的影响不明显(图6).当空气量为70mL/250mL时,其生物量和油脂产量与空气量为70mL/300mL相比,差异不显著(P>0.05),但随着空气量的减少,其生物量和油脂产量均呈下降趋势.综合考虑,选择空气量70mL/250mL作为EAM-AC16生长和发酵的最佳空气量.
2.2.6葡萄糖浓度对菌株EAM-AC16产油的影响

图7葡萄糖浓度对EAM-AC16发酵结果的影响
碳源不仅为微生物生长提供碳源,维持渗透压,而且还可以为合成油脂提供碳骨架[19].葡萄糖浓度对生物量和油脂产量的影响较显著(图7).随着葡萄糖浓度的增加,生物量和油脂产量逐渐增加,葡萄糖浓度80 g/L时,生物量和油脂产量显著大于其他水平(P<0.05);葡萄糖浓度超过80 g/L时,其生物量和油脂产量都显著下降.因此,菌株EAM-AC16生长和油脂积累的最适葡萄糖浓度为80 g/L.
2.2.7 (NH4)2SO4对菌株EAM-AC16产油的影响

图8(NH4)2SO4浓度对菌株NU-Y004-2发酵结果的影响
无机氮源能促进菌体增殖[20],且合适的C/N比更有利于油脂酵母的生长和油脂积累[21].(NH4)2SO4浓度对菌株EAM-AC16生物量和油脂产量均呈现先上升后下降的趋势(图8).当(NH4)2SO4浓度为1 g/L时,生物量和油脂产量均显著高于其他处理水平(P<0.05).因此,在培养基中添加1 g/L的(NH4)2SO4为菌株生长和油脂积累的最适无机氮源.
2.3发酵条件优化——响应面试验
2.3.1试验设计及结果
表1试验设计因素及水平
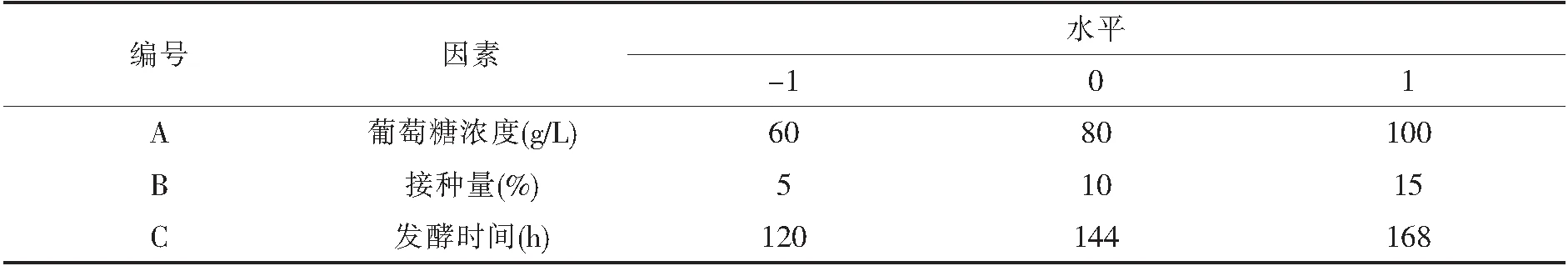
表2 响应面分析方案及结果

在单因素试验中,碳源、接种量和发酵时间对生物量和油脂产量的影响较显著,因此,采用Design-Expert8.0软件设计Box-Behnken试验,考察葡萄糖浓度、接种量和发酵时间对菌株EAM-AC16发酵产油的影响.以这3个因素作为变量,每个变量按低、中、高3个水平分别以-1、0、1进行编码,试验因素及水平表见表1.以A、B、C为自变量,油脂产量(g/L)作为响应值,分析方案及结果见表2.
利用Design-Expert 8.0软件,对表2的试验结果进行响应面回归分析,获得油脂产量R对自变量葡萄糖浓度(A)、接种量(B)、发酵时间(C)多元二次拟合回归方程,其方程为:Y=5.20+0.14A-0.11B+0.017C+0.074AB-0.053AC-0.021BC-0.56A2-0.45B2-0.39C2.方程中的系数具有正值和负值,说明存在极大点,且响应面最高点对应等高线的最小椭圆的中心点为极值点.
对该模型进行方差分析的结果见表3,其中A、B、C、A2、B2和C2呈极显著影响(P<0.01),AB呈显著影响(P<0.05),AC和BC为不显著影响.失拟项α=0.05水平上不显著,残差由随机误差引起.模型的F检验为极显著(P<0.01).说明该拟合方程与实际情况相符合,模型显著,具有实际意义.该模型的决定系数R2为0.992 2,变异系数为1.36%,由此可以确定该模型的精确性和可信性.因此,该模型可以用于分析和预测UN-Y004-2的发酵条件.
表3方差分析

2.3.2三维图和等高线图
根据回归方程,用Design-Expert8.0软件做出拟合三维图,考察三维图的形状.三维图和等高线的颜色和形状变化能够反映两个因素之间的交互作用,即等高线的形状如果为椭圆形表示交互作用显著,圆形则表示交互作用不显著.颜色对比越强烈,交互作用越显著[22].由图9、10和11可知,葡萄糖浓度和接种量、葡萄糖浓度和培养时间以及接种量和培养时间之间的交互作用显著.

图9 (A) 葡萄糖浓度和接种量的三维图 图9 (B) 葡萄糖浓度和接种量的等高线图

图10 (A) 葡萄糖浓度和培养时间的三维图 图10 (B) 葡萄糖浓度和培养时间的等高线图

图11 (A) 接种量和培养时间的三维图 图11 (B)接种量和培养时间的等高线图
2.3.3试验结果的验证
利用响应面法得出最优发酵工艺参数为:在葡萄糖浓度82.37 g/L,接种量9.45%,培养时间为146.4 h,pH6.0,培养温度为30 ℃,空气量为70mL/250mL和(NH4)2SO4浓度为1 g/L时,预测油脂产量为5.219 39 g/L.
采用上述最佳发酵工艺参数验证响应面分析的可靠性,经过3次平行试验,得到实际油脂产量为5.204 g/L.说明响应面法提供的模型较真实地拟合了实际情况,可以用于菌株EAM-AC16发酵条件的预测.
2.4气相色谱分析
利用索氏抽提法提取菌株EAM-AC16的油脂,气相色谱结果如图12所示.结果显示菌株EAM-AC16油脂的主要成分为棕榈酸(C16:0)、亚油酸(C18:2)、γ-亚麻酸(C18:3)和反油酸(C18:3).

注:1-棕榈酸甲酯;2-亚油酸甲酯;3-γ-亚麻酸甲酯;4-反油酸甲酯.
图12以葡萄糖为碳源的微生物油脂的脂肪酸甲酯气相色谱
3 结论
通过单因素试验,确定较优的培养条件为:培养时间144 h、培养温度30 ℃、初始pH6.0、接种量为10%、空气量(装液量mL/三角瓶mL)为70mL/250mL、葡萄糖浓度80 g/L和(NH4)2SO4浓度1 g/L.选取影响较大的影响因子,即葡萄糖浓度、接种量和发酵时间为自变量,利用响应面法确定最优发酵条件为:葡萄糖浓度82.37 g/L,接种量9.45%,培养时间146.4 h,培养温度为30 ℃,初始pH6.0,空气量70mL/250mL 和(NH4)2SO4浓度1 g/L时,菌株EAM-AC16的油脂产量达5.204 g/L.气相色谱结果显示菌株EAM-AC16脂肪酸的主要成分为:棕榈酸(C16:0)、亚油酸(C18:2)、γ-亚麻酸(C18:3)和反油酸(C18:3)等.
在后续的研究中,可以建立简单高效的微生物油脂提取技术和高效的下游分离技术,以实现工业化大规模生产.同时,在发酵工艺学方面,可以尝试补料分批发酵、连续发酵等工艺方法,进一步提高油脂产量、缩短发酵时间和节约成本.
[1] Ratledge C. Lipid biotechnology a wonderland for the microbial physicologist[J]. J Am Oil Chem Soc, 1987,64(12): 1647-1656.
[2] 马艳玲. 微生物油脂及其生产工艺的研究进展[J]. 生物加工过程,2006, 4(4): 7-11.
[3] 石婷婷. 产油脂微生物菌株的选育[D]. 济南: 山东轻工业大学,2012.
[4] Armenta RE,Valentine MC. Single-Cell Oils as a Source of Omega-3 Fatty Acids:An Overview of Recent Advances[J]. J Am Oil Chem Soc,2013,90: 167-182.
[5] 周同永,任飞,邓黎,等. γ-亚麻酸及其生理生化功能研究进展[J]. 贵州农业科学,2011,39(3): 53-58.
[6] 施东魁,胡春梅. 花生四烯酸的主要作用及提取方法[J]. 中国中药杂志,2007,32,(11): 1009-1011.
[7] 赵春燕. 浅谈EPA和DHA的生理作用[J]. 西藏科技,2010,7: 29-30.
[8] 曹万新,孟橘,田玉霞. DHA的生理功能及应用研究进展[J]. 中国酿造,2011,36(3):1-4.
[9] Dillschneider R, Schulze I, Neumann A et. Combination of algae and yeast fermentation for an integrated process to produce single cell oils[J]. Applied Microbiology & Biotechnology, 2014,98(18): 7793-7802.
[10] 刘欢.利用食品工业废水培养斯达油脂酵母产油的研究[D]. 杨凌: 西北农林科技大学,2011.
[11] 咸漠,康亦兼,刘延,等.菌油脂肪酸碱法甲酯化的研究[J]. 吉林大学自然科学学报,2001,(1): 103-105.
[12] 张鹏鹏. 油脂高产菌株深黄被孢霉的诱变及发酵培养基的优化[D]. 洛阳: 河南科技大学,2013.
[13] Papanikolaou S,Aggelis G. Lipid production by Yarrowia lipolytica grown on industrial glycerol in a single-stage continuous culture[J]. Bioresource Techenology,2002,82(1): 43-49.
[14] Fukunage T,Wada, Honjo M,et al. Effect of temperature and salt on lipid and fatty acid compositions of a bacterium isolated form the bottle layer of lake vanda, andarctica[J]. Journal of General and Applied Microbiology,1995,41(3): 1991-205.
[15] 沈萍,陈向东. 微生物学(第二版)[M]. 北京: 高等教育出版社,149-150.
[16] Box,GEP,Draper NR. Empirical model building and response surface[M]. New York: John Wiley &SONS INC,1987.
[17] Gill CO,Hall MJ,Ratledge C. Lipid accumulation in an oleaginous yeast (Candida 107) growing on glucose in single stage continuous culture[J]. Applied and Environmental microbiology,1977,33(2): 231-239.
[18] 陶发琴. 高产油脂酵母的选育及发酵条件优化[D]. 西安: 西北大学,2013.
[19] Zhu LY,Zong MH,Wu H. Efficient lipid production with Trichosporon fermentans and its use for biodiesel preparation [J]. Bioresource Technology,2008,99(16): 7881-7885.
[20] 赵人俊,严虹,郑幼霞. 被孢霉产生含γ-亚麻酸油脂的几种因素[J]. 生物工程进展,1995,4: 361-365.
[21] Cheirsilp B, Louhasakul,Y. Industrial wastes as a promising renewable source for production of microbial lipid and direct transesterification of the lipid into biodiesel[J].Bioresource Technology,2013,8(142): 329-337.
[22] Gu XB,Zheng ZM,Yu HQ,et al. Optimization of medium constituents for a novel lipopeptide production by Bacillus subtilis MO-01 by a response surface method[J]. Process Biochemistry,2005,40(10): 3196-3201.
2016-05-10
西北民族大学研究生科研(实践)创新项目(Ymx2014180).
*
钟琦(1990—),女(白族),湖南桑植县人,硕士研究生,主要从事油脂微生物方面的研究.
TQ641
A
1009-2102(2016)02-0057-08

