MALAT1在膀胱癌中的表达及其临床意义
章成玉,崔雨,陈金波,李超
(中南大学湘雅医院1.手术部,2.泌尿外科,湖南长沙410008)
MALAT1在膀胱癌中的表达及其临床意义
章成玉1,崔雨2,陈金波2,李超2
(中南大学湘雅医院1.手术部,2.泌尿外科,湖南长沙410008)
目的探讨膀胱癌中长链非编码R NA肺癌转移相关转录本1(MALAT1)的表达及其与膀胱癌患者预后的相关性。方法原位杂交方法检测120例膀胱癌组织中MALAT1的表达,分析MALAT1表达与膀胱癌临床特征及预后的相关性;Kaplan-Meier生存法及Log-rank检验分析MALAT1表达强度与膀胱癌患者生存时间的关系;Cox比例风险回归模型评价影响膀胱癌生存危险性的个体变量。结果高表达的MALAT1与高组织学分级、高临床分期及淋巴结转移阳性相关(P<0.05),而与患者的性别、年龄及肿瘤的大小、数目无关(P> 0.05);Kaplan-Meier生存分析显示,MALAT1高表达组的总生存期短于低表达组;Cox回归多变量分析表明,高临床分期、淋巴结转移阳性和高表达量的MALAT1为影响膀胱癌预后的独立危险因素。结论MALAT1的表达随着组织学分级、临床分期的升高,以及淋巴结转移阳性而显著上调,其高表达可作为判断膀胱癌预后的一个独立危险因素。
长链非编码R NA;肺癌转移相关转录本1;膀胱癌
在我国,膀胱癌发病率居泌尿生殖系肿瘤的第1位,居所有恶性肿瘤发病率的第6位[1]。50~70岁为膀胱癌高发年龄段,男性发病率高于女性,约为女性的3.3倍[2]。膀胱癌具有反复复发、局部浸润及远处转移的生物学特征,可分为非肌层浸润性膀胱癌(non muscle-invasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(Muscle-invasive bladder cancer,MIBC),后者具有极强的侵袭转移能力,预后较差,5年存活率不足五成[3]。
肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1),定位于染色体11q13.1,全长8.7 kb。2003年由JI等[3]在非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的肿瘤细胞中首次发现并报道。近年来随着研究的不断深入,证实MALAT1参与包括肿瘤在内的多种疾病的发生、发展过程,与肿瘤细胞增殖、侵袭、转移等恶性生物学行为紧密相关。在乳腺癌、胰腺癌、肺癌、结肠癌和肝癌等恶性肿瘤中均有相关研究报道[4-8],但目前国内关于MALAT1与膀胱癌的相关研究较少。在本研究中,笔者通过原位杂交的方法检测120例膀胱癌病理标本中MALAT1的表达,分析MALAT1表达与膀胱癌临床特征及预后的相关性,为膀胱癌淋巴结转移的预测、诊断及治疗后的预后判断等提供新的生物标志物。
1 资料与方法
1.1一般资料
选取2008年1月-2012年12月在中南大学湘雅医院就诊的120例膀胱癌患者病理标本。所有患者经过手术治疗(膀胱电切或膀胱根治性切除),且术前未行放、化疗等辅助治疗,随诊时间3~5年,前2年每3个月随访1次,之后每6个月1次。收集患者的临床资料,包括患者的年龄、性别、生存时间和肿瘤的大小、数目、分级、分期及淋巴结转移情况等。
1.2实验方法
原位杂交寡核苷酸探针序列为:TATGACACTT TCCTTGCCCA,3'-和5'-末端均采用地高辛标记,以增加信号强度。探针序列利用Primer Primier 5.0设计,由上海英骏生物技术有限公司合成。探针试剂盒购自瑞士Roche公司,光学显微镜使用重庆奥特光学仪器有限公司的产品(型号B203LED)。实验步骤:组织芯片脱蜡,滴加胃蛋白酶置于37℃水浴锅漂洗30min,依次浸泡在梯度酒精中脱水。37℃环境下预杂交2h后,地高辛标记的MALAT1探针恒温杂交,置于42℃水浴锅过夜,滴加生物素化鼠抗地高辛,置于37℃水浴锅中1 h,0.5 mol磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤后加入二氨基联苯胺(diaminobenzidine,DAB)显色液50μl,在显微镜下观察显色结果。最后苏木素染核、脱水、封片、观察拍照。
1.3判定标准
MALAT1表达强度用阴性、弱阳性、中等阳性和强阳性4个不同等级表示,依次对应1~4分。标本一式4份,两位病理医生双盲看片,确定每个标本的染色强度及相应分数,取均数作为对应标本的MALAT1表达量(表达强度)。
1.4统计学方法
采用SPSS 17.0统计软件进行数据分析,计数资料用率或百分比表示,用χ2检验。Kaplan-Meier生存法及Log-rank检验分析MALAT1表达强度与膀胱癌患者术后生存时间的关系,Cox比例风险回归模型评价影响膀胱癌生存危险性的个体变量,用Wald's检验决定单变量和多变量Cox回归模型的统计学意义,P<0.05为差异有统计学意义。
2 结果
2.1MALAT1在膀胱癌组织中的表达
原位杂交结果显示,120例患者标本中,MALAT1表达阴性为24例,弱阳性为32例,中等阳性为26例,强阳性为38例。将所有患者MALAT1表达强度的均值(2.64)作为截断值,分为高表达组(n=64)和低表达组(n=56)。见图1。
2.2MALAT1与膀胱癌临床特征的关系
高表达的MALAT1与高组织学分级、高临床分期和淋巴结转移阳性比较,差异有统计学意义(P< 0.05)。而与患者的性别、年龄及肿瘤的大小、数目比较,差异无统计学意义(P>0.05)。见表1。
2.3MALAT1表达与膀胱癌患者预后的关系
使用Kaplan-Meier生存法及Log-rank检验分析MALAT1表达强度与膀胱癌患者生存时间的关系。Kaplan-Meier曲线显示,MALAT1高表达组的生存曲线在低表达组之下,高表达组的总生存期短于低表达组,差异有统计学意义(χ2=6.421,P=0.017)。见图2。
2.4MALAT1表达与膀胱癌预后的危险因素分析
使用逐步Cox回归模型分析影响膀胱癌生存预后的个体变量。除MALAT1表达量外,其他变量包括患者性别、年龄和肿瘤大小、数目、分级、分期,以及淋巴结转移。单变量分析显示,组织学分级、临床分期、淋巴结转移及MALAT1的表达与膀胱癌的总生存期相关(P<0.05)。对以上有统计学意义的变量行进一步的多变量分析,结果表明高临床分期、淋巴结转移阳性和MALAT1高表达为影响膀胱癌预后的危险因素(P<0.05)。见表2。
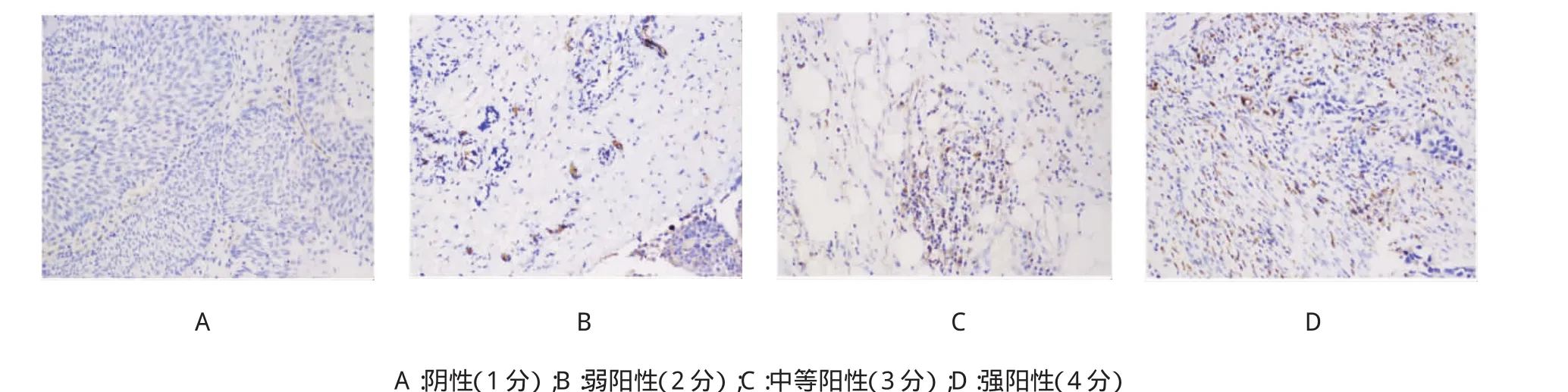
图1 原位杂交检测MALAT1在膀胱癌组织中的表达强度(×100)
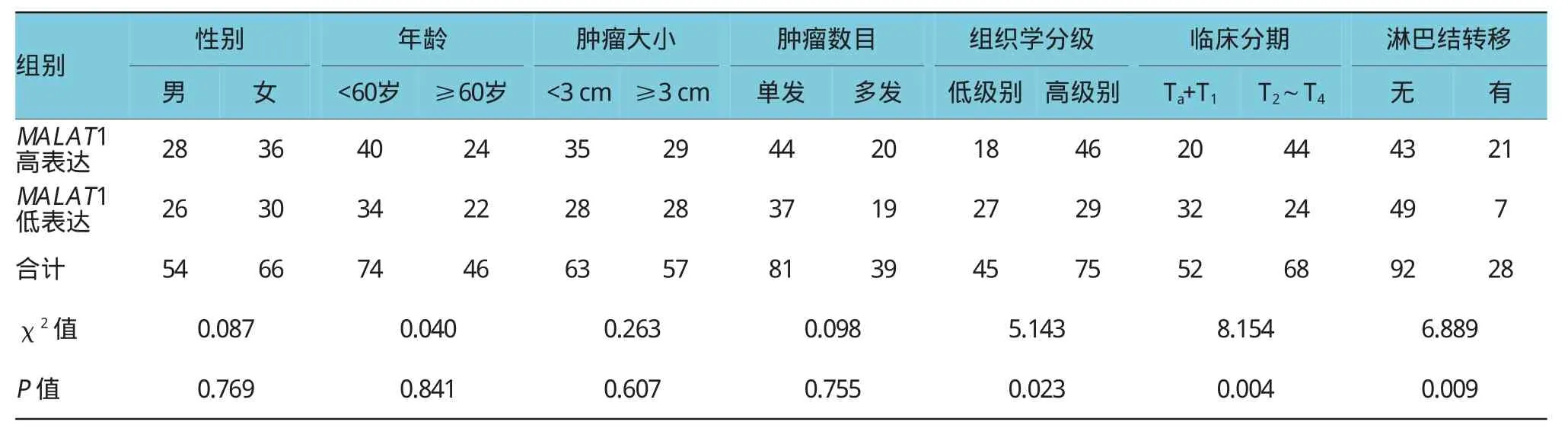
表1 MALAT1表达与膀胱癌临床特征的关系例
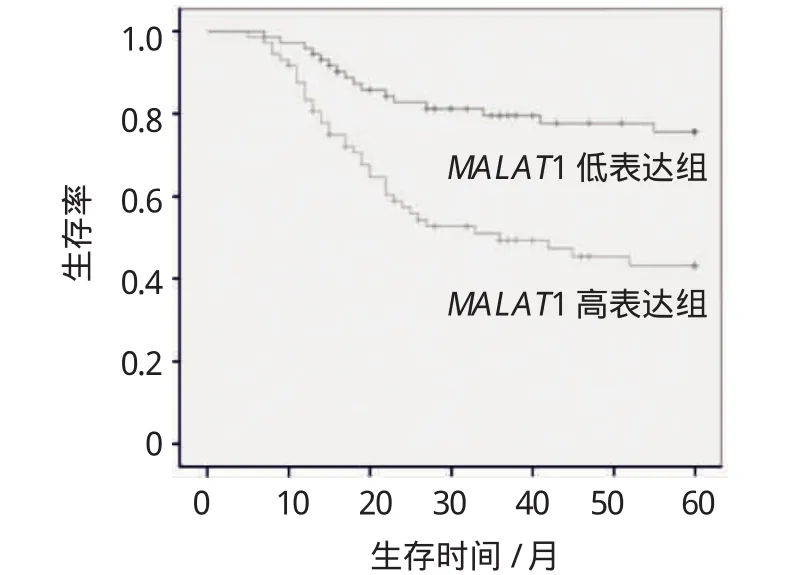
图2 MALAT1表达强度与膀胱癌患者生存时间关系的Kaplan-Meier曲线
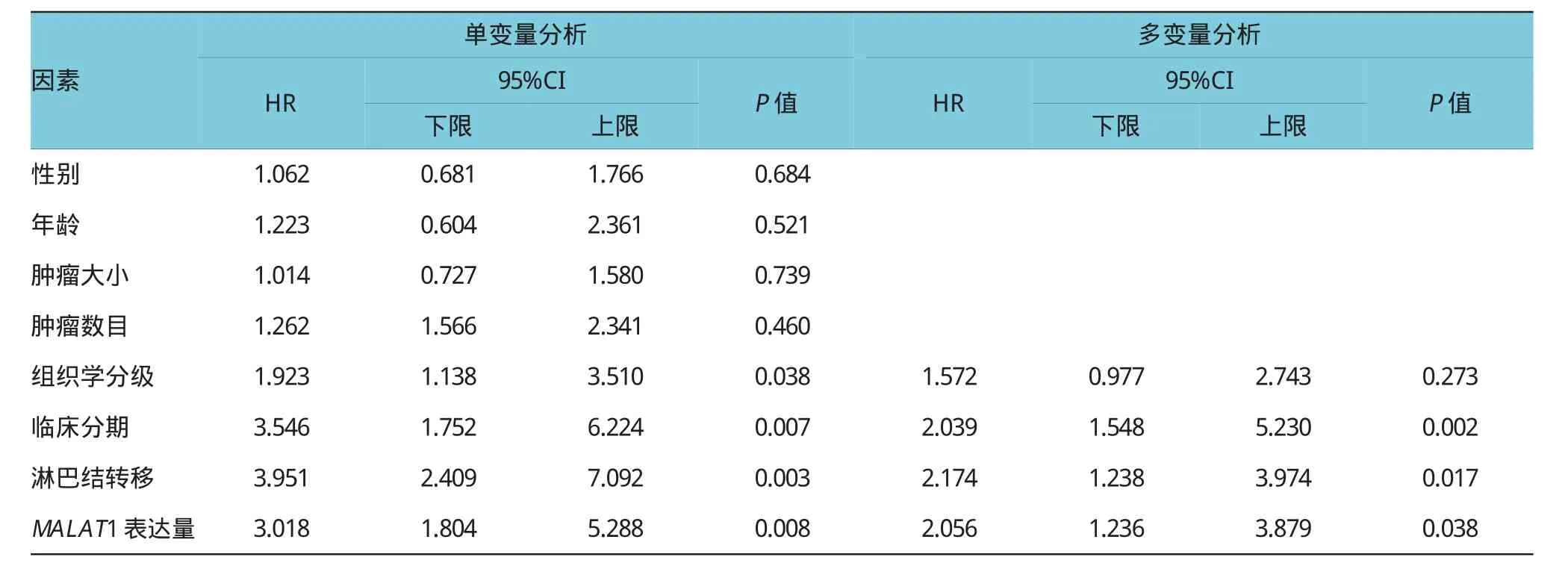
表2 膀胱癌预后因素的多变量Cox比例风险回归模型分析
3 讨论
膀胱癌是一类发生在膀胱黏膜上的恶性肿瘤,也是我国泌尿系统最常见的恶性肿瘤,全球每年约有40万新发病例;在西方,居泌尿系恶性肿瘤的第2位,其发病率仅次于前列腺癌[2]。大部分膀胱癌初诊患者为非肌层浸润性尿路上皮癌,行内镜手术切除肿瘤和膀胱灌注治疗后,一半以上患者在5年内复发,且有进一步发展为肌层浸润性尿路上皮癌的风险。肌层浸润性尿路上皮癌具有较强的侵袭能力,患者的预后较差,5年生存率<50%[9]。因此,进一步探究膀胱癌发生、发展的分子机制,寻找可靠的生物标志物和有效的分子治疗靶点对提高膀胱癌患者生存率的意义重大而深远。
通过对全基因组研究发现,编码功能基因的DNA仅仅占整个基因组的2%,剩余绝大部分的基因组为非编码DNA,而该类DNA转录的产物即为非编码RNA。依据非编码RNA碱基序列长度的不同,可将其分为3种类型,即长链、中链和短链非编码RNA。长度>200nt的即为长链非编码RNA(long non-coding RNA,lncRNA)[10]。过去一直认为lncRNA作为一种非编码RNA,仅仅是基因转录的噪音,而未引起足够重视[11]。然而近年来研究发现,lncRNA广泛参与人体多种生物学过程,具备多种生物学功能,包括转录干扰、基因剪接、转录后调控,基因组印迹、X染色体失活、细胞周期调控、染色质修饰、表观遗传学修饰及免疫应答等[12]。
FAN等[13]在研究TGF-β诱导膀胱癌细胞侵袭转移的机制时发现,TGF-β能够促进MALAT1的表达及上皮间质转化的发生。进一步研究发现MALAT1可与多梳蛋白SUZ12结合,导致上皮型标志基因E-钙黏蛋白表达降低,间质型标志物N-钙黏蛋白表达增加。在干扰MALAT1或SUZ12后,能够抵消TGF-β对细胞的作用。在国内的研究中,王沛等[14]发现干扰MALAT1在膀胱癌细胞株UMUC-3中的表达,能够抑制UMUC-3细胞的增殖、迁移及侵袭。克隆形成结果显示,MALAT1的表达受到干扰后,克隆集落数明显减少;同时采用基因芯片筛选异常表达的基因,发现P53相关信号通路发生明显变化,MEG3、MMP9等基因表达也发生明显变化。综上看来,MALAT1作为一个原癌基因,能增强膀胱癌迁移及(Ta+T1期)MALAT1介导的肿瘤细胞迁移机制,可为分子靶向治疗膀胱癌提供新的理论依据。
有少量文献报道,MALAT1在膀胱癌组织中存在较高表达,尤其是在转移性膀胱癌中[15]。但是在KOHLS等[16]的研究中,其检测泌尿系肿瘤患者血清中的MALAT1表达水平,发现与非肿瘤患者血清中的MALAT1表达水平无明显差异,推测可能是循环系统与实体肿瘤组织存在差异所致。本研究发现,在45例低级别尿路上皮癌中,MALAT1高表达18例,占40.0%(18/45),而在75例高级别尿路上皮癌中,MALAT1高表达46例,占61.3%(46/75),经χ2检验,差异有统计学意义(χ2=5.143,P=0.023),高级别尿路上皮癌对比低级别尿路上皮癌,具有更高的MALAT1表达率。在52例非肌层浸润性膀胱癌(Ta+T1期)中,MALAT1高表达20例,占38.5%(20/ 52),而在68例肌层浸润性膀胱癌(T2~T4期)中,MALAT1高表达44例,占64.7%(44/68),经χ2检验,差异有统计学意义(χ2=8.154,P=0.004),MALAT1在非肌层浸润性膀胱癌(Ta+T1期)中的表达率低于在肌层浸润性膀胱癌(T2~T4期)中的表达率。在92例无淋巴结转移的膀胱癌组织中,MALAT1高表达43例,占46.7%(43/92),而在28例有淋巴结转移的膀胱癌组织中,MALAT1高表达21例,占75.0%(21/ 28),经χ2检验,差异有统计学意义(χ2=6.889,P= 0.009),有淋巴结转移的膀胱癌比无淋巴结转移的膀胱癌具有更高的MALAT1表达率。可见,高表达的MALAT1与高组织学分级、高临床分期和淋巴结转移阳性相关。这也提示MALAT1在膀胱癌进展中发挥重要的作用。
另外,Kaplan-Meier曲线显示MALAT1高表达组的总生存期短于低表达组(P<0.05),结合Cox回归多变量分析的结果进一步表明,高表达量的MALAT1为影响膀胱癌患者术后总生存期的独立危险因子。该研究结果为深入探索膀胱癌的发病机理提供较好的补充,也为今后临床上膀胱癌的检测和治疗提供新的生物标志物及分子治疗靶点。
[1]韩苏军,张思维,陈万青,等.中国膀胱癌发病现状及流行趋势分析[J].癌症进展,2013,11(1):89-95.
[2]EDWARDS B K,NOONE A M,MARIOTTO A B,et al.Annual report to the nation on the status of cancer,1975-2010,featuring prevalence of comorbidity and impact on survival among persons with lung,colorectal,breast,or prostate cancer[J].Cancer, 2014,120(9):1290-1314.
[3]JI P,DIEDERICHS S,WANG W,et al.MALAT-1,a novel noncoding RNA,and thymosin β4 predict metastasis and survival in early-stage non-small cell lung cancer[J].Oncogene,2003, 22:8031-8041.
[4]SCHMIDT L H,SPIEKER T,KOSCHMIEDER S,et al.The long noncodingMALAT-1RNAindicatesapoorprognosisin non-smallcelllungcancer and induces migration and tumor growth[J].J Thorac Oncol,2011,6(12):1984-1992.
[5]LAI M C,YANG Z,ZHOU L,et al.Long non-coding RNA MALAT1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplantation[J].Med Oncol,2012, 299(3):1810-1816.
[6]WANG J Y,WANG H M,ZHANG Y,et al.Mutual inhibition between YAPand SRSF1maintainslong non-coding RNA, MALAT1-induced tumourigenesis in liver cancer[J].Cellular Signalling,2014,26(5):1048-1059.
[7]ZHAO Z,CHEN C,LIU Y,et al.17β-Estradiol treatment inhibitsbreast cell proliferation,migration and invasion by decreasing MALAT-1 RNA level[J].Biochem Biophys Res Commun, 2014,445(2):388-393.
[8]PANG E J,YANG R,FU X B,et al.Overexpression of long noncoding RNA MALAT1 is correlated with clinical progression and unfavorable prognosis in pancreatic cancer[J].Tumour Biol, 2015,36(4):2403-2407.
[9]ZHANG Q,SU M,LU G,et al.The complexity of bladder cancer:long noncoding RNAs are on the stage[J].Mol Cancer,2013, 12(1):1-8.
[10]NAGANO T,FRASER P.No-nonsense functions for long noncoding RNA[J].Cell,2011,142(2):178-181.
[11]GUTSCHNER T,DIEDERICHS S.The hallmarks of cancer:a long noncoding RNA point of view[J].RNA Biol,2012,9:703-719.
[12]PANDEY R R,KANDURI C.Transcriptional and posttranscriptional programming by long noncoding RNAs[J].Prog Mol Subcell Biol,2011,51:1-27.
[13]FAN Y,SHEN B,TAN M,et al.TGF-β induced upregulation of malat1 promotes bladder cancer metastasis by associating with suz12[J].Clin Cancer Res,2014,20(6):1531-1541.
[14]王沛,江春,何旺,等.MALAT1对膀胱癌UMUC3细胞功能的印象及下游基因的筛选[J].岭南现代临床外科,2014,14(2):122-126.
[15]HAN Y,LIU Y,NIE L,et al.Inducing cell proliferation inhibition,apoptosis,and motility reduction by silencing long noncoding ribonucleic acid metastasis-associated lung adenocarcinoma transcript 1 in urothelial carcinoma of the bladder[J].Urology,2013,81(1):201-207.
[16]KOHLS K,SCHMIDT D,HOLDENRIEDER S,et al.Detection of cell-free lncRNA in serum of cancer patients[J].Urologe A, 2015,54(6):819-825.
(童颖丹编辑)
Expression of metastasis-associated lung adenocarcinoma transcript 1 in bladder cancer and its clinical significance
Cheng-yu Zhang1,Yu Cui2,Jin-bo Chen2,Chao Li2
(1.Department of Operation;2.Department of Urology,Xiangya Hospital,Central South University,Changsha,Hunan 410008,China)
Objective To study the expression of long non-coding RNA(lncRNA)metastasis-associated lung adenocarcinoma transcript 1(MALAT1)and explore its relationship with prognosis in bladder cancer patients.Methods A total of 120 bladder cancer pathological specimens were obtained from Xiangya Hospital,and the expression ofMALAT1was tested byin situhybridization.The association betweenMALAT1expression and overall survival of bladder cancer patients was evaluated by Kaplan-Meier analysis and log-rank tests.To identify the risk factors associated with overall survival of bladder cancer patients,several factors were evaluated by Cox univariate and multivariate analyses.Results HighMALAT1expression was associated with advanced histological grade,high tumor stage and positive lymph-node metastasis(P<0.05),and not related to gender,age,tumor size or tumor number(P>0.05).Kaplan-Meier survival analysis indicated that the overall survival time of the bladder cancer patients with highMALAT1expression was significantly shorter than that of the patients with lowMALAT1expression.Multivariate analysis showed that high tumor stage,positive lymph-node metastasis and highMALAT1expression were the independent risk factors for prognosis of bladder cancer.Conclusions The expression ofMALAT1is obviously increased in bladder cancer patients with advanced histological grade,high clinical stage and lymph node metastasis.Therefore,highMALAT1 expression can be served as an independent risk factor for prognosis of bladder cancer.
long non-coding RNA;metastasis-associated lung adenocarcinoma transcript 1;bladder cancer
R 737.14
B
10.3969/j.issn.1005-8982.2016.17.025
1005-8982(2016)17-0116-05
2016-06-01
李超,E-mail:li4307chao@126.com

