骨髓间充质干细胞移植对大鼠急性肺损伤的保护作用及其机制研究
沈鹏
(天津市第一中心医院风湿免疫科,天津300192)
骨髓间充质干细胞移植对大鼠急性肺损伤的保护作用及其机制研究
沈鹏
(天津市第一中心医院风湿免疫科,天津300192)
目的分析骨髓间充质干细胞(MSC)移植对脂多糖(LPS)急性肺损伤(ALI)大鼠模型中炎症因子的影响及其作用机制。方法选取4只4个月龄的无特定病原体(SPF)级雄性C57BL/6J小鼠,用于MSC培养。另选取45只SPF级雄性Sprague Dawley大鼠,随机分为5组,每组9只:MSC对照组(A组)、MSC低剂量组(B组)、MSC高剂量组(C组)、内毒素组(D组)、正常对照组(E组)。于6、24和72h分别留取每组中3只大鼠的血液标本与肺组织,分别给予血气分析,并测定肺组织中的肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)的含量,同时测定肺湿重/干重比值,观察肺组织病理学变化。结果3个时间点比较,D组IL-1β、TNF-α水平及肺湿重/干重比值高于E组,差异有统计学意义(P<0.05);B组与C组的血气指标、IL-1β、TNF-α水平及肺组织结构改善优于D组,差异有统计学意义(P<0.05);A组与E组各项指标比较,差异无统计学意义(P>0.05)。结论MSC移植对LPS ALI大鼠有明显保护作用,可明显降低组织中炎症因子水平,缓解炎症反应,改善血气指标,且无明显毒副作用。
骨髓间充质干细胞;移植;大鼠模型;急性肺损伤;炎症因子
急性肺损伤(acute lung injury,ALI)是临床上常见的一种危急重症,病情严重者甚至会出现急性呼吸窘迫综合征,病死率极高,占30%~40%[1]。该病的发病机制尚未明确,但一般认为是肺内抗炎促炎平衡失调所致[2]。目前,临床上对该病尚无有效治疗措施,常用方法包括机械通气、纤溶与凝血失衡改善、抗氧化、抗炎等,治疗效果有限[3]。最近文献报道,骨髓间充质干细胞(mesenchymal stem cells,MSC)具有再生修复、免疫调节、抗氧化、抗凋亡等作用[4],且已用于治疗心、脑、肾及全身炎症反应性疾病,并取得良好的效果[5]。但MSC在急性肺损伤中的作用及其机制尚无明确结论,需进一步验证。本实验在成功建立大鼠脂多糖(lipopolysaccharide,LPS)ALI模型的基础上,采取尾静脉注射MSC,观察其对脂多糖ALI大鼠白细胞介素-1β(Interleukine-1 beta,IL-1β)、人肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)等炎症因子水平及大鼠血气指标等的影响,并探讨其可能的作用机制。
1 材料与方法
1.1实验材料
1.1.1实验动物4只无特定病原体(specefic pathogen free,SPF)级健康C57BL/6J雄性小鼠,年龄4个月,体重20~25 g,用于骨髓间充质干细胞培养。45只SPF级健康雄性Sprague Dawley大鼠,体重180~220 g。所有实验动物由天津中医药大学实验动物中心提供。
1.1.2实验试剂IL-1β试剂盒(武汉华美生物工程有限公司),TNF-α试剂盒(武汉博士德生物科技公司),胎牛血清(美国Hyclone公司),0.02 mol/L乙二胺四乙酸+0.25%胰酶(美国Gibco公司),低糖改良Eagle培养基(dulbecco's modified eagle medium,DMEM)培养基(美国Gibco公司),内毒素LPS(美国Sigma公司)。
1.2方法
1.2.1制备MSC根据既往文献[6]标准进行小鼠MSC培养及鉴定。无菌获取SPF级雄性C57BL/6J小鼠的胫骨、股骨,取出骨髓,制成单细胞悬液,1 200 g离心3 min,选取含100 IU/ml双抗的低糖DMEM及10%胎牛血清对基重悬细胞予以培养,将浓度调至1×108/ml,并在25 cm2培养瓶中进行接种,置于二氧化碳CO2培养箱中培养,培养箱的饱和湿度控制在37℃左右,5%CO2细胞融合达80%~90%后,经0.25%胰蛋白酶消化,获取较为均质的MSC,并按1∶2传至Ⅳ代。MSC流式细胞仪分析CD34阴性(0.9%)、CD105阳性(95.3%),可见细胞纯度>95%。见图1。
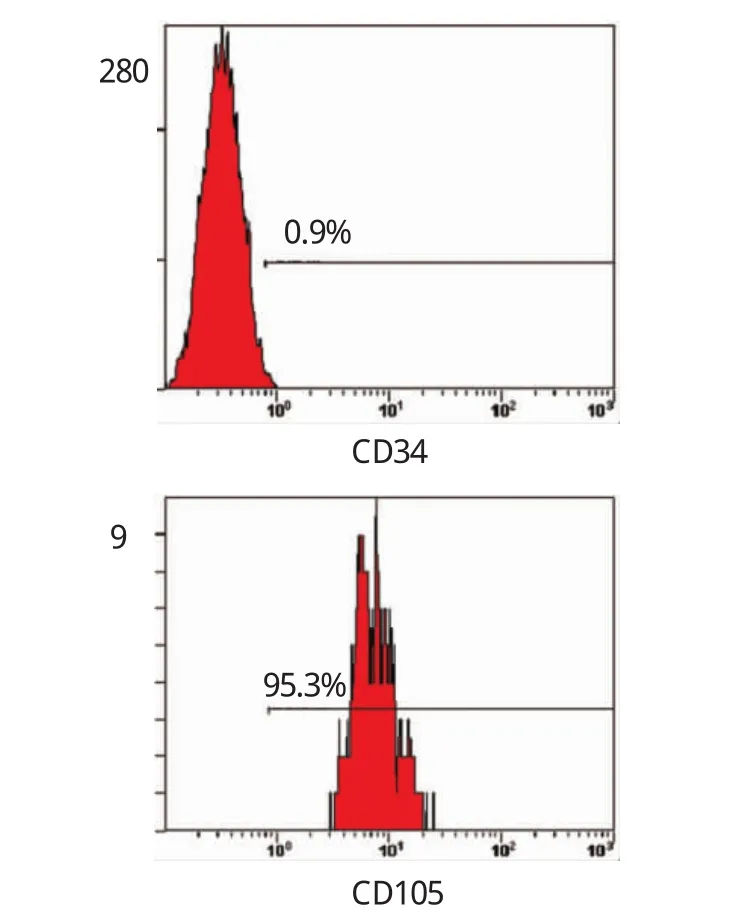
图1 流式细胞分析第Ⅳ代MSC的表型
1.2.2建立大鼠ALI模型45只SD大鼠随机划分5组,每组9只:MSC对照组(A组)、MSC低剂量组(B组)、MSC高剂量组(C组)、内毒素组(D组)、正常对照组(E组)。A组MSC 1×106个/ml 0.5ml经尾静脉注射;B组MSC 1×106个/ml 0.5ml+LPS 5mg/kg经尾静脉注射;C组MSC 1×106个/ml 0.5 ml+LPS 5 mg/kg经尾静脉注射;D组LPS 5 mg/kg经尾静脉注射;E组尾静脉注射等量生理盐水。于造模后6、24和72 h处死大鼠,获取标本,每个时间各组处死3只大鼠。
1.2.3收集与处理血及肺组织标本腹主动脉采血后立即予以血气分析。取右肺上叶,在多聚甲醛中置入右肺下叶组织,观察组织形态学。取大鼠余肺组织,生理盐水洗净,置于-70℃冰箱内液氮冷冻保存。
1.2.4肺湿重/干重比值取右肺上叶,取量控制在250~300mg,吸净肺表面血液,分析天平测湿重后,置入80℃烘烤,48h后测干重。
1.2.5肺组织形态学取右肺下叶组织,4%多聚甲醛固定,石蜡包埋、切片,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,常规光镜观察、照相。
1.2.6测定肺组织中IL-1β和TNF-α利用酶联免疫吸附试验法检测肺组织IL-1β、TNF-α含量。
1.3统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较用方差分析,方差齐则两两比较用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1肺组织病理学改变
光镜观察发现,A组肺泡腔内无明显炎症细胞浸润与红细胞渗出,间质水肿不明显,肺泡结构完整;B组肺泡腔内炎症细胞、红细胞多量渗出,部分肺泡结构破坏;C组肺泡腔内可见少量中性粒细胞、红细胞浸润,一部分肺泡间隔宽度稍微增加,大部分肺组织完整;D组肺泡腔内出现大量中性粒细胞、红细胞,可见浆液性渗出,肺组织水肿严重,大部分肺泡结构破坏;E组肺泡腔内没有发现炎症细胞浸润,支气管黏膜上皮处于完整状态,肺泡壁薄,肺组织结构十分清晰。A组和E组肺组织病理改变一致,属正常肺组织,故笔者只留取A组肺组织的镜下图。见图2。
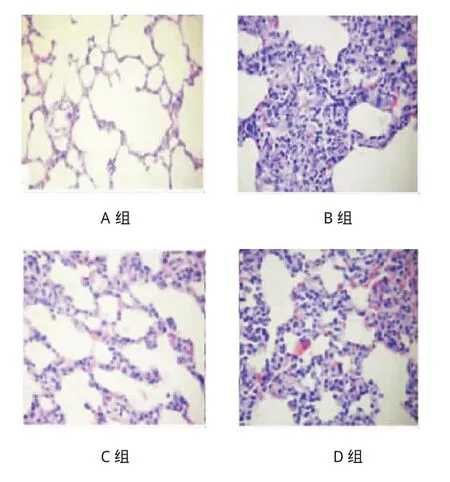
图2 肺组织病理学改变(HE染色×200)
2.2肺湿重/干重比值
5组各时间肺湿重/干重比值比较,经方差分析,差异有统计学意义(P<0.05)。其中两两结果比较,D组6、24和72 h肺湿重/干重比值高于E组,差异有统计学意义(P<0.05);D组6h肺湿重/干重比值与B、C组比较,差异无统计学意义(P>0.05);D组24和72h肺湿重/干重比值高于B、C组,差异有统计学意义(P<0.05);A组与E组比较,差异无统计学意义(P>0.05)。见表1。
表1 各组肺湿重/干重比值比较(±s)

表1 各组肺湿重/干重比值比较(±s)
注:1)与D组比较,t=12.154,P=0.004;2)与D组比较,t=3.497,P=0.046;3)与D组比较,t=9.367,P=0.036;4)与D组比较,t=19.253,P=0.002;5)与E组比较,t=23.790,P=0.001;6)与E组比较,t=39.098,P=0.000;7)与E组比较,t=13.843,P=0.002
72h湿重/干重比值A组3.91±0.314.12±0.284.17±0.25 B组5.11±0.344.77±0.391)4.62±0.312)C组5.04±0.304.69±0.373)4.43±0.144)D组5.32±0.235)5.19±0.166)4.98±0.157)E组4.02±0.263.96±0.224.16±0.13 F值25.37119.67635.643 P值0.0390.0460.021组别6h湿重/干重比值24h湿重/干重比值
表25 组不同时间血气分析比较(mmHg±s)
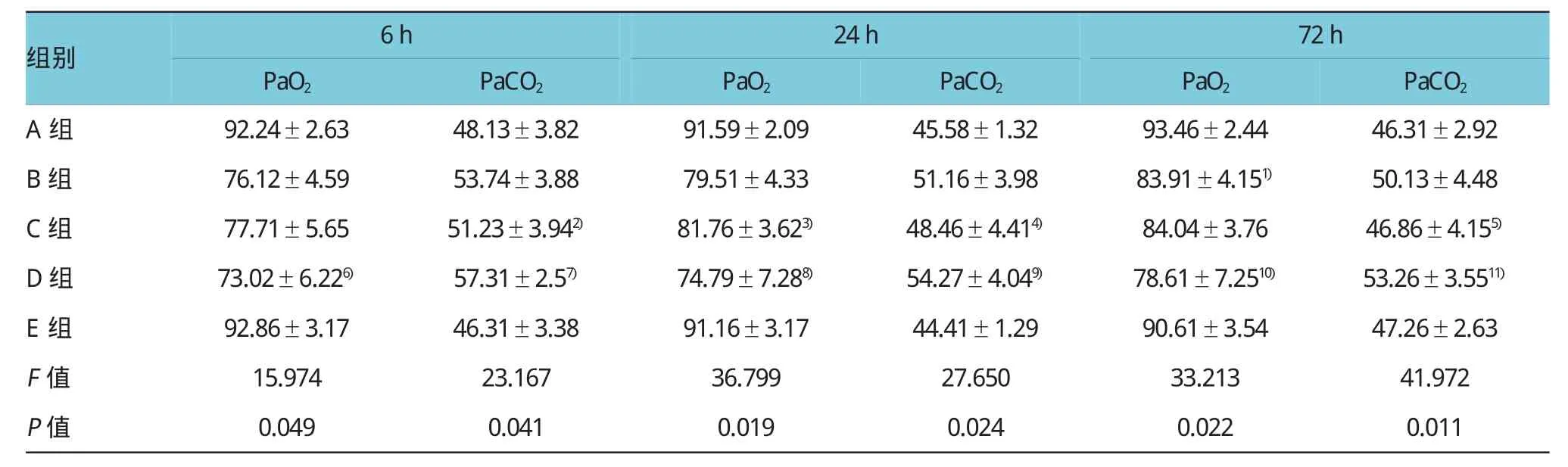
表25 组不同时间血气分析比较(mmHg±s)
注:1)与D组比较,t=23.445,P=0.001;2)与D组比较,t=19.716,P=0.002;3)与D组比较,t=36.643,P=0.000;4)与D组比较,t=6.308,P= 0.043;5)与D组比较,t=38.042,P=0.000;6)与E组比较,t=41.097,P=0.000;7)与E组比较,t=7.695,P=0.040;8)与E组比较,t=21.474,P=0.001;9)与E组比较,t=43.983,P=0.000;10)与E组比较,t=47.485,P=0.000;11)与E组比较,t=17.632,P=0.002
组别6h24h72h PaO2PaO2PaO2PaCO2A组92.24±2.6348.13±3.8291.59±2.0945.58±1.3293.46±2.4446.31±2.92 B组76.12±4.5953.74±3.8879.51±4.3351.16±3.9883.91±4.151)50.13±4.48 C组77.71±5.6551.23±3.942)81.76±3.623)48.46±4.414)84.04±3.7646.86±4.155)D组73.02±6.226)57.31±2.57)74.79±7.288)54.27±4.049)78.61±7.2510)53.26±3.5511)E组92.86±3.1746.31±3.3891.16±3.1744.41±1.2990.61±3.5447.26±2.63 F值15.97423.16736.79927.65033.21341.972 P值0.0490.0410.0190.0240.0220.011 PaCO2PaCO2
2.3血气分析
5组各时间动脉血氧分压(partial pressure of oxygen in arterial blood,PaO2)、动脉血二氧化碳分压(partial pressure of carbon dioxide in arterial blood,PaCO2)比较,经方差分析,差异有统计学意义(P<0.05)。其中两两比较结果,D组PaCO2高于E组,差异有统计学意义(P<0.05);D组6、24和72h PaCO2较C组升高,差异有统计学意义(P<0.05);D组PaO2低于E组,差异有统计学意义(P<0.05);D组24和72 h PaO2与C组比较,差异有统计学意义(P<0.05);B组72h PaO2与D组比较,差异有统计学意义(P<0.05);A组PaCO2、PaO2与E组比较,差异无统计学意义(P> 0.05)。见表2。
2.4肺组织IL-1β、TNF-α水平
5组各时间IL-1β、TNF-α水平比较,经方差分析,差异有统计学意义(P<0.05)。其中两两比较结果,D组较A组6、24和72h肺组织IL-1β、TNF-α水平上升,差异有统计学意义(P<0.05);D组6、24和72 h肺组织IL-1β、TNF-α水平高于B、C组,差异有统计学意义(P<0.05);A组6、24和72h肺组织IL-1β、TNF-α水平与E组比较,差异无统计学意义(P>0.05)。见表3。
表35 组不同时间肺组织IL-1β、TNF-α水平比较(mg/L±s)

表35 组不同时间肺组织IL-1β、TNF-α水平比较(mg/L±s)
注:t1、P1值:A组与E组比较;t2、P2值:B组与D组比较;t3、P3值:C组与D组比较;t4、P4值:D组与E组比较
组别6h24h72h TNF-αTNF-αTNF-αIL-1β A组108.01±28.0274.26±27.28114.44±25.4569.23±24.26112.34±30.5274.01±25.57 B组266.53±24.58250.15±41.78242.93±32.51235.78±39.92211.48±30.79186.81±34.88 C组233.14±42.73205.93±37.77215.31±41.34184.41±33.17178.68±36.69168.81±32.49 D组341.21±36.32309.25±37.38304.01±32.58279.26±35.72281.98±36.13231.22±34.37 E组83.73±35.9566.18±16.6187.19±29.4762.01±19.9181.28±32.6465.28±18.44 F值35.17650.28519.74828.77464.32354.379 P值0.0200.0090.0450.0230.0000.004 t1值16.4536.86236.65426.2983.45656.732 P1值0.0030.0380.0000.0010.0450.000 t2值11.73657.52745.7904.62925.90120.008 P2值0.0050.0000.0000.0470.0010.003 t3值53.21379.43035.27032.57523.42513.873 P3值0.0000.0000.0000.0000.0010.004 t4值46.46916.93157.84319.00736.65463.380 P4值0.0000.0030.0000.0030.0000.000 IL-1βIL-1β
3 讨论
ALI的病理特征为多形核白细胞积聚、微血管通透性增加及非心源性肺水肿[7]。其临床表现主要为进行性低氧血症与呼吸窘迫[8];而在肺部影像学上的表现主要为非均一性的渗出性病变[9]。关于其发病机制,现阶段普遍认为多种致病因素可激活全身炎症反应或者肺组织炎症反应,多种炎症细胞穿过上皮细胞屏障与内皮细胞屏障进入肺泡腔内,大量释放细胞因子与毒素,导致肺氧合功能障碍、肺水肿及肺泡-毛细血管屏障通透性增加[10]。目前,有较多学者对于ALI的治疗进行深入研究,主要治疗措施仍是针对缺氧对症处理[11],对于ALI的失控性或失平衡性炎症,临床仍缺乏行之有效的治疗策略[12]。另外,中医药对于该病的发病机制及治疗也有一定进展,从中医角度,ALI属于暴喘、喘脱等范畴[13],病理基础为肺不主气[14],目前某些中药或复方制剂从抑制炎症反应、调节免疫功能、抗氧化等方面着手,对该病的治疗有一定疗效[15]。尽管如此,该病仍是一种极危重症,有极高的致死率,因此需要有效、可靠的治疗方法来提高临床疗效。
目前,干细胞移植术对危重疑难系统系疾病的治疗效果逐渐崭露头角[16],是国内外学者的研究热点。干细胞是一种具有多向分化潜能的细胞,其自我增值能力强,可归巢至组织、修复组织损伤[17]。据报道,某些干细胞可分泌细胞因子和生长因子,该因子也可促进组织修复[18]。现阶段临床上及科研中常用的干细胞有两种,即胚胎干细胞和成体干细胞,但前者因伦理因素及致瘤风险使其应用受到限制[19],成体干细胞因不受限制则有广泛的应用前景。MSC属于干细胞的一种,主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ蛋白、MHCⅠ蛋白表达低,故其免疫原性低,异体干细胞移植耐受性高[20]。目前已有较多关于MSC的临床应用研究,如自身免疫病[21]、心脏疾病、骨骼疾病等[22]。
在体内或体外特定条件诱导下,MSC可向支气管上皮和肺泡上皮细胞分化[23]。最新研究发现,MSC对急性肺损伤具有修复功效,可以有效降低髓过氧化酶活性、肺湿干重比值[24]。张峰等[25]探讨骨髓间充质干细胞移植对内毒素诱发急性肺损伤模型兔的保护作用,发现与对照组比较,MSC移植组家兔支气管肺泡灌洗液中性粒细胞数目、蛋白含量明显升高,湿干比明显降低,且病理变化较轻。郑凯等[26]建立急性放射性肺损伤大鼠模型,观察MSC移植对其治疗作用,结果表明,骨髓间充质干细胞可以迁移到放射性损伤的肺组织,促进放射性肺损伤组织的修复,其治疗机制可能与MSC抑制炎症反应、抗氧化、减轻肺组织纤维化等有关。本研究中,MSC移植组6h肺湿重/干重比值与对照组比较,差异无统计学意义;移植后24和72h肺湿重/干重比值下降,表示MSC移植有利于降低肺泡-毛细血管膜通透性,可抑制肺泡、肺间质中血浆渗透,有利于缓解肺水肿。除此之外,血气分析中,MSC高剂量组PaO2、PaCO2改善情况明显优于对照组,间接表明干细胞移植有利于缓解肺水肿。6h时MSC的治疗作用不明显,可能是因为作用时间短,其修复能力未显现。相关研究报道中提出,干细胞移植可缓解肺水肿,主要在于干细胞分泌血管生成素-1可抑制肌动蛋白结构破坏,但是现阶段具体机制尚未明确。另外,本研究结果显示,与对照组比较,MSC高剂量组6、24和72 h肺组织IL-1β、TNF-α水平降低,表明MSC移植有利于缓解急性肺损伤炎症反应。A组与E组(即MSC对照组和正常对照组)各个指标比较,差异无统计学意义,表明高剂量干细胞的毒副作用不明显。
综上所述,MSC移植对大鼠LPS急性肺损伤有一定的治疗作用,有利于减轻炎症反应,无明显毒副反应。为临床利用MSC治疗ALI提供实验基础和理论依据,相信随着研究的不断深入,MSC终将应用于临床,成为治疗ALI的有效手段。
[1]CHU C,RE N H,XU N,et al.Eupatorium lindleyanum DC. sesquiterpenes fraction attenuates lipopolysaccharide-induced acute lung injury in mice[J].J Ethnopharmacol,2016,185:263-271.
[2]吴海青,李涛平,黄丽.骨髓间充质干细胞对脂多糖急性肺损伤大鼠炎症因子的影响[J].实用医学杂志,2012,3(12):1971-1974.
[3]贾雪梅,杨光福.急性肺损伤/急性呼吸窘迫综合征发病机制的研究进展[J].中国实用医药,2011,6(2):242-244.
[4]蔡存良,文仲光,周岗,等.骨髓间充质干细胞移植对急性肺损伤大鼠血浆TNF-α、IL-6水平的影响[J].感染.炎症.修复,2006,7(2): 98-101.
[5]TAN Z,SU Z Y,WU R R,et al.Immunomodulative effects of mesenchymalstem cells derived from human embryonic stem cells in vivo and in vitro[J].J Zhejiang Univ Sci B,2011,12(1): 18-27.
[6]李晓峰,赵劲民,苏伟,等.大鼠骨髓间充质干细胞的培养与鉴定[J].中国组织工程研究与临床康复,2011,15(10):1721-1725.
[7]MOON K M,HAN M S,RIM C B,et al.Transfusion related acute lung injury after cesarean section in a patient with HELLP syndrome[J].Korean J Fam Med,2016,37(1):71-74.
[8]CASSIANO SILVEIRA A P,VENTO D A,ALBUQUERQUE A A,et al.Effects of methylene blue in acute lung injury induced by oleic acid in rats[J].Ann Transl Med,2016,4(1):8.
[9]燕明宇,陈亮,熊文激,等.恶性疾病化疗后急性肺损伤的影像学表现[J].中国实验诊断学,2010,5:745-746.
[10]吴海青,李涛平,徐健,等.间充质干细胞对脂多糖诱导急性肺损伤大鼠亲环素A表达的影响[J].国际药学研究杂志,2012,9(5): 425-429.
[11]钱桂生.急性肺损伤和急性呼吸窘迫综合征的诊断与治疗[J].解放军医学杂志,2009,34(4):371-373.
[12]刘涛,任成山.炎症介质在急性肺损伤/急性呼吸窘迫综合征发病机制中的作用[J].中华肺部疾病杂志:电子版,2013,6(3):265-269.
[13]陈慧婷,白丽,刘灵.人工牛黄对急性肺损伤大鼠HIF-la、NF-KB p65的干预作用研究[J].光明中医,2015,2:264-266.
[14]肖光华,吴敏,宓越群.急性肺损伤中医病机及治法探讨[J].上海中医药杂志,2008,42(10):80-82.
[15]曾明辉,谭正怀.5种中药制剂对急性肺损伤小鼠的保护作用[J].华西药学杂志,2015,30(3):305-307.
[16]黄前川,张新华.多发性骨髓瘤干细胞移植术后伴异常蛋白带与疗效和预后的相关性[J].实用癌症杂志,2016,31(1):169-170.
[17]强勇,梁贵友.间充质干细胞移植治疗急性肺损伤的研究进展[J].中华细胞与干细胞杂志:电子版,2014,4(3):56-60.
[18]翟晶磊,曹宁,岳文,等.人脐带间充质干细胞通过分泌IL-6介导冈田酸对SH-SY5Y细胞毒性的保护作用[J].生物化学与生物物理进展,2016,43(2):141-149.
[19]SONG Z,CAI J,LIU Y,et al.Efficient generation of hepatocyte-like cells from human induced pluripotent stem cells[J]. Cell Research,2009,19(11):1233-1242.
[20]LEE J W,KRASNODEMBSKAYA A,MCKENNA D H,et al. Therapeutic effects of human mesenchymal stem cells in ex vivo human lungs injured with live bacteria[J].Am JRespir Crit Care Med,2013,187(7):751-760.
[21]阮光萍,王金祥,杨建勇,等.系统性红斑狼疮小鼠骨髓间充质干细胞的成骨、成脂分化能力下降[J].中国组织工程研究,2014,18(1): 1-6.
[22]李瑞琦,张国平,任立中,等.骨髓间充质干细胞治疗股骨头坏死的评价[J].中国组织工程研究,2013,17(35):6327-6332.
[23]顾问,郭雪君,徐卫国.间充质干细胞治疗呼吸系统疾病的研究进展[J].中华肺部疾病杂志:电子版,2016,9(1):82-86.
[24]张继峰,张紫琦,雒晓甜,等.骨髓间充质干细胞对脓毒症急性肺损伤大鼠肺泡巨噬细胞NF-κB的调控[J].中国组织工程研究, 2015,19(10):1556-1561.
[25]张峰,程瑾,楚东岭,等.骨髓间充质干细胞移植对家兔急性肺损伤的保护作用[J].中国组织工程研究与临床康复,2009,13(27): 5225-5228.
[26]郑凯,赵兴旺,吴卫真,等.骨髓间充质干细胞移植治疗大鼠急性放射性肺损伤[J].中国组织工程研究,2014,50:8122-8129.
(童颖丹编辑)
Protective effect of bone marrow mesenchymal stem cell transplantation on acute lung injury in rats and its mechanism
Peng Shen
(Department of Rheumatology,the First Central Hospital of Tianjin,Tianjin 300192,China)
Objective To analyze the impact of bone marrow mesenchymal stem cell(MSC)transplantation on inflammatory factors of rat model with lipopolysaccharide(LPS)-induced acute lung injury(ALI)and the mechanism.Methods Four 4-month SPF male C57BL/6J mice were recruited for bone marrow MSC.In addition,45 SPF male SD rats were randomly divided into five groups as follows:MSC control group(group A),low-dose MSC group(group B),high-dose MSC group(group C),endotoxin group(group D)and normal control group(group E).At 6,24 and 72 h,blood samples and lung tissue of three rats from each group were collected.Blood gas analysis,TNF-α and IL-1β in lung tissue,and lung wet weight/dry weight were detected.Pathological changes of lung tissue were observed.Results At 6,24 and 72 h,TNF-α and IL-1β levels and lung wet weight/dry weight ratio of the group D were significantly higher than those of the group E(P<0.05);blood gas indexes,TNF-α and IL-1β levels and the improvement of lung structure of the groups B and C were significantly superior to those of the group D(P<0.05);but there was no significant difference in any of the above indexes between the group A and the group E(P>0.05).Conclusions MSC transplantation has significantly protective effects on acute lung injury in rats,can significantly reduce the tissue levels of inflammatory factors,relieve inflammation,improve blood indicators,and has no obvious side effects.
mesenchymal stem cell;transplant;rat;acute lung injury;inflammatory cytokine
R 563
A
10.3969/j.issn.1005-8982.2016.17.003
1005-8982(2016)17-0013-06
2016-04-07

