沉默人宫颈癌细胞Hela中FAL1的表达对人宫颈癌细胞Hela增殖、侵袭及迁移的影响*
石兴源,余宏伟,黄文瑾,廖志伟,贾保昌,罗凯
(1.广州医科大学附属肿瘤医院,广东广州510095;2.广州医科大学肿瘤研究所,广东广州510095)
沉默人宫颈癌细胞Hela中FAL1的表达对人宫颈癌细胞Hela增殖、侵袭及迁移的影响*
石兴源1,余宏伟1,黄文瑾1,廖志伟1,贾保昌1,罗凯2
(1.广州医科大学附属肿瘤医院,广东广州510095;2.广州医科大学肿瘤研究所,广东广州510095)
目的探讨沉默人宫颈癌细胞Hela中功能基因组趋化基因(FAL1)的表达对人宫颈癌细胞Hela增殖、侵袭及迁移的影响。方法设计并合成FAL1的siR NA片段转染Hele细胞分别命名为FAL1-siR NA/Hela细胞组和FAL1-NC/Hela细胞组。比较两组Hela细胞转染FAL1-siR NA后的FAL1 mR NA相对表达量、光密度(OD)值、穿膜细胞数、迁移距离的差异。结果FAL1-siR NA/Hela细胞的FAL1 mR NA相对表达量(0.49± 0.21)低于FAL1-NC/Hela细胞(1.34±0.13),差异有统计学意义(P<0.05)。FAL1-siR NA/Hela细胞在72、96和120h的OD值分别为(2.04±0.15)、(2.43±0.08)和(2.48±0.15),低于FAL1-NC/Hela细胞的(2.36±0.18)、(3.11±0.27)和(3.44±0.26),差异有统计学意义(P<0.05);FAL1-siR NA/Hela细胞的穿膜细胞数(126.18± 8.75)个低于FAL1-NC/Hela细胞(208.54±6.75)个,差异统计学意义(P<0.05);FAL1-siR NA/Hela细胞在24、48和72h的细胞迁移距离为(6.34±1.48)、(11.65±2.52)和(15.08±3.19)μm低于FAL1-NC/Hela细胞的(11.42± 2.73)、(19.56±4.33)和(27.71±5.12)μm,差异有统计学意义(P<0.05)。结论FAL1-siR NA/Hela细胞的FAL1 mR NA相对表达量下降,进而抑制Hela细胞的增殖、侵袭和迁移能力。
宫颈癌;Hela细胞;功能基因组趋化基因siR NA;增殖;侵袭;迁移
R 737.33
A
宫颈癌是临床上较为常见的妇科恶性肿瘤,虽然宫颈人乳头状瘤病毒(human papillomavirus,HPV)筛查和细胞学筛查,如膜式液基检测等可以提高宫颈癌的早期筛查成功率,但近年来我国宫颈癌的发病率仍然呈上升趋势[1]。手术是治疗宫颈癌的主要方式,广泛全子宫切除术联合盆腔或者髂总淋巴结清扫虽然可以提高患者术后的生存时间,但17.5%的宫颈癌患者术后半年内复发,且临床分期越晚,复发和局部转移阳性率越高[2-3]。
肿瘤分子生物学研究表明,基因水平的编码异常或者非编码基因产物的调控失衡,往往可以导致细胞增殖、侵袭能力的增强[4]。长链非编码RNA(long noncoding RNA,lncRNA)不仅承担遗传信息中间载体的辅助性角色,同时更多地承担各种调控功能。相关研究表明,lncRNA在卵巢癌、肺癌及乳腺癌等恶性肿瘤的早期发生、发展中具有重要的介导作用[5-6],但对于功能基因组趋化基因(functional genomic approach identifies,FAL1)标志物的异常表达与宫颈癌的增殖和侵袭能力的改变研究不足。本研究通过基因敲除进而沉默FAL1的表达,从而探讨FAL1对宫颈癌细胞株Hela的影响,为临床上控制宫颈癌术后复发和转移提供理论基础。
1 材料与方法
1.1细胞来源
Hela细胞购置于上海交通大学医学院细胞中心,FAL1-siRNA/Hela细胞和FAL1-NC/Hela细胞由广州医科大学基础实验室转染、鉴定和保存。设计并合成FAL1的siRNA片段转染Hela细胞分别命名为FAL1-siRNA/Hela细胞组和FAL1-NC/Hela细胞组。
1.2细胞培养和转染方法
Hela细胞用含10%血清的洛斯维帕克纪念研究所改良Eagle培养基(dulbecco's modified eagle medium,DMEM)培养,置于37℃、5%二氧化碳CO2饱和湿度的培养箱中,2~3 d更换培养基。将8μg待转重组质粒、10μl Lipafectamine 2000脂质体及无血清的DMEM混匀后于室温下孵育20 min,均匀滴加于细胞培养皿中,培养6h后,更换完全培养基。
1.3FAL1 mRNA表达的检测方法
取已消化的细胞悬浮液,10 000 r/min离心,每1 ml Trizol试剂裂解的样品中加入0.2 ml氯仿,进行裂解操作,采用无酶RNA冲洗液在4℃冰上进行洗涤,10000r/min离心5min,得到RNA。混合液在加入逆转录酶(cdna synthesis kit,CSK)前先70℃干浴3min,取出后立即冰水浴至管内外温度一致,加逆转录酶0.5μl,37℃水浴60min,室温放置5min使其完全溶解,使其逆转录为cDNA。以肌动蛋白β为模版,在反应体系中加入SYBR Green1染料、正向引物、反向引物、脱氧核糖核苷三磷酸,使总体积达20μl。反应条件为:93℃预变性2 min,93℃变性1min,55℃退火2min,共40个循环。SYBR Green和逆转录试剂盒购自南京碧云天生物科技有限公司。
1.4Hela细胞迁移和侵袭实验方法
Hela细胞以2×105个细胞/小室的浓度小心加入上室,保证上室的无血清培养基量为200μl,下室中加入含有血清的正常培养基500μl,常规培养细胞24h后,进行细胞固定、染色。在100倍显微镜下每张片子随机取5个视野,照相、计数分析穿过小室的细胞数。
1.5细胞增殖检测
Hela细胞生长至融合度为90%时,用胰蛋白酶乙二胺四乙酸消化液消化细胞,加入适当培养基,吹匀后细胞计数,使细胞最终密度为1×105个/ml,96孔板每孔加入100μl吹匀后的细胞,置于37℃、5% CO2饱和湿度的培养箱中培养,24 h后每孔加入10μl新型细胞增殖,用活细胞计数法试剂盒(cell counting kit-8,CCK-8)(南京凯基生物科技发展有限公司KGA317)检测毒性溶液,37℃培养箱中孵育2 h,酶标仪在450 nm波长处检测每孔的吸光度光密度(optical density,OD)值。细胞增长率(%)=(OD值MVs-OD值空白)/OD值空白×100%。
1.6统计学方法
采用SPSS 16.0统计软件进行数据分析,FAL1 mRNA相对表达量、OD值、穿膜细胞数和迁移距离,用均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1Hela细胞转染FAL1-siRNA后FAL1 mRNA相对表达量
FAL1-siRNA转染Hela细胞后,两组FAL1 mRNA相对表达量比较,经t检验,差异有统计学意义(t= 8.430,P=0.000),FAL1-siRNA/Hela细胞的FAL1 mRNA相对表达量(0.49±0.21)低于FAL1-NC/Hela细胞(1.34±0.13)。
2.2FAL1-siRNA转染后对Hela细胞增殖的影响
FAL1-siRNA/Hela细胞和FAL1-NC/Hela细胞在48h内的OD值比较,经t检验,差异无统计学意义(P>0.05)。FAL1-siRNA/Hela细胞在72、96和120 h的OD值比较,经t检验,差异有统计学意义(P<0.05),FAL1-siRNA/Hela细胞72、96和120 h的OD值低于FAL1-NC/Hela细胞。FAL1-siRNA/Hela细胞在48h后增殖速度明显受到抑制。见表1。
表1 FAL1-siRNA转染后对Hela细胞增殖的影响(%±s)
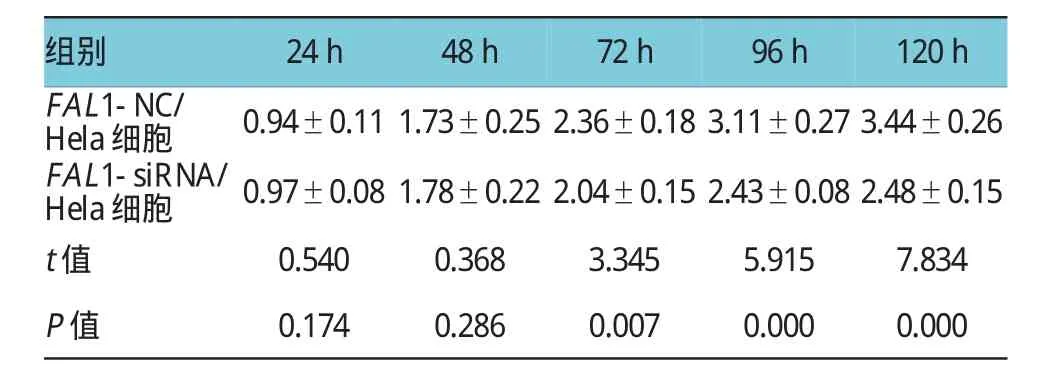
表1 FAL1-siRNA转染后对Hela细胞增殖的影响(%±s)
组别24 h48 h72 h96 h120 h FAL1-NC/ Hela细胞0.94±0.11 1.73±0.25 2.36±0.18 3.11±0.27 3.44±0.26 FAL1-siRNA/ Hela细胞0.97±0.08 1.78±0.22 2.04±0.15 2.43±0.08 2.48±0.15 t值0.5400.3683.3455.9157.834 P值0.1740.2860.0070.0000.000
2.3FAL1-siRNA转染后对Hela细胞侵袭能力的影响
两组穿膜细胞数比较,经t检验,差异有统计学意义(t=18.255,P=0.000),FAL1-siRNA/Hela细胞的穿膜细胞数(126.18±8.75)个低于FAL1-NC/Hela细胞(208.54±6.75)个。FAL1-siRNA组穿过滤膜的细胞数目明显减少,沉默FAL1表达可抑制Hela细胞的侵袭能力。见图1。
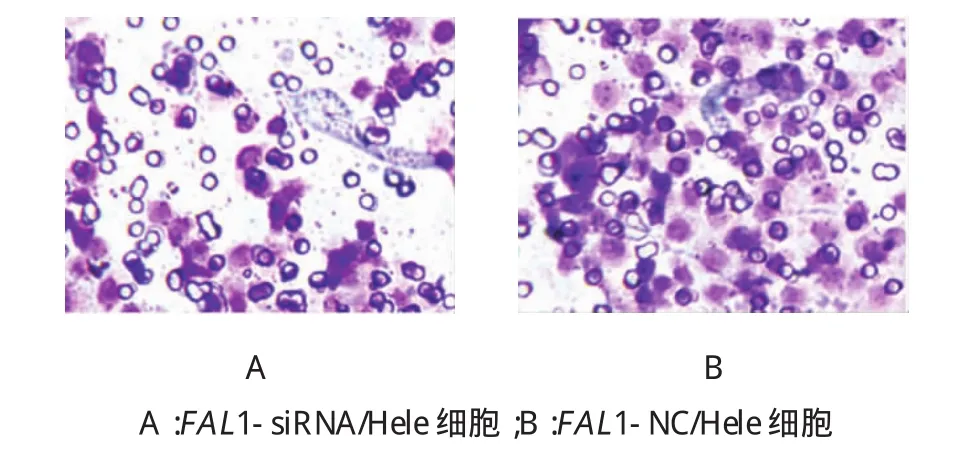
图1 FAL1-siRNA转染后对Hela细胞侵袭能力的影响(结晶紫染色×100)
2.4FAL1-siRNA转染后对Hela细胞迁移距离的影响
两组24、48和72 h的细胞迁移距离比较,经t检验,差异有统计学意义(P<0.05)(见表2)。FAL1-siRNA组细胞迁移距离明显缩短,沉默FAL1表达可抑制Hela细胞的迁移能力(见图2)。
表2 FAL1-siRNA转染后对Hela细胞迁移距离的影响(μm±s)
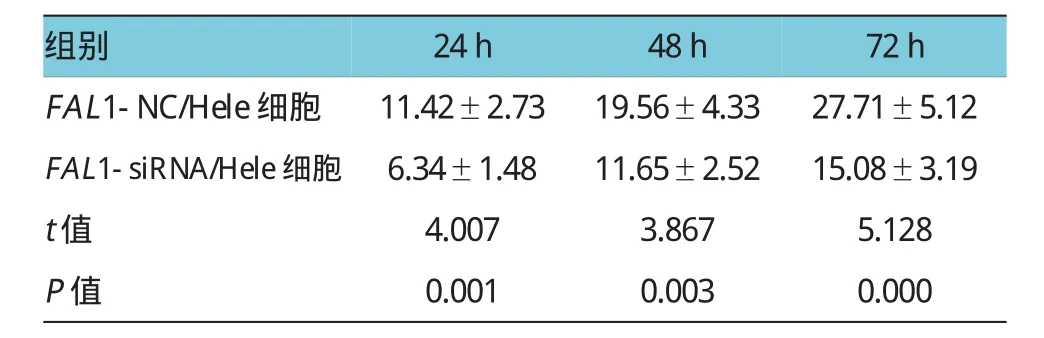
表2 FAL1-siRNA转染后对Hela细胞迁移距离的影响(μm±s)
组别FAL1-NC/Hele细胞24h 11.42±2.73 48h 19.56±4.33 72h 27.71±5.12 FAL1-siRNA/Hele细胞6.34±1.4811.65±2.5215.08±3.19 t值4.0073.8675.128 P值0.0010.0030.000
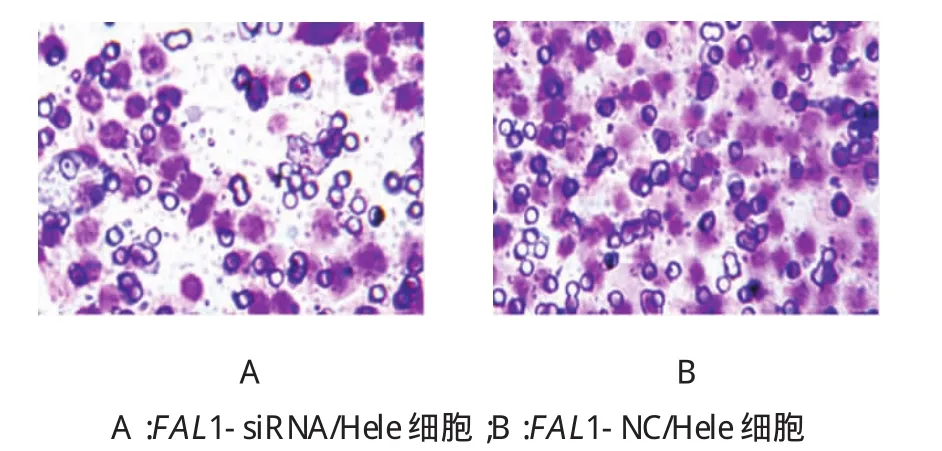
图2 FAL1-siRNA转染后对Hela细胞迁移距离的影响(结晶紫染色×100)
3 讨论
宫颈癌是最常见的妇科恶性肿瘤,原位癌高发年龄为30~35岁,浸润癌为45~55岁,近年来其发病有年轻化的趋势。近几十年宫颈细胞学筛查的普遍应用,使宫颈癌和癌前病变得以早期发现和治疗,宫颈癌的发病率和死亡率已明显下降[7-11]。但临床上对于宫颈的相关临床特征进行分析,发现25%左右的早期宫颈癌(宫颈癌临床分期为Ⅰb1~Ⅱa1)的患者,其子宫宫旁组织的浸润率可达35%[12-15],同时根治性手术患者术后盆腔后腹膜和直肠的转移率可>15%,较高的临床复发率和术后转移率促进宫颈癌患者术后病死率上升,同时可降低6~8个月的术后生存时间,预后较差[16-20]。现阶段临床上术后联合放、化疗已广泛应用于临床,但其控制宫颈癌患者术后复发和转移的整体效果并不理想,且副反应较多,严重的并发症已严重影响到患者的生存质量。而肿瘤生物分子靶向治疗可以通过对靶基因或者靶分子的沉默和清除,进而抑制下游信号通路或者癌蛋白的转录和翻译,控制宫颈癌残留细胞的侵袭和转移[21-23]。
肿瘤基础研究发现,非编码RNA在包括宫颈癌在内的多种肿瘤发生、发展中发挥重要作用,使宫颈癌的研究又向前迈进一步,其中lncRNAFAL1可以通过对于稳定PCR1基因调节稳定家族相关非编码RNA的表达,促进BMI1蛋白末端残基的磷酸化,并影响转录起始区相关增强子和启动子,促进瘤蛋白P21的表达,影响恶性肿瘤的增殖和转移[14-26]。肿瘤侵袭能力的改变与上皮间质转换、E-cadherin、Vimemtin蛋白等的表达具有重要的关系,lncRNA FAL1可以抑制E-cadherin、Vimemtin的表达,降低细胞间的黏附作用,进而促进肿瘤细胞的侵袭能力,以及对于局部临近组织或者器官的浸润[27]。本研究的创新性在于首次探讨lncRNAFAL1对于宫颈癌细胞株Hela生物学特性的影响,重点探讨Hela细胞株增殖和侵袭能力的改变。
本研究发现,在RNA干扰技术沉默lncRNAFAL1的表达后,宫颈癌细胞株Hela的lncRNAFAL1表达下降,FAL1-siRNA/Hela细胞的FAL1 mRNA相对表达量(0.49±0.21)低于FAL1-NC/Hela细胞(1.34± 0.13),提示基因转染成功。在成功转染后,观察组细胞株的细胞增殖能力下降,转染后48 h后OD值低于对照组,特别是转染成功96和120 h后,观察组细胞株Hela的增殖率与对照组比较,差异有统计学意义,表明lncRNAFAL1对于维持Hela细胞的增殖具有重要作用。MENG[28]、郑春花[29]、袁俐等[30]学者也发现,lncRNAFAL1沉默后24h,即可发现宫颈癌细胞株扩增能力改变,虽然OD值下降<5%,但随后观察48h后,OD值可持续下降20%~35%。本研究进一步探讨lncRNAFAL1对于宫颈癌细胞株侵袭和转移能力的影响,在沉默lncRNAFAL1基因后,Hela细胞的穿膜细胞数仅为(126.18±8.75)个,相比于FAL1-siRNA组下降30%左右,表明低表达或者不表达FAL1基因的细胞株,其细胞侵袭能力较低。穿膜细胞数每下降50个,宫颈癌细胞侵袭和局部浸润即可明显改善。FAL1-siRNA/Hela的穿膜细胞株下降>70个,进一步表明通过特异性地沉默FAL1基因可以为临床上控制宫颈癌患者术后复发和转移提供新的思路。另外,FAL1-siRNA/Hela细胞在24、48和72h的细胞迁移距离下降,其机制可能与FAL1沉默导致E-cadherin、Vimemtin蛋白高表达有关,但仍然需要进一步证实。
综上所述,沉默FAL1基因后宫颈癌细胞株Hela的生物学特性明显改变,FAL1-siRNA/Hela细胞的FAL1 mRNA相对表达量下降,可以抑制Hela细胞的增殖、侵袭和迁移能力。针对肿瘤细胞侵袭转移过程中的关键分子进行干涉,可以实现控制宫颈癌术后肿瘤侵袭、转移。
[1]刘变利,郭霞.高迁移率蛋白1(HMGB1)在宫颈癌中表达及其意义[J].现代仪器与医疗,2015,21(6):86-87.
[2]汤英姿,郑洪,魏娜,等.XIAP、OMI/HTRA2蛋白对HeLa细胞的影响及两种蛋白间相互作用[J].临床与实验病理学杂志,2012,23(3): 287-291.
[3]翁梅英,洪顺家,郑澄宇.巨噬细胞移动抑制因子在复发性宫颈癌中的表达及其对预后的影响[J].中国病理生理杂志,2013,29(9): 1641-1644.
[4]吴素霞,张赛男,李伟华,等.沉默TNFAIP8基因对宫颈癌HeLa细胞生物学特性的影响[J].肿瘤,2015,33(11):1208-1215.
[5]肖艳,成慧君,王莉.贝伐珠单抗联合化疗治疗复发及转移性子宫颈癌的安全性及近期疗效观察[J].中华妇产科杂志,2015,26(3): 223-224.
[6]杨慧,余敏敏,陆晓媛.长链非编码RNA在宫颈癌及宫颈上皮内瘤样病变中的表达[J].江苏医药,2014,34(22):2685-2688.
[7]ZHANG Y H,WANG J J,LI M,et al.Matrix metallopeptidase 14 plays an important role in regulating tumorigenic gene expression and invasion ability of Hela cells[J].Int J Gynecol Cancer,2016,26(3):600-606.
[8]SHI C,ZHANG G,HAN B,et al.Effects of alpha1-PDX,a furin inhibitor,on growth,invasion,and tumorigenicity of cervical cancer Hela cells[J].Journal of Southern Medical University,2015, 35(3):432-436.
[9]LU J N,LEE W S,YUN J W,et al.Anthocyanins from vitis coignetiae pulliat inhibit cancer invasion and epithelial-mesenchymal transition,but these effects can be attenuated by tumor necrosis factor in human uterine cervical cancer Hela cells[J].E-vid Based Complement Alternat Med,2013,20(06):90-93.
[10]张金晓,张瑞,汪蓓蕾,等.双启动子shRNA表达载体对hTERT和bcl-2基因表达的抑制作用[J].天津医药,2012,43(5):480-482.
[11]张乃怿,高雨农,燕鑫,等.具复发危险因素的ⅠB1~ⅡA期宫颈癌术后辅助化疗的疗效和安全性评价[J].实用妇产科杂志,2014, 30(1):21-25.
[12]张艳梅,陈晓忠.长链非编码RNA HOTAIR在宫颈癌中的表达及其对宫颈癌Hela细胞增殖和凋亡的影响[J].肿瘤,2015,33(4): 446-452.
[13]朱丽红,高燕,朱瑾.子宫颈癌细胞中HOXA10、NF-κB对MMP-9基因的调控作用[J].中华妇产科杂志,2015,24(2):144-145.
[14]李菲菲,唐慧子,吴猛猛,等.宫颈癌中SOCS-1表达的研究新进展[J].现代生物医学进展,2015,15(7):1383-1385.
[15]ARTINI M,SCOARUGHI G L,CELLINI A,et al.Holo and apo-transferrins interfere with adherence to abiotic surfaces and with adhesion/invasion to Hela cells in staphylococcus spp[J]. Biometals,2012,25(2):413-421.
[16]叶裕丰,陈秋梅,向之明,等.磁共振灌注加权成像在宫颈癌表现特点的研究[J].磁共振成像,2015,6(4):299-303.
[17]刘唯,吴素慧,史晓峰,等.RNA干扰沉默MIF基因对宫颈癌SiHa细胞上皮细胞间质变的影响[J].中国肿瘤,2014,23(11):956-960.
[18]刘洪丽.TMPyP_4光动力疗法联合核仁素沉默对人宫颈癌SiHa细胞杀伤作用的研究[D].山东:山东大学,2014.
[19]赵红珂,莫凌昭.慢病毒介导的siRNA沉默hTERT基因对宫颈癌Caski细胞增殖和凋亡的影响[J].广西医学,2015,5:599-602.
[20]江艳.MALAT1对宫颈癌细胞生物学表型的影响[D].湖南:中南大学,2014.
[21]郑海燕,阮健,潘玲兰,等.溶酶体组织蛋白酶L对人宫颈癌细胞Hela迁移及侵袭能力的影响[J].广东医学,2014,35(22):3460-3463.
[22]任卉.Survivin基因沉默对Hela细胞凋亡、细胞周期和启动子甲基化的影响[D].广东:广东医学院,2015.
[23]张德太,左曙蓉,杨文,等.siRNA沉默转酮醇酶样基因1下调人宫颈癌细胞HIF-α表达及糖酵解关键酶活性[J].中国病理生理杂志,2014,30(1):72-76.
[24]潘巍巍,徐营,曹利仙,等.shRNA介导的hWAPL表达沉默对人宫颈癌CaSki细胞增殖与凋亡的影响[J].中国病理生理杂志,2013, 29(7):1213-1218.
[25]吴琦,于红,张文卿.siRNA沉默SIRT1基因对宫颈癌细胞HeLa增殖和凋亡的影响[J].微生物学杂志,2014,34(3):47-51.
[26]王平,刘珊,程波,等.siRNA介导的HPV16E6/E7基因沉默对宫颈癌SiHa增殖及凋亡的影响[J].诊断病理学杂志,2015,22(12): 781-786.
[27]陈雪,李欣,高福禄,等.MTT与HOECHST染色法检测膜联蛋白A7基因沉默对Hela细胞的影响[J].中国临床解剖学杂志,2014, 32(1):57-60.
[28]MENG F,CHEN X,SONG H,et al.LAPTM4B down regulation inhibits the proliferation,invasion and angiogenesis of HeLa cells in vitro[J].Cell Physiol Biochem,2015,37(3):890-900.
[29]郑春花,付艳.RNA干扰技术在宫颈癌中应用进展[J].中华实用诊断与治疗杂志,2014,28(7):625-626.
[30]袁俐,姜忠敏,盛凤,等.聚酰胺-胺介导耐药基因ABCG2沉默策略治疗宫颈癌侧群细胞[J].国际妇产科学杂志,2015,42(3):273-276.
(童颖丹编辑)
Effect of silencingFAL1expression on proliferation,invasion and migration of human cervical carcinoma Hela cells*
Xing-yuan Shi1,Hong-wei Yu1,Wen-jin Huang1,Zhi-wei Liao1,Bao-chang Jia1,Kai Luo2
(1.The Affiliated Cancer Hospital,2.Cancer Institute,Guangzhou Medical University,Guangzhou,Guangdong 510095,China)
Objective To study the effects of silencingFAL1expression on the proliferation,invasion and migration of the human cervical carcinoma Helacells.MethodsSiRNAFAL1fragmentwasdesigned,synthesized and transfected into Hela cells,which were namedFAL1-siRNA/Hela cell group andFAL1-NC/ Hela cell group.The differences inFAL1mRNA relative expression,OD value,number of transmembrane cells and migration distance were compared between the two groups after transfection.Results The relative expression ofFAL1mRNA in theFAL1-siRNA/Hela cells(0.49±0.21)was significantly lower than that of FAL1-NC/Hela cells[(1.34±0.13),P<0.05].The OD value of theFAL1-siRNA/Hela cells in 72,96 and 120 h[(2.04±0.15),(2.43±0.08)and(2.48±0.15)respectively]was significantly lower than that of the FAL1-NC/Hela cells[(2.36±0.18),(3.11±0.27)and(3.44±0.26)respectively,P<0.05].The number of transmembrane cells in theFAL1-siRNA/Hela cells(126.18±8.75)was significantly smaller than that of the FAL1-NC/Hela cells[(208.54±6.75),P<0.05].The cell migration distance of theFAL1-siRNA/Hela cells in24,48 and 72 h[(6.34±1.48),(11.65±2.52)and(15.08±3.19)μm respectively]was significantly shorther than that of theFAL1-NC/Hela cells[(11.42±2.73),(19.56±4.33)and(27.71±5.12)μm respectively,P<0.05].Conclusions The relative expression ofFAL1mRNA in theFAL1-siRNA/Hela cells decreases,which inhibits proliferation,invasion and migration of Hela cells.
cervical carcinoma;Hela cell;FAL1-siRNA;proliferation;invasion;migration
10.3969/j.issn.1005-8982.2016.17.007
1005-8982(2016)17-0034-05
2016-04-08
广州医科大学青年基金(No:2013A45)

