茶多酚改善代谢综合征大鼠糖脂代谢的作用机制研究*
夏燕萍,俞茂华,陈蔚,陈刚
(复旦大学附属华山医院老年病科,上海200040)
论著
茶多酚改善代谢综合征大鼠糖脂代谢的作用机制研究*
夏燕萍,俞茂华,陈蔚,陈刚
(复旦大学附属华山医院老年病科,上海200040)
目的探讨茶多酚对代谢综合征(MS)大鼠糖脂代谢的干预作用及其分子作用机制。方法高糖高脂饮食诱导建立MS大鼠模型,经茶多酚干预16周后测定各组大鼠血脂、血糖、空腹胰岛素及游离脂肪酸水平,计算胰岛素抵抗指数。逆转录聚合酶链反应法检测各组大鼠脂肪组织过氧化物酶体增殖剂激活受体-γ、脂联素、肿瘤坏死因子-α、磷脂酰肌醇3-激酶、蛋白激酶B的mR NA表达,Western blot法检测大鼠脂肪组织上述细胞因子在蛋白水平的表达。结果茶多酚干预组大鼠血三酰甘油、胆固醇、低密度脂蛋白、空腹血糖、游离脂肪酸水平均较MS对照组下降(P<0.05),经茶多酚干预后MS大鼠胰岛素抵抗指数较对照组下降(P< 0.05)。干预组脂肪组织过氧化物酶体增殖剂激活受体-γ、脂联素、磷脂酰肌醇3-激酶、蛋白激酶B的mR NA及蛋白表达水平较代谢综合征对照组均有上调(P<0.05),药物干预组肿瘤坏死因子-α的mR NA及蛋白表达水平较MS对照组下调(P<0.05)。结论茶多酚可以通过降低游离脂肪酸水平及肿瘤坏死因子-α的表达,增加过氧化物酶体增殖剂激活受体-γ、蛋白激酶B、磷脂酰肌醇3-激酶、脂联素的表达来改善MS大鼠的糖脂代谢。
茶多酚;胰岛素抵抗;代谢综合征;动物模型
由于人们饮食结构以及生活习惯的改变,代谢综合征(metabolic syndrome,MS)及2型糖尿病的患病率日渐上升,心脑、大血管、微血管并发症已严重危害到人们的身体健康。国内外大量研究证实茶叶的保健功效,尤其是在降脂、降糖方面的作用成为近年来研究的热点。茶多酚是茶叶提取物中含多酚羟基的一类物质,本研究以高糖高脂饮食诱导建立MS大鼠模型[1],探讨茶多酚对代谢综合征相关指标的干预作用及其分子作用机制,为茶多酚用于临床治疗MS提供相关理论依据。
1 材料与方法
1.1药物与实验动物
茶多酚纯度为98%,采用溶剂萃取法提取,由上海师范大学生命与环境科学院魏新林教授惠赠。30只健康雄性SD大鼠(8周龄),购于复旦大学上海医学院实验动物中心。
1.2仪器及试剂
DNA纯化试剂盒及逆转录聚合酶链反应(reversetranscription polymerase chain reaction,RT-PCR)试剂盒为美国Promega公司产品,Trizol为美国Gibco公司产品,探针由上海捷兰生物技术有限公司合成(采用Primer Express软件设计)。胰岛素放免试剂盒为天津中外DPC合资公司产品,显微摄像机(Nikon UFX-Ⅱ型)由复旦大学上海医学院病理教研室提供,电动匀浆器为美国Backman公司产品,紫外分光光度计(Unico UV-2000)为上海尤尼柯仪器有限公司产品,台式高速离心机(TGL-16B)购于上海安亭科学仪器厂,基因扩增仪TC-96/T/H(a)购于杭州大和热磁电子有限公司,凝胶成像系统GIS-2008购于上海天能科技有限公司。
1.3大鼠代谢综合征模型的建立及实验分组
8周龄雄性SD大鼠随机分成3组:A组为茶多酚干预组(10只),高糖、高脂饲料喂养的同时,予茶多酚800mg/(kg·d)溶于生理盐水灌胃;B组为MS对照组(10只),持续给予高糖高脂饮食;C组为正常对照组(10只),与A、B组在相同环境下予常规饲料喂养。药物干预时间共计16周。
1.4各指标检测
每隔2周测量体重、身长、尾动脉收缩压、空腹血糖,16周后处死大鼠,取血检测空腹胰岛素、血脂[胆固醇、三酰甘油、高密度脂蛋白(high density lipidcholesterol,HDL-C)、低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)]及游离脂肪酸水平,同时计算胰岛素抵抗指数(homeostatic model as sessment of insulin resistance,HOMA-IR),HOMAIR=空腹血糖(mmol/l)×空腹胰岛素(μU/ml)/22.5。其中血清胰岛素水平测定采用放射免疫法,血清游离脂肪酸水平测定采用酶联免疫吸附法,血脂测定采用标准酶法。
1.5RT-PCR法检测大鼠白色脂肪组织(腹腔大网膜脂肪组织)PPAR-γ、脂联素、TNF-α、PI3K、蛋白激酶B的表达
药物干预16周后处死大鼠,取腹腔脂肪组织保存于聚合酶链反应(polymerase chain reaction,PCR)冷冻管,置入液氮罐待用。抽提各组大鼠脂肪组织的总RNA,分光光度计测定其浓度,取2μg RNA进行逆转录反应,结束后各管置冰上冷却,取2μl cDNA用以做PCR扩增,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作内参照,分别检测过氧化物酶体增殖剂激活受体-γ(peroxisome proliferators-activated receptors-γ,PPAR-γ)、脂联素、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、蛋白激酶B(protein kinase B,PKB)的mRNA表达。见表1。
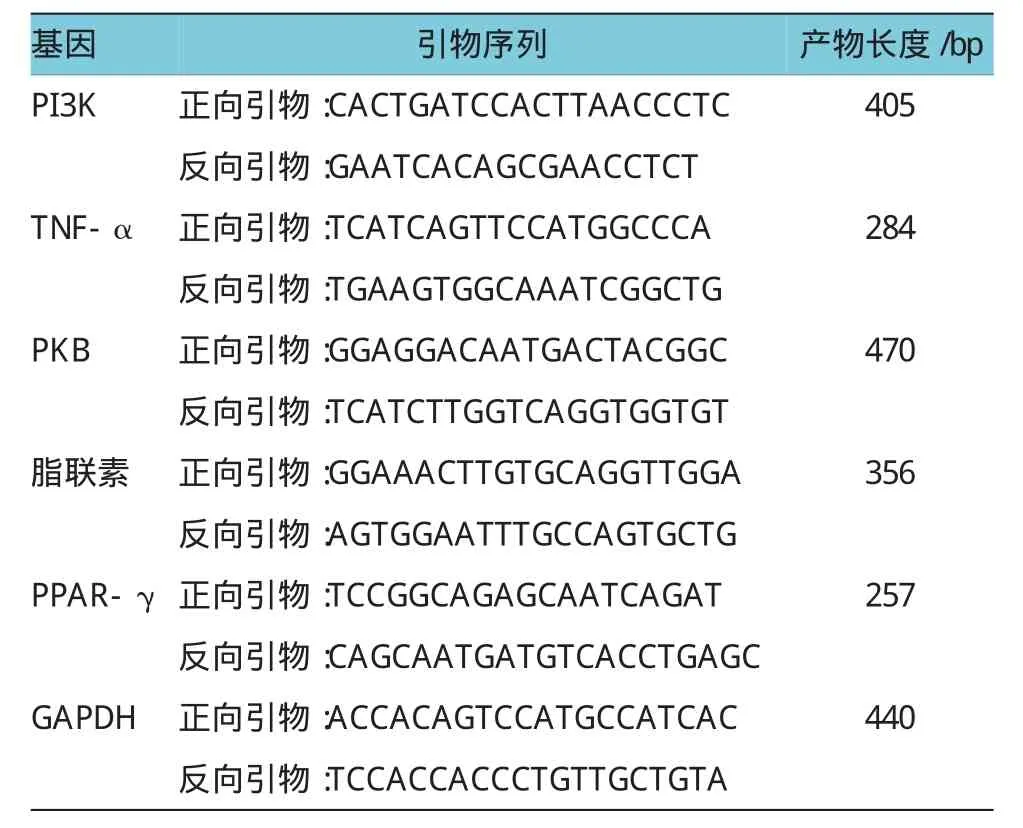
表1 各检测基因的引物序列
1.6Western blot法检测大鼠脂肪组织PPAR-γ、脂联素、TNF-α、PI3K、PKB在蛋白水平的表达
在检测样品中加入磷酸缓冲盐溶液冲洗裂解,然后测定蛋白浓度,经凝胶电泳,转膜,封闭过夜,再分别加入一抗、二抗孵育后洗膜,显影后应用凝胶成像分析仪测定蛋白条带灰度,并计算各蛋白条带和内参照比值。
1.7统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,行正态性检验,试验数据均为正态分布,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1茶多酚干预后大鼠空腹血糖、体重、身长、尾动脉收缩压、胆固醇、三酰甘油、HDL-C、LDL-C、空腹胰岛素及游离脂肪酸水平
经茶多酚干预后,MS大鼠体重增加有延缓趋势,自第12周起与MS对照组比较差异有统计学意义(P=0.028),茶多酚干预后的MS大鼠尾动脉收缩压的升高趋势有所减缓,自第16周起差异有统计学意义(P=0.026)。而各组大鼠的身长变化差异无统计学意义(P=0.158)。第14周起茶多酚干预组空腹血糖水平较MS未干预组下降,茶多酚干预组游离脂肪酸水平、血三酰甘油、胆固醇、LDL-C、空腹血糖水平较MS对照组下降,差异有统计学意义(P=0.017、0.021、0.029、0.041和0.030)。见表2、3。
表2 不同时间各组大鼠体重、身长、血糖、尾动脉收缩压及空腹血糖变化(±s)
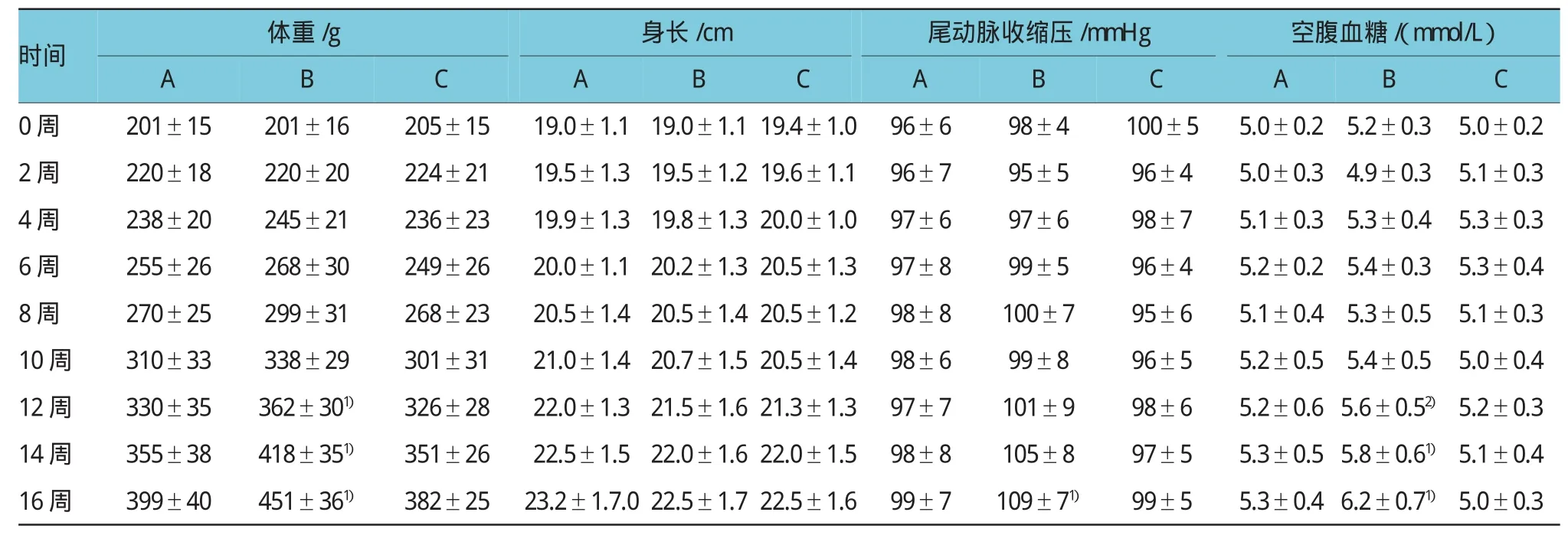
表2 不同时间各组大鼠体重、身长、血糖、尾动脉收缩压及空腹血糖变化(±s)
注:1)与A、C组比较,P12周体重=0.028和0.018,P14周体重=0.015和0.015,P16周体重=0.012和0.010,P16周尾动脉压=0.026和0.027,P14周空腹血糖= 0.041和0.027,P16周空腹血糖=0.030和0.010;2)与C组比较,P=0.040
时间体重/g身长/cm尾动脉收缩压/mmHg空腹血糖/(mmol/L)A B ABABABC C C C 0周201±15201±16205±1519.0±1.1 19.0±1.1 19.4±1.096±698±4100±55.0±0.25.2±0.35.0±0.2 2周220±18220±20224±2119.5±1.3 19.5±1.2 19.6±1.196±795±596±45.0±0.34.9±0.35.1±0.3 4周238±20245±21236±2319.9±1.3 19.8±1.3 20.0±1.097±697±698±75.1±0.35.3±0.45.3±0.3 6周255±26268±30249±2620.0±1.1 20.2±1.3 20.5±1.397±899±596±45.2±0.25.4±0.35.3±0.4 8周270±25299±31268±2320.5±1.4 20.5±1.4 20.5±1.298±8100±795±65.1±0.45.3±0.55.1±0.3 10周310±33338±29301±3121.0±1.4 20.7±1.5 20.5±1.498±699±896±55.2±0.55.4±0.55.0±0.4 12周330±35362±301)326±2822.0±1.3 21.5±1.6 21.3±1.397±7101±998±65.2±0.6 5.6±0.52)5.2±0.3 14周355±38418±351)351±2622.5±1.5 22.0±1.6 22.0±1.598±8105±897±55.3±0.5 5.8±0.61)5.1±0.4 16周399±40451±361)382±2523.2±1.7.0 22.5±1.7 22.5±1.699±7109±71)99±55.3±0.4 6.2±0.71)5.0±0.3
表3 各组大鼠血脂、胰岛素及游离脂肪酸水平变化(±s)
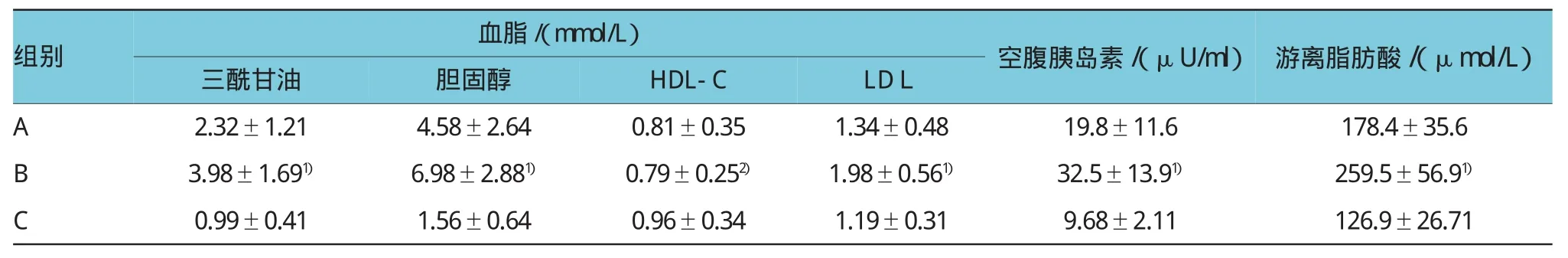
表3 各组大鼠血脂、胰岛素及游离脂肪酸水平变化(±s)
注:1)与A、C组比较,P三酰甘油=0.021和0.002,P胆固醇=0.029和0.001,PLDL=0.041和0.028,P空腹胰岛素=0.018和0.001,P游离脂肪酸=0.017和0.001;2)与C组比较,PHDL-C=0.035
组别血脂/(mmol/L)空腹胰岛素/(μU/ml)游离脂肪酸/(μmol/L)三酰甘油胆固醇HDL-CLDL A 2.32±1.214.58±2.640.81±0.351.34±0.4819.8±11.6178.4±35.6 B 3.98±1.691)6.98±2.881)0.79±0.252)1.98±0.561)32.5±13.91)259.5±56.91)C 0.99±0.411.56±0.640.96±0.341.19±0.319.68±2.11126.9±26.71
2.2各组大鼠胰岛素抵抗指数比较
以HOMA-IR作为衡量大鼠胰岛素抵抗水平的指标,茶多酚干预组的HOMA-IR为(4.66±0.39),MS对照组为(8.96±0.88),正常对照组为(2.15± 0.33),经茶多酚干预后MS大鼠的胰岛素抵抗水平下降,差异有统计学意义。
2.3各组大鼠脂肪组织相关细胞因子的mRNA表达
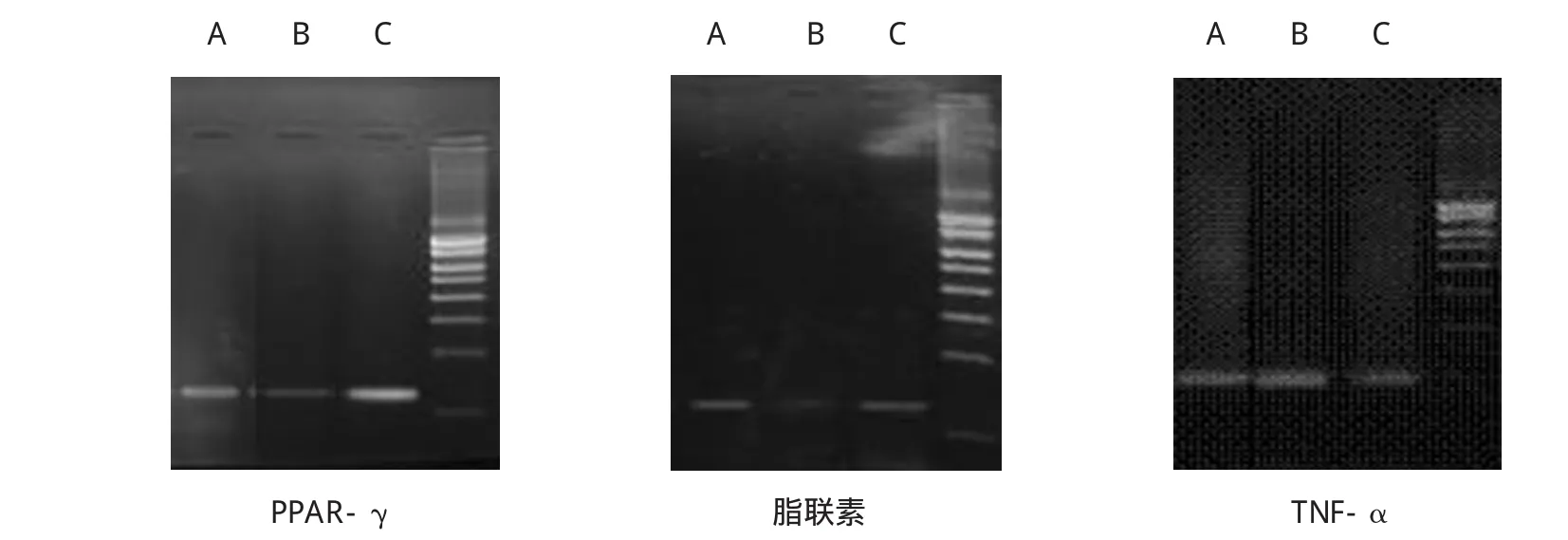
结果显示,经茶多酚干预16周后大鼠脂肪组织PPAR-γ[(0.419±0.021)vs(0.202±0.015),P=0.009]、脂联素[(0.141±0.008)vs(0.118±0.005),P=0.040]、PI3K[(0.628±0.024)vs(0.548±0.015),P=0.037]、PKB[(0.724±0.020)vs(0.613±0.015),P=0.032]的mRNA表达与MS对照组比较均有上调,差异有统计学意义。茶多酚干预组TNF-α的mRNA表达与MS对照组比较[(0.518±0.016)vs(0.721±0.013),P=0.028]均有下调,差异有统计学意义。见图1、2。
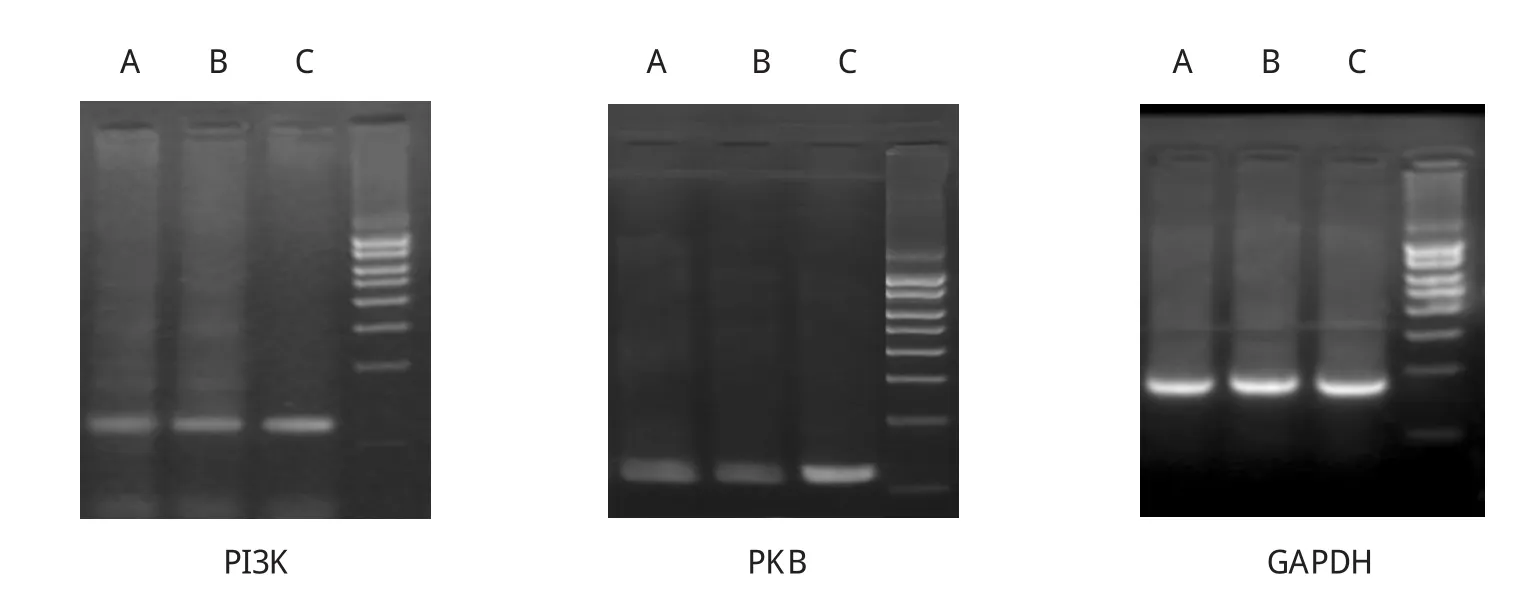
图1 各组大鼠脂肪组织细胞因子的mRNA表达(RT-PCR)
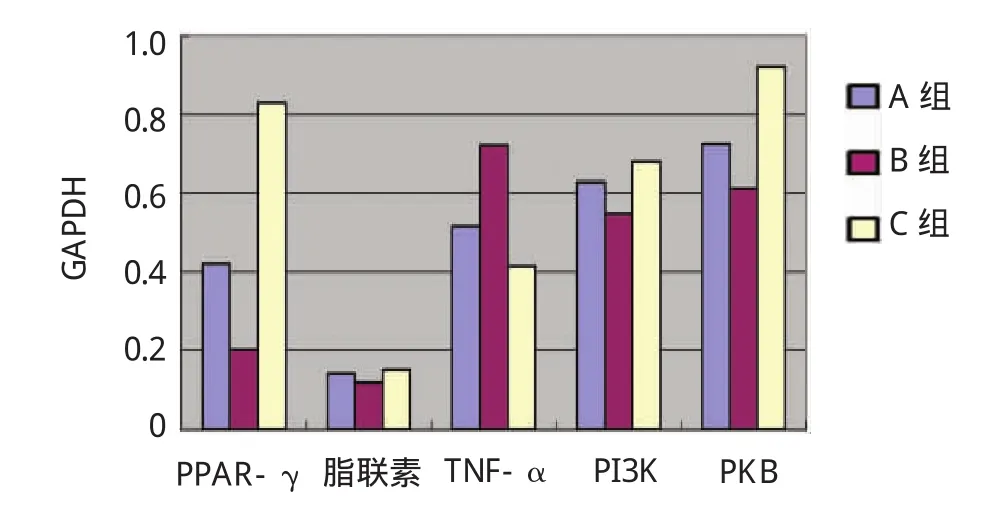
图2 各组大鼠脂肪组织相关细胞因子与内参照泳道面积比值比较(RT-PCR法)
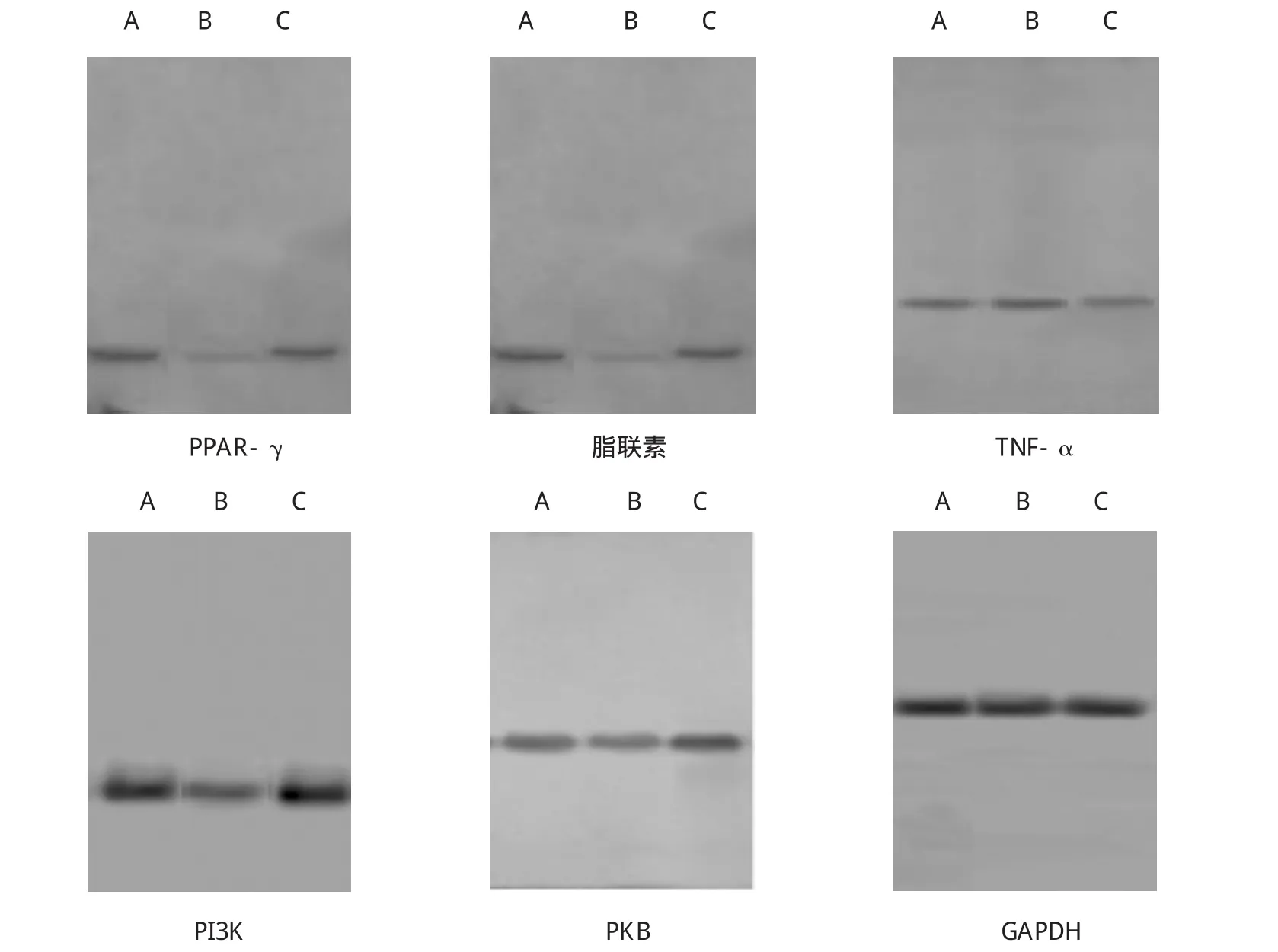
图3 各组大鼠脂肪组织细胞因子的蛋白表达(Western blot法)
2.4各组大鼠脂肪组织相关细胞因子的蛋白表达
结果显示,茶多酚干预后大鼠脂肪组织PPAR-γ[(0.529±0.018)vs(0.192±0.015),P=0.006]、脂联素[(0.619±0.021)vs(0.222±0.013),P=0.003]、PI3K [(1.119±0.031)vs(0.8202±0.025),P=0.027]、PKB [(0.568±0.008)vs(0.452±0.010),P=0.042]在蛋白水平的表达较MS对照组均有增加,茶多酚干预组TNF-α的蛋白表达与MS对照组比较有减少[(0.489±0.009)vs(0.582±0.011),P=0.030],差异有统计学意义。见图3、4。
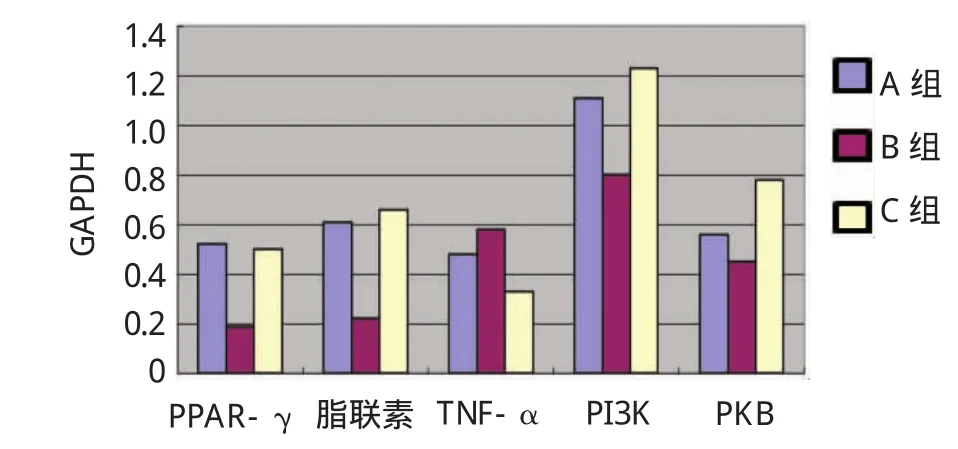
图4 大鼠脂肪组织相关细胞因子与内参照泳道面积比值比较(Western blot法)
3 讨论
MS的发病并不是由某一因素单独构成病因,而是众多因素相互影响、相互作用的结果,但胰岛素抵抗是目前公认的MS的致病因素,MS的病理生理基础是起源于胰岛素抵抗的发生并进一步导致相关的氧化应激损伤及炎症反应[2]。目前关于MS的治疗策略从西医角度多是针对MS单个组份(高血糖、高血压、高血脂等)的处理,虽然在大多数情况可以使患者的血糖、血压、血脂紊乱得以改善,但是这样的治疗策略常常存在“头痛医头、脚痛医脚”的弊端,并不能针对MS病理生理机制从根源上进行治疗。如果能找到一种针对MS发病机制、全面改善胰岛素抵抗、同时降糖降脂降压的综合性治疗药物是MS研究的热点。
茶多酚是从茶叶中提取的一类含多酚羟基的物质,约占茶叶干重的30%,其主要成分为儿茶素类化合物,占65%~80%。茶多酚具有抗炎、抗氧化、预防动脉粥样硬化、抗肿瘤、抗凝血以及促进纤溶等多方面的药理作用[3-4]。近年来,研究发现茶多酚在降脂降糖治疗MS方面也具有调节作用[5-8]。本研究通过高糖高脂饮食诱导建立MS大鼠模型,给予茶多酚干预后大鼠体重增加有延缓趋势,茶多酚干预组尾动脉收缩压、空腹血糖水平均有明显好转趋势,血三酰甘油、胆固醇、LDL-C、胰岛素水平及游离脂肪酸水平、HOMA-IR均较MS对照组下降,这与BOSE、NAGAO、SHIMADA等的研究结果相一致[9-12]。
关于茶多酚降糖作用的机制,目前报道较多的是它可以改善胰岛素抵抗、抑制碳水化合物的吸收、减少糖异生、增加胰岛素分泌及敏感性、加速骨骼肌细胞对葡萄糖的利用等机制[13-15]。本研究发现,茶多酚干预后大鼠游离脂肪酸水平下降。而在MS患者中,常常存在高游离脂肪酸血症,高浓度的游离脂肪酸可以干扰糖、脂代谢的多个环节,并且在干扰胰岛素受体后的信号转导通路,抑制胰岛素刺激的葡萄糖转运,是加重胰岛素抵抗的主要物质。因此茶多酚可能通过降低游离脂肪酸水平、改善MS大鼠胰岛素抵抗来发挥其降糖降脂的作用。
本研究进一步探索茶多酚改善糖脂代谢的分子生物机制,发现茶多酚干预后大鼠脂肪组织PPAR-γ、PI3K、PKB、脂联素的mRNA及蛋白表达均明显上调。PPARγ作为调控脂肪细胞因子的表达以及胰岛素信号传导通路的主要参与者,具有广泛的生物学效应,它在脂肪细胞的分化、调节机体糖脂代谢紊乱、增强胰岛素敏感性、抗炎和抗肿瘤等方面有着积极的作用[16-18]。而TNF-α、PI3K、PKB均是PPAR-γ的下游基因。本课题组前期研究已证实,茶多酚可以显著上调MS大鼠脂肪组织PPAR-γ的表达[19],而文献报道PPAR-γ激动剂能够通过抑制脂肪细胞表达TNF-α,并进一步增加c-CBL相关蛋白及胰岛素受体底物-2的表达,从而增强胰岛素信号转导[20-21]。因此茶多酚可能通过上调PPARγ从而抑制TNF-α的表达来发挥其作用。此外,PI3K/PKB信号通路的作用也与PPARγ密切相关。有研究显示,PPAR-γ可以促进PI3K的基因表达,而PI3K是葡萄糖摄取和葡萄糖转运蛋白-4所必需的信号分子。PI3K被激活后在细胞膜上生成磷脂酰肌醇3磷酸(phos phatidylinositol-3,4,5-trisphosphate,PIP3),PIP3又作为第2信使激活其下游的PKB,从而促进葡萄糖的摄取和转运,减轻胰岛素抵抗[22]。因此笔者推测茶多酚在上调MS大鼠PPARγ的表达后,进一步促进PI3K基因的表达,并通过激活其下游PKB的表达发挥减轻胰岛素抵抗的作用。
脂联素作为脂肪细胞的特异性蛋白,在白色脂肪组织呈高度表达,与机体胰岛素的敏感性密切相关,已有研究证实在发生胰岛素抵抗的情况下血浆脂联素水平明显降低,低脂联素血症可以作为一种预测指标提示糖尿病大血管病变的发生[23]。本研究发现,茶多酚干预后大鼠脂肪组织的脂联素表达明显上调,这可能也是茶多酚改善胰岛素抵抗的另一作用机制。
综上所述,茶多酚具有改善MS大鼠的糖脂代谢,减轻胰岛素抵抗的作用,而该作用可能是通过降低游离脂肪酸水平,增加MS大鼠PPAR-γ的表达,并进一步影响其下游PKB、肿瘤坏死因子-α、磷脂酰肌醇3-激酶的表达以及上调脂联素的表达来实现的。
[1]夏燕萍,俞茂华,陈刚.高糖高脂饮食诱导建立SD大鼠代谢综合征模型[J].中国现代医学杂志,2009,19(17):2607-2609.
[2]路影,杨华章.代谢综合征防治的新进展[J].国际内分泌代谢杂志, 2007,27(3):147-149.
[3]TANGNEYC C,RASMUSSEN H E.Polyphenols inflammation, and cardiovascular disease[J].Current Atherosclerosis Reports, 2013,15(5):1-10.
[4]XIAO J,HO C T,LIONG E C,et al.Epigallocatechin gallate attenuates fibrosis,oxidative stress,and inflammation in non-alcoholic fatty liver disease rat model through TGF/SMAD,PI3K/Akt/ FoxO1,and NF-kappa B pathways[J].European Journal of Nutrition,2013,24(1):1-13.
[5]BASU A,BETTS NM,MULUGETA A,et al.Green tea supplementation increases glutathione and plasma antioxidant capacity in adults with the metabolic syndrome[J].Nutrition Research, 2013,33(3):180-187.
[6]KISHIMOTO Y,TANI M,KONDO K.Pleiotropic preventive effects of dietary polyphenols in cardiovascular diseases[J].European Journal of Clinical Nutrition,2013,15(1):1-13.
[7]高媛圆,毛立民,徐平,等.茶多酚防治2型糖尿病的分子机理研究进展[J].茶叶科学,2015,10(3):239-247.
[8]王硕,侯小利,周小雷,等.甜茶多酚对高脂血症大鼠的降血脂作用及其机制研究[J].中国药学杂志,2015,12(20):1811-1815.
[9]BOSE M,LAMBERT J D,JU J,et al.The major green tea polyphenol,-epigallocatechin-3-gallate,inhibits obesity,metabolic syndrome,and fatty liver disease in high-fat-fed mice[J].Journal of Nutrition,2008,138(9):1677-1683.
[10]NAGAO T,HASE T,TOKIMITSU I.A green tea extract high in catechins reduces body fat and cardiovascular risks in humans[J].Obesity,2007,15(6):1473-1483.
[11]SHIMADA M,MOCHIZUKI K,SAKURAI N,et al.Dietary supplementation with epigallocatechin gallate elevates levels of circulating adiponectin in non-obese type-2 diabetic Goto-Kakizaki rats[J].Bioscience,Biotechnology and Biochemistry,2007, 71(8):2079-2082.
[12]YANG C S,ZHANG J,ZHANG L,et al.Mechanisms of body weight reduction and metabolic syndrome alleviation by tea[J]. Mol Nutr Food Res,2016,60(1):160-174.
[13]CRESPY V,WILLIAMSON G.A review of the health effects of green tea catechins in in vivo animal models[J].J Nutr,2004, 134(12):3431-3440.
[14]KAO Y H,CHANG H H,LEE MJ,et al.Tea,obesity,and diabetes[J].Mol Nutr Food Res,2006,50(2):188-210.
[15]LIN C L,LIN J K.Epigallocatechin gallate(EGCG)attenuates highglucose-inducedinsulinsignalingblockadeinhuman hepG2 hepatoma cells[J].Mol Nutr Food Res,2008,52(8):930-939.
[16]KIM J A.Mechanisms underlying beneficial health effects of tea catechins to improve insulin resistance and endothelial dysfunction[J].Endocr Metab Immune Disord Drug Targets,2008,8(2): 82-88.
[17]WILDING J P H.PPAR agonists for the treatment of cardiovascular disease in patients with diabetes[J].Diabetes Obesity and Metabolism,2012,14(11):973-982.
[18]LAO W,TAN Y,JIN X,et al.Comparison of cytotoxicity and the anti-adipogenic effect of green tea polyphenols with epigallocatechin-3-gallate in 3T3-L1 preadipocytes[J].Am JChin Med,2015,43(6):1177-1190.
[19]夏燕萍,陈刚,俞茂华.茶多酚对实验性肥胖大鼠脂肪组织PPAR-r表达的影响[J].中国糖尿病杂志,2012,20(8):625-628.
[20]PATEL NG,HOLDER J C,SMITH S A,et al.Differential regulation of lipogene leptin production by independent signaling pathways and rosiglitazone human adipocyte differentiation[J]. Diabetes,2003,52(1):43-50.
[21]CONG L,CAO C,CHENG Y,et al.Green tea polyphenols attenuated glutamate excitotoxicity via antioxidative and antiapoptotic pathway in the primary cultured cortical neurons[J].OxidMed Cell Longev,2016,19(1):205-211.
[22]ANANDHARAJAN R,JAIGANESH S,SHANKERNARAYANAN N P,et al.In vitro glucose uptake activity of Aegles marmelos and Syzygium cumini by activation of Glut-4,PI3 kinase and PPARgamma in L6 myotubes[J].Phytomedicine,2006,13(6): 434-441.
[23]LI R,WANG W Q,ZHANG H F,et al.Adiponectin improves endothelial function in hyperlipidemic rats by reducing oxidative/nitrative stress and differential regulation of eNOS/iNOS activity[J].AJP-Endocrinol Metab,2007,293:1703-1708.
(申海菊编辑)
Effect of tea polyphenols on improving insulin resistance of rats with metabolic syndrome*
Yan-ping Xia,Mao-hua Yu,Wei Chen,Gang Chen
(Department of Geratology,Huashan Hospital,Fudan University,Shanghai 200040,China)
Objective To observe the effect of tea polyphenols on rats with metabolic syndrome(MS)and its molecular mechanism.Methods A rat model of metabolic syndrome was induced by high-glucose and high-fat diet.After intervention of tea polyphenols for 16 weeks the levels of blood glucose,blood fat,fasting insulin and free fatty acid were detected,and the index of insulin resistance(HOMA-IR)was calculated.The mRNA expressions of peroxisome proliferators activiated receptor-γ(PPAR-γ),adiponectin,TNF-α,phosphatidylinositol-3 kinase(PI3K)and protein kinase B in adipose tissue were detected by RT-PCR;and their protein expressions were detected by Western blot.Results The levels of fasting blood glucose,triglyceride,cholesterol,LDL,free fatty acid and HOMR-IR in the tea polyphenol group were significantly lower than those in the control group(P<0.05).Compared with the control group,the mRNA and protein expressions of PPAR-γ,adiponectin,PI3K and protein kinase B in the adipose tissue of the tea polyphenol group were upregulated(P<0.05).The mRNA and protein expressions of TNF-α in the tea polyphenol group were significantly lower than those in the control group(P<0.05).Conclusions Tea polyphenols can improve glucolipid metabolism in MS rats through decreasing the levels of free fatty acid and TNF-α while increasing the expressions of PPARγ,protein kinase B,PI3K and adiponectin.
tea polyphenol;insulin resistance;metabolic syndrome;rat model
R 589
A
10.3969/j.issn.1005-8982.2016.17.001
1005-8982(2016)17-0001-06
2015-09-30
上海市卫生和计划生育委员会科研基金项目(No:20134459)

