高糖环境下mircoRNA-200b影响视网膜血管内皮细胞功能的机制研究*
蒋群,朱小华,刘建明,李兵
(1.中南大学湘雅二医院眼科,湖南长沙410011;2.中南大学湘雅三医院,湖南长沙410013)
高糖环境下mircoRNA-200b影响视网膜血管内皮细胞功能的机制研究*
蒋群1,朱小华1,刘建明2,李兵2
(1.中南大学湘雅二医院眼科,湖南长沙410011;2.中南大学湘雅三医院,湖南长沙410013)
目的探讨高糖环境下microR NA-200b(miR-200b)影响人视网膜血管内皮细胞(hR ECs)功能的作用机制。方法在正常和高糖环境下培养hR ECs,实时荧光定量聚合酶链式反应检测miR-200b表达。分别用miR-200b和特异性miR-200b抑制剂转染hR ECs,并且用噻唑蓝法检测高糖环境下miR-200b对hR ECs增殖的影响。用Western blot测定hR ECs转染miR-200b和miR-200b抑制剂后对血管内皮生长因子(VEGF)、转化生长因子-β1(TGF-β1)蛋白和mR NA的表达的影响。结果高糖组VEGF、TGF-β1mR NA和蛋白表达较对照组增加(P<0.05)。转染miR-200b后,hR ECs中miR-200b表达升高,而VEGF、TGF-β1mR NA和蛋白的表达降低。与高糖组比较,hR ECs增殖受到抑制(P<0.05)。结论miR-200b通过改变VEGF和TGF-β1的表达,调节hR ECs生长和增殖,延缓糖尿病视网膜病变的发生、发展。
糖尿病视网膜病变;视网膜血管内皮细胞;血管内皮生长因子;转化生长因子β1
糖尿病性视网膜病变是糖尿病的重要并发症之一,是导致成人失明的主要原因[1-2]。据世界卫生组织调查,目前全世界有多达3.6亿糖尿病患者,预计2030年将达10亿[3-4]。研究发现,糖尿病视网膜病变(diabetic retinopathy,DR)与高糖环境对视网膜微血管系统损害密切相关[5]。DR可以影响视网膜结构,导致其代谢和功能紊乱。视网膜微血管内皮细胞负责视网膜神经营养需求。视网膜微血管内皮细胞维持血-视网膜屏障稳定,并清除毒素和炎症因子,其在保护视力方面发挥关键作用[6-7]。microRNA(miRNA)是一种有调节功能的短链非编码RNA,广泛存在在动植物中[8]。miRNA可降解为mRNA并且通过与靶基因完全或不完全配对,或通过抑制下游靶蛋白的表达来调节蛋白质翻译[9]。miRNA与癌症发生有关[10-12],与其他疾病的关系尚未见报道。miR-200b是一种新发现的miRNA,研究发现糖尿病患者的miR-200b表达明显降低,并与糖尿病的发展密切相关。因此,miR-200b被认为参与糖尿病的发生、发展[13-14]。进一步研究表明,miR-200b可能参与DR的发生、发展[15]。但miR-200b作用于视网膜内皮细胞的具体功能和机制仍不清楚。高血糖状态会导致视网膜血管内皮细胞(retinal endothelial cell,REC)直接或间接损伤,可导致视力障碍和DR的发生。同时,血管内皮生长因子(vascular endothelial growth factor,VEGF)和转化生长因子β1(transforming growth factor-β1,TGF-β1)被证实参与DR病变的调节机制[16-17]。本研究目的是探讨高糖状态下miR-200b对REC的影响及其调节TGF-β1、VEGF的机制,分析miR-200b在DR中的作用。
1 材料与方法
1.1实验试剂与仪器
人视网膜血管内皮细胞(human retinal endothelial cells,hRECs)购于美国Sciencell公司,青霉素、链霉素和乙二胺四乙酸为美国Hyclone公司产品,Enzyme-乙二胺四乙酸购于美国Sigma公司,二甲基亚砜(dimethyl sulfoxide,DMSO)和噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]购自美国Gibco公司,RNA提取试剂盒、反转录试剂盒lipo2000购自美国Invitrogen公司,增强化学发光法(enhanced chemiluminescence,ECL)试剂购自瑞典Amersham biociences公司,兔抗人VEGF和TGF-β1抗体、标记免疫球蛋白G二抗辣根过氧化物酶购自美国Cell signaling公司,Western blot检测试剂盒购自上海Beyotime公司,DNA扩增器和聚合酶链式反应(polymerase chain reaction,PCR)仪为美国ABI公司产品,其他常见的试剂购于上海生物工程有限公司。
1.2实验方法
1.2.1hR ECs培养和分组将hRECs接种在不含胎牛血清,含5.5 mmol/L葡萄糖的达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)中,(含100 u/ml青霉素和100μg/ml链霉素),第8代细胞数达1×106个/cm2,将其随机分为4组:①对照组:正常情况下细胞培养;②高糖组:在高糖环境下诱导培养72 h后,hRECs在33 mmol/L葡萄糖的微血管内皮细胞培养基增殖;③转染组:转染miR-200b的REC-5细胞在高糖条件下培养;④抑制剂组:转染miR-200b抑制剂的REC-5细胞在普通条件下培养。
1.2.2miR-200b及抑制剂转染miR-200b及抑制剂由在上海吉玛公司模拟合成。其序列分别为5'-UAAUACUGCCUGGUAAUGAUGAC-3'和5'-AU UAUGACGGACCAUUACUACUG-3'。在普通条件和高糖环境下,用转染液lipo2000将miR-200b抑制剂和miR-200b转染hRECs。hRECs在增殖期,接种于3×106个/cm2的6孔培养板,37℃、5%二氧化碳CO2培养箱中培养12h,将混有miR-200b和抑制剂的lipo2000转染液添加到细胞培养8h,用10%胎牛血清的DMEM培养液继续培养。
1.2.3实时荧光定量聚合酶链式反应用Trizol从hRECs中提取mRNA,应用实时荧光定量PCR检测目标基因的表达。反应条件为:52℃预变性60 s,90℃变性30s,58℃退火50s,72℃延伸35s,共35个循环。见附表。

附表PCR反应相关引物
1.2.4MTT细胞接种于96孔板后,取5 g/L MTT溶液20μl添加至每孔,孵育4h。除上清液后,加入150μl DMSO,10 min后,采用紫外分光光度仪测570nm处吸光度值,计算细胞增殖率。
1.2.5Western blot检测从超声处理的提取液中提取hRECs总蛋白。10000r/min离心15min,取上清液转移到新的Eppendorf管,置于-20℃冰箱冷冻存放。蛋白质由10%聚丙烯酰胺凝胶电泳分离并转移到聚偏二氟乙烯膜膜,用5%脱脂奶封闭2h,与VEGF抗体(1∶1 000)或TGF-β1抗体(1∶2 000)在4℃共同孵育一整夜;用聚丁二酸-共-对苯二甲酸丁二醇酯漂洗后,膜被进一步与羊抗兔二抗体(1∶2000)一起孵育30min,用化学发光剂显像。IPP 6.0软件分析Western blot条带。
1.3统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1hRECs中miR-200b表达
实时荧光定量PCR检测hRECs中miR-200b表达,结果显示,逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)的扩增曲线、熔解曲线稳定,提示miR-200b的异物特异性好,能较好地检测hRECs中miR-200b的表达。见图1~2。

图1 miR-200b的RT-PCR扩增曲线图
各组miR-200b表达比较,经单因素方差分析,差异有统计学意义(F=22.511,P=0.000)。各组miR-200b表达比较,经LSD-t检验,抑制剂组和高糖组中miR-200b表达低于对照组,差异有统计学意义(t=3.972,P=0.003),转染组中miR-200b表达高于高糖组,差异有统计学意义(t=3.171,P=0.010)。见图3。

图3 miR-200b的表达
2.2miR-200b对hRECs细胞增殖的影响
MTT法检测在高血糖环境下miR-200b对hRECs细胞增殖的影响,结果发现,各组hRECs增殖率比较,经单因素方差分析,差异有统计学意义(F= 7.286,P=0.011)。各组miR-200b表达比较,经LSD-t检验,抑制剂组和高糖组中hRECs增殖率高于对照组,差异有统计学意义(t=5.561,P=0.001),转染组中hRECs增殖率低于高糖组,差异有统计学意义(t=2.383,P=0.039)。表明miR-200b降低可以促进血管内皮细胞增殖,而增高能抑制靶细胞视网膜血管内皮细胞增殖。见图4。
2.3miR-200b对hRECs内VEGF和TGF-β1 mRNA表达的影响
采用实时定量PCR反应检测在高血糖环境下miR-200b对hRECs中VEGF和TGF-β1mRNA的表达影响。各组hRECs的VEGF和TGF-β1mRNA表达比较,经单因素方差分析,差异有统计学意义(F= 13.801和8.72,P=0.003和0.007)。各组hRECs的VEGF和TGF-β1mRNA表达比较,经LSD-t检验,抑制剂组和高糖组中hRECs的VEGF和TGF-β1mRNA表达高于对照组(t=4.733和6.551,P=0.000和0.001),转染组中hRECs的VEGF和TGF-β1 mRNA表达低于高糖组(t=4.301和6.913,P=0.025和0.010)。见图5。
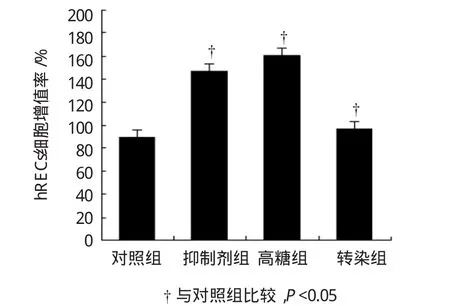
图4 miR-200b对hRECs增殖的比较

图5 miR-200b对VEGF和TGF-β1mRNA影响的比较
2.4miR-200b对hRECs中VEGF和TGF-β1蛋白表达的影响
Western blot测定hRECs转染miR-200b后对VEGF和TGF-β1蛋白及mRNA的表达的影响。各组hRECs的VEGF和TGF-β1蛋白表达水平比较,经单因素方差分析,差异有统计学意义(F=20.131和16.303,P=0.000和0.001)。各组hRECs的VEGF和TGF-β1蛋白表达表达比较,经LSD-t检验,抑制剂组和高糖组hRECs的VEGF和TGF-β1蛋白表达高于对照组,差异有统计学意义(t=3.443和 4.121,P=0.021和0.015),转染组中hRECs的VEGF和TGF-β1蛋白表达低于高糖组,差异有统计学意义(t=5.113和7.214,P=0.023和0.001)。研究表明,高糖环境可以抑制hRECs中miR-200b,促进VEGF、TGF-β1mRNA和蛋白的表达,进一步引起视网膜血管内皮细胞结构和功能紊乱。转染miR-200b后靶向细胞促进其表达,并下调VEGF、TGF-β1 mRNA和蛋白的表达,从而改善糖尿病视网膜病变。见图6~7。
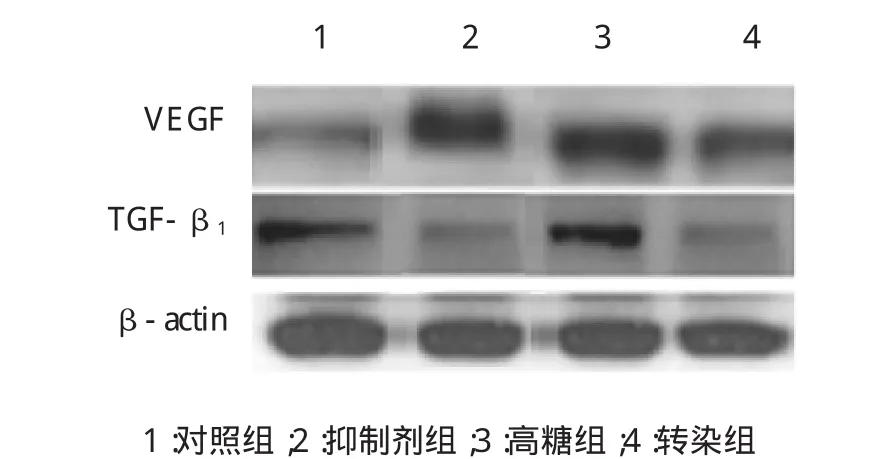
图6 miR-200b对hRECs中VEGF和TGF-β1蛋白表达的影响

图7 miR-200b对hRECs中VEGF和TGF-β1蛋白表达影响
3 讨论
糖尿病视网膜病变是一种常见的糖尿病微血管并发症,可导致视网膜微血管进行性损伤。其严重影响患者的身心健康,给社会带来沉重经济负担[18-19]。尽管医学不断进步,治疗效果仍不满意。高血糖环境可导致糖尿病患者视网膜血管内皮细胞发生一系列内分泌代谢变化。高血糖是导致糖尿病并发症发生、发展的重要因素,可引起器官结构和功能紊乱[20-21]。视网膜血管内皮细胞结构和功能改变是糖尿病慢性过程的主要病理机制。高血糖可导致视网膜血管内皮细胞功能障碍,包括通过调节内皮素和血管内皮生长因子促进细胞增殖和新生血管形成[22-23]。
miRNA参与各种生理过程,包括细胞增殖、凋亡、信号转导、分化、代谢和激素分泌,以及维持胚胎干细胞的潜能。其能调节人体的生长发育,使人体适应环境。
目前,有关miRNA的大量研究主要集中在其对肿瘤发生、发展、侵袭、转移和其他生物特征的作用上[9],而有关miRNA在糖尿病视网膜病变中的作用报道较少。
miR-200b参与调节糖尿病的发生、发展[10],但其在糖尿病视网膜病变研究中的作用尚未阐明。通过hRECs培养和高糖环境处理,本研究证实,在高糖状态下hRECs中miR-200b水平下降,进一步表明细胞可以通过转染miR-200b抑制hRECs异常增殖。
VEGF有多种亚型,通过结合相应受体发挥作用。大部分相应受体位于内皮细胞表面,VEGF特异性结合可改变血管通透性,促进血管形成。因此,对于早期的糖尿病视网膜病变,血管内皮生长因子可通过调节改变血管通透性;晚期其参与糖尿病视网膜新生血管形成[24-25]。TGF-β1是一种多肽生长因子,广泛分布于众多细胞中,具有多种生物学功能。其调节细胞生长、分化和迁移,调节细胞外基质的合成和分泌,并参与免疫调节,在糖尿病视网膜病变的形成过程中发挥重要的作用。TGF-β1还是一种促细胞增殖的重要调控因子,能上调整联蛋白的表达,促进细胞外基质分泌,调节细胞与基质的相互作用,趋化巨噬细胞促进新生血管形成和成纤维细胞生长。其通过抑制抗体生成和淋巴细胞增殖,抑制CTL、NK、LAK细胞的细胞毒作用,发挥免疫抑制作用[26-27]。目前,有关TGF-β1在糖尿病视网膜病变中作用的研究未见报道。因此,笔者重点研究miR-200b对视网膜血管内皮细胞的影响。经证实,高糖环境下通过抑制miR-200b表达可促进VEGF、TGF-β1mRNA和蛋白的表达,促进内皮细胞增殖和新生血管形成,导致视网膜病变。通过上调miR-200b表达可以减少VEGF、TGF-β1mRNA和蛋白的表达,改善血管内皮细胞的结构和功能,延缓DR的进展。
综上所述,通过miR-200b改变VEGF和TGF-β1表达,可导致视网膜血管内皮细胞的生长和增殖,可以延缓DR的进展。
[1]ANTONETTI D A,KLEIN R,GARDNER T W.Mechanisms of disease diabetic retinopathy[J].N Engl J Med,2012,366(13): 1227-1239.
[2]MYSONA B A,MATRAGOON S,STEPHENS M,et al.Imbalance of the nerve growth factor and its precursor as a potential biomarker for diabetic retinopathy[J].Biomed Res Int,2015,15(8): DOI:10.1155/2015/571456.
[3]PARK Y H,SHIN J A,HAN J H,et al.The association between chronic kidney disease and diabetic retinopathy:the Korea nationalhealth and nutrition examination survey 2008-2010[J]. PLoS One,2015,10(4):353-381.
[4]BOYNTON G E,STEM MS,KWARK L,et al.Multimodal characterization of proliferative diabetic retinopathy reveals alterations in outer retinal function and structure[J].Ophthalmology,2015, 122(5):957-967.
[5]GARCIAdeLATORREN,FERNANDEZ-DURANGOR, GOMEZ R,et al.Expression of angiogenic microRNAs in endothelial progenitor cells from type 1 diabetic patients with and without diabetic retinopathy[J].Invest Ophthalmol Vis Sci,2015, 56(6):4090-4098.
[6]SAVAGE S R,MCCOLLUM G W,YANG R,et al.RNA-seq identifies a role for the PPAR beta/delta inverse agonist GSK0660 in the regulation of TNFalpha-induced cytokine signaling in retinal endothelial cells[J].Mol Vis,2015,21:568-576.
[7]LOUKOVAARA S,GUCCIARDO E,REPO P,et al.Indications of lymphatic endothelial differentiation and endothelial progenitor cell activation in the pathology of proliferative diabetic retinopathy[J].Acta Ophthalmol,2015,93(6):512-523.
[8]ORANG A V,BARZEGARI A.MicroRNAs in colorectal cancer: from diagnosis to targeted therapy[J].Asian Pac J Cancer Prev, 2014,15(17):6989-6999.
[9]GANDHI N S,TEKADE R K,CHOUGULEM B.Nanocarrier mediated delivery of siRNA/miRNA in combination with chemotherapeutic agents for cancer therapy:current progress and advances[J].J Control Release,2014,194:238-256.
[10]张潍,张伟,王辉,等.miRNA-141、miRNA-145在非小细胞肺癌中的表达及与临床病理的关系[J].西安交通大学报,2015,36(3): 368-372.
[11]秦丹丹,任野平.miRNA-30a在肾细胞癌中的表达及作用[J].中国肿瘤临床,2015,42(13):663-667.
[12]许常娟,邓丹玲,丁彦青,等.miRNA-143靶向MACC1抑制宫颈癌细胞侵袭[J].中国肿瘤临床,2015,42(18):900-905.
[13]RUIZ M A,FENG B,CHAKRABARTI S.Polycomb repressive complex 2 regulates miR-200b in retinal endothelial cells:po tential relevance in diabetic retinopathy[J].PLoS One,2015,10(4): DOI:10.1371/journal.pone.0123987.
[14]CAO Y,FENG B,CHEN S,et al.Mechanisms of endothelial to mesenchymal transition in the retina in diabetes[J].Invest Ophthalmol Vis Sci,2014,55(11):7321-7331.
[15]MURRAY A R,CHEN Q,TAKAHASHI Y,et al.MicroRNA-200b downregulates oxidation resistance 1(Oxr1)expression inthe retina of type 1 diabetes model[J].Invest Ophthalmol Vis Sci,2013,54(3):1689-1697.
[16]SHIN E S,SORENSON C M,SHEIBANI N.Diabetes and retinal vascular dysfunction[J].Ophthalmic Vis Res,2014,9(3): 362-373.
[17]RAJAMANI U,IALAL I.Hyperglycemia induces Toll-like receptor-2 and-4 expression and activity in human microvascular retinal endothelial cells:implications for diabetic retinopathy[J]. J Diabetes Res,2014,15(8):DOI:10.1155/2014/790902.
[18]LIU L,WU J,YUE S,et al.Incidence density and risk factors of diabetic retinopathy within type 2 diabetes:a five-year cohort study in China(Report 1)[J].Int J Environ Res Public Health,2015,12(7):7899-7909.
[19]郑志.糖尿病视网膜病变临床防治:进展、挑战与展望[J].中华眼底病杂志,2012,28:209-214.
[20]CASTILHO A,MADSEN E,AMBROSIO A F,et al.Diabetic hyperglycemia reduces Ca2+permeability of extrasynaptic AMPA receptors in AII amacrine cells[J].J Neurophysiol,2015,114(3): 1545-1553.
[21]BAPTISTA F I,CASTILHO A F,GASPAR J M,et al.Long-term exposure to high glucose increases the content of several exocytotic proteins and of vesicular GABA transporter in cultured retinal neural cells[J].Neurosci Lett,2015,602:56-61.
[22]MONAGHAN K,MCNAUGHTEN J,MCGAHON M K,et al. Hyperglycemia and diabetes downregulate the functional expression of TRPV4 channels in retinal microvascular endothelium[J]. PLoS One,2015,10(6):DOI:10.1371/journal.pone.0128359.
[23]BEHL T,KAUR I,KOTWANI A.Implication of oxidative stress in progression of diabetic retinopathy[J].Surv Ophthalmol,2016, 61(2):187-196.
[24]BEHL T,KAUR I,GOEL H,et al.Significance of the antiangiogenic mechanisms of thalidomide in the therapy of diabetic retinopathy[J].Vascul Pharmacol,2015,16(7):3.
[25]JIANG Y,ZHANG Q,STEINLE J J.Beta-adrenergic receptor agonist decreases VEGF levels through altered eNOS and PKC signaling in diabetic retina[J].Growth Factors,2015,33(3):192-199.
[26]KO H.Geraniin inhibits TGF-beta1-induced epithelial-mesenchymal transition and suppresses A549 lung cancer migration, invasion and anoikis resistance[J].Bioorg Med Chem Lett,2015, 25(17):3529-3534.
[27]KAMATH V V,KRISHNAMURTHY S,SATELUR K P,et al. Transforming growth factor-beta1 and TGF-beta2 act synergistically in the fibrotic pathway in oral submucous fibrosis:an immunohistochemical observation[J].Indian J Med Paediatr Oncol, 2015,36(2):111-116.
(童颖丹编辑)
Effect ofmicroRNA-200bon function of retinal endothelial cells under high-glucose environment and related mechanism*
Qun Jiang1,Xiao-hua Zhu1,Jian-ming Liu2,Bing Li2
(1.Department of Ophthalmology,the Second Xiangya Hospital,Central South University,Changsha,Hunan 410011,China;2.The Third Xiangya Hospital,Central South University,Changsha,Hunan 410013,China)
Objective To investigate the effect ofmicroRNA-200b(miR-200b)on human retinal endothelial cells(hRECs)under high-glucose environment and its mechanism.Methods hRECs were cultured under high-glucose or normal environment.Real time PCR was applied to detectmiR-200bexpression.miR-200b was transfected to hRECs and MTT was used to detect its effect on hRECs proliferation under high-glucose environment.Real time PCR and Western blot were performed to determine VEGF and TGF-β1 expressions in the retina endothelial cells.Results Compared with the normal control group,VEGF and TGF-β1 mRNA and protein expressions increased markedly in the high-glucose group(P<0.05).AftermiR-200btransfection,miR-200bexpression increased in the hRECs,while VEGF and TGF-β1 mRNA and protein expressions decreased obviously.Compared with the high-glucose group,hRECs proliferation was inhibited(P<0.05). ConclusionsmiR-200bcan regulate the growth and proliferation of RECs by changing VEGF and TGF-β1 expression and delay diabetic retinopathy.
diabetic retinopathy;retinal endothelial cell;VEGF;TGF-β1
R 774.1
A
10.3969/j.issn.1005-8982.2016.17.005
1005-8982(2016)17-0023-06
2015-12-03
湖南省科技厅项目(No:2014TT2024、2012TT2029)
刘建明,E-mail:liujianming101@sina.com

