儿童患者中分离的碳青霉烯类耐药肺炎克雷伯菌分子流行病学分析及耐药机制研究
祝俊英, 王 春, 孙 燕, 胡付品, 张 泓
·论著·
儿童患者中分离的碳青霉烯类耐药肺炎克雷伯菌分子流行病学分析及耐药机制研究
祝俊英1, 王 春1, 孙 燕1, 胡付品2, 张 泓1
目的 研究儿童患者中分离的碳青霉烯类耐药肺炎克雷伯菌 (CRKP)的流行特征及耐药机制。方法 收集2013年1-12月上海市儿童医院临床微生物室分离的12株碳青霉烯类耐药肺炎克雷伯菌,采用琼脂稀释法检测其对常用抗菌药物的耐药性,乙二胺四乙酸(EDTA)协同试验和3'-氨基苯硼酸(APB)协同试验进行碳青霉烯酶表型分析,PCR扩增及DNA测序进行碳青霉烯酶基因型确证,接合试验检测碳青霉烯酶耐药基因是否位于质粒上,脉冲场凝胶电泳(PFGE)和多位点序列分型(MLST)检测菌株间基因相关性。结果 12株CRKP对多黏菌素E均敏感,对头孢菌素类耐药率均为100%,对亚胺培南、美罗培南和厄他培南耐药率分别为91.7%、91.7%和100%。PCR及DNA测序显示12株CRKP中8株产KPC-2,1株产NDM-1,3株未检出碳青霉烯酶。将12株CRKP与大肠埃希菌J53进行接合,获得3株接合子。PFGE分型显示,12株CRKP可分为4个型3个亚型。MLST结果显示,8株blaKPC阳性肺炎克雷伯菌均为ST11型,1株blaNDM-1阳性肺炎克雷伯菌为ST278,3株不产碳青霉烯酶菌分别为ST76、ST37、ST610。结论 产KPC-2型碳青霉烯酶是该院分离的肺炎克雷伯菌对碳青霉烯类抗菌药物耐药的主要机制,产NDM-1阳性的肺炎克雷伯菌已在该院出现。
儿童; 碳青霉烯酶; 肺炎克雷伯菌
碳青霉烯类是临床治疗多重耐药肠杆菌科细菌感染的有效抗生素。该类药物在临床上的广泛使用使细菌不可避免的产生了耐药性,产碳青霉烯酶是肠杆菌科细菌对碳青霉烯类抗生素耐药的主要机制[1]。自2001年美国报道第1株产KPC型碳青霉烯酶耐药菌后,碳青霉烯类耐药肠杆菌科细菌(carbapenem-resistant Enterobacteriaceae, CRE)在全球被广泛报道[2]。2009年,YONG等[3]在1例有过印度住院史的瑞典人尿液中检出第1株产新德里金属β内酰胺酶(NDM)的肠杆菌科细菌,此后,该类菌株在全球广泛播散并引起暴发流行。2013年,HU等[4]在江西检出我国大陆地区第1株产NDM-1肠杆菌科细菌。产KPC酶和NDM-1酶的肠杆菌科细菌感染给患者健康造成极大的威胁。本研究对上海市儿童医院儿童患者分离的CRE进行研究,以了解CRE在儿童患者中的流行特征及耐药机制。
1 材料与方法
1.1 材料
1.1.1 细菌来源 收集上海市儿童医院2013年1-12月临床分离的12株碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)作为研究对象。CRKP定义为对亚胺培南、美罗培南或厄他培南中任一药物耐药者。
1.1.2 培养基 药敏试验用MH琼脂,接合试验用MH肉汤,均购自英国OXOID公司。
1.1.3 抗菌药物 抗菌药物标准品购自上海市药品检验所。
1.2 方法
1.2.1 药敏试验 参照2014年CLSI推荐的琼脂稀释法测定12株CRKP对14种抗菌药物的敏感性,大肠埃希菌ATCC 25922为质控菌株。药敏试验结果中,除多黏菌素E和替加环素按照EUCAST折点判断标准外,其他药物均按照CLSI 2014版折点标准判读。
1.2.2 碳青霉烯酶表型及基因型检测 使用无菌生理盐水将待测菌调至0.5麦氏单位,用棉签将菌液均匀涂布于MH平皿上,用镊子在MH平皿上均匀地贴3张厄他培南纸片,第1张纸片滴加0.1 mol/L二胺四乙酸(EDTA)溶液10 μL,第2张滴加50 mg/mL的3'- 氨基苯硼酸(APB)6 μL,第3张不做任何处理。35℃过夜培养后观察结果,加有EDTA的厄他培南纸片与未做任何处理的纸片抑菌圈直径相差≥5 mm提示为产金属酶菌株。加APB的厄他培南纸片与未做任何处理纸片抑菌圈直径相差≥5 mm为产KPC酶菌株。
1.2.3 PCR扩增 采用PCR法扩增碳青霉烯酶(KPC、NDM-1、IMP、VIM、AIM、SPM、GIM、BIC、SIM、DIM)、AmpC酶(MOX、CIT、DHA、ACC、EBC、FOX)、 ESBL(CTX-M)耐药基因,所用引物参考文献 [5-7]。阳性产物测序后在美国国立生物技术信息中心(NCBI)上BLAST进行比对。
1.2.4 接合试验 选用叠氮钠耐药的大肠埃希菌J53作为受体菌,产碳青霉烯酶菌作为供体菌进行质粒接合试验。供体菌和受体菌分别在MH肉汤中培养后,按照1∶1混合后加于新鲜的MH肉汤中,置于35℃静置孵育6 h后,取100 μL混合液均匀地涂布在含有150 μg/mL叠氮钠和0.25 mg/L厄他培南的MH筛选平皿上,在含药平皿上挑取单个菌落接种于CHROMagar显色平皿上判断是否为接合子,对疑似接合子进行PCR扩增及药敏试验,判断接合试验是否成功。
1.2.5 脉冲场凝胶电泳(PFGE) 采用PFGE对12株CRKP进行同源性分析,菌株经XbaI酶切后包埋于1%琼脂糖凝胶中,在无硫脲的含有0.5×Tris-硼酸(TBE)缓冲液中进行脉冲场电泳,沙门菌H9812为参考菌株。酶切图谱按照美国CDC TENOVER等[8]推荐的方法判读。
1.2.6 多位点序列分型(MLST) 采用PCR扩增12株CRKP 7个管家基因:ropB,gapA, mdh, pgi,phoE, infB, tonB, 引物参见网站(http://bigsdb.web. pasteur.fr/klebsiella/klebsiella.html),扩增产物经过测序后与网站标准序列进行比对。
1.2.7 数据分析 使用WHONET 5.6对MIC结果进行分析。
2 结果
2.1 药敏试验
12株CRKP对14种常用抗菌药物的药敏试验结果见表1。12株CRKP对多黏菌素E全部敏感;对头孢他啶、头孢噻肟、头孢吡肟、头孢西丁和氨曲南率耐药,对亚胺培南、美罗培南和厄他培南耐药率分别为91.7%(11/12)、91.7%(11/12)、100%(12/12),对阿米卡星和环丙沙星耐药率均为83.3%(10/12),对头孢哌酮-舒巴坦和哌拉西林-他唑巴坦耐药率均为91.7%(11/12)。
2.2 碳青霉烯酶表型和基因型
12株CRKP中8株blaKPC-2阳性,1株blaNDM-1阳性,3株未检出碳青霉烯酶基因,12株CRKP中有10株为blaCTX-M阳性。而其他碳青霉烯酶及AmpC酶基因在12株CRKP中均未检测到。APB协同试验和EDTA协同试验表型和基因型检测的符合率分别为6/8和1/3,见表2。
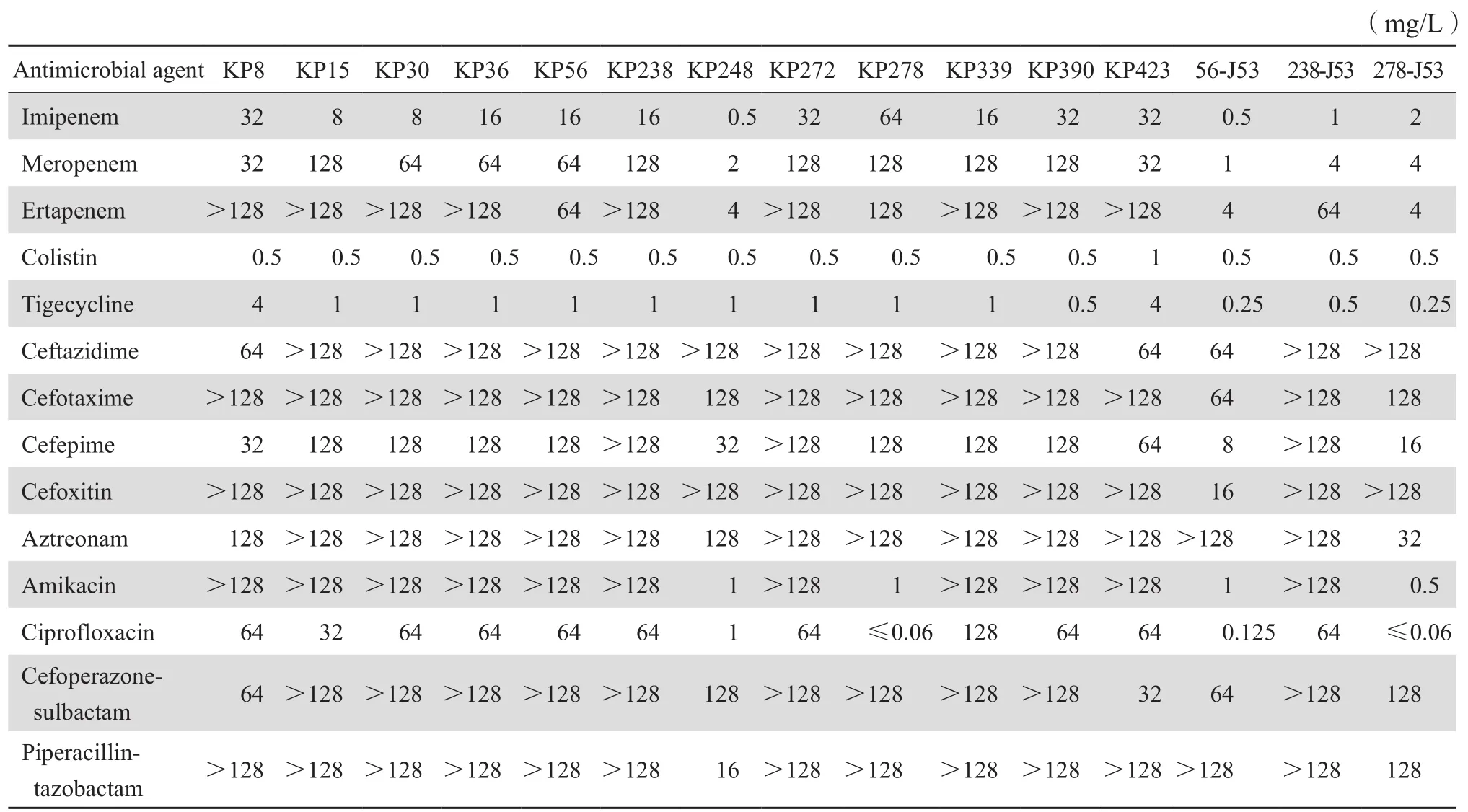
表1 12株碳青霉烯类耐药肺炎克雷伯菌及接合子MIC值Table1 MIC of 12 carbapenem-resistant Klebsiella pneumoniae and transconjugants

表2 12株碳青酶烯类耐药肺炎克雷伯菌 β内酰胺酶表型、基因型和MLST结果Table2 The phenotypic and genetic results of β-lactamase and MLST of 12 CRKP
2.3 CRKP耐药基因水平传播及分子流行病学
2.3.1 接合试验 将已明确碳青霉烯酶基因的9株细菌与受体菌J53接合后,共获得3株接合子,分别为56-J53、238-J53、278-J53,接合子与受体菌相比,对抗菌药物MIC明显升高,见表1。
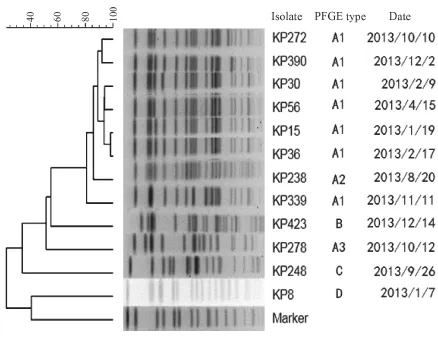
图1 12株碳青霉烯类耐药肺炎克雷伯菌经脉冲场凝胶电泳后所得聚类分析树状图Figure 1 Dendrogram obtained from pulsed-field gel electrophoresis (PFGE) profiles of XbaI-digested genomics DNAs from 12 carbapenem-resistant Klebsiella pneumoniae isolates
2.3.2 分子流行病学检测(PFGE、MLST) PFGE将12株CRKP分为4个型3个亚型(A1、A2、A3、B、C、D),12株CRKP的树状图分析见图1,主要来源于新生儿病房(41.7%,5/12)、综合病房(多为弃婴)(25.0%,3/12)及重症监护病房(16.7%, 2/12)。对12株CRKP 7个管家基因进行扩增、测序并与网站内已建立的标准进行比对,12株CRKP主要分为ST11、ST37、ST278、ST610、ST76 5种ST型别,见图1。
3 讨论
碳青霉烯类抗生素具有抗菌谱广、抗菌活性强等特点,是治疗多重耐药肠杆菌科细菌感染的最后一道防线。近年来,其在临床的使用增多使CRE不断增多,2008-2013年CHINET监测数据显示肠杆菌科细菌中碳青霉烯类耐药菌株的检出率由2008年的<1%升至2013年的<7%,临床分离的CRE以肺炎克雷伯菌为主[9-10]。CRE感染性疾病具有高发病率和高病死率的特性,儿童患者由于基础免疫力较低更容易感染CRE[11]。因此,研究儿童患者中CRE的流行特征和耐药机制非常重要,我国对于儿童患者CRE流行的数据相对较少,本研究针对2013年1-12月上海市儿童医院收集的12株CRKP进行研究。
12株CRKP多为多重耐药菌,对多黏菌素E均敏感,其次为替加环素、阿米卡星和环丙沙星,耐药率均为16.7%。CRKP对阿米卡星和环丙沙星耐药率较低的原因可能是这2种药物特定不良反应而少用或禁用于儿童。替加环素作为近年国内刚上市的甘氨环素类药物,其耐药菌株的出现应引起临床广泛重视。总之,多重耐药菌的出现及有限的抗菌药物选择给临床抗感染治疗造成了更大的挑战,及时监测耐药菌的流行播散,并采取相应防控措施极为重要。
目前,国内外报道最多的碳青霉烯酶是KPC型,本研究收集了2013年儿童患者体内分离的12株CRKP,发现上海市儿童医院患儿中分离的肺炎克雷伯菌所产碳青霉烯酶与成人相同,主要产KPC-2型,占75.0 %。值得注意的是,我们发现1株产NDM-1酶的肺炎克雷伯菌,NDM-1最初发现于印度和巴基斯坦等南亚地区,此后因跨国医疗和旅游而在全球各地播散。自2013年江西检出第1株NDM-1型肺炎克雷伯菌后,NDM-1在肠杆菌科细菌中检出在各地区陆续报道,2015年湖南和山东各报道了一次产NDM-1肺炎克雷伯菌在新生儿病房和新生儿重症监护病房(NICU)的流行[12-13]。但北京地区儿童患者分离的CRKP以产KPC和IMP-4型金属酶为主,不同地区CRKP产生的碳青霉烯酶类型不同,可能与各地区使用抗菌药物种类不同有关[14],及时监测耐药菌变迁以防止其大范围流行非常迫切。本研究发现2株CRKP(KP8,KP423)表型试验和基因型检测均为阴性,其耐药机制可能是膜孔蛋白丢失合并产ESBL或AmpC酶;此外,有2株(KP248,KP390)EDTA协同试验阳性的CRKP也未检出金属碳青霉烯酶,推测可能是某种金属酶的变异体或新型金属碳青霉烯酶导致细菌耐药,其耐药机制还需进一步研究阐明。
MLST结果显示,12株CRKP以ST11为主,这与国内其他研究相似,另外还有ST37、ST278、ST610、ST76的出现。PFGE同源性分析显示产KPC-2的肺炎克雷伯菌ST11型具有较高的同源性,3株产KPC型和NDM-1型酶的CRKP可通过接合试验与大肠埃希菌J53接合,证明碳青霉烯酶基因位于可移动质粒或基因元件上,可导致耐药基因在细菌间水平传播。及时监测耐药菌出现以避免耐药菌大范围暴发流行意义重大。
[1]QUEENAN AM, BUSH K. Carbapenemases: the versatile beta-lactamases [J]. Clin Microbiol Rev, 2007, 20(3): 440-458.
[2]YIGITI H, QUEENAN AM, ANDERSON GJ, et al. Novel carbapenem-hydrolyzing beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae [J]. Antimicrob Agents Chemother, 2001, 45(4): 1151-1161.
[3]YONG D, TOLEMAN MA, GISKE CG, et al. Characterization of a new metallo-beta-lactamase gene, bla(NDM-1), and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India[J]. Antimicrob Agents Chemother, 2009, 53(12): 5046-5054.
[4]HU L, ZHONG Q, TU J, et al. Emergence of blaNDM-1 among Klebsiella pneumoniae ST15 and novel ST1031 clinical isolates in China [J]. Diagn Microbiol Infect Dis, 2013, 75(4): 373-376.
[5]WOODFORD N, FAGAN EJ, ELLINGTON MJ. Multiplex PCR for rapid detection of genes encoding CTX-M extendedspectrum( beta)-lactamases [J]. J Antimicrob Chemother,2006, 57(1): 154-155.
[6]POIRE L, WALSH TR, CUVILLIER V, et al. Multiplex PCR for detection of acquired carbapenemase genes [J]. Diagn Microbiol Infect Dis, 2011, 70(1): 119-123.
[7]DALLENNE C, DA COSTA A, DECRE D, et al. Development of a set of multiplex PCR assays for the detection of genes encoding important beta-lactamases in Enterobacteriaceae [J]. J Antimicrob Chemother, 2010, 65(3): 490-495.
[8]TENOVER FC, ARBEIT RD, GOERING RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing [J]. J Clin Microbiol, 1995, 33(9): 2233-2239.
[9]汪复,朱德妹,胡付品,等. 2008年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2009,9(5):321-329.
[10]胡付品,朱德妹,汪复,等. 2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,(5):365-374.
[11]PATEL G, HUPRIKAR S, FACTOR SH, et al. Outcomes of carbapenem-resistant Klebsiella pneumoniae infection and the impact of antimicrobial and adjunctive therapies[J]. Infect Control Hosp Epidemiol, 2008, 29(12):1099-1106
[12]JIN Y, SHAO C, LI J, et al. Outbreak of multidrug resistant NDM-1-producing Klebsiella pneumoniae from a neonatal unit in Shandong Province, China [J]. PloS one, 2015, 10(3):e0119571.
[13]ZHANG X, LI X, WANG M, et al. Outbreak of NDM-1-producing Klebsiella pneumoniae causing neonatal infection in a teaching hospital in mainland China [J]. Antimicrob Agents Chemother, 2015, 59(7): 4349-4351.
[14]张冀霞,刘颖梅,陈宏斌,等.我国产碳青霉烯酶肠杆菌科细菌的基因型及流行病学研究[J].中华内科杂志,2014,53(2):116-120.
Molecular epidemiology and mechanism of resistance of carbapenem-resistant Klebsiella pneumoniae in pediatric patients
ZHU Junying, WANG Chun, SUN Yan, HU Fupin, ZHANG Hong.
(Department of Laboratory Medicine,Shanghai Children's Hospital, Shanghai Jiaotong University, Shanghai 200040, China)
Objective To characterize the epidemiology and resistance mechanism of the carbapenem-resistant Klebsiella pneumoniae (CRKP) strains isolated from pediatric patients. Methods A total of 12 CRKP strains were isolated in Shanghai Children's Hospital from January to December in 2013. Antimicrobial susceptibility testing was conducted by agar dilution method. The phenotypes of carbapenemase-producing strains were identifed by 3'-aminophenylboronic acid (APB) or EDTA synergy test. Resistance determinants were detected by PCR and DNA sequencing. Conjugation experiment was used to determine whether the carbapenemase genes were located in mobile plasmids. Clonal relatedness was identified by pulsed field gel electrophoresis(PFGE) and multiple locus sequence typing (MLST). Results All the 12 CRKP strains were susceptible to colistin but all resistantto cephalosporins and ertapenem. Overall 91.7% (11/12) of the strains were resistant to both imipenem and meropenem. PCR and DNA sequencing analysis confirmed that 8 isolates produced blaKPC-2and 1 isolate produced blaNDM-1. Carbapenemase-related genes were not found in the remaining 8 strains. The plasmids harboring resistance genes were successfully transferred from 3 of the 12 strains to Escherichia coli J53. The PFGE results showed that the 12 strains of K. pneumoniae were classified into five types and three subtypes. MIST results showed that all the 8 strains of KPC-2carbapenemase-producing K. pneumoniae were ST11 and 1 NDM-1-producing K. pneumoniae strain was ST278, while the remaining 3 isolates belonged to ST76, ST37, ST610, respectively. Conclusions KPC-2 production is one of the mechanisms of carbapenem resistance in K. pneumoniae in the pediatric patients of this hospital. NDM-1-producing K. pneumoniae is emerging in this hospital.
children; carbapenemase; Klebsiella pneumoniae
R378. 996
A
1009-7708 ( 2016) 05-0578-05
10.16718/j.1009-7708.2016.05.009
2015-11-09
2015-12-10
上海卫计委重点学科-传染病与卫生微生物学(15GWZK0101);上海市卫生计生系统重要薄弱学科建设(2015ZB0203)。
1.上海市儿童医院,上海交通大学附属儿童医院检验科,上海 200040;
2. 复旦大学附属华山医院抗生素研究所。
祝俊英(1988—),女,硕士研究生,主要从事细菌耐药机制及分子流行病学研究。
张泓,E-mail:zhanghong3010@126.com。

