铜绿假单胞菌血流感染56例临床分析
陈愉生, 吴春兰,李鸿茹,王大璇,林晓红,林 明,许能銮,胡辛兰
·论著·
铜绿假单胞菌血流感染56例临床分析
陈愉生, 吴春兰,李鸿茹,王大璇,林晓红,林 明,许能銮,胡辛兰*
目的 探讨铜绿假单胞菌血流感染的危险因素和预后影响因素。方法 采用1∶1配对病例对照研究方法,收集福建省立医院各科室2006年1月-2015年9月发生铜绿假单胞菌血流感染的住院患者,按照基础病、性别、年龄、血流感染前住院时间、住院科室配对选择大肠埃希菌或肺炎克雷伯菌血流感染的患者作为对照组,共56对,运用单因素和多因素的条件logistics回归分析危险因素与预后影响因素。结果 经多因素分析发现,先前使用超过2类抗铜绿假单胞菌抗菌药物(OR:4.92,95 % CI:1.31~18.44)、抗MRSA药物(OR: 9.09,95 % CI:1.05~78.99)是铜绿假单胞菌血流感染的独立危险因素;而预后分析提示铜绿假单胞菌组的30 d病死率(30.4 %)显著高于对照组(14.3 %)(χ2:4.171,P= 0.041),进一步多因素logistics回归分析发现高急性生理与慢性健康评分(APACHE Ⅱ评分)(OR:1.23,95 % CI:1.08~1.40)、不恰当的经验治疗(OR: 6.55,95 % CI: 1.44~29.72)是铜绿假单胞菌血流感染死亡的独立危险因素。结论 铜绿假单胞菌血流感染病死率高,疾病的严重程度是其预后的关键因素,而合理使用抗菌药物和恰当的经验治疗将有利于降低铜绿假单胞菌血流感染的发病率和病死率。
铜绿假单胞菌; 血流感染; 危险因素; 预后影响因素
铜绿假单胞菌是医院获得血流感染的主要病原菌,我国细菌耐药性监测网2011-2012年度数据显示,在血流感染病原菌中该菌占7.2 %,居革兰阴性菌第3位,仅次于大肠埃希菌与肺炎克雷伯菌,较2010年度上升了3.1 %[1-2]。铜绿假单胞菌常造成严重感染,铜绿假单胞菌血流感染病死率26 %~39 %[3-4]。本研究采用病例对照研究方法探讨铜绿假单胞菌血流感染的危险因素和预后影响因素,为防治该菌血流感染提供科学依据以进一步降低该菌所致血流感染的发病率、病死率。现报道如下。
1 材料与方法
1.1 病例来源
福建省立医院各科室开放病床2 227张,收集2006年1月-2015年9月铜绿假单胞菌血流感染所有住院患者。
纳入标准:≥18岁住院患者,≥1次血培养铜绿假单胞菌阳性,且有相应感染的临床证据[5],多次感染者取首次感染的资料。
排除标准:铜绿假单胞菌血流感染前有其他病原体血流感染,一过性铜绿假单胞菌培养阳性(仅1次血培养阳性,而无感染的临床征象,在无针对铜绿假单胞菌感染治疗下,再次血培养阴性)。
按1∶1比例选择同科室、同性别、同年龄(±10岁)、基础病相同、血流感染前住院时间相同的大肠埃希菌或肺炎克雷伯菌血流感染而无铜绿假单胞菌血流感染患者为对照组。在配对过程中首先考虑基础疾病和血流感染前住院时间,其次为年龄和科室,最后考虑性别,以达到最优配对。
1.2 方法
1.2.1 病例资料调查 采用回顾性调查方法,按以上纳入标准与排除标准选择研究对象,查阅并收集病案资料,内容主要包括一般项目[如年龄、性别、病区、基础疾病、住院时间、是否存在合并症、入院意识状态、入住ICU、急性生理与慢性健康评分(APACHEⅡ评分)等],耐药情况,原发感染部位和合并其他感染部位,使用侵袭性操作(包括深静脉置管、气管导管、引流管、导尿管、胃管、血管内导管等),先前药物治疗情况,治疗及转归情况等。每个因素均予以明确的定义,并进行准确的测量和调查。先前抗菌药物治疗为确诊血流感染前30 d内使用抗菌药物超过48 h;具有抗铜绿假单胞菌活性抗菌药物包括哌拉西林-他唑巴坦、氨曲南、头孢他啶、头孢哌酮、头孢吡肟、头孢哌酮-舒巴坦、美罗培南、亚胺培南、帕尼培南、比阿培南、环丙沙星、左氧氟沙星,阿米卡星、异帕米星、庆大霉素、妥布霉素和多黏菌素;抗MRSA抗菌药物包括万古霉素、利奈唑胺、替考拉宁[6];不恰当的经验性治疗为从留取阳性血标本24 h内至收到细菌药敏结果期间使用的抗菌药物, 根据体外药敏结果对铜绿假单胞菌均不敏感[7];多重耐药铜绿假单胞菌为耐三类及其以上抗铜绿假单胞菌抗菌药物(包括环丙沙星、头孢他啶、哌拉西林-他唑巴坦、美罗培南、阿米卡星)[8-9]。
1.2.2 细菌鉴定与药敏试验 细菌培养按《全国临床检验操作规程》进行,血培养使用Bact/Alert 3D全自动血培养仪及配套血液增菌培养瓶进行细菌培养,阳性标本按操作规程进行转种,采用法国生物梅里埃公司VITEK 2全自动微生物分析仪对细菌进行鉴定和药敏分析。药敏试验方法和结果判定严格遵照美国临床实验室标准化协会(CLSI)2012年标准,以敏感(S)、中介(I)、耐药(R)报告结果。质控菌株为铜绿假单胞菌ATCC 27853、大肠埃希菌ATCC 25922、金黄色葡萄球菌(金葡菌)ATCC 29213。
1.2.3 数据整理和统计分析 采用SPSS 17.0软件先进行描述性分析,采用t检验或χ2检验对患者临床特点进行分析,然后对危险因素和预后相关因素分别进行单因素分析,在单因素分析的基础上再应用向前逐步筛选变量法(相似比)行条件logistics回归分析,以α= 0.05为检验标准,以P <0.05为差异有统计学意义。
2 结果
2.1 基本情况
共查出83例铜绿假单胞菌血流感染患者,其中排除6例儿童、2例门诊患者、5例资料不全、8例感染铜绿假单胞菌前存在其他病原体血流感染、6例无合适配对,实际配对56例。其中有3对配对组科室无配对,10对性别无配对。铜绿假单胞菌组与对照组在年龄、性别、入住病区、血流感染前住院天数、基础疾病方面差异均无统计学意义,对照组和铜绿假单胞菌组具有可比性。铜绿假单胞菌组和对照组的原发感染源无显著性差异,30 d病死率铜绿假单胞菌组为30.4 %,对照组为14.3 %,差异有统计学意义(χ2:4.171,P= 0.041),归因病死率为16.1 %。见表1。
2.2 常用抗菌药物药敏试验
铜绿假单胞菌组56株铜绿假单胞菌中,18株全敏,占铜绿假单胞菌组总菌株数32.1 %,36株至少对1种抗铜绿假单胞菌抗菌药物耐药,耐药率达64.3 %,15株多重耐药,多重耐药率达26.8 %。对阿米卡星、环丙沙星、左氧氟沙星、头孢吡肟、头孢他啶、哌拉西林-他唑巴坦、亚胺培南和美罗培南的敏感率分别为94.6 %、80.4 %、73.2 %、73.2 %、66.1 %、80.4 %、69.6 %和76.8 %。

表1 铜绿假单胞菌组和对照组的临床特征Table1 Clinical characteristics of patients with P. aeruginosa bloodstream infections or non-P. aeruginosa bloodstream infection
2.3 感染危险因素单因素分析
单因素分析结果表明血流感染前入住ICU,1个月内住院史,先前使用超过1类抗铜绿假单胞菌抗菌药物,超过2类抗铜绿假单胞菌抗菌药物,碳青霉烯类,第三、四代头孢菌素,抗MRSA药物,APACHEⅡ评分≥10分这8项因素是铜绿假单胞菌血流感染的关联因素,见表2。
2.4 感染危险因素多因素条件logistics回归分析
将单因素分析中具有P<0.1的因素及有专业意义的因素予共线性诊断以排除共线性问题,进一步进行多因素(逐步回归法Forward LR)分析,变量的入选和剔除水准分别为0.05和0.1。结果显示先前使用超过2类抗铜绿假单胞菌抗菌药物、使用抗MRSA药物,2项因素在两组中差异均有统计学意义(P <0.05),说明这2个因素是铜绿假单胞菌血流感染的独立危险因素,见表3。
2.5 预后影响因子的单因素与多因素logistics回归分析
单因素分析结果表明合并肺部感染、呼吸衰竭、使用气管镜检查、机械通气、感染性休克、低白蛋白血症、血肌酐升高、高APACHE Ⅱ评分、不恰当的经验性治疗9项与铜绿假单胞菌血流感染预后不良相关,见表4。进一步多因素分析(行共线性诊断排除共线性问题),结果显示高APACHE Ⅱ评分、不恰当的经验性治疗是其死亡的独立预后因素。见表5。

表2 铜绿假单胞菌血流感染条件logistics单因素分析结果Table2 Univariate conditional logistic regression analysis of risk factors for P. aeruginosa bloodstream infection
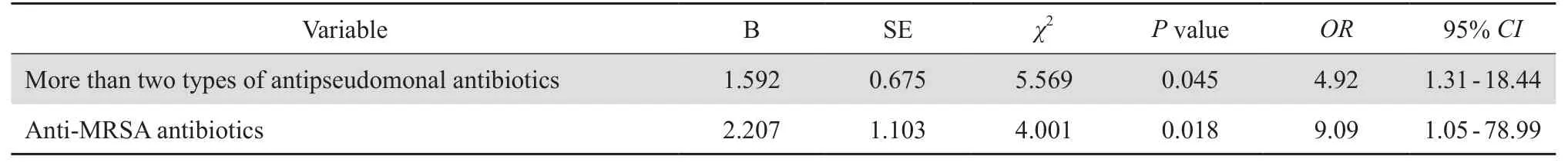
表3 铜绿假单胞菌血流感染多因素条件logistics回归分析结果Table3 Multivariate conditional logistic regression analysis of risk factors for P. aeruginosa bloodstream infection
3 讨论
铜绿假单胞菌血流感染具有高发病率、高病死率的特点,相较于其他非条件致病革兰阴性菌,铜绿假单胞菌血流感染患者给予不恰当的治疗方案不仅可导致不良预后,而且可引起获得性耐药而限制后续用药。因此探讨铜绿假单胞菌相比于其他非条件致病革兰阴性菌血流感染的危险因素具有重要意义。本研究将铜绿假单胞菌血流感染与大肠埃希菌或肺炎克雷伯菌进行配对以探讨铜绿假单胞菌血流感染的危险因素。铜绿假单胞菌血流感染往往医疗情况复杂,高达90 %的患者存在严重的基础疾病,常见基础病包括恶性肿瘤、糖尿病、慢性心功能不全、慢性肾衰竭、脑血管意外;常见的原发感染灶包括肺部感染、尿路感染和原发灶不明[10-11]。本研究结果与之一致。另外,本研究显示常见的基础病还包括胆道疾病,考虑这与医院的病种相关,本研究83.3 %胆道系统疾病留置胆管导管,铜绿假单胞菌可在导管表面形成生物膜,增加血流感染的风险[12-13]。
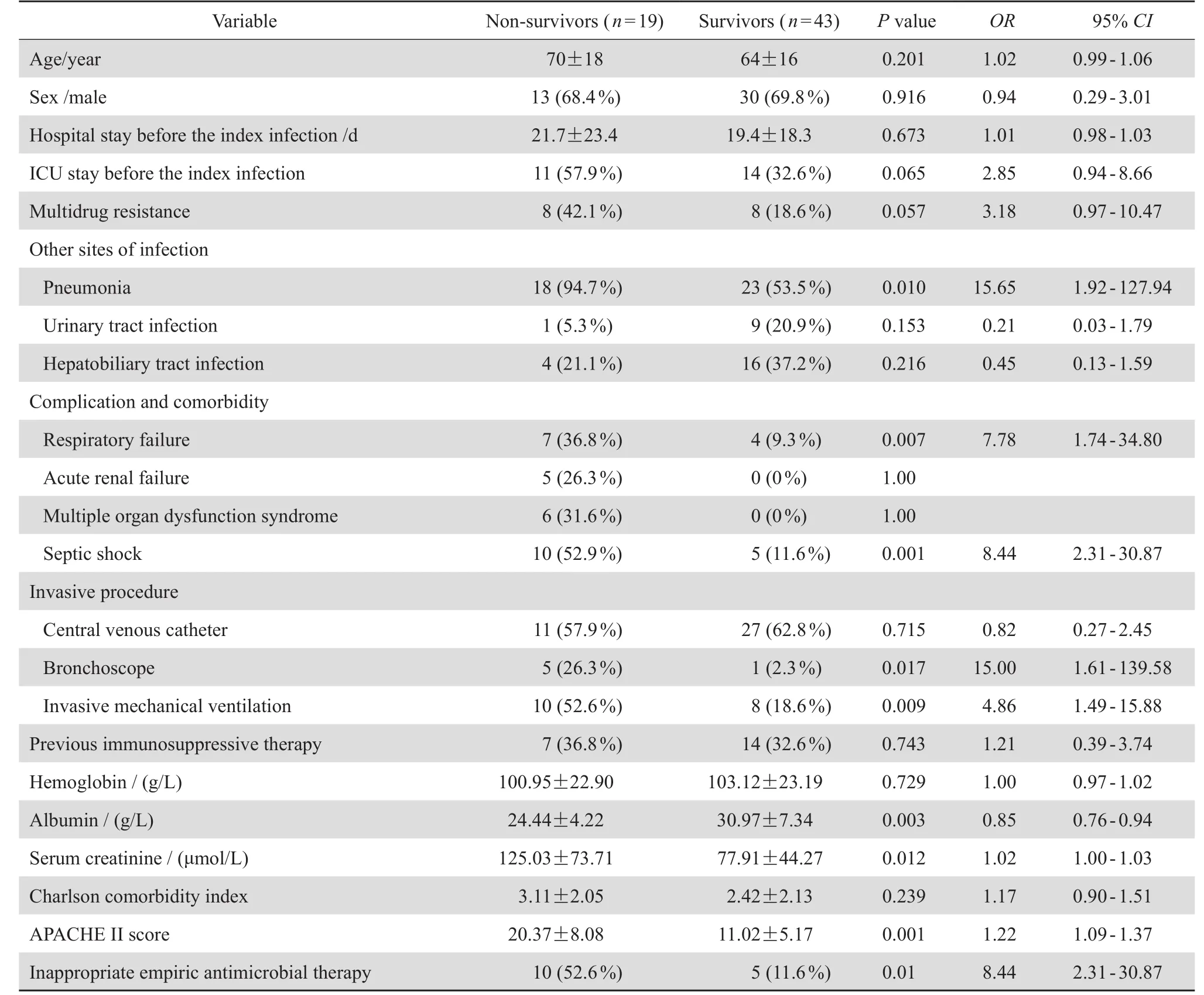
表4 铜绿假单胞菌血流感染预后因素的单因素logistics回归分析结果Table4 Univariate logistic regression analysis of risk factors for mortality in patients with P. aeruginosa bloodstream infection

表5 铜绿假单胞菌血流感染预后因素的多因素logistics回归分析结果Table5 Multivariate logistic regression analysis of risk factors for mortality in patients with P. aeruginosa bloodstream infection
本研究发现抗菌药物的暴露仍是铜绿假单胞菌血流感染最重要的危险因素,曾暴露于2类以上抗铜绿假单胞菌抗菌药物是铜绿假单胞菌血流感染的独立危险因素。EL AMARI等[14]研究发现单独使用任何一种抗铜绿假单胞菌抗菌药物均可增加铜绿假单胞菌对该药的耐药性,使用的抗菌药物越多,耐药的菌株越多,而同时抗铜绿假单胞菌抗菌药物抗菌谱广,可抑制其他竞争性病原菌,从而容易诱发耐药铜绿假单胞菌成为优势菌而发生感染。另外,抗菌药物都有不良反应,多种抗菌药物的使用可以造成不良反应的叠加作用,影响机体各组织器官功能,引起微环境的改变,而更容易引起条件致病的铜绿假单胞菌发生感染。但GOMEZ等[11]则认为使用不具抗铜绿假单胞菌活性的抗菌药物是铜绿假单胞菌感染的风险。考虑本研究铜绿假单胞菌血流感染细菌耐药率高,对于抗铜绿假单胞菌抗菌药物的暴露是否是引起铜绿假单胞菌血流感染,抑或是引起耐药铜绿假单胞菌血流感染,尚需进一步研究。
单因素分析结果提示碳青霉烯类,第三、四代头孢菌素更为显著增加铜绿假单胞菌血流感染风险。铜绿假单胞菌对第三代头孢菌素中常用的头孢曲松、头孢噻肟天然耐药,碳青霉烯类在重症感染中暴露率高,而其外膜孔蛋白OprD2的表达缺失、外排系统、产生β内酰胺酶及碳青霉烯酶多个机制使它更容易形成碳青霉烯类耐药,且常同时对头孢菌素类、喹诺酮类多种抗菌药物耐药,故这两类抗菌药物的使用使该菌被动筛选为优势菌而发生感染[14]。
本研究还显示抗MRSA药物是铜绿假单胞菌血流感染显著危险因素。一方面,铜绿假单胞菌可能因抗MRSA药物对竞争性革兰阳性菌的抑制而被选择,诱发铜绿假单胞菌的感染。另一方面,曾暴露于抗MRSA药物的患者常因病情危重而联合使用具有抗铜绿假单胞菌活性的抗菌药物,可增加铜绿假单胞菌感染的风险[15-16]。
深静脉置管可增加铜绿假单胞菌血流感染的风险[17],此次研究却未得到一致的结果,考虑与本研究中对照组包括肺炎克雷伯菌血流感染有关,肺炎克雷伯菌亦是常见的导管相关性感染的病原菌[18]。
研究中分别评估了Charlson合并症指数和APACHEⅡ评分对铜绿假单胞菌血流感染的发生和预后的影响,分析结果显示Charlson合并症指数与感染和死亡均无显著性关系。而APACHEⅡ评分主要反映重症患者病情的严重性及其本身所储备的抗病能力,评分结果与医院感染的发生率、病死率呈线性关系[19-20],本研究显示高APACHE Ⅱ评分不仅与铜绿假单胞菌感染相关,且是铜绿假单胞菌血流感染死亡的独立危险因素。因此高APACHEⅡ评分的患者是铜绿假单胞菌血流感染重点防控对象。
研究显示恰当的经验治疗可以改善铜绿假单胞菌血流感染的预后,但由于抗铜绿假单胞菌抗菌药物的缺乏以及铜绿假单胞菌快速获得性耐药的特点,使得铜绿假单胞菌经验治疗十分困难,并且根据药敏结果改变抗菌药物治疗方案并不改善临床预后[21-22]。VAN DELDEN等[23]发现,联合治疗将有效降低不恰当经验治疗的发生,因样本量的限制,本次未进行相关方面研究。因此准确地预测铜绿假单胞菌血流感染的可能性,给予适当的经验性治疗将有利于控制铜绿假单胞菌血流感染的发生和改善预后。
综上所述,铜绿假单胞菌血流感染仍有高病死率,我们应该合理使用抗菌药物以降低铜绿假单胞菌血流感染发病率,了解用药史、住院史并及时评估病情以预测铜绿假单胞菌血流感染的可能性,及时准确给予经验性治疗以改善预后。
[1]吕媛,李耘,薛峰,等.卫生部全国细菌耐药监测网(Mohnarin)2011-2012年度血流感染细菌耐药监测报告[J].中国临床药理学杂志,2014,30(3):278-288.
[2]马序竹,吕媛,薛峰,等. 2010年度卫生部全国细菌耐药监测报告:血流感染细菌耐药监测[J].中华医院感染学杂志,2011,21(24):5147-5151.
[3]SUAREZ C,PENA C,TUBAU F,et al. Clinical impact of imipenem-resistant Pseudomonas aeruginosa bloodstream infections[J]. Infect, 2009,58(4):285-290.
[4]AL-HASAN MN,WILSON JW,LAHR BD,et al. Incidence of Pseudomonas aeruginosa bacteremia:a population-based study[J]. Am J Med,2008,121(8):702-708.
[5]路明,姚婉贞,王筱宏,等.金黄色葡萄球菌血流感染的临床特征分析[J].中华医院感染学杂志,2011,21(8):1596-1598.
[6]中华医学会呼吸病学分会.社区获得性肺炎的诊断与治疗指南[J].中华结核和呼吸杂志,2006,29(10):651-655.
[7]OSIH RB,MCGREGOR JC,RICH SE,et al. Impact of empiric antibiotic therapy on outcomes in patients with Pseudomonas aeruginosa bacteremia[J]. Antimicrob Agents Chemother,2007,51(3):839-844.
[8]FALAGAS ME, KARAGEORGOPOULOS DE. Pandrug resistance( PDR),extensive drug resistance( XDR), and multidrug resistance(MDR) among Gram negative bacilli: need for international harmonization in terminology[J]. Clin Infect Dis,2008,46(7):1121-1122.
[9]MAGIORAKOS AP,SRINIVASAN A,CAREY RB,et al. Multidrug-resistant, extensively drug-resistant and pandrugresistant bacteria: an international expert proposal for interim standard definitions for acquired resistance[J]. Clin Microbiol Infect,2012,18(3):268-281.
[10]KUMASAKA K,HOSOKAWA N,YANAI M,et al. Clinical analysis of Pseudomonas aeruginosa bacteremia[J]. Rinsho Byori,1999,47(11):1064-1069.
[11]GOMEZ J,ALCANTARA M,SIMARRO E,et al. Pseudomonas aeruginosa bacteremia: clinical and epidemiological patterns and treatment[J]. Rev Esp Quimioter,2002,15(4):360-365.
[12] MANN EE,WOZNIAK DJ.Pseudomonas biofilm matrix composition and niche biology[J]. FEMS Microbiol Rev,2012,36(4):893-916.
[13]BANG JH,JUNG Y,CHEON S,et al.Pseudomonas aeruginosa bacteremia in patients with liver cirrhosis: a comparison with bacteremia caused by Enterobacteriaceae[J]. BMC Infect Dis,2013,13:332.
[14]EL AMARI EB,CHAMOT E,AUCKENTHALER R,et al. Influence of previous exposure to antibiotic therapy on the susceptibility pattern of Pseudomonas aeruginosa bacteremic isolates[J]. Clin Infect Dis, 2001,33(11):1859-1864.
[15]ONGURU P,ERBAY A,BODUR H,et al. Imipenemresistant Pseudomonas aeruginosa: risk factors for nosocomial infections[J]. J Korean Med Sci,2008,23(6):982-987.
[16]ZAVASCKI AP,CRUZ RP,GOLDANI LZ. Risk factors for imipenem-resistant Pseudomonas aeruginosa: a comparative analysis of two case-control studies in hospitalized patients[J]. J Hosp Infect,2005,59(2):96-101.
[17]Schechner V,Nobre V,Kaye KS,et al. Gram-negative bacteremia upon hospital admission: when should Pseudomonas aeruginosa be suspected? [J]. Clin Infect Dis,2009,48(5):580-586.
[18]盛慧球,陈尔真,韩立中,等. 3189例次深静脉导管的病原学检测结果分析[J].中国急救医学,2006,10(10):652-655.
[19]王力红,马文晖,张京利,等. APACHEⅡ评分与医院感染相关性研究[J].中华医院感染学杂志,2007,17(6):651-653.
[20]马文晖,王力红,张京利,等.重症监护病房患者APACHEⅡ评分与医院感染相关性研究[J].中华医院感染学杂志,2010,20(2):183-186.
[21]KOLLEF MH,WARD S. The influence of mini-BAL cultures on patient outcomes: implications for the antibiotic management of ventilator-associated pneumonia[J]. Chest,1998, 113(2):412-420.
[22]TUON FF,GORTZ LW,ROCHA JL. Risk factors for panresistant Pseudomonas aeruginosa bacteremia and the adequacy of antibiotic therapy[J]. Braz J Infect Dis,2012,16(4): 351-356.
[23] VAN DELDEN C.Pseudomonas aeruginosa bloodstream infections:how should we treat them? [J]. Int J Antimicrob Agents,2007,30(Suppl 1):s71-s75.
Clinical analysis of 56 cases of bloodstream infections due to Pseudomonas aeruginosa
CHEN Yusheng, WU Chunlan, LI Hongru, WANG Daxuan, LIN Xiaohong, LIN Ming, XU Nengluan, HU Xinlan.
(Department of Respiratory Medicine, Fujian Provincial Hospital, Fuzhou 350001, China)
Objective To investigate the risk factors and outcomes of bloodstream infections due to Pseudomonas aeruginosa. Methods A 1∶1 matched case-control study was conducted in Fujian Provincial Hospital. A total of 56 patients with bloodstream infection due to P. aeruginosa were compared with 56 control patients with bloodstream infections due to Klebsiella pneumoniae or Escherichia coli between January 2006 and September 2015, according to the matching criteria based on underlying disease, sex,age, hospital stay before the index bloodstream infection, and hospital department. Univariate and multivariate conditional logistic regression analysis were introduced to reveal the risk and prognostic factors. Results Multivariate conditional logistic regression analysis showed that prior use of more than two types of antipseudomonal antibiotics (OR: 4.92, 95 % CI: 1.31-18.44) and anti-MRSA drugs (OR: 9.09, 95 % CI: 1.05-78.99) were the independent predisposing factors for detection of P. aeruginosa bloodstream infection. The 30-day mortality rate of the case patients (30.4 %) was signifcantly higher than that of the control group (14.3 %)(χ2= 4.171, P= 0.041). The Acute Physiology and Chronic Health Evaluation (APACHE II) score (OR: 1.23, 95 % CI: 1.08-1.40)and inappropriate empiric antimicrobial therapy (OR: 6.55, 95 % CI: 1.44-29.72) were the independent risk factor for mortality inP. aeruginosa bloodstream infections. Conclusions Disease severity is a critical factor for mortality in our patients with P. aeruginosa bloodstream infection. Rational use of antibiotics and more appropriate antimicrobial therapy might improve the outcome of patients with P. aeruginosa bloodstream infections.
Pseudomonas aeruginosa; bloodstream infection; risk factor; prognostic factor
R378.991
A
1009-7708(2016)05-0529-07
10.16718/j.1009-7708.2016.05.001
2015-11-18
2016-01-10
福建省发展改革委员会项目(2060404);福建省立医院重点项目(2014YNZD02)。
福建医科大学省立临床医学院,福建省立医院呼吸内科,福州 350001; *微生物室。
陈愉生(1957—),女,教授,博士生导师,主要从事呼吸系统感染性疾病、肺部肿瘤的诊治。
陈愉生,E-mail: slyyywb@126.com。

