南极磷虾油中总砷含量及砷形态分析
王松 LIKe 崔鹤 王境堂 赵鑫鹏 苗钧魁 刘小芳 赵宪勇 冷凯良

摘要:南极磷虾油富含Omega3磷脂而具有强大的保健功能, 但由于其砷含量较高,在保健品领域的应用受到一定限制。由于南极磷虾油中含有大量的磷脂质,采用常规的提取方法分析难以对其砷形态进行准确定量分析。本研究采用高效液相色谱电感耦合等离子体质谱((HPLCICPMS)联用技术建立了针对砷甜菜碱(AsB)、二甲基砷酸(DMA)、一甲基砷酸(MMA)、三价砷As、五价砷As5种砷形态的分析方法。采用C18固相萃取进行样品脱脂前处理,采用阴离子交换色谱IonPac AS9H阴离子分析柱(250 mm×4 mm),流动相采用38 mmol/L Na2SO4 +15 mmol/L乙酸钠;流速0.6 mL/min,流速1 mL/min,进行5种形态砷化合物的分析。结果表明,5种砷化合物的线性范围为0.5~500 μg/L,相关系数R>0.9993. 检出限(LOD)为 0.1~0.2 μg/L,定量限(LOQ)为1.5~2.6 μg/L,RSD<5%。加标回收率为88.9%~106.3%。样品的测定结果显示,南极磷虾油中砷形态的主要存在形式为无毒的砷甜菜碱,因此可以安全地应用于食品及保健品。
关键词 :南极磷虾油; 砷; 形态分析; 高效液相色谱电感耦合等离子体质谱
1 引 言
南极磷虾已成为世界远洋捕捞业最重要的渔业资源[1,2]。南极磷虾中总脂肪含量丰富,约占鲜重的3%,从南极磷虾中提取的南极磷虾油含有丰富的Omega3(ω3)多不饱和脂肪酸磷脂质以及虾青素等生物活性脂质[3]。研究表明,南极磷虾油具有抗氧化、抗衰老、清除自由基、降血脂、健脑益智等多种功能,南极磷虾油已经在食品、保健品等多个领域得到应用[4~10]。
在南極磷虾作为重要的生物资源受到普遍重视的同时,其相关产品的食用安全性,特别是其中所含有毒重金属含量备受关注。自然界的砷元素存在于沉积岩和熔积岩中,主要经过地表径流等途径进入到海水中,又通过食物链在海产生物体内富集,特别是以水体中浮游生物为食物链的生物体内的富集倾向更明显,致使海洋生物中含有较多的砷[11]。海产品中砷的存在有很多种化学形态,包括无机砷和有机砷。其中无机砷包括三价的亚砷酸盐(As)和五价的砷酸盐(As);检测到的有机砷形态包括一甲基砷酸(MMA)、二甲基砷酸(DMA)、砷胆碱(AsC)、砷甜菜碱(AsB)、砷糖及砷脂等[12]。砷元素的毒性与其存在形态密切相关,无机砷具有致癌毒性,有机砷通常被认为是低毒或无毒的。以砷化合物的半致死量LD50计,其毒性从大到小依次为As>As>MMA>DMA>AsC>AsB[13]。研究表明,海产品中虽然砷含量较高,但主要是以无毒的有机砷形态存在,在海洋动物(如虾、蟹)中最主要的砷形态是砷甜菜碱[13]。因此,在测定海产品中砷的含量时,进行砷的形态分析十分必要。对砷形态采用不同的毒性综合评价,比单纯用砷的总量评价海产品安全性更具科学性。
南极磷虾油中具有较高的总砷含量,使人们对其食用安全性产生一定疑虑,因此有必要建立准确、高效的南极磷虾油砷形态分析检测方法,进行南极磷虾油中砷元素的安全性评价。目前,针对食品中的砷形态分析研究已多有报道,由于多数砷化合物(如砷甜菜碱等)为水溶性化合物,因此样品大多可采用酸溶液或甲醇/水等极性溶剂进行直接提取,提取液经过滤后进行HPLCICPMS检测[12,14~17]。目前,针对南极磷虾以及鱼油等产品的砷元素分析已有相关研究报道[18,19],但针对南极磷虾油样品的砷元素形态分析尚未见报道,使得南极磷虾油砷元素的安全性评价缺少必要的数据依据。南极磷虾油中砷形态分析的主要难点在于其主要成分与鱼油等油脂类样品存在较大差异。鱼油中主要成分为甘油酯等低极性脂,可以直接采用极性溶剂进行提取。南极磷虾油中除甘油脂外,还含有大量磷脂等极性脂,采用甲醇/水等极性溶剂的提取过程中会产生乳化现象,严重影响提取效率和检测精确度,因此样品前处理对分析检测结果准确性具有较大影响。本研究主要根据砷甜菜碱等5种形态砷化合物与南极磷虾油中脂质的极性差异,采用固相萃取方法对南极磷虾油样品进行脱脂处理,实现南极磷虾油中砷化合物的有效提取。采用HPLCICPMs法进行砷形态分析,实现了南极磷虾油中5种形态砷含量的准确检测,为南极磷虾油的食用安全性评价提供可靠了科学依据。
2 实验部分
2.1 仪器、试剂与材料
CIC160型离子色谱仪(德国戴安公司),配有自动进样器; 8800型电感耦合等离子体质谱仪(美国Agilent公司);IonPac AS19阳离子分析柱(250 mm×4 mm);MilliQ超纯水处理系统(美国Millipore 公司);MS 3basic(IKA)混旋仪数控超声清洗器;高速离心机(美国Eppendorf公司)。C18固相萃取柱(1000 mg,美国Agilent公司)。
砷酸根溶液标准物质 (GBW08667)、亚砷酸根溶液标准物质(GBW08666)、一甲基砷溶液标准物质(GBW08668)、二甲基砷溶液标准物质(GBW08669)、砷甜菜碱溶液标准物质(GBW08670)均购自国家标准物质研究中心;质谱调谐液(Ce,Co,Li,Mg,Tl,Y,质量浓度为1 μg/L,美国Agilent公司),内标溶液:Sc, Ge, In, Bi,质量浓度为10 mg/L,使用前用1% HNO3稀释至1 mg/L。超纯水(电阻率18.2 MΩ cm);NH4H2PO4、无水乙酸钠、KNO3、乙二胺四乙酸二钠、冰乙酸、无水乙醇、NaOH为优级纯。冰冻南极磷虾购自远洋渔业公司,以鲜南极磷虾为原料,采用95%乙醇为提取剂,料液比1∶8,在40℃下振荡提取多次,合并提取液,40℃旋转蒸发脱溶,获得南极磷虾油样品。
2.2 实验方法
2.2.1 总砷测定
称取0.5 g样品于聚四氟乙烯离心管中,加入3 mL HNO3和1 mL H2O2,拧松离心管帽于750 W微波消解3~4 min。重复两次,每次间隔冷却10 min,清澈的样品液用去离子水定容至10 mL, 用于总砷检测[15]。
2.2.2 砷形态测定
(1) 样品前处理 称取南极磷虾油样品约2.5 g于15 mL离心管中,于5 mL 90%甲醇中超声溶解,于4℃静置5 min后,取上清液0.5 mL,经过SepPak C18柱(1000 mg),以50%甲醇为洗脱液进行洗脱。收集洗脱液,减压浓缩,以超纯水定容至5 mL,8000 r/min离心5 min,取上清液过0.22 μm滤膜,待测。(2)ICPMS工作条件 扫描类型串接,等离子体模式为高灵敏度模式,分析模式为He模式,RF入射功率1600 W,载气为高纯氩气,采样深度10.0 mm,载气流速0.34 L/min,碰撞池氦气流量4.3 mL/min,雾化室温度2℃,射频电压1.68 V,蠕动泵泵速30 r/min,选择He为反应气,检测质量数为m/z 75(As)。(3)离子色谱条件 IonPac AS9H阴离子分析柱(250 mm×4 mm),IonPac AG9HC阴离子保护柱(50 mm×4 mm);ASRS 300阴离子抑制器(4mm);流动相: 38 mmol/L Na2CO315 mmol/L 乙酸钠; 流速0.6 mL/min;进样量100 μL; 流速1 mL/min; 柱温21℃ ; 进样体积25 μL。 与标准物保留时间对照对砷的化合物进行定性分析。 本方法以标准物质的保留时间对南极磷虾萃取物以及南极磷虾油中的砷的化合物进行定性分析, 以标准品的标准曲线对不同形态的砷进行定量分析。
3 结果与讨论
3.1 总砷的测定
对南极磷虾整虾和南极磷虾油样品进行总砷含量的测定。南极磷虾整虾样品的总砷含量(以干重计)為(2.031±0.021) mg/kg。南极磷虾油是以解冻南极磷虾为原料,以95%乙醇提取获得,虾油提取率约为3.2%(南极磷虾含水率为81.2%),其总砷浓度达到(8.334±0.019) mg/kg。由此可知,南极磷虾中大部分的砷化合物在萃取过程中迁移到虾油中。
3.2 南极磷虾油中砷化合物形态分析
3.2.1 南极磷虾油前处理条件的选择 南极磷虾油主要成分是甘油酯、磷脂以及虾青素酯。大量脂类物质的存在会造成仪器污染,干扰检测结果,影响回收率,因此,去除脂肪是南极磷虾油中的砷化合物的检测前处理的关键步骤。
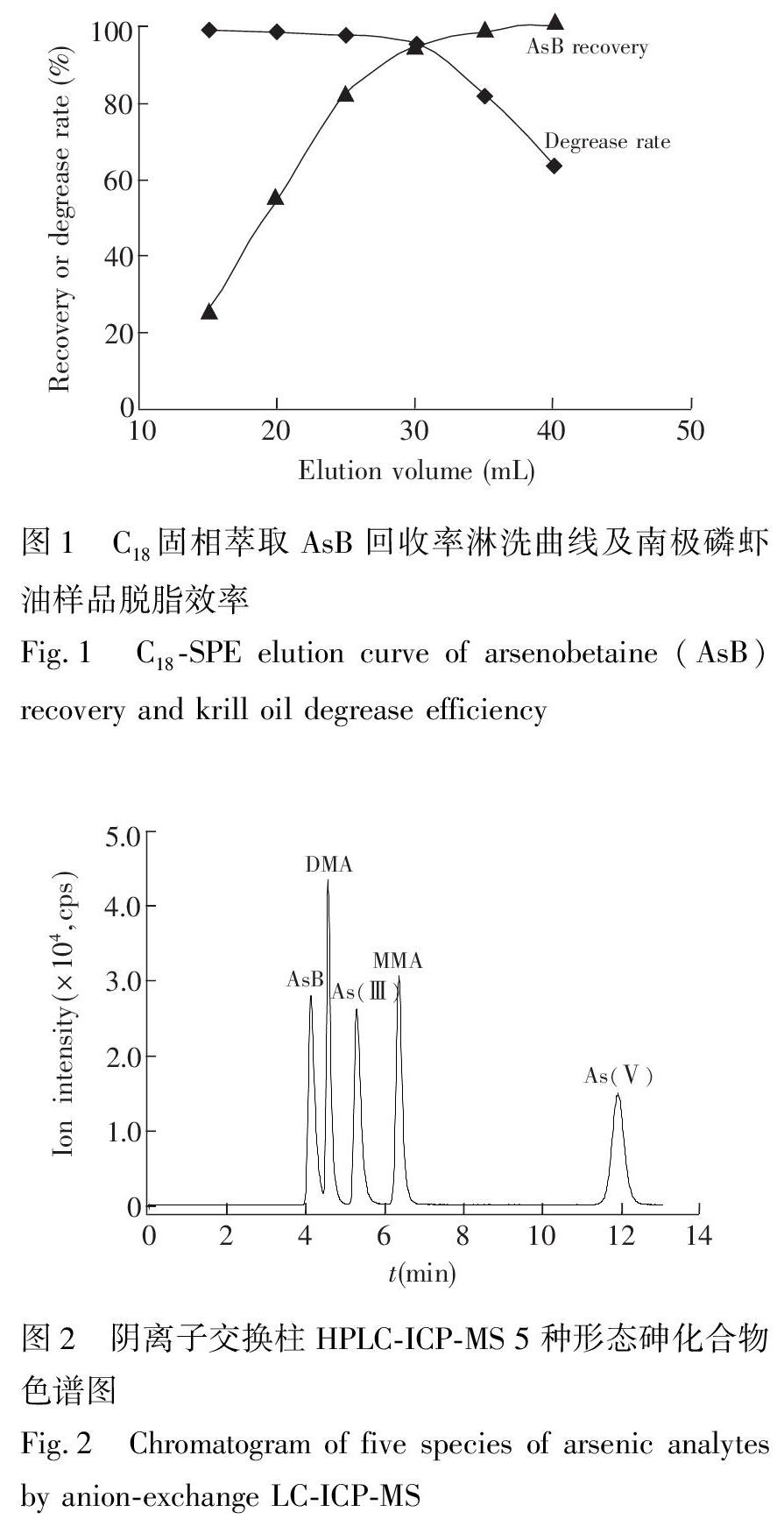
由于AsB等5种砷化合物均为极性化合物,在C18柱上吸附率很低,因此参考Moll等采用的SepPak C18固相萃取法[12],可以有效地去除脂类基质,达到理想的油脂净化效果。本实验以5种砷化合物中与C18吸附性最强的AsB为研究对象,以50%甲醇溶液为洗脱剂。由图1可知,随着洗脱剂用量增大,AsB回收率提高,当洗脱体积达到30 mL时,AsB回收率达到95.3%,继续增大洗脱剂用量,AsB回收率不再有明显上升,说明采用30 mL 以上体积洗脱剂可以实现AsB的理想回收。从脱脂效率结果可知,当洗脱剂用量小于30 mL时,油脂脱除率接近100%,继续增大洗脱剂用量,油脂脱除率逐渐下降。综合考虑回收率和脱脂效率,最终确定采用30 mL 50%甲醇溶液进行洗脱。
3.2.2 色谱分离条件的选择 由于AsB在水溶液中为阳离子化合物,
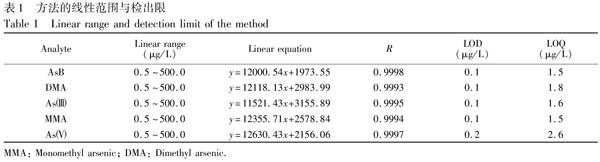
图2 阴离子交换柱HPLCICPMS 5种形态砷化合物色谱图
Fig.2 Chromatogram of five species of arsenic analytes by anionexchange LCICPMSDMA, MMA, As和As均为阴离子化合物,因此参考文献[11]的方法,采用阴离子交换色谱HPLCICPMS联用技术进行多种砷形态的分离分析。选择Na2CO3、乙酸钠溶液为流动相,对色谱分离条件进行了优化。当Na2CO3浓度为38 mmol/L 和乙酸钠浓度15 mmol/L,pH 10.5时,5种砷形态化合物可以在13 min内实现基线分离。从图2可见,5种砷化合物出峰顺序依次是AsB, DMA, As, MMA和As。
3.2.3 方法线性范围与检出限
分别配制0.05, 0.1, 0.5, 1.0, 5.0, 10.0, 20.0, 50.0, 100.0, 200.0和500.0 μg/L 系列砷化合物混合标准溶液,在优化实验条件下进行分析。5种砷化合物的线性范围较宽,相关系数≥0.9999,检出限(S/N=3)为0.1~0.2 μg/L,定量限(S/N=10)为1.5~2.6 μg/L (表1)。在常规工作中,根据实际样品中各砷化合物的质量浓度,校准曲线质量浓度范围通常选择为0.5~500.0 μg/L。
3.3 南极磷虾油5种砷形态测定
采用优化的前处理条件和色谱条件进行南极磷虾油中砷形态的测定。分析结果的色谱图如图3所示,共检出6种砷化合物,包括AsB, DMA, As, MMA, As及1种未知砷化合物。南极磷虾油中砷化合物含量检测结果如表3所示,其中含量最高的砷化合物AsB的浓度达到(7.322±0.021) mg/kg,占总砷含量的87.9%;其次是DMA (0.622±0.0015)mg/kg,MMA为(0.0182±0.0009)mg/kg。3种检出的有机砷含量超过总砷含量的95.58%。无机砷As及As含量总计约为0.027 mg/kg, 仅约占南极磷虾油中总砷含量的0.27%。研究表明,AsB几乎存在于所有的海产品中,是海洋甲壳类和节肢动物中最主要的砷赋存形态[19,20]。AsB的结构类似于甜菜碱。其半致死量LD50>10000 mg/kg,通常认为AsB是无毒的。同时AsB是稳定性较好的化合物,其在人体中不能代谢,直接被排出体外,不会危害人体健康[21~23]。由此可知,南极磷虾油中总砷含量虽然较高,但主要是实际无毒有机砷。因此,南极磷虾油可以作为安全的食品或保健品原料予以广泛应用。
3.4 方法的加标回收率
根据检测结果,南极磷虾油样品中主要含有AsB和少量的DMA, 以及微量的MMA,As和As。选择1份南极磷虾油样品,AsB和DMA含量分别为7.322和0.622 mg/kg,其余3种砷化合物含量均<0.02 mg/kg。 在样品中分别按照3个不同水平加入混合标准物质,平行制备6份样品,采用本方法检测5种砷化合物,进行加标回收实验,结果见表4。
4 结 论
本研究建立了一种适合高磷脂含量油脂中不同形态的砷的提取净化及检测的方法。采用C18固相萃取净化法,从南极磷虾油中提取砷化合物,可以有效实现油脂的脱除,提高了南极磷虾油中砷化合物的提取效率。采用HPLCCPMS分析检测南极磷虾油中5种砷形态,优化了色谱分离条件,实验结果显示, 5种砷化合物可以在12 min内实现基线分离。检测方法的线性范围为0.5~500 μg/L,相关系数均大于0.9993,检出限为0.1~0.2 μg/L,定量限为1.5~2.6 μg/L,RSD均小于5%,加标回收率为88.9%~106.3%。结果表明,本方法线性范围宽、准确性好、精密度高,样品前处理方法简便,适用于南极磷虾油中5种砷化合物形态的分析检测。同时本研究方法可适用于其它磷脂含量较高的油脂类产品的砷化合物的检测。
南极磷虾油中检测到的AsB, DMA和MMA等3种有机砷含量占南极磷虾油总砷含量的95.58%,而毒性较高的As及As含量仅约占南极磷虾油中总砷含量的0.27%。由此可见,南极磷虾油中总砷含量虽然较高,但主要是无毒的有机砷。因此,南极磷虾油可以作为安全的食品或保健品原料予以使用。
References
1 Roger P H, Elizabeth H L L. Rev. Fishs. Sci., 2000, 8(3): 235-241
2 Grantham G J. Rome, Italy: Food and Agrie Organ., 1977: 1-61
3 Gigliotti J C, Davenport Matthew P, Beamer Sarah K. Food Chem., 2011, 125(3): 1028-1036
4 Venkatraman J T, Chandrasekar B, Kim J D, Fernandes G. Lipids, 1994, (29): 561-568
5 Bunea R, Farrah K E I, Deutsch L. Alter Medi. Rev., 2004, 9(4): 420-428
6 Marzo VD, Griinari M, Carta G, Murru E, Ligresti A. J. Inter. Dairy, 2010, 20(4): 231-235
7 Ulven S M, Kirkhus B, Lamglait A, Basu S. Lipids, 2011, 46: 37-46
8 Gamoh S, Hashimoto M, Hossain S, Masumura S. Clin. Experi. Pharm. Physi., 2001, 28: 266-270
9 Fontani G, Corradeschi F, Felici A, Alfatti F, Migliorini S. J. Euro. Clini. Invest., 2005, 35: 691-699
10 Eleese C J. Acad. Nutri. Diet, 2012, 112(2): 1344-1444
11 Súer M A, Devesa V, Clemente M J, Vélez D, Montoro R. J. Agr. Food Chem., 2002, 50(4): 924-93
12 Gong Z L, Lu X F, Ma M S,Corinna W, Chris L X. Talanta, 2002, (58): 77 -96
13 Kaise T, Watanabe S, Itoh K. Chemosphere, 1985, 14(9): 1327-1332
14 ZHANG Hua, WANG YingFeng, SHI YanZhi, CHEN YuHong. Spectroscopy and Spectral Analysis, 2007, 27(2): 386-390
張 华, 王英锋, 施燕支, 陈玉红. 光谱学与光谱分析, 2007, 27(2): 386-390
15 Narukawa T, Suzuki T, Inagaki K, Hioki A. Talanta, 2014, 130(5): 213-220
16 CHEN ShaoZhan, DU ZhenXia, LIU LiPing, JIANG Hong. Chinese J. Anal.Chem., 2014, 42(3): 349-354
陈绍占, 杜振霞, 刘丽萍, 姜 泓. 分析化学,2014, 42(3): 349-354
17 ZHU ZhiLiang, QIN Qin. Spectroscopy and Spectral Analysis, 2008, 28(5): 1176-1180
朱志良, 秦 琴. 光谱学与光谱分析, 2008, 28(5): 1176-1180
18 Marco G, Francesco S, Walter G, Findenig S, Francesconi K A. Talanta, 2010, 80(3): 1441-1444
19 Francesconi K A. Pure Appl. Chem., 2010, 82(2): 373-381
20 Francesconi K A, Edmonds J S. Croatica Chemica Acta, 1998, 71(2): 343-359
21 Hanaoka K I, Yamamoto H, Kawashima K, Tagawa S. Appl.Organ. Chem., 1988, 2(4): 371-376
22 Csanaky L, Gregus Z. Comp. Biochem. Physiol C Toxi. Pharm., 2002, 131(3): 355-365
23 Mathews V V, Paul MS, Abhilash M, Manju A, Abhilash S, Nair R H. Toxicol Ind Health, 2014, 30(9): 806-813
Abstract Arsenic is a toxic metalloid that is abundant in many marine species, including Antartic krill. Krill oil is being developed for the healthfood and dietary supplement because it possesses of omega3 fatty acids and phospholipidderived fatty acids; however, it was limited due to its multiple arsenic species residues. Here, we presented a high performance liquid chromatographyinductively coupled plasma mass spectrometric (HPLCICPMS) method for the simultaneous, sensitive, and rapid quantification of five arsenic metabolites including organic and inorganic forms, then the method was applied to the analysis of arsenic species in krill oil. The analytes were separated on a hydroxideselective anionexchange column with sodium carbonate (38 mmol/L) and sodium acetate (15 mmol/L) as mobile phase at a flow rate of 0.6 mL/min for 15 min. Arsenic analytes were monitored with a triple quadrupole ICP mass spectrometer. Validation revealed that the method had a linear range from 0.5 to 500 μg/L with R>0.9993. The LOD was 0.1-0.2 μg/L and LOQ was 1.5-2.6 μg/L with RSD<5%. The standard addition method displayed a recovery range from 88.9% to 106.3%. Application of the method to arsenic species analysis in krill oil indicated that krill oil was a safe food or diet supplement.
Keywords Antartic krill oil; Arsenic; Speciation analysis; High performance liquid chromatographyinductively coupled plasma mass spectrometry

