土壤中10种多溴联苯醚的加速溶剂—固相萃取净化方法优化研究
相雷雷 宋洋 卞永荣 生弘杰 柳广霞 蒋新 李国华 王芳
摘要:建立了土壤中10种多溴联苯醚(PBDEs)的加速溶剂萃取固相萃取净化气相色谱分析测定方法。采用加速溶剂萃取(ASE)技术对土壤中10种PBDEs进行提取, 并对4种萃取体系(正己烷、正己烷丙酮(4∶1, V/V)、正己烷丙酮(1∶1, V/V)、正己烷二氯甲烷(1∶1, V/V))进行优化;采用固相萃取(SPE)技术对样品进行净化, 制备了10种不同填料的SPE柱, 通过洗脱实验和加标回收率实验对各SPE柱的净化性能进行对比筛选。最终优化条件为正己烷丙酮(4∶1, V/V)体系提取, 酸性硅胶柱净化。在优化条件下, 10种PBDEs 的回收率为74.4%~125.2%, 相对标准偏差为4.4%~14.4%, 方法检出限为0.04~0.22 ng/mL。本方法简单、快速、净化效果较好、重現性和回收率良好, 可用于土壤样品中PBDEs的分析。
关键词 :土壤;多溴联苯醚;加速溶剂萃取;固相萃取净化;气相色谱
1 引 言
多溴联苯醚(Polybrominated diphenyl ethers, PBDEs)作为一类溴代阻燃剂(BFRs), 广泛应用于电子、纺织、建材和家具等工业产品。PBDEs属于持久性有机污染物(POPs), 具有疏水性, 易于在颗粒物和沉积物中吸附[1]。PBDEs在环境中难降解, 滞留时间长。大气、水体、土壤中的PBDEs可通过“蚱蜢跳效应”广域迁移, 导致全球污染[2]。毒理学研究表明, PBDEs在动物和人体中会长期累积, 并通过食物链和生物放大作用向人体转移, 影响甲状腺[3~7]、内分泌及神经[7~9]等系统的正常功能, 同时可能存在潜在的致癌性[10]。
目前,对土壤样品中PBDEs的提取方法有索氏萃取[11~13]、超声波辅助萃取[14]、微波辅助萃取[13]、加速溶剂萃取等[13~19]。索氏萃取法费时, 且有机溶剂消耗量大;超声波和微波萃取法可节省提取时间和溶剂, 但提取不完全[11,14]。加速溶剂萃取技术(Accelerated solvent extraction, ASE)具有操作简便、萃取效率高、速度快、有机溶剂用量少等特点, 是一种省时、安全、自动化的萃取技术, 广泛应用于土壤中农药残留[15]、多氯联苯[13,16]、多环芳烃以及多溴联苯[12,14,16,19,20]等污染物的分析检测。
ASE土壤提取液成分复杂, 杂质较多, 须进行净化处理。本研究将固相萃取技术(Solid phase extraction, SPE)应用于土壤样品的净化。SPE样品前处理技术具有高效、快速、方便和高选择性等优点, 被广泛应用于环境样品分析的前处理过程中[21~27]。目前, 土壤介质中PBDEs的净化存在过程复杂、有机溶剂用量大、灵敏度低、重现性差等问题[14,28,29]。选择合适的填料是提高除杂效率、获得良好的回收率及重现性的关键, 因此, 本研究重点优化了ASE提取和SPE纯化条件, 并结合气相色谱电子捕获法(Gas chromatography with electron capture detector, GCECD), 建立一种高效、快捷、高灵敏度且具有低检出限的土壤中PBDEs分析方法。
2 实验部分
2.1 实验试剂
正己烷、二氯甲烷(DCM)、丙酮(色谱纯,美国Merck公司);硅藻土(100~200目, 德国Fluka公司);弗罗里硅土(60~100目, 美国TEDIA公司);无水Na2SO4、Al2O3(100~200目)、硅胶(100~200目)、石英砂、H2SO4(分析纯)购于国药集团化学试剂公司;实验用水为去离子水。
PBDEs标准样品:BDE15, BDE28, BDE47, BDE66, BDE77, BDE99, BDE100, BDE153, BDE154, BDE183, 浓度为1000 ng/mL, 购自美国AccuStandard公司。
2.2 供试土壤
2.3 PBDEs标准曲线的绘制及检出限的确定
采用Agilent 7890A GCECD(美国Agilent公司), 对PBDEs进行定性与定量分析。色谱条件:DB5色谱柱(30 m × 0.32 mm × 0.25 μm), 进样口温度为265℃, 载气为高纯氮气, 流量为2 mL/min, 检测器温度为298℃, 进样量为1 μL, 不分流进样。升温程序:初始温度140℃, 保持2 min, 5℃/min升至180℃, 保持5 min;5℃/min 升至265℃, 保持5 min;15℃/min升至315℃, 保持10 min。
配制浓度为10, 25, 50, 100, 250和500 ng/mL的PBDEs混标溶液, GC测定。以进样浓度为横坐标, 峰面积为纵坐标, 绘制标准曲线。同时, 以信噪比S/N=3时对应的浓度作为仪器的方法检出限。
2.4 固相萃取柱制备及洗脱实验
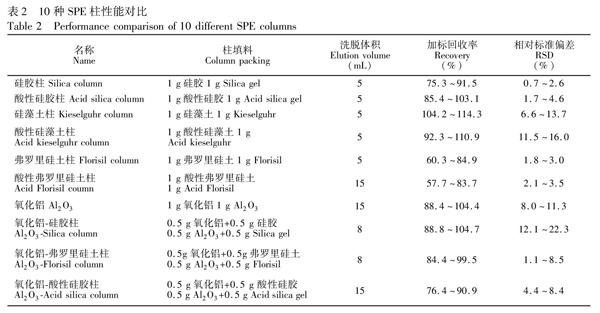
选取实验室常用的硅胶、弗罗里硅土、硅藻土、氧化铝4种填料, 并通过浓H2SO4改性制备了酸性硅胶、酸性弗罗里硅土、酸性硅藻土3种改性填料。SPE柱装填顺序(自下而上)为垫片、0.5 g无水Na2SO4、填料层、1 g无水Na2SO4及垫片。根据不同填料的单一及复配组合, 共制备了10种SPE柱(表2)。
洗脱实验:用5 mL正己烷活化SPE柱后向柱中加入40 μL 1000 ng/mL PBDEs混合标准溶液, 移取1 mL正己烷进行洗脱, 以进样瓶接收洗脱液, 待洗脱液完全过柱后更换进样瓶。重复以上操作, 直至洗脱液总体积达18 mL。洗脱液氮吹定容至0.5 mL, GC测定。以洗脱体积为横坐标, 总回收率(累积求和)为纵坐标, 绘制洗脱曲线。
2.5 PBDEs土壤提取液净化实验
土壤中PBDEs提取:准确称取1.00 g供试空白土壤于烧杯中, 加入40 μL 1000 ng/mL PBDEs混标溶液, 待溶剂挥发后加入2 g硅藻土, 搅拌均匀后装入不锈钢萃取池, 采用ASE200型加速溶剂萃取仪(美国DIONEX公司)进行提取。萃取仪炉温为100℃, 压力为1500 psi, 提取剂为正己烷丙酮(4∶1, V/V)。萃取过程:加热5 min, 静态萃取5 min, 冲洗体积60%, 氮气吹扫60 s, 循环2次。提取液用R210/R215型旋转蒸发器(瑞士Buchi公司)浓缩至约1 mL。
PBDEs土壤提取液净化:选取2.4节制备的10种SPE柱进行实验, 实验均设置6个平行, 并设置3个空白对照。净化过程:5 mL正己烷活化SPE柱后, 将浓缩后的土壤提取液加入柱中, 用正己烷洗脱, 洗脱体积由洗脱曲线确定, 收集全部洗脱液, 浓缩定容至1 mL, GC测定。
2.6 ASE萃取溶剂优化
ASE萃取溶剂直接影响PBDEs的萃取效率及基质效应。为确定最佳萃取溶剂, 本实验设计了以下4种萃取体系:正己烷、正己烷DCM(1∶1, V/V)、正己烷丙酮(4∶1, V/V)、正己烷丙酮(4∶1, V/V)进行萃取剂优化实验, 采用酸性硅胶柱进行净化, GC测定(具体步骤参照2.5节)。
3 结果与讨论
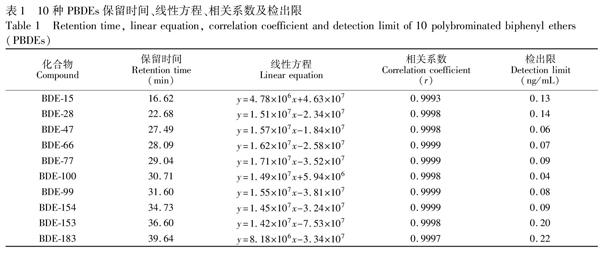
3.1 方法线性关系和检出限
由表1可知, 各目标化合物在各自浓度范围内(10~500 ng/mL)均呈现出良好的线性关系, 相关系数均大于0.999, 检出限为0.042~0.22 ng/mL。
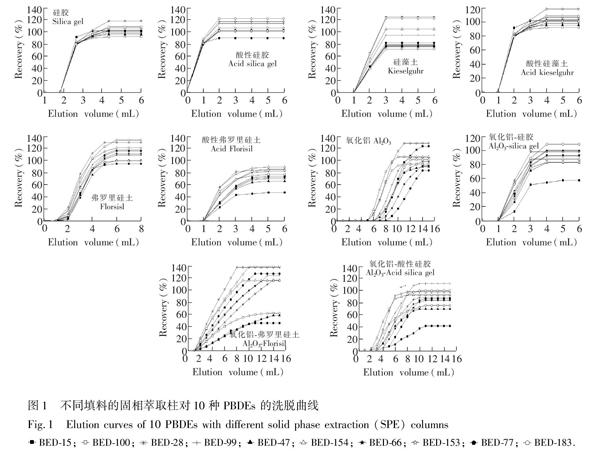
3.2 SPE填料选择和洗脱优化
由图1可知, 硅藻土柱、酸性硅藻土柱、弗罗里硅土柱、硅胶柱和酸性硅胶柱的洗脱趋势大体一致, 对PBDEs的最大洗脱量出现在1~3 mL之间, PBDEs完全洗脱所需体积为5 mL(即洗脱体积, Vmax);酸性弗罗里硅土柱和氧化铝硅胶复合柱洗脱趋势大体一致, 最大洗脱量在2~5 mL之间, Vmax为8 mL; 氧化铝柱、氧化铝弗罗里硅土复合柱和氧化铝酸性硅胶复合柱的最大洗脱量在5~10 mL之间, Vmax为15 mL;氧化铝柱和氧化铝酸性硅胶复合柱对PBDEs拖尾现象较明显。
硅藻土具有良好的微孔结构, 比表面积较大, 吸附能力较强。实验表明, 土壤提取液过硅藻土柱和酸性硅藻土柱后, 溶液颜色仍然较深, 说明两种SPE柱除杂效果较差。由表 2可知, 杂质的存在影响了PBDEs的定量分析, 使PBDEs回收率偏高。
弗罗里硅土是一种极性较强的硅镁型吸附剂, 对脂肪及类脂类杂质有较理想的去除效果, 常用于净化土壤、植物和动物组织样品的萃取液[20,29,30]。酸性弗罗里硅土极性更强, 同时, 浓H2SO4的存在可有效去除有色有机杂质。由表2可知, 两种SPE柱的回收率相对偏低。
氧化铝对目标物保留的主要机理是偶极偶极作用, 可用于除去土壤提取液中极性较强的有机酸类及其它极性杂质。氧化铝对PBDEs有一定的保留能力, 这使得PBDEs在氧化铝柱中出现不同程度的拖尾现象, Vmax为15 mL。随着洗脱量增加, 杂质会随洗脱液共流出, 净化效果变差。为减少氧化铝的拖尾现象, 本研究制备了氧化铝硅膠柱、氧化铝弗罗里硅土柱和氧化铝酸性硅胶柱。实验表明, 硅胶、酸性硅胶及弗罗里硅土中加入氧化铝后, 洗脱速度明显变慢, 洗脱时间明显增加, 有机溶剂用量增多, 增加了环境污染。由表2可知, 氧化铝柱和其它3种氧化铝复合柱对PBDEs回收率在75.3%~110.9%之间。
硅胶表面由于吸水作用形成硅醇基, 合理数量的硅醇基可以增加硅胶与极性物质之间除疏水作用以外的氢键作用、离子相互作用和偶极偶极相互作用, 故硅胶表面硅醇基的数量决定了硅胶的吸附性能[31]。本研究对所用硅胶先进行去活化处理后, 再进行定量活化, 这样制备出的硅胶的表面硅醇基含量均一, 性质稳定, 保证了实验的重现性。酸改性使得硅胶表面引入了磺酸基, 增加了酸性硅胶对极性杂质吸附作用;同时浓H2SO4能较好地去除有色有机杂质[32,33]。由表2可知, 酸性硅胶柱与硅胶柱相比回收率更高, 除杂效果更好。由图1还可知, 浓H2SO4改性的硅胶对PBDEs的作用机制及强度并无明显变化, 而良好的回收率说明浓H2SO4的存在并没有使PBDEs发生氧化降解等现象。
综上, 对于土壤提取溶液的净化, 当以正己烷作为洗脱液时, 酸性硅胶具有洗脱溶剂用量少、价格低廉、净化效果好、回收率及重现性好等优点, 是一种理想的PBDEs土壤提取溶液SPE净化的柱填料。
3.3 ASE萃取条件优化
由表 3可知, 对于土壤中PBDEs的提取, 正己烷回收率为87.6%~113.4%, 但提取稳定性(RSD=4.1%~9.1%)较正己烷丙酮(4∶1, V/V)体系差一些(RSD=1.7%~4.6%), 故极性和非极性溶剂的组合提取效果更好。在正己烷中加入极性溶剂(丙酮或二氯甲烷)后, PBDEs的提取效率增加, 而随着提取体系极性增加, 所得提取溶液颜色越深, 提取出的杂质越多, 这增加了净化过程的复杂性, 而未净化除掉的杂质的存在会影响仪器的定性及定量准确性。
最终实验选取正己烷丙酮(4∶1, V/V)作为ASE提取剂, 该提取体系对PBDEs的平均加标回收率为85.4%~103.1%;相对标准偏差为1.7%~4.6%, 实验重现性较好;提取液经净化后杂质较少, 且不影响定量分析, 可用作加速溶剂萃取土壤中PBDEs的提取剂。
3.4 方法准确度和精密度
以1.00 g海南砖红壤作为基质, 分别加入浓度相当于10、40和100 ng/mL PBDEs进行加标回收实验(参照2.5节), 每个浓度重复6次, 并设置3个空白对照。方法的准确度和精密度分别通过加标回收率和相对标准偏差表征。由表4可知, 低、中、高 3组(浓度分别为10, 40和100 ng/mL )的平均加标回收率分别为74.4%~115.2%, 87.5%~125.2%, 87.3%~115.9%;相对标准偏差分别为4.4%~14.4%, 5.0%~13.8%, 4.8%~7.1%。
3.5 实际样品分析
采用上述优化后的方法, 对采集自某地的土样进行分析。由表5可知, 该地区存在不同程度的PBDEs污染, ΣPBDEs为5.91~17.69 ng/g, 污染物以中、高溴代PBDEs为主。同时, 实际样品分析结果说明, 优化的方法可用于测定土壤中的PBDEs。
4 结 论
采用ASE法提取土壤中的PBDEs, 正己烷丙酮(4∶1, V/V)的提取效果最佳;采用酸性硅胶SPE柱对样品净化, PBDEs完全流出仅需5 mL正己烷, 溶剂用量少, 环境污染小, 洗脱速度快, 杂质干扰少。本方法简单、快捷, 具有良好的净化效果、准确度和精密度(回收率74.4%~125.2%, RSD<15%), 良好的线性关系(r>0.999)及较低的检出限(≤0.22 ng/mL), 可作为土壤介质中PBDEs的有效净化和检测方法。
References
1 Wenlu S, Ford J C, An L, Mills W J, Buckley D R, Rockne K J. Environ. Sci. Technol., 2004, 38(12): 3286-3293
2 Gouin T, Harner T. Environ. Int., 2003, 29(6): 717-724
3 Brouwer A, Morse D C, Lans M C, Schuur A G, Murk A J, KlassonWehler E, Bergman A, Visser T J. Toxicol. Ind. Health, 1998, 14(12): 59-84
4 Glinoer D. Endocr. Rev., 1997, 18(3): 404-433
5 Eriksson P. Neurotoxicology, 1997, 18(3): 719-26
6 Costa L G, Giordano G. Neurotoxicology, 2007, 28(6): 1047-1067
7 Skarman E, Darnerud P O, hrvik H, Oskarsson A. Environ. Toxicol. Pharmacol., 2005, 19(2): 273-281
8 Branchi I, Bichler Z, BergerSweeney J, Ricceri L. Neurosci. Biobehav. Rev., 2003, 27(12): 141-153
9 Per Ola D, Sofia R. Chemosphere, 2006, 62(3): 485-493
10 Elliott J E, Wilson L K, Wakeford B. Environ. Sci. Technol., 2005, 39(15): 5584-91
11 Pu W, Zhang Q, Wang Y, Wang T, Li X, Lei D. Jiang G. Anal. Chim. Acta, 2010, 663(1): 43-48
12 LU Min, HAN ShuYuan, YU YingXin, ZHANG DongPing, WU MingHong, SHENG GuoYing, FU JiaMo. Journal of Instrumental Analysis, 2009, 28(1): 1-6
陸 敏, 韩姝媛, 余应新, 张东平, 吴明红, 盛国英, 傅家谟. 分析测试学报, 2009, 28(1): 1-6
13 Abrha Y, Raghavan D. J. Hazard. Mater., 2000, 80(13): 147-157
14 JIANG JinHua, CHEN Tao. Chinese J. Anal. Chem., 2009, 37(11): 1627-1632
江锦花, 陈 涛. 分析化学, 2009, 37(11): 1627-1632
15 Tao S, Guo L Q, Wang X J, Liu W X, Ju T Z, Dawson R, Cao J, Xu F L, Li B G. Sci. Total Environ., 2004, 320(1): 1-9
16 Tapie N, Le Menach K, Pasquaud S, Elie P, Devier M H, Budzinski H. Chemosphere, 2011, 83(2): 175-185
17 Liaud C, Millet M, Le Calvé S. Talanta, 2015, 131: 386-394
18 Yus V, Quintas G, Pardo O, Pastor A, Guardia M D L. Talanta, 2006, 69(4): 807-815
19 XU NengBin, QIAN FeiZhong, FENG JiaYong, WANG ShengLe, HONG ZhengFang, XU LiHong, CHEN ZhongQuan. Chinese J. Anal. Chem., 2015, 43(2): 251-256
徐能斌, 钱飞中, 冯加永, 汪晟乐, 洪正昉, 徐立红, 陈钟佺. 分析化学, 2015, 43(2): 251-256
20 Król S, Zabiegaa B, Namies'nik J. Talanta, 2012, 93: 1-17
21 FernándezPeralbo M, Vera C F, PriegoCapote F, de Castro M L. Talanta, 2014, 126: 170-176
22 Willenberg I, Von Elsner L, Steinberg P, Schebb N H. Food Chem., 2015, 166: 537-543
23 Liu Y, Nielsen M, Staerk D, Jger A K. J. Ethnopharmacol., 2014, 155(2): 1276-1283
24 Rossmann J, Schubert S, Gurke R, Oertel R, Kirch W. J. Chromatogr. B, 2014, 969: 162-170
25 Wang X, Li P. Food Chem., 2015, 173: 897-904
26 Wiese S, Wubshet S G, Nielsen J, Staerk D. Food Chem., 2013, 141(4): 4010-4018
27 Heuett N V, Ramirez C E, Fernandez A, Gardinali P R. Sci. Total Environ., 2015, 511: 319-330
28 Roszko M, Szymczy K, Jedrzejczak R. Anal. Chim. Acta, 2013, 799(17): 88-98
29 Sun J, Liu J, Liu Q, Qu G, Ruan T,Jiang G. Talanta, 2012, 88,(1): 669-676
30 Liu H, Zhang Q, Cai Z, Li A, Wang Y, Jiang G. Anal. Chim. Acta, 2006, 557: 314-320
31 YANG XinLi, WANG JunDe, XIONG BoHui. Chinese Journal of Chromatography, 2000, 4(18): 308-312
楊新立, 王俊德, 熊博晖. 色谱, 2000, 4(18): 308-312
32 Manirakiza P, Covaci A, Nizigiymana L, Ntakimazi G, Schepens P. Environ. Pollut., 2002, 117(3): 447-455
33 Lino C M, Silveira M I N D. J. Chromatogr. A, 1997, 769(97): 275-283
Abstract A method was established for the determination of 10 polybrominated diphenyl ethers (PBDEs) in soil using accelerated solvent extraction (ASE), solid phase extraction (SPE) and gas chromatography with electron capture detector (GCECD). ASE was used to obtain 10 PBDEs in soil and a good extraction system was investigated by comparison of kinds of extraction systems (nhexane, nhexane∶acetone (4∶1, V/V), nhexane∶acetone (1∶1, V/V), and nhexane∶dichloromethane (1∶1, V/V)). Besides, 10 kinds of SPE columns with different filters were applied to the purification of 10 PBDEs in soil solution. The optimized conditions were acquired by using the mixture of nhexane and acetone (4∶1, V/V) as extract and acidic silica gel column for the purification. Under the optimized conditions, the average recoveries of 10 PBDEs in soil ranged from 74.4% to 125.2% with the RSDs of 4.4%-14.4%. Method detection limits (MDLs) were 0.04-0.22 ng/mL. The method is simple, rapid and efficient, which has been successfully applied to determine 10 PBDEs in contaminated soil.
Keywords Soil; Polybrominated diphenyl ethers; Accelerated solvent extraction; Solid phase extraction; Gas chromatography

