香菇菌丝体多糖的化学结构与抗氧化活性分析
元向东
(包头轻工职业技术学院,内蒙古 包头,014035)
香菇菌丝体多糖的化学结构与抗氧化活性分析
元向东*
(包头轻工职业技术学院,内蒙古 包头,014035)
对香菇菌丝体多糖(Lentinus edodesmyceliumpolysaccharides,LMPS)的2种组分(LMPS-1和LMPS-2)进行化学结构特征分析,旨为香菇菌丝体多糖的构效关系研究提供依据。文中利用高效液相色谱法(HPLC)、气相色谱(GC)、红外光谱(IR)分析等对其化学结构特征进行解析,并测定其抗氧化活性。构成糖分析结果显示:LMPS-1单糖组成为阿拉伯糖、木糖、甘露糖和葡萄糖,其摩尔比为2.5∶0.8∶1∶1.8;LMPS-2的单糖组成为鼠李糖、木糖和葡萄糖,其摩尔比为4.2∶1∶2.7。LMPS-1和LMPS-2均有较强的抗氧化活性,LMPS-2更为显著。香菇菌丝体多糖主要由阿拉伯糖和鼠李糖组成的吡喃型多糖,有较强的抗氧化活性。
香菇;菌丝体;多糖;化学结构;抗氧化
香菇(Lentinus edodes)又称为花菇,属真菌门(Eumycophyta),侧耳科(Pleurotaceae),香菇属(Lentinus),是世界第二大食用菌。香菇口味鲜美,营养丰富,富含多糖、维生素、蛋白质、多元酚、朴菇素、膳食纤维等多种生物活性物质菌丝体多糖是香菇菌丝体中最重要的生物活性物质,作为一种免疫促进剂,已引起人们广泛的兴趣。菌丝体多糖的生物学功能主要有以下几方面:抗氧化、抗衰老、抗肿瘤、免疫调节、抗炎、保肝护肝和降血糖等作用[1-2]。有关香菇菌丝体多糖的药理研究,特别是结构方面的研究已引起国内外学者的高度关注,并成为多糖领域的研究热点。本研究对香菇菌丝体多糖(Lentinus edodesmyceliumPolysaccharides,LMPS)通过DEAE-52纤维素柱和G-100葡聚糖多糖进行分离纯化。分别研究了LMPS-1和LMPS-2分子质量、单糖组成、键型和抗氧化活性,为香菇菌丝体多糖的研究开发及利用提供参考。
1 材料与方法
1.1材料、试剂与仪器
供试菌种:香菇(Lentinus edodes),内蒙古农科院保存。
深层液体种子培养基:马铃薯200g,葡萄糖20g,KH2PO41g,MgSO4·7H2O1g,VB10.1g, 水1L,pH自然。
液体种子培养条件:25 ℃恒温摇床160r/min振荡培养10d。
深层液体发酵培养基:马铃薯200g,葡萄糖20g,KH2PO41g,MgSO4·7H2O1g,Vb10.1g, 蛋白胨3g,酵母粉3g,水1L,pH自然。
深层液体发酵培养条件:100L气升式液体深层发酵罐中培养14d,发酵温度25 ℃,连续通入无菌空气。
实验试剂:30%H2O2,天津市凯通化学试剂有限公司;体积分数95%乙醇,天津市百世化工有限公司;DPPH,Sigma公司;DEAE-52纤维素,Sigma公司;葡聚糖G-100,Sigma公司;苯酚,天津市天大化学试剂厂;浓H2SO4,淄博化学试剂厂有限公司;浓HCl,淄博化学试剂厂有限公司;三氯乙酸,天津大茂化学试剂厂。
实验仪器:752-N紫外可见分光光度计,上海精宏实验设备有限公司;GC2010气相色谱仪,日本津岛公司;TDL-5-A型台式离心机上海安亭科学仪器厂;Nicolet380傅立叶变换红外光谱仪,美国热电集团;Nicolet380傅立叶变换红外光谱仪,美国热电集团;DK-S24型恒温水浴锅,上海精宏实验设备有限公司;LXJ-68-02型离心机,北京医疗仪器修理厂;DZF-6021型真空干燥箱,上海精宏实验设备有限公司。
1.2多糖的提取
利用水提醇沉法提取香菇菌丝体多糖。
1.3成分含量测定
总糖含量采用苯酚-硫酸法[3]测定。
1.4多糖的凝胶柱层析
首先采用DEAE-纤维素离子交换柱对多糖进行分离纯化,用浓度梯度为0.2、0.5、1.0mol/L的NaCl溶液洗脱,洗脱速度控制在1mL/min,每个洗脱梯度收集25管,每管收集2mL,利用苯酚-硫酸法测定收集到的多糖溶液浓度,绘制洗脱曲线。然后用葡聚糖G-100凝胶柱对多糖进行进一步分离纯化和纯度鉴定[4]。用0.1mol/LNaCl溶液充分平衡层析柱后,用蒸馏水作为洗脱剂,洗脱速度控制在0.1mL/min,每管收集2mL,同样利用硫酸-苯酚法对收集到的多糖溶液浓度测定,绘制洗脱曲线。
1.5多糖的分子质量测定
采用高效凝胶渗透色谱法(HPLC)对多糖的分子质量进行测定[5]。用高效液相色谱仪(1260,AgilentTechnologies,USA),SHODEXSB-806HQ色谱柱column(8.0mm× 300mm)及示差折光检测器测定。流动相为0.2mol/LNaCl溶液,进样量为100μL,流速为0.5mL/min,柱温保持在5 ℃。标准品及样品质量浓度均为2mg/mL。用葡聚糖系列样品作为标准品,以lgMw(分子质量对数)对ET(保留时间)绘制标准曲线,得线性回归方程:lgMw=1-0.342 9ET+11.975,R2= 0.999 1。用0.2mol/LNaCl水溶液将样品配成浓度为2mg/mL的溶液,上柱测定其保留时间,根据回归方程计算分子质量。
1.6构成糖分析
糖样品经过酸加热完全水解(0.25mol/LH2SO4,100 ℃,16h),或者不经过水解处理,按照BLAKENEY[6]等制备成各单糖的全乙酰化糖醇衍生物,然后进行气相色谱(GC)分析(岛津GC-14C,柱温210 ℃,N2流速30mL/min),分离柱为岛津公司的毛细管柱DB-1(0.25mm× 30m)。
1.7多糖的红外光谱(IR)分析
多糖的IR分析仪采用PerkinElmer公司的SpectrunGXFT-IR红外光谱分析系统。样品采用KBr压片法进行测定。
1.8多糖的体外抗氧化分析
多糖对DPPH自由基的清除率测定反应体系如下:2mL体积分数为95%的乙醇或DPPH溶液(0.1μmol/L),2mL不同浓度的多糖溶液(100~1 000mg/L)。反应混合物在25 ℃水浴15min,在517nm处测定吸光度[7]。清除羟基自由基的测定方法是采用SMIRONFF的方法[8]。多糖还原力的测定方法根据OYAIZU的方法[9]。
2 结果与分析
2.1香菇菌丝体多糖的组分分离纯化
采用DEAE-纤维素柱对LMPS进行组分分离,分别利用蒸馏水和0.2、0.5、1.0mol/L的NaCl溶液作为流动相对LMPS洗脱,得到2个组分(LMPS-1和LMPS-2),如图1所示。对经过DEAE-纤维素分离得到的2个组分用葡聚糖G-100凝胶做进一步分离。如图2所示,LMPS-1和LMPS-2均分离得到一个单一的洗脱峰,表明LMPS-1和LMPS-2均为纯多糖。对LMPS-1和LMPS-2进行紫外光谱扫描(ultravialetspectrum,UV),试验结果显示LMPS-1和LMPS-2在280nm处有特征吸收峰,表明2种组分可能是以糖蛋白的形式存在。
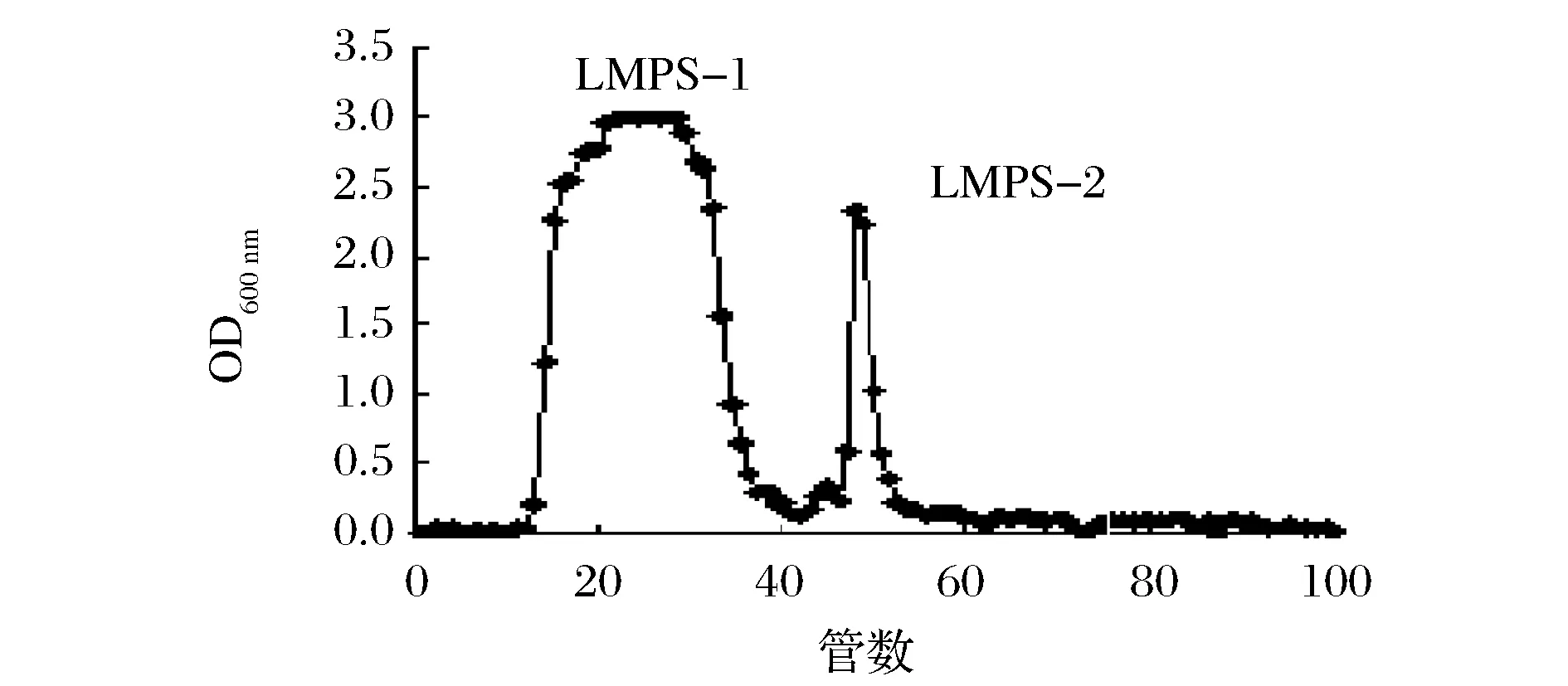
图1 LMPS的DEAE-纤维素离子交换柱层析洗脱曲线Fig.1 The profile of DEAE-cellulose ion exchange column chromatography byLMPS

图2 两种多糖组分的葡聚糖G-100凝胶层析洗脱曲线(A)LMPS-1和(B)LMPS-2Fig.2 The profile of G-100 gel filtration chromatography by two polysaccharides (A)LMPS-1 and (B) LMPS-2
2.2化学结构分析
用高效液相色谱分析多糖分子质量如图3所示。LMPS-1色谱图出现了2个洗脱峰,说明LMPS-1含有分子质量相对集中的2个组分,因此,LMPS-1为不均一多糖。用GPC分析软件计算后可知,LMPS-1的Mw为5.49×104Da,Mn为2.40×104Da,Mv为5.01×104Da,Mz为1.07×105Da,Mp为1.24×104Da,LMPS-1的Mw/Mn值为2.29。LMPS-2为单一对称峰,说明LMPS-2为均一多糖。其Mw为1.35×104Da,Mn为1.05×104Da,Mv为3.55×104Da,Mz为1.20×105Da,Mp为1.14×104Da。LMPS-2的Mw/Mn值为1.29。

图3 两种多糖高效液相色谱图分析(A)LMPS-1和(B)LMPS-2Fig.3 Analysis of HPGPC chromatogram by LMPS-1 and LMPS-2
根据标样的保留时间来测定单糖的含量,由图4和表1可知,LMPS-1含有37%的阿拉伯糖、11.4%的木糖、18.2%的甘露糖和33.4%的葡萄糖, 它们的摩尔比为2.5∶0.8∶1∶1.8,从这些数据可以看出,LMPS-1含量最多的单糖是阿拉伯糖和葡萄糖。
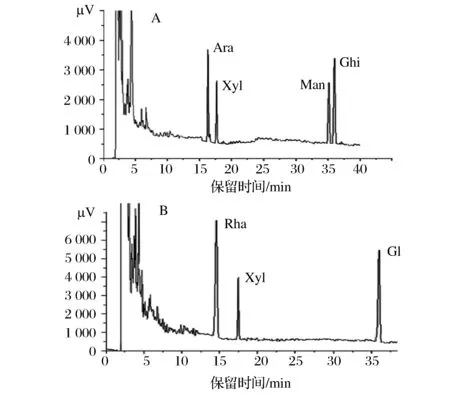
图4 两种多糖气相色谱图分析(A)LMPS-1和(B)LMPS-2Fig.4 Analysis of GC chromatogram by LMPS-1 and LMPS-2

表1 气相色谱结果
注:-:表明多糖组分中不含有该单糖。
LMPS-2含有54.7%的鼠李糖、10.8%的木糖和34.5%的葡萄糖,它们的摩尔比为4.2∶1∶2.7,可以看出LMPS-2含量最多的单糖是鼠李糖和葡萄糖。

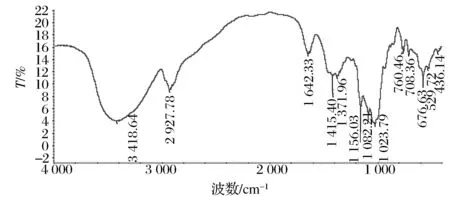
图5 LMPS-1的红外光谱Fig.5 FT-IR spectra of LMPS-1


图6 LMPS-2的红外光谱Fig.6 FT-IR spectra of LMPS-2
2.3两种组分的体外抗氧化活性
2.3.1LMPS-1和LMPS-2对DPPH自由基的清除作用
图7为LMPS-1和LMPS-2对DPPH自由基的清除作用。在浓度为200mg/L时,LMPS-1和LMPS-2对DPPH的清除率分别为(13.85±0.69)%和(32.96±1.65)%。据报道,当浓度为200mg/L时,桑黄菌丝体多糖对DPPH自由基的清除率为8%[13]。结果表明,LMPS-2对DPPH具有较高的清除率,是桑黄的412%。
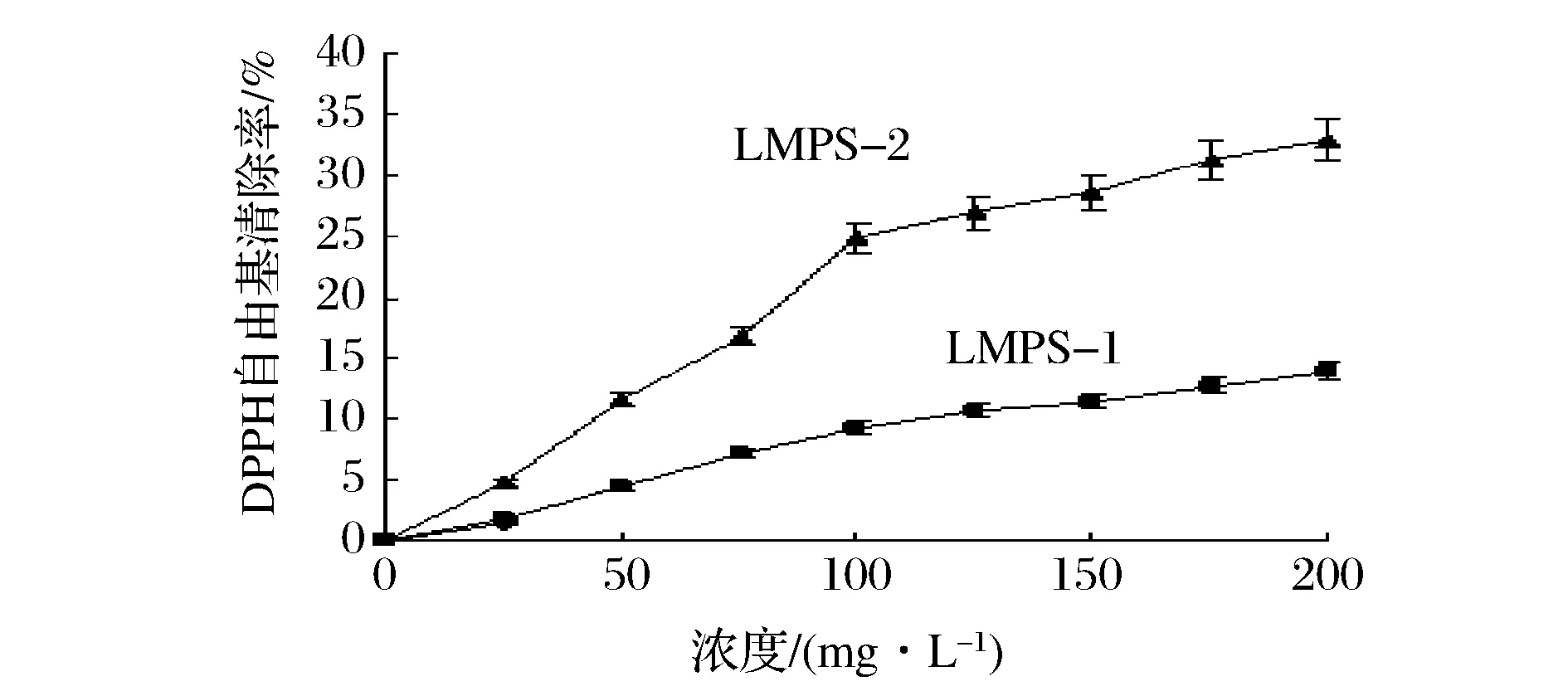
图7 LMPS-1和LMPS-2对DPPH自由基的清除作用Fig.7 Scavenging effects of LMPS-1 and LMPS-2 on DPPH radicals
2.3.2LMPS-1和LMPS-2对羟基自由基的清除作用
LMPS-1和LMPS-2对羟基自由基的清除作用见图8,在1 000mg/L时LMPS-1和LMPS-2对羟基自由基的清除率分别为(8.50 ± 0.43)%和(41.2 ± 2.06)%。据相关报道,当浓度为1 000mg/L时,虫草的清除率为20%[14],桦褐孔菌的清除率为10%[15]。即LMPS-2对羟基自由基的清除作用是虫草的206.0%,桦褐孔菌的412.0%。

图8 LMPS-1和LMPS-2对羟基自由基的清除作用Fig.8 Scavenging effects of LMPS-1 and LMPS-2 on hydroxyl radicals
2.3.3LMPS-1和LMPS-2的还原力测定
如图9所示,在100mg/L时,LMPS-1和LMPS-2在700nm处测得的还原力分别为(0.19 ± 0.01)和(0.53 ± 0.03),据报道,桑黄的为0.10[16],树舌灵芝的为0.40[17],即LMPS-2的还原力是桑黄的530.0%,树舌灵芝的132.5%。LMPS-2的EC50为893.2mg/L。
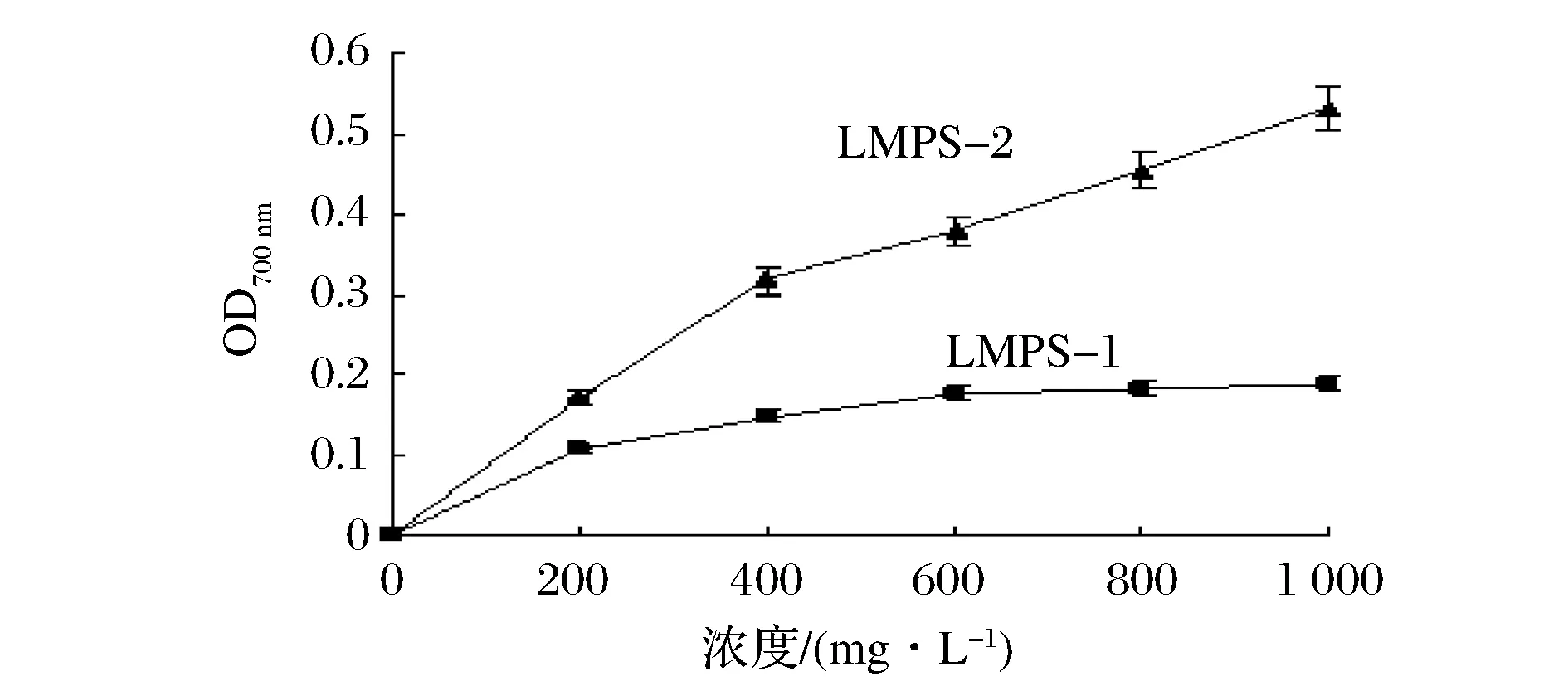
图9 LMPS-1和LMPS-2还原力测定Fig.9 Reducing power of LMPS-1 and LMPS-2
3 结论

[1]吕国英,范雷法,张作法,等.香菇多糖研究进展[J].浙江农业学报,2009,21(2):183-188.
[2]张昕,张强,梁彦龙.香菇多糖的抗肿瘤和降糖作用机制的研究进展[J].中国药事,2008,22(2):149-151.
[3]GILLESDM,HAMILTONKA,REBERSJK,etal.Colorimetricmethodfordeterminationofsugarsandrelatedsubstances[J].AnalChem, 2002, 28(3):350-356.
[4]王博,徐莎,黄琳娟,等.白芨多糖BSPI-A的分离纯化及结构研究[J].食品科学,2010, 31(7):120-123.
[5]LINHJ,QINXM,AIZAWAI,etal.Chemicalpropertiesofwater-solublepectinsinhot-andcold-breaktomatopastes[J].FoodChemistry, 2005, 93(3):409-415.
[6]BLAKENEYAB,HARRISPT,HENRYRJ,etal.Asimpleandrapidpreparationofalditolacetatesformonosaccharideanalysis[J].CarbohydrateRes, 1983, 113 (83):219-299.
[7]LIUXH,FENGPY,SHIYL.StudyofisolationandpurificationofpolysaccharidesfromfreshmyceliaofAgaricus blazeiMussillanditsanti-fatigueeffect[J].JournalofSouthwestAgriculturalUniversity, 2006, 28(2):190-194.
[8]SMIRNOFFN,CUMBESQJ.Hydroxylradicalscavengingactivityofcompatiblesolutes[J].Phytochemistry, 1989, 28(4):1 057-1 060.
[9]OYAIZU.M.Antioxidativeactivityofbrowningproductsofglucosaminefractionatedbyorganicsolventandthinlayerchromatography[J].JJpnSocFoodSci, 1986, 35(11):771-775.
[10]ZOUX.Quickisolationandpurificationofextracellularpolysaccharidesfromagaricusblazeimurillandelementarypropertyanalysis[J].FoodScience, 2005, 17(4):14.
[11]LIUX,ZHAOM.AntioxidantactivitiesandfunctionalcompositioncontentofselectedPhyllanthus emblicafruitsjuice[J].FoodandFermentationIndustries, 2006, 32(5):151-154.
[12]MELOMRS,FEITOSAJPA,FREITASALP,etal..IsolationandcharacterizationofsolublesulfatedpolysaccharidefromtheredseaweedGracilaria cornea[J].CarbohydratePolymers, 2002, 49(4):491-498.
[13]ZHUZP,LIN.AntioxidantpropertiesofpolysaccharidesfromPhellinus igniariusinvitro[J].FoodScience, 2011, 32(19):92-95.
[14]李晓磊,赵珺,李丹,等.冬虫夏草深层发酵菌丝体和蛹虫草子实体抗氧化活性的对比研究[J].食品科技,2009,34(9):75-79.
[15]SHENJW,YUHY,HUOYF,etal..PurificationofpolysaccharideofPhaeoporus obliquusandthebioactivityofpurifiedfractions[J].Mycosystema, 2009, 28(3):564-570.
[16]XIELY,ZHANGY,PENGWH.ImmunefunctionandantioxidantactivityofintracellularpolysaccharidesfromPhellinusbaumii[J].FoodScience, 2011, 32(9):276-281.
[17]LIZP,WUP,WUSQ.StudyonantioxidantactivityofGanoderma applanatumintracellularpolysaccharides[J].ScienceandTechnologyofFoodIndustry, 2010, 31(6):108-110.
CharacteristicandantioxidantactivitiesofpolysaccharidesbyLentinus edodesmycelium
YUANXiang-dong*
(BaotouLightIndustryVocationalTechnicalCollege,InnerMongolia,Baotou014035,China)
ToisolateandpurifyLentinus edodesmyceliumpolysaccharides(LMPS)throughion-exchangechromatographyandgelfiltrationchromatography,andtoprovideatheoreticalreferenceforrelationshipbetweenstructureandactivityofLMPS.ThestructuralcharacteristicsofpolysaccharidewereelucidatedbyHighPerformanceLiquidChromatography(HPLC),gaschromatography(GC),andinfraredspectrum(IR).Results:TheresultshowedthatLMPS-1wascomposedofrhamnose(Rha),arabinose(Ara),xylose(Xyl),mannose(Man),glucose(Glu)andgalactose(Gal)withamolarratioof1.52:2.96:2.91:0.78:1:1.35;LMPS-2containedRha,AraandXylwithamolarratioof2.91:1:1.1:0.2:0.5..TheresultsshowedthatLMPS-1andLMPS-2hadverystrongreducingpowerandscavengingeffectsonDPPHandhydroxylradicals.LMPSfuranoidsweremainlycomposedofRhaandGluwithstrongantioxidantactivities.
Lentinus edodes;mycelium;polysaccharide;chemicalstructure;antioxidantactivities
10.13995/j.cnki.11-1802/ts.201608036
硕士,讲师(本文通讯作者,E-mail:18865489890@163.com)。
2015-09-01,改回日期:2016-01-24

