高效液相色谱法测定樱桃汁及不同酿酒酵母所酿樱桃酒的活性成分
吕国涛,牛宇,单璐,冀佩双,张丽珍*
1(山西大学 生命科学院,山西 太原, 030006) 2(山西省农业科学院 农业资源与经济研究所,山西 太原, 030006)
高效液相色谱法测定樱桃汁及不同酿酒酵母所酿樱桃酒的活性成分
吕国涛1,牛宇2,单璐1,冀佩双1,张丽珍1*
1(山西大学 生命科学院,山西 太原, 030006)2(山西省农业科学院 农业资源与经济研究所,山西 太原, 030006)
以As2399、grapeZ2、WineZ3 三种酿酒酵母对樱桃果汁进行发酵酿造的樱桃酒为研究对象,利用高效液相色谱法对3种樱桃酒和樱桃果汁的酚酸类化合物、黄酮类化合物、有机酸类化合物进行分析比较。结果表明,所检测的各酚酸、黄酮、有机酸均呈现良好的线性关系(R2>0.992),不同水平的添加回收率为91.93%~106.82%。4种样品分析表明,筛选的较优酿酒酵母是As2399。樱桃酒中总酚酸与总黄酮的含量均比樱桃果汁中减少。4种样品总酚含量依次为果汁>As2399>WineZ3>grapeZ2;总黄酮含量依次为果汁>As2399>WineZ3>grapeZ2。樱桃酒中的绿原酸、咖啡酸、香草酸、p-香豆素和阿魏酸的含量均显著高于樱桃果汁,As2399樱桃酒中p-香豆素的含量显著高于另2种樱桃酒。樱桃酒与樱桃果汁中的芦丁、白藜芦醇、槲皮素、山奈酚含量无显著差异,在As2399樱桃酒检测到了黄芩素。3种樱桃酒中酒石酸、苹果酸、柠檬酸含量均比樱桃果汁中增加,草酸含量均比樱桃果汁减少;草酸、柠檬酸、富马酸在3种樱桃酒中无显著差异,As2399樱桃酒中酒石酸、柠檬酸与琥珀酸含量较另2种樱桃酒高。
樱桃酒;活性成分;高效液相色谱法;酿酒酵母
樱桃(cherry)属蔷薇科(Rosaceae)李属(PrunusL.)乔木,樱桃果实较其他落叶果树果实成熟较早。其果实甜美,多汁爽口,富含大量的糖类、维生素、蛋白质、可溶性固形物及钙、铁、钾等物质[1]。考虑到樱桃不易储存的原因,可对樱桃进行一些加工处理,目前广泛利用樱桃进行樱桃酒的酿造。樱桃酒中含有大量的酚酸、黄酮、有机酸类化合物。
酚类物质作为植物体中重要的次生代谢产物,对植物生长发育起着重要作用,多酚物质是判断果酒存在差异性的主要原因之一,不仅决定着果酒涩味和苦味的优劣与强弱,还影响着原果的色泽、贮藏寿命及生物化学稳定性[2]。黄酮类物质作为自然界存在的酚类化合物中最大的一类,其功效众多,是一种强抗氧剂,能够有效清除体内的氧自由基,大部分单宁是由黄酮类化合物转变而来的[3-4]。有机酸是一类含有羧基的化学物质,具有增加冠脉流量、抑制脑组织脂质过氧化物生成、抗突变和抗癌等作用,作为果酒中主要的营养物质之一,其含量的高低与酒制品的品质和保健功能有着极其密切的关系[5-8]。
随着生活节奏的加快,人们越来越重视食品的营养价值及其保健功能,人们对酒类的消费要求也逐渐发生了变化,消费趋势由高度酒转变为低度酒,开发樱桃酒具有重要意义。目前国内外对与樱桃酒中的酚酸、黄酮、有机酸及挥发性成分的定量定性研究甚少[9-10]。本文以As2399、grapeZ2、WineZ3 3种酿酒酵母对樱桃果汁进行发酵酿造的樱桃酒为研究对象,利用高效液相色谱技术(HPLC)对3种不同发酵方式所得樱桃酒的活性物质与樱桃果汁进行了分析与对比,为樱桃酒的风味评价和生产工艺优化提供可靠的科学依据。
1 材料与方法
1.1材料与试剂
樱桃(品种‘红玛瑙’),采收于山西省农业科学院果树研究所;酿酒酵母由天津科技大学馈赠;标准品没食子酸、咖啡酸、绿原酸、阿魏酸、香草酸、p-香豆酸(纯度:97.5%~102.5%) 西格玛奥德里奇(上海)贸易有限公司;标准品芦丁、槲皮素、白藜芦醇、山奈酚、黄芩素、汉黄芩素北京世纪奥科生物技术有限公司(纯度≥98%);标准品草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、富马酸(纯度≥90.8%) 上海阿拉丁试剂公司;乙腈(色谱纯) 天津市四友精细化学品有限公司;甲醇(色谱纯) 天津市大茂化学试剂厂;冰醋酸(色谱纯) 天津市化学试剂三厂;福林酚北京索莱宝宝科技有限公司;乙醇(95%)、磷酸(96%)、硼氢化钠、AlCl3、Na2CO3、氯醌、香草醛、三氟酸、四氢呋喃(99%)、盐酸均为市售分析纯;试验中所用水均为超纯水。
1.2仪器与设备
U3000型戴安高效液相色谱仪;ME204电子天平,梅特勒-托利多仪器(上海)有限公司产品;InfiniteM200PRO全波长多功能微孔板检测仪,帝肯公司;HH-4数显恒温水浴锅,江苏金坛市环宇科技仪器厂。
1.3实验方法
1.3.1樱桃酒的酿造

1.3.2酚酸类化合物的分析
1.3.2.1总酚含量的测定
总酚含量的测定采用福林-酚法[11-12]。在试管中加入样品液(或标准溶液)、福林酚试剂各100μL,再加入400μL去离子水,充分振荡反应6min。后加0.8mL超纯水和1mL7%的Na2CO3溶液,混匀于室温进行黑暗反应90min后于760nm处测吸光度值。总酚含量以没食子酸含量mg/L表示。
1.3.2.2酚酸类化合物的定量定性检测
混合标准品的制备:称取0.5mg各酚酸的标准品,溶于1mL流动相中,混合各酚酸标准品的母液,得到混合标准品,通过控制进样量的多少来改变各标准品的浓度,建立各酚酸的标准曲线。
色谱条件:C18色谱柱(4.6mm×150nm,5μm);柱温30 ℃;流动相为V(乙腈)∶V(超纯水)=2∶8,pH=3.0;流速0.5mL/min;进样量10μL;紫外检测波长280nm。
1.3.3黄酮类化合物的分析
1.3.3.1总黄酮的测定
总黄酮含量的测定采用硼氢化钠/氯醌法[13-14]。将样品(或槲皮素标准液)1mL置于试管中,加入0.5mL硼氢化钠和0.5mLAlCl3室温振荡30min,之后加入0.5mL硼氢化钠室温振荡30min。将2mL乙醇充分混合后避光处理振荡15min。加入1mL氯醌95 ℃水浴60min。自来水冷却,用甲醇定容至4mL,加入1mL香草醛,摇匀后加入2mL浓盐酸,室温黑暗反应15min后2 500r/min离心3min。取200μL上清液于490nm处检测其吸光值。总黄酮含量以槲皮素含量(g/L)表示。
1.3.3.2黄酮类化合物的定量定性检测
混合标准品的制备:称取1mg各黄酮的标准品,溶于1mL流动相中, 之后同1.3.2.2。
色谱条件:C18色谱柱(4.6mm×150nm,5μm);柱温30 ℃;流动相:A为10%乙腈水溶液(含0.2%乙酸),B为V(甲醇)∶V(乙腈)∶V(超纯水)=2∶2∶1(含0.2%乙酸);流速0.5mL/min;进样量10μL;紫外检测波长360nm[15];梯度洗脱程序见表1。

表1 梯度洗脱程序
1.3.4有机酸类化合物的定量定性检测
混合标准品的制备:称取1mg各有机酸的标准品,溶于1mL流动相中, 之后同1.3.2.2。
色谱条件:C18色谱柱(4.6mm×150mm,5μm);柱温55 ℃;流动相为0.05mol/LV(磷酸)∶V(甲醇)=95∶5; 流速0.7mL/min;进样量10μL;紫外检测波长230nm[16-18]。
1.3.5添加回收率计算[公式(1)]

(1)
式中:X为标准品与样品混合后测定某项指标的含量,mg/L;Y为样品中某项指标的含量,mg/L;Z为某项标准品含量,mg/L。
2 结果与分析
2.1酚酸类化合物的检测分析
2.1.1总酚含量测定
总酚含量的测定以没食子酸为参照,横坐标为没食子酸的浓度(mg/L),纵坐标为对应吸光度值,绘制标准曲线。其线性回归方程为:Y=0.002 1X+0.0483,R2=0.993,计算得到各样品总酚含量。
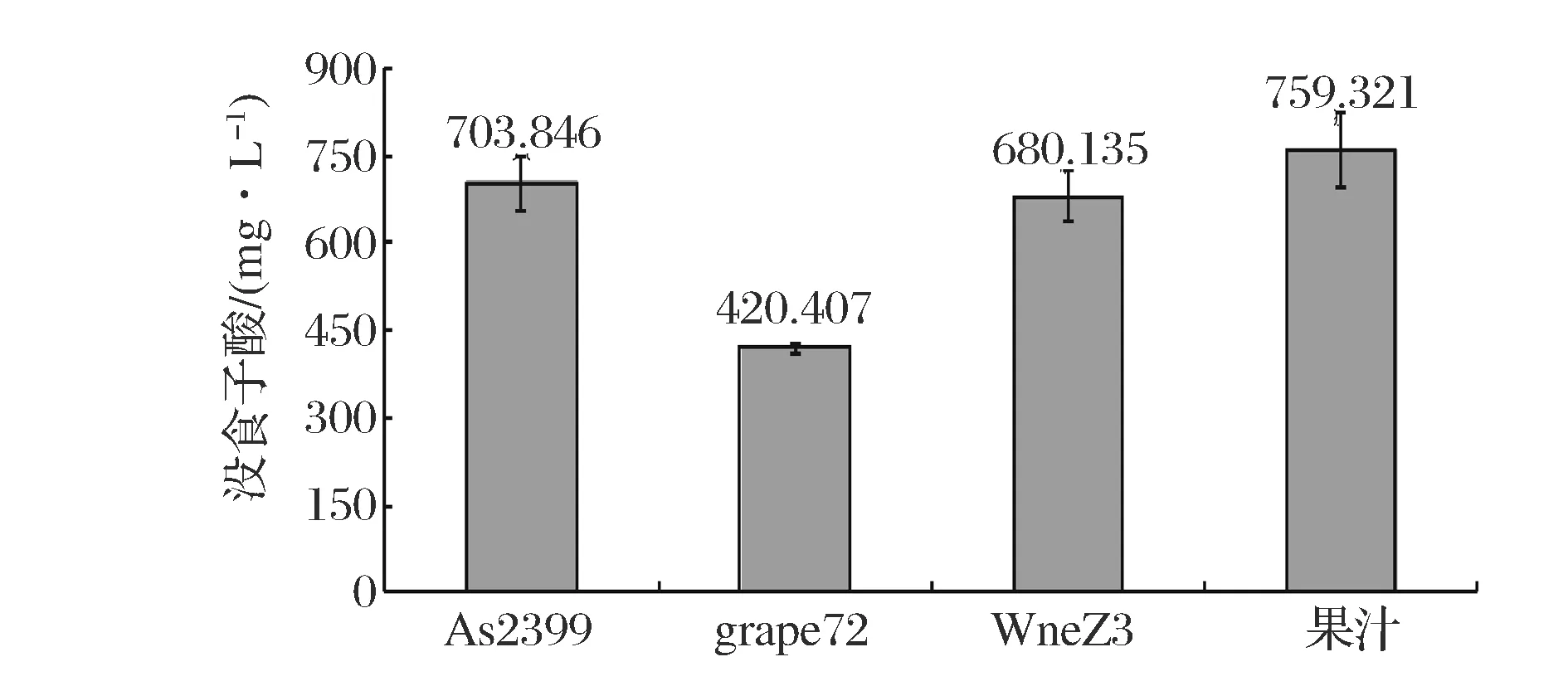
图1 樱桃果汁及樱桃酒中总酚酸含量Fig.1 The total phenolic acid content in cherry juice and cherry wine
如图1所示,4种样品总酚含量从高到低依次为:果汁>As2399>WineZ3>grapeZ2,樱桃果汁中的总酚含量较3种樱桃酒多。As2399樱桃酒在与WineZ3樱桃酒与樱桃汁对比其酚酸的保留程度较大,相对于grapeZ2酿酒酵母较优。
2.1.2各酚酸化合物的测定分析
按1.3.2.2色谱条件对标准品与样品进行分析,6种酚酸标准品色谱图如图2所示,grapeZ2樱桃酒样品色谱图如图3所示,各酚酸之间分离良好,选取色谱条件合适。样品中各酚酸检测结果如表2所示。 各酚酸类化合物添加回收率在93.50%~102.32%之间,满足研究需要。樱桃果汁与3种樱桃酒中没食子酸、绿原酸、咖啡酸、香草酸、p-香豆素和阿魏酸均含量差异显著(P<0.05)。检测的6种酚酸类化合物中,除没食子酸外,樱桃酒中各酚酸含量较樱桃汁果汁均有不同程度的增长。

1-没食子酸;2-绿原酸;3-咖啡酸;4-香草酸;5-p-香豆素;6-阿魏酸图2 酚酸类混合标准溶液色谱图Fig.2 Chromatogram of mixed standards on pheolic acid

1-没食子酸;2-绿原酸;3-咖啡酸;4-香草酸;5-p-香豆素;6-阿魏酸图3 grapeZ2樱桃酒酚酸色谱图Fig.3 Phenolic acids chromatograms of grapeZ2 cherry wine
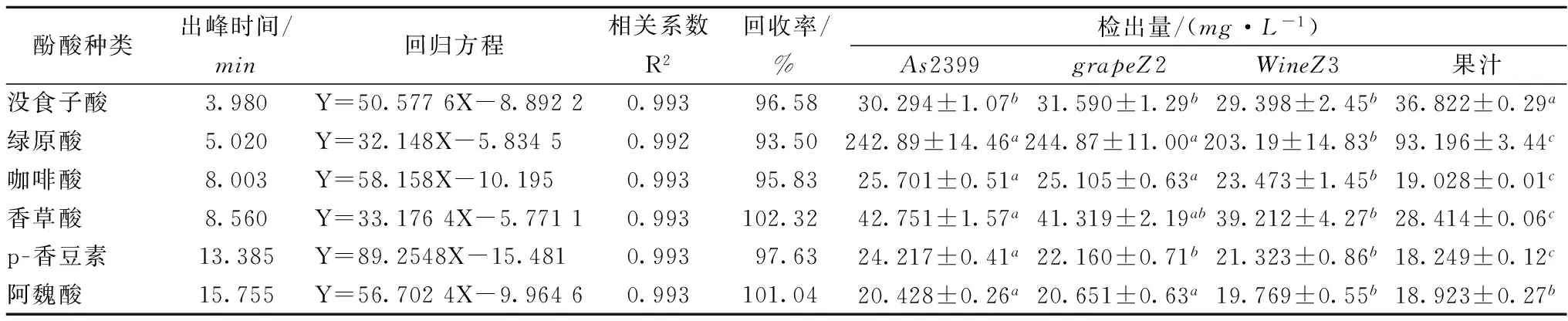
表2 樱桃果汁及樱桃酒中各酚酸含量
注:同行不同字母代表差异显著(P<0.05,n=3)。
As2399樱桃酒中p-香豆素的含量显著高于另2种酵母所酿樱桃酒(P<0.05),没食子酸、咖啡酸、绿原酸、咖啡酸、香草酸及阿魏酸的含量在As2399和grapeZ2 2种樱桃酒差异不显著(P<0.05);WineZ3所酿樱桃酒中各酚酸的含量均为最少。
2.2黄酮类化合物的检测分析
2.2.1总黄酮含量测定
总黄酮含量的测定以槲皮素为参照,横坐标为槲皮素浓度(g/L),纵坐标为对应的吸光度值绘制标准曲线。线性回归方程为:Y=0.011 95X+0.079 58,R2=0.992,计算得到各样品中总黄酮的含量。
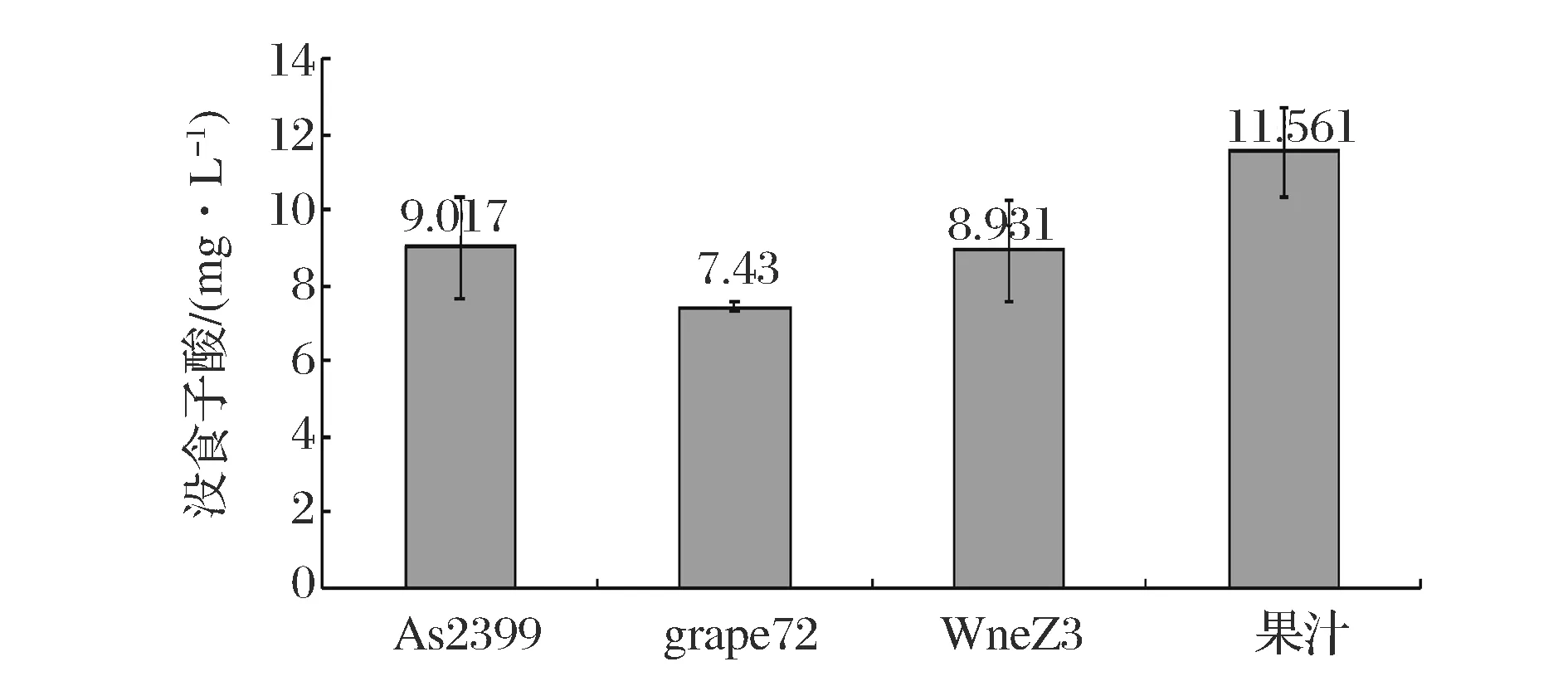
图4 樱桃果汁及樱桃酒中总黄酮含量Fig.4 The total flavonoid content of cherry juice and cherry wine
如图4所示,4种样品总黄酮含量从高到低依次为:果汁>As2399>WineZ3>grapeZ2,樱桃酒中总黄酮含量较樱桃汁中减少,是因为在酿造的过程中的一些次级代谢产物会与黄酮发生反应,形成大分子衍生物[19]。虽然3种酵母酿造的樱桃酒中总黄酮含量较其果汁中少,但利用As2399和WineZ3酿酒酵母所酿造的樱桃酒总黄酮相对樱桃果汁变化小,总黄酮在As2399与WineZ3所酿樱桃酒中的保留较高,相对于grapeZ2酵母较优。
2.2.2各黄酮类化合物的分析测定
按1.3.3.2色谱条件对标准品与样品进行测定,7种黄酮标准品色谱图如图5所示,As2399樱桃酒样品色谱图如图6所示,各黄酮之间分离良好,选取色谱条件合适。样品中各黄酮检测结果如表3所示。
如表3所示,添加回收率在92.66%~106.82%,可满足研究需要。樱桃汁与3种樱桃酒中芦丁、白藜芦醇、槲皮素、山奈酚含量差异不显著(P<0.05),样品中没有检出汉黄芩素,只在As2399樱桃酒中检测到黄芩素。结果表明樱桃汁在酵母作用的发酵过程中,芦丁、白藜芦醇、槲皮素、山奈酚的结构与含量是稳定的。

1-芦丁;2-白藜芦醇;3-槲皮素;4-山奈酚;5-黄芩素;6-汉黄芪素图5 黄酮类混合标准溶液色谱图Fig.5 Chromatogram of mixed standards on flavonoids
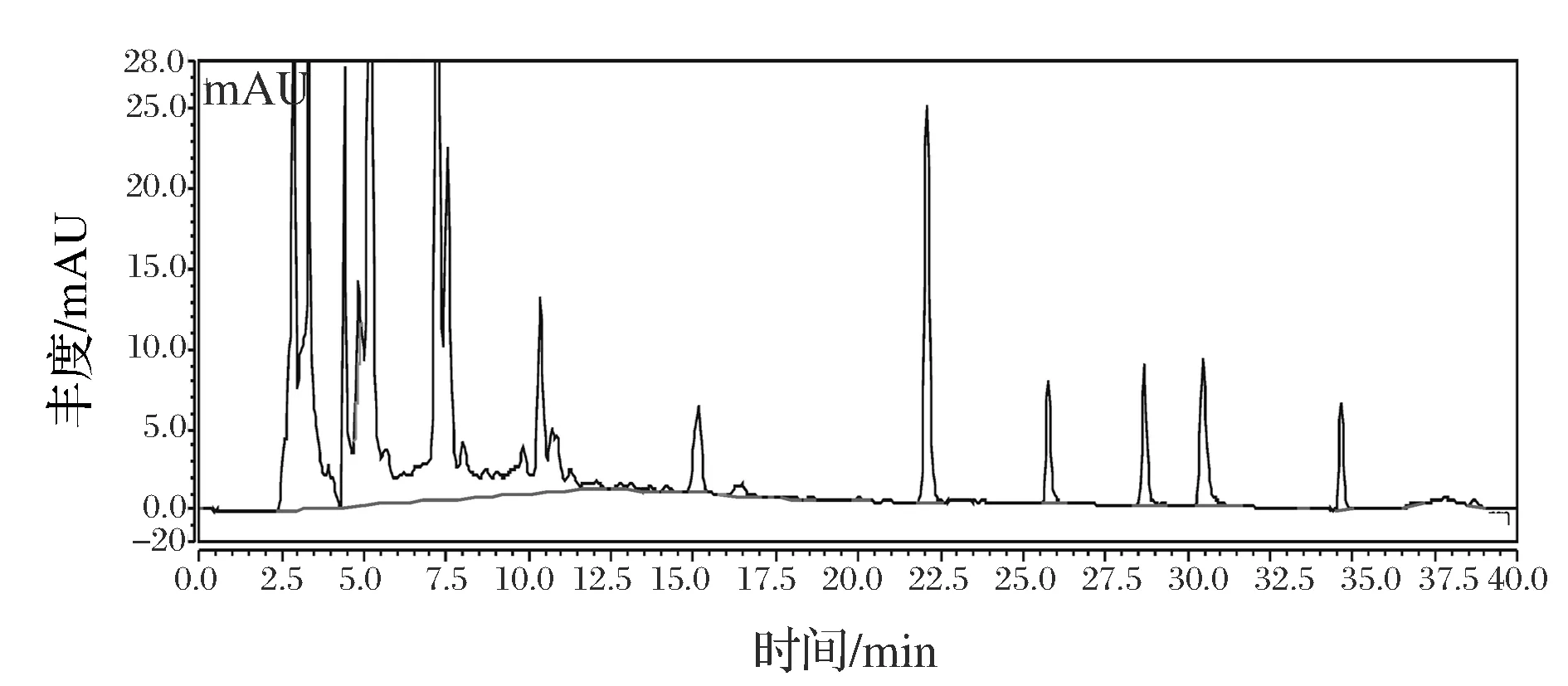
1-芦丁;2-白藜芦醇;3-槲皮素;4-山奈酚;5-黄芩素图6 As2399樱桃酒黄酮色谱图Fig.6 Flavonoids chromatograms of As2399 cherry wine

黄酮种类出峰时间/min回归方程相关系数R2回收率/%检出量/(mg·L-1)As2399grapeZ2WineZ3果汁芦丁15.182Y=21.570X-2.78140.9994102.3817.063±0.61a16.813±0.32a16.363±0.18a19.173±6.5a白藜芦醇22.070Y=83.064X-2.78140.999597.983.410±0.01a3.410±0.003a3.407±0.003a3.417±0.01a槲皮素25.747Y=23.6814X-3.1850.999396.8113.830±0.05a13.813±0.08a13.797±0.08a13.747±0.09a山奈酚28.668Y=28.5486X-3.8500.9993106.8213.543±0.04a13.300±0.05a13.417±0.23a13.387±0.70a黄芩素30.448Y=40.734X-5.5310.999497.8513.687±0.06ndndnd汉黄芩素34.647Y=18.3834X-5.4310.99492.66ndndndnd
注:同行不同字母代表差异显著(P<0.05,n=3)。
2.3有机酸类化合物的分析
按1.3.4色谱条件对标准品与样品进行测定,7种有机酸标准品色谱图如图7所示,樱桃汁样品色谱图如图8所示各有机酸之间分离良好,选取色谱条件合适。样品中各有机酸检测结果如表4所示。
由表4可知,各有机酸添加回收率在91.93%~105.85%,可满足研究需要。樱桃汁与3种樱桃酒中草酸、酒石酸、苹果酸、乳酸、柠檬酸含量均差异显著(P<0.05)。苹果酸是樱桃果汁和樱桃酒中含量最高的。樱桃果汁中的草酸在经过酿造后,含量降低,As2399酿酒酵母对草酸有很好的保留性与稳定性。3种樱桃酒中苹果酸、琥珀酸、富马酸没有显著差异。As2399樱桃酒中草酸、酒石酸与柠檬酸含量较另2种酵母发酵樱桃酒高。As2399樱桃酒中没有检测到乳酸。As2399酿酒酵母相对较优。苹果酸作为天然果汁的重要成分,味道温润、香味特殊、余味时间长[20-21];柠檬酸有清爽的酸味,口感温和清爽,有新鲜感,后苦时间短[22];琥珀酸的味感较浓,既苦又咸,引起唾液的分泌,最富有味觉特征,可使酒的滋味浓厚,增加醇厚感;乳酸微奶味、酸味微弱尖利,稍有涩味[23-24]。有机酸的含量差异在樱桃酒的口感和风味上起重要作用,对有机酸含量的控制也对酿造工艺的优化提供了理论依据。

1-草酸;2-酒石酸;3-苹果酸;4-乳酸;5-柠檬酸;6-琥珀酸;7-富马酸图7 有机酸混合标准溶液色谱图Fig.7 Chromatogram of mixed standards on organic acids
1-草酸;2-苹果酸;3-乳酸;4-柠檬酸;5-琥珀酸;6-富马酸图8 樱桃汁有机酸色谱图Fig.8 organic acids of cherry juice

表4 樱桃果汁及樱桃酒中各有机酸含量
注:同行不同字母代表差异显著(P<0.05,n=3)。
3 结 论
本研究通过高效液相色谱法,在保证分离效果的同时,对3种不同酿酒酵母所酿的樱桃酒及其果汁的活性物质进行比较,对最优酿酒酵母进行了筛选。实验结果表明樱桃酒在酿造的过程中,酚酸类化合物与黄酮类化合物的含量均会比樱桃果汁中减少。4种样品总酚含量依次为:果汁>As2399>WineZ3>grapeZ2;总黄酮含量依次为:果汁>As2399>WineZ3>grapeZ2。As2399樱桃酒中的总酚酸及总黄酮量保留最高。SUN[25]等人也利用不同酿酒酵母对其多酚类物质进行筛选,其筛选的最优酵母所酿樱桃酒中总酚含量为742.7mg/L与本实验中总酚703.85mg/L差异不大。
樱桃酒中的绿原酸、咖啡酸、香草酸、p-香豆素和阿魏酸的含量均显著高于樱桃果汁,As2399樱桃酒中p-香豆素的含量显著高于另2种酵母所酿樱桃酒(P<0.05),没食子酸、咖啡酸、绿原酸、咖啡酸、香草酸及阿魏酸的含量在As2399和grapeZ2 2种樱桃酒差异不显著(P<0.05);WineZ3所酿樱桃酒中各酚酸的含量均为最少。樱桃酒与樱桃果汁中的芦丁、白藜芦醇、槲皮素、山奈酚含量无明显变化,在As2399樱桃酒检测到了黄芩素。3种樱桃酒中酒石酸、苹果酸、柠檬酸含量均比樱桃果汁中增加;草酸含量均比樱桃果汁减少,3种樱桃酒中草酸、柠檬酸、富马酸无显著差异(P<0.05),As2399樱桃酒中酒石酸、柠檬酸与琥珀酸含量较另2种樱桃酒高,苹果酸是所测各机酸中含量最多的,As2399樱桃酒中的苹果酸较樱桃汁增加了56.31%。高卫卫[16]利用反向高效液相色谱法对樱桃酒中的有机酸类化合物进行了定量定性分析,其所测定的苹果酸、乳酸、柠檬酸、草酸均远小于本实验所筛选出的As2399樱桃酒。原因可能是所选用的樱桃品种或酿酒酵母不同。通过对3种酵母中的酚酸类物质、黄酮类物质和有机酸类物质进行综合考量,As2399酿酒酵母明显优于另两种酵母。关于樱桃品种对樱桃酒品质的影响,需要在后续研究中探究。
本实验建立的樱桃汁和樱桃酒中的各酚酸类化合物、黄酮类化合物及有机酸类化合物的高效液相色谱检测方法,各活性成分得到了良好的分离,操作简便且具有良好的灵敏性和检测度。酿酒酵母的筛选为樱桃酒酿造工艺的研究提供了理论基础。
[1]曹家树, 秦岭主编. 园艺植物种质资源学[M]. 北京:中国农业出版社, 2005:128-129.
[2]YOOKM,AI-FARSIM,LEEH,etal.AntiproliferativeeffectsofcherryjuiceandwineinChinesehamsterlungfibroblastcellsandtheirphenolicconstituentsandantioxidantactivities[J].FoodChemistry, 2010,123(8):734-740.
[3]刘一健, 孙剑锋, 王颉. 葡萄酒酚类物质的研究进展[J]. 中国酿造, 2009 (8):5-9.
[4]ANAMARIAH,VASILE-MIRCEAC,ClAUDIAC.Analysisoftotalphenolic,flavonoids,anthocyaninsandtanninscontentinRomanianredwines:Predictionofantioxidantactivitiesandclassificationofwinesusingartificialneuralnetworks[J].FoodChemistry, 2014,150(4):113-118.
[5]ESTEVESVI,LIMASSF.Usingcapillaryelectrophoresisforthedeterminationoforganicacidinportwine[J].AnalyticaChimicaActa, 2004, 513(1):163-167.
[6]KOEKMM,BASM,WERFMJVD,etal.Microbialmetabolomicswithgaschromatography/massspectrometry[J].AnalyticalChemistry, 2006, 78(4):1 272-1 281.
[7]高海燕, 王善广, 胡小松. 利用反相高效液相色谱法测定梨汁中有机酸的种类和含量[J]. 食品与发酵工业, 2004,30(8):96-100.
[8]朱婷婷, 吴帅, 杜金华. 不同原浓啤酒中有机酸的含量分析[J]. 食品与发酵工业, 2005,31(4):108-112.
[9]杨启贤, 徐莉莉, 王安香. 干型樱桃酒酿制及相关技术的研究[J]. 中国食品工业, 2008(10):54-55.
[10]SUNSY,GONGHS,JIANGXM,etal.Selectednon-SaccharomyceswineyeastsincontrolledmultistarterfermentationswithSaccharomyces cerevisiaeonalcoholicfermentationbehaviourandwinearomaofcherrywines[J].FoodMicrobiology,2014, 44(6):15-23.
[11]SINGLETONVL,ORTHOFERR,LAMUELA-RAVENTOSRM.AnalysisoftotalphenolsandotheroxidationsubstratesandantioxidantsbymeansofFoin-Ciocalteureagent[J].MothodsinEnzymology, 1999, 299(1):152-178.
[12]SUNJ,LIUSF,ZhANGCS,etal.Chemicalcompositionandantioxidantactivitiesofbroussonetiapapyriferafruits[J].PLosOne, 2012,7(2):251-264.
[13]HEXJ,LIUD,LIURH.Sodiumborohydride/chloranil-basedassayforquantifyingtotalflavonoids[J].JAgricFoodChem, 2008, 56(20):9 337-9 344.
[14]WANGSS,WANGDM,PUWJ,etal.Phytochemicalprofiles,antioxdantandantimicrobialactivitiesofthreePotentillaspecies[J].BMCComplementaryandAlternativeMedicine,2013,13(1):321.
[15]FUENTES-ALVENTOSAJM.IdentificationofflavonoiddiglycosidesinseveralgenotypesofAsparagusfromtheHuetor-Tajarpopulationvariety[J].JAgricFoodChem, 2007,55(24):10 028-10 035
[16]高卫卫, 杜金华, 于玲, 等. 樱桃酒中的有机酸种类和含量的研究[J]. 食品与发酵工业, 2008,34(10):145-148.
[17]ZOTOUA,LOUKOUZ,KARAVAO.Methoddevelopmentforthedeterminationofsevenorganicacidinwinesbyreversedphasehighperformanceliquidchromateography[J].Chromatographia, 2004,60(1-2):39-44.
[18]段雪荣, 陶永胜, 杨雪峰.HPLC法快速检测李子酒中多种有机酸[J]. 西北农业学报, 2007(5):208-210.
[19]杨 华, 刘亚娜, 郭德军. 红豆越橘果酒发酵过程总酚及总黄酮含量的变化[J]. 酿酒科技,2015(11):22-25.
[20]黄桂颖, 白卫东, 杨幼慧, 等. 反相高效液相色谱法测定荔枝肉中10种有机酸[J]. 现代食品科技, 2009, 25(5):568-570.
[21]白卫东, 陈悦娇, 陈海光.RP-HPLC法测定荔枝果酒中的有机酸[J].食品研究与开发, 2010, 31(10):130-134.
[22]刘晓艳, 白卫东, 蒋爱民, 等. 荔枝果酒加工过程中有机酸的变化研究[J].中国酿造, 2011(11):65-69.
[23]WHITINGGC.Organicacidmetabolismofyeastsduringfermentationofalcoholicbeverages-Areview[J].JInstBrew,1976, 82(2):84-92.
[24]INESM,SUAREZ-LUQUES,HUIDOBROJF.Areviewoftheanalyticalmethodstodetermineorganicacidsingrapejuicesandwines[J].FoodResInt, 2005, 38(10):1 175-1 188.
[25]SUNSY,JIANGWG,ZHAOYP.EvaluationofdifferentSaccharomyces cerevisiaestrainsontheprofileofvolatilecompoundsandpolyphenolsincherrywines[J].FoodChemistry,2011, 127(2):547-555.
Analysisofactiveingredientincheeryjuiceanddifferentcherrywinebyhighperformanceliquidchromatography
LYUGuo-tao1,NIUYu2,SHANLu1,JIPei-shuang1,ZHANGLi-zhen1*
1(SchoolofLifeScience,ShanxiUniversity,Taiyuan030006,China)2(InstituteofAgriculturalResourcesandEconomy,ShanxiAcademyofAgriculturalSciences,Taiyuan030006,China)
ThecurrentstudywascarriedouttoelucidatetheeffectofinoculationofAs2399,grapeZ2,WineZ3yeastonthechemicalmaterialsproductionincherrywines,especiallythecontentsofphenolicacids,flavonoids,andorganicacids.Thequalitativeandquantitativedeterminationofphenolicacids,flavonoidsandorganicacidsincherrywineandcherryjuicewerecarriedoutbyHPLC.Resultsshowedthattherewasgoodlinearrelationshipamongthecontentofthephenolicacids,flavonoids,andorganicacids(R2>0.992).Therecoveryrateatdifferentadditionlevelswere91.93%-106.82%.AnalysisoffoursamplesshowedthatthebestyeaststrainwasAs2399.Thetotalcontentsofphenolicacidandflavonoidsincherrywinewerelowerthanthoseincherryjuice.Theorderoftotalcontentofphenolicacidinthefoursampleswasasfollows:fruitjuice>As2399>WineZ3>grapeZ2.Theorderoftotalcontentofflavonoidswasasfollows:fruitjuice>As2399>WineZ3>grapeZ2.Thecontentsofchlorogenicacid,coffeeacid,vanillaacid, p-coumarinandferulicacidincherrywineweresignificantlyhigherthanthoseincherryjuice.Thecontentofp-coumarininAs2399cherrywinewassignificantlyhigherthanthoseintheothertwokindsofcherrywine.Therewasnosignificantdifferencebetweencherrywineandcherryjuiceonthecontentofrutin,resveratrol,quercetinandkaempferol.HuangQinsuonlywasdetectedincherrywineAs2399.Thecontentsoftartaricacid,malicacidandcitricacidinthethreekindsofcherrywineweremorehigherthanthatincherryjuice,butthecontentofoxalicacidwaslowerthanthatincherryjuice.Therewasnosignificantdifferenceinthethreekindsofcherrywineonthecontentofoxalicacid,citricacidandfumaricacid.Thecontentoftartaricacid,citricacidandfumaricacidinAs2399cherrywinewerehigherthanthoseintheother2kindsofcherrywine.
cherrywine;activeingredient;highperformanceliquidchromatography(HPLC); Saccharomyces cerevisiae
10.13995/j.cnki.11-1802/ts.201608030
硕士研究生(张丽珍教授为通讯作者,E-mail:lizhen@sxu.edu.cn)。
山西省科技厅重点研发计划(农业)(2016)
2016-03-01,改回日期:2016-03-28

