Siewert Ⅱ、Ⅲ型胃食管结合部癌的临床特点及HER2、SKP2表达
刘中元,张黎
(1 济宁市第一人民医院,山东济宁272100;2 山东大学附属山东省立医院)
Siewert Ⅱ、Ⅲ型胃食管结合部癌的临床特点及HER2、SKP2表达
刘中元1,张黎2
(1 济宁市第一人民医院,山东济宁272100;2 山东大学附属山东省立医院)
目的 探讨Siewert Ⅱ、Ⅲ型胃食管结合部癌(AEG)的临床特点及人表皮生长因子受体2(HER2)、细胞S期激酶相关蛋白2(SKP2)表达变化。方法 选取SiewertⅡ及Ⅲ型AEG患者206例,比较二者的临床特点;应用免疫组化方法检测其HER2、SKP2表达情况,分析SiewertⅡ、Ⅲ型AEG患者HER2、SKP2阳性表达与临床病理参数的关系。结果 两型AEG患者肿瘤大小、淋巴结转移、肿瘤分化程度和TNM分期比较有统计学差异(P均<0.05)。SiewertⅡ型AEG 患者HER2 、SKP2 阳性表达率分别为32.9%、41.2%,SiewertⅢ型AEG患者HER2、 SKP2阳性表达率分别为36.3%、55.4%;两组SKP2阳性表达率差异有统计学意义(P<0.05)。SiewertⅡ或Ⅲ型AEG患者中,肿瘤直径<5 cm与≥5 cm、浸润深度T1~T2与T3~T4、高~中分化与低分化、淋巴结转移N0~N1与N2~N3之间HER2阳性表达率有统计学差异(P均<0.05)。结论 HER2、SKP2异常表达可促进AEG的发生发展,HER2、SKP2表达检测对AEG早期诊断及疗效判断有重要作用。
食管胃结合部腺癌;人表皮生长因子受体2;细胞S期激酶相关蛋白2
1987年Siewert等基于食管胃结合部的解剖特点提出远端食管癌和贲门癌应属同一种疾病,即食管胃结合部腺癌(AEG)。1998年国际胃癌联合会和国际食管疾病学会提出AEG的分型标准:SiewertⅠ型为食管下端癌,指癌肿位于食管胃连接线上1~5 cm;SiewertⅡ型即为传统意义的贲门癌,指癌肿在食管胃连接线上1 cm至连接线下2 cm;SiewertⅢ型即贲门下癌,癌肿位于食管胃连接线下2~5 cm。目前,临床广泛开展了人表皮生长因子受体2(HER2)与胃癌的关联性研究,发现多数HER2阳性胃癌患者预后不良。研究显示,细胞S期激酶相关蛋白2(SKP2)在胃癌的恶性进展中发挥重要作用,检测SKP2表达对胃癌患者的预后判断有潜在价值。但是,目前关于HER2、SKP2与AEG相关性研究较少。为此,本文对Siewert Ⅱ、Ⅲ型AEG患者肿瘤组织中HER2、SKP2的表达及临床意义进行了探讨。
1 资料与方法
1.1临床资料收集济宁市第一人民医院胃肠外科2012年1月~2015年12月AEG患者206例,男109例、女97例,年龄35~82岁,中位年龄64.4岁。患者均行AEG根治术,术中证实无远处转移。术前胃镜及术后病理证实为SiewertⅡ、Ⅲ型原发性AEG,术前均未行放化疗或其他抗肿瘤治疗。Siewert Ⅱ型85例,男46例、女39例,年龄<60岁40例,≥60岁45例;Siewert Ⅲ型121例,男63例、女58例,年龄<60岁59例,≥60岁62例。两类AEG患者性别、年龄构成比较无统计学意义(P均>0.05)。
1.2肿瘤组织HER2、SKP2表达检测术前活检或手术取患者肿瘤标本,送病理科行组织切片后采用全自动染色仪进行免疫组织化学染色。①HER2表达判断标准:HER2表达阳性细胞为细胞膜出现棕黄色细颗粒。手术标本染色无反应或胞膜染色肿瘤细胞< 10%,活检标本任何肿瘤细胞无膜染色,评分为0分,为HER2表达阴性;手术标本微弱或隐约膜染色细胞≥10%,活检标本肿瘤细胞见微弱或隐约膜染色(不管着色的肿瘤细胞占观察细胞的百分比),评分为1分,为HER2表达阴性;手术标本弱到中度的基底侧膜、侧膜或完全性膜染色肿瘤细胞≥10%,活检标本肿瘤细胞团有弱到中度的基底侧膜、侧膜或完全性膜染色,评分为2分;手术标本基底侧膜、侧膜或完全性膜强染色肿瘤细胞≥10%,活检标本肿瘤细胞的基底侧膜、侧膜或完全性膜强染色,评分为 3分,为HER2表达阳性。评分为2分的病例为不确定病例,需进一步行荧光原位杂交 (FISH )检测,如FISH阳性,判断为HER2阳性;如FISH阴性,判断为HER2阴性。②SKP2表达判断标准:SKP2表达阳性细胞为细胞核呈棕黄色颗粒。随机计数5个高倍视野(×400倍)的所有细胞,以确定每个视野的阳性率;将5个视野阳性率取其平均值作为该例的阳性率,综合着色强度和阳性率进行分析处理。不着色0分,黄色1分,棕黄色2分,黄褐色3分;阳性率小于5%判为0分,5%~25%为判为1分,26%~50%判为2分,大于50%为3分。着色强度评分和阳性率评分相加,0~1.5分为阴性,2~3分为弱阳性,4~6为强阳性。
1.3统计学方法应用 SPSS17.0统计软件。计数资料以例数和百分比表示,不同类型AEG患者HER2、SKP2阳性表达比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 SiewertⅡ、Ⅲ型AEG患者的临床特点 两种类型肿瘤在大小、临床分期、分化程度、淋巴转移方面比较差异有统计学意义(P均<0.05)。两类AEG患者的临床特点见表1。
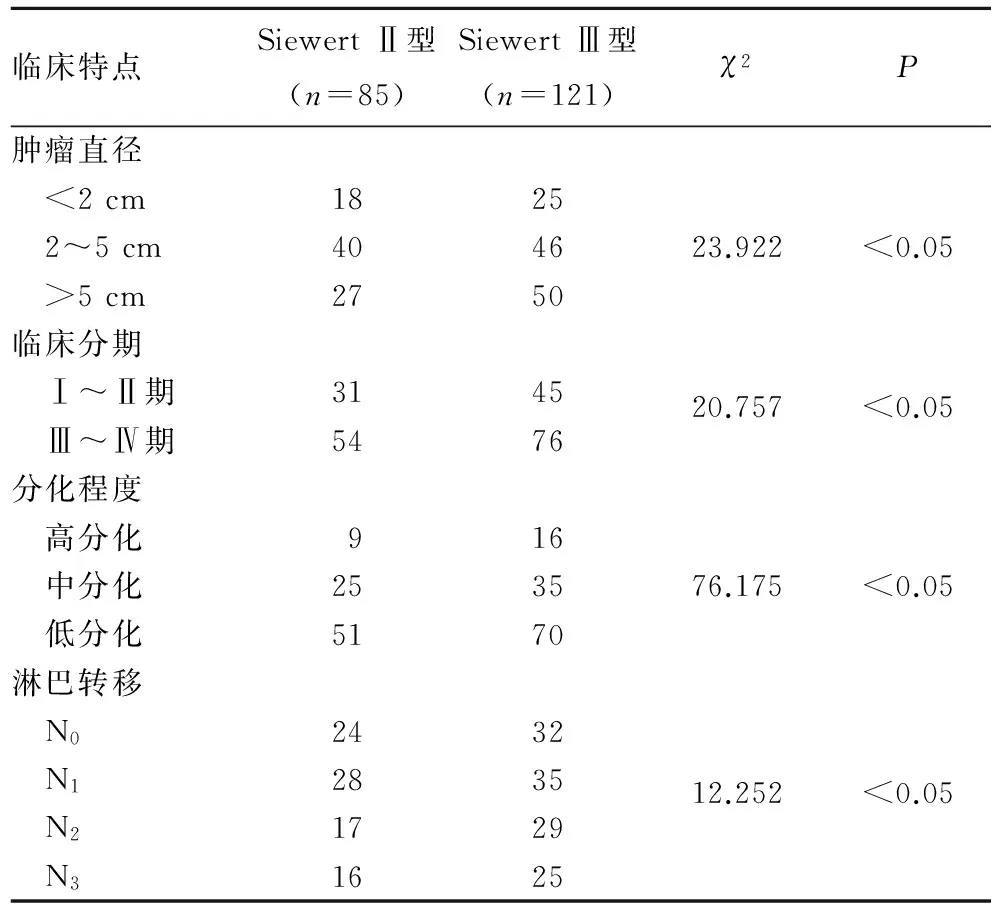
表1 SiewertⅡ、Ⅲ型AEG患者的临床特点比较(例)
2.2SiewertⅡ、Ⅲ型AEG患者HER2、SKP2阳性表达与临床病理参数的关系SiewertⅡ型AEG 患者HER2 、SKP2 阳性表达率分别为32.9%、41.2%,SiewertⅢ型AEG患者HER2、 SKP2阳性表达率分别为36.3%、55.4%;两型患者SKP2阳性表达率差异有统计学意义(P<0.05)。SiewertⅡ或Ⅲ型AEG患者中,肿瘤直径<5 cm与≥5 cm、浸润深度T1~T2与T3~T4、高~中分化与低分化、淋巴结N0~N1与N2~N3之间HER2阳性表达率有统计学差异(P<0.05)。SiewertⅡ、Ⅲ型AEG患者HER2、SKP2阳性表达与临床病理参数的关系见表2。
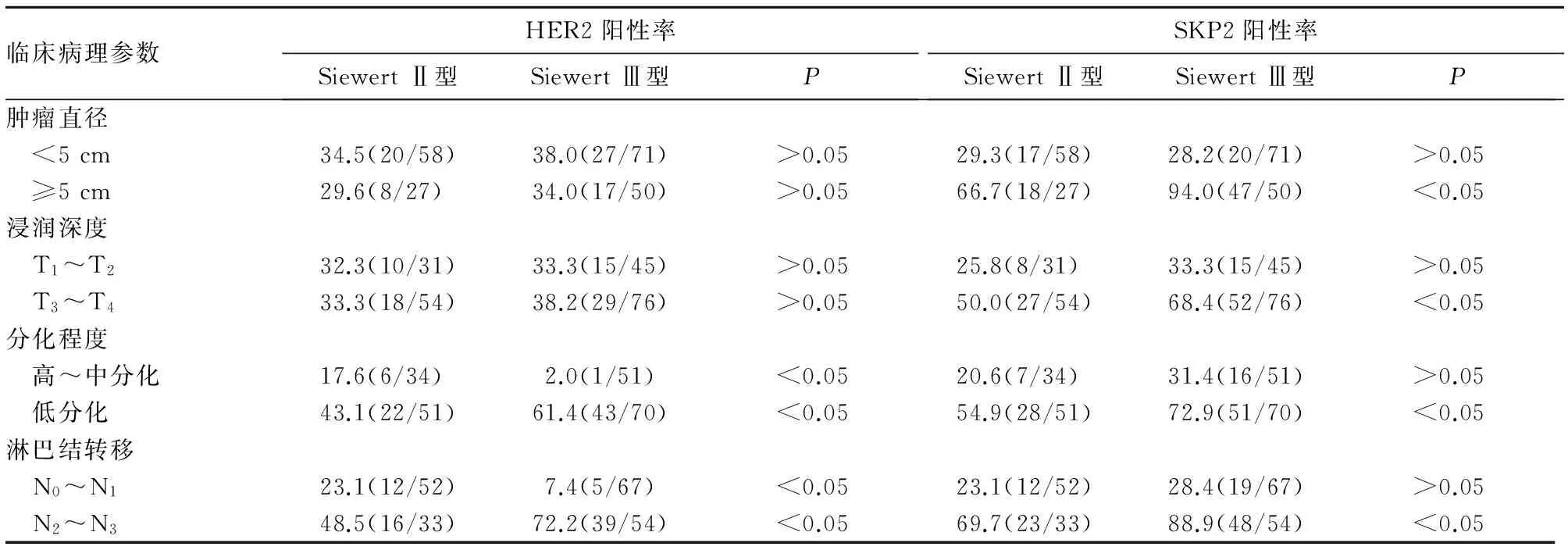
表2 SiewertⅡ、Ⅲ型AEG患者HER2、SKP2阳性表达与临床病理参数的关系(%)
3 讨论
近年来,AEG及贲门腺癌的发病率显著升高[1],而远端胃癌发病率有下降趋势。由于AEG及贲门腺癌患者早期症状不明显,就医者多为中晚期;由于贲门解剖的特殊性,患者根治性手术受限,单纯手术治疗效果不佳,且术后联合化疗和放疗等辅助治疗的效果也不理想,5年生存率低于30%。AEG具有胃癌的基本特性,但由于AEG处于胸腹相交的特殊区域,故也有其特殊的病理特点及生物学行为。目前,国内对于AEG的研究较少,对其SiewertⅠ型、Ⅱ型、Ⅲ型三种分型多数学者基本认可。Ⅱ型、Ⅲ型AEG的发病与贲门肠化生有关,亚洲AEG患者以Ⅱ型和Ⅲ型多见,5年生存率没有统计学差别;欧美国家三型发病比例基本相同,其中Ⅰ型预后最好,Ⅲ型预后最差[2]。本研究发现,Ⅱ型、Ⅲ型AEG在肿瘤大小、临床分期、分化程度、淋巴转移分布上有统计学差异,此与Ⅱ型、Ⅲ型AEG 解剖位置有关。Ⅱ型AEG患者更早出现临床症状,也更可能早期发现。AEG患者放化疗的有效率较低,因此临床主张以手术为主的综合治疗。Ⅱ型AEG手术入路有经胸、胸腹联合和经腹三种,目前有多数学者主张经腹手术。对于Ⅱ、Ⅲ型AEG是行近端胃癌根治术还是行全胃根治术仍存在较大争议。本文AEG患者多数就诊时已属中晚期,主要是肿瘤直径≥2 cm、临床分期Ⅲ~Ⅳ期、及中~低分化患者,即使行根治手术治疗,也难以达到理想效果。
HER2过表达在胃癌的发生、发展和侵袭过程中发挥重要作用。胃癌中HER2蛋白阳性表达率为8.2%~53.4%[3],且HER2阳性表达患者生存期明显缩短[3]。研究显示,HER2的过表达与胃癌分化程度、淋巴结转移情况、Bormann分型、Lauren分型、静脉浸润程度等相关,而与肿瘤大小、分期无关[4]。孙毅等[5]研究提示,HER2的表达与胃癌分化程度明显相关,低分化、未分化癌HER2阳性率明显低于高、中分化癌。本研究显示,Ⅱ、Ⅲ型AEG患者在肿瘤大小、临床分期、分化程度、淋巴转移情况比较差异有统计学意义。HER2蛋白在胞膜表达的增加,会引起细胞恶性程度的增加,而肿瘤大小、临床分期、分化程度、淋巴转移情况决定肿瘤恶性程度,Ⅲ型AEG患者较Ⅱ型AEG患者HER2蛋白阳性表达率高,导致肿瘤恶性程度高,肿瘤临床分期晚,分化程度低,易出现淋巴结转移。免疫组织化学染色和FISH 是胃癌HER2的主要检测技术,两者有很好的一致性。有研究显示免疫组织化学染色与FISH检查结果的吻合度为87%~93%[6,7]。本研究按照NCCN《胃癌HER2检测指南》,将免疫组织化学染色评分与FISH 结果联合判定HER2的表达,提高了检测结果的准确性。本研究显示,SiewertⅡ或Ⅲ型AEG患者中,肿瘤直径<5 cm与≥5 cm、浸润深度T1~T2与T3~T4、高~中分化与低分化癌、淋巴结N0~N1与N2~N3之间HER2阳性表达率有统计学差异,此与HER2过表达胃癌患者具有高度侵袭性有关。因此,针对HER2过表达的相关研究有可能为治疗AEG患者提供新的靶点。
研究显示,SKP2对细胞周期的调控有重要作用[8],SKP2过表达与多种肿瘤的发生、发展有关。SKP2表达增高可不同程度地影响肿瘤的分化程度及其恶性进程,且与上皮细胞癌变以及预后有关。SKP2 表达调节胃癌的恶性表型,SKP2阳性表达与胃癌分化程度、淋巴结转移及脉管内瘤栓形成呈正相关[9,10]。本研究显示,两种类型肿瘤患者SKP2阳性表达率差异有统计学意义。Ⅲ型AEG患者肿瘤分化程度差,SKP2阳性表达率升高,SKP2的表达随肿瘤分化程度的降低而呈现出上升趋势,显示SKP2可能参与癌细胞过度增殖、转移及分化过程。
[1] Dolan K, Sutton R, Walker SJ, et al. New classification of oesophageal and gastric carcinomas derived from changing patterns in epidemiology[J]. Br J Cancer, 1999,80(5-6):834-842.
[2] Siewert JR, Feith M, Stein HJ. Biologic and clinical variations of adenocarcinoma at the esophago-gastric junction:relevance of a topographic-anatomic subclassification [J]. J Surge Oncol, 2005,90(3):139-146.
[3] Abrabao-Machado LF, Jacome AA, Wohnrath DR, et al. HER2 in gastric cancer:comparative analysis of three different antibodies using whole -tissue sections and tissue microarrays [J]. World J Gastroentero, 2013,19(38):6438-6446.
[4] Liang JW, Zhang JJ, Zhang T, et al. Clinicopathological and prognostic significance of HER2 overexpression in gastric cancer: a meta-analysis of the literature[J]. Tumour Biol, 2014,35(5):4849-4856.
[5] 孙毅,赵化荣,张华,等.HER2基因在新疆维汉民族胃癌中的表达及其对预后的影响[J].山东医药,2014,54(37):8-10.
[6] Ruschoff J, Dietel M, Baretton G, et al. HER2 diagnostics in gastric cancer-guideline validation and development of standardized immunohistochemical testing [J]. Virchows Arch, 2010,457(3):299-307.
[7] He C, Bian XY, Ni XZ, et al. Correlation of human epidermal growth factor receptor 2 expression with clinicopatholog ica1 charaeteristics and prognosis in gastric cancer[J]. World J Gastroenterol,2013,19 (14):2171-2178.
[8] Carrano AC, Eytan E, Hershko A, et al. SKP2 is required for ubiquitin-mediated degradation of the CDK inhibitor p27[J]. Nat Cell Biol,1999,1(4):193-199.
[9] 冯润华,朱正纲,燕敏,等.淋巴结转移率对T2~T3期胃癌患者预后的价值[J].中华胃肠外科杂志,2007,10(5):431-435.
[10] Gertler R, Stein HJ, Langer R, et al. Long-term outcome of 2920 patients with cancers of the esophagus and esophagogastric junction:evaluation of the New Union Internationale Contre Ie Cancer/American Joint Cancer Committee staging system[J]. Ann Surg, 2011;253(4):689-698.
Clinical characteristics and expression of HER2 and SKP2 in Siewert Ⅱ and Ⅲ adencarcinoma of gastric esophageal junction
LIUZhongyuan1,ZHANGLi
(1JiningNo. 1People'sHospital,Jining272100,China)
ObjectiveTo invesitgate the clinical characteristics and expression of human epidermal growth factor receptor 2 (HER2) and S-phase kinase-associated protein 2 (SKP2) in Siewert Ⅱ and Ⅲ adencarcinoma of gastric esophageal junction (AEG). MethodsTotally 206 patients with Siewert II or Ⅲ AEG were selected for comparison of the clinical characteristics between the two types. The expression of HER2 and SKP2 was detected by immunohistochemistry. The relationships between positive HER2 and SKP2 expression and the clinical pathologic parameters in Siewert Ⅱ and III AEG were analyzed. ResultsThere were statistically significant differences between the two AEG types in tumor size, lymph node metastasis, differentiation grade and TNM stage (allP<0. 05). The positive expression rates of HER2 and SKP2 were respectively 32.9% and 41.2% in patient with Siewert II AEG, and 36.3% and 55.4% in patients with Siewert Ⅲ AEG; there was statistically significant difference in SKP2 positive expression rate between the two groups (P<0.05). Among the patients with Siewert II or Ⅲ AEG, there were statistically significant differences in HER2 positive expression rate between those with tumor size <5 cm and ≥5 cm, those with infiltration depth T1-T2and T3-T4, those with high-moderate and low differentiation, and between those with lymph node metastasis N0-N1and N2-N3(allP<0.05). Conclusion Abnormal expression of HER2 and SKP2 could promote the development and progression of AEG, and thus may provide a new approach for early diagnosis and treatment of AEG.
adencarcinoma of esophagogastric junction; human epidermal growth factor receptor 2; S-phase kinase-associated protein 2
刘中元 (1983-),男,主治医师,研究方向为胃肠外科疾病的诊治。 E-mail:345394100@qq.com
简介:张黎(1971-),男,主任医师,医学博士,硕士生导师,研究方向为腹腔镜治疗胃肠道肿瘤。E-mail:pzzl@sina.com
10.3969/j.issn.1002-266X.2016.33.008
R735.1;R735.2
A
1002-266X(2016)33-0025-04
2016-04-11)

