水通道蛋白4基因敲除对博来霉素诱导小鼠肺纤维化的影响
余舒莹 魏尔清


[摘要] 目的 觀察水通道蛋白4(AQP4)基因敲除对博莱霉素(BLM)致小鼠肺纤维化过程的影响,初步评价半胱氨酰白三烯受体在此过程的作用。 方法 设AQP4+/+对照组、AQP4+/+ BLM组、AQP4-/-对照组、AQP4-/- BLM组,每组各6只小鼠。每日记录一般情况,第12天处死小鼠,算肺系数及HE、Masson染色观察病理变化,提取蛋白行免疫印迹杂交(Western blotting)检测半胱氨酰白三烯受体1(CysLT1R)、受体2(CysLT2R)的表达。 结果 第12天时,AQP4+/+BLM组小鼠肺系数(14.65±1.92)为AQP4+/+对照组(6.97±1.54)的2.1倍(P < 0.01),AQP4+/+ BLM组的CysLT1 R表达明显高于AQP4+/+对照组(P < 0.05),而CysLT2 R表达稍低于AQP4+/+对照组,但差异无统计学意义(P > 0.05)。第12天时,AQP4-/-BLM组小鼠肺系数(10.99±1.66)为AQP4-/-对照组(6.19±2.09)的1.8倍(P < 0.01),AQP4-/- BLM组的CysLT1R、CysLT2R表达与AQP4-/-对照组比较,差异无统计学意义(P > 0.05)。AQP4-/-BLM组肺系数明显低于AQP4+/+BLM组,差异有高度统计学意义(P < 0.01)。肺组织病理学结果表明AQP4-/-BLM组小鼠炎症细胞浸润及纤维化程度较AQP4+/+BLM组轻。 结论 AQP4基因敲除可减轻博莱霉素诱导的小鼠肺纤维化过程中的肺水肿、肺泡炎,AQP4可能是通过调控CysLT1R参与此过程。
[关键词] 水通道蛋白4;肺纤维化;半胱氨酰白三烯受体;博来霉素
[中图分类号] R332 [文献标识码] A [文章编号] 1673-7210(2016)03(c)-0043-04
[Abstract] Objective To observe the effects of aquporin-4 and Cysteinyl leukotriene receptor on Bleomycin (BLM) induced pulmonary fibrosis in mice. Methods The experiment was divided into AQP4+/+ control group, AQP4+/+ BLM group, AQP4-/- control group and AQP4-/- BLM group, with 6 mice in each group. General status of mice were recorded every day, The mice were sacrificed on the 12th day and the pulmonary index was calculated. HE and Masson's staining were administered to observe the pathological changes. The expression of CysLT1 receptor (CysLT1R) and CysLT2 receptor (CysLT2R) were observed by Western blotting. Results At the 12th day, the lung coefficient of AQP4+/+ BLM group (14.65±1.92) was 2.1 times as much as AQP4+/+ control group (6.97±1.54) (P < 0.01), the level of CysLT1 receptor expression in AQP4+/+ BLM group was higher than that in AQP4+/+ control group (P < 0.05), CysLT2R expression was slightly lower, but the differences were not statistically significant (P > 0.05). At the 12th day, the lung coefficient of AQP4-/- BLM group (10.99±1.66) was 1.8 times as much as AQP4-/- control group (6.19±2.09) (P < 0.01), CysLT1R and CysLT2R expression in AQP4-/- BLM group was compared with AQP4-/- control group, the differences were not statistically significant (P > 0.05). the lung coefficient of AQP4-/-BLM group was lower than that in AQP4+/+BLM, the differences were statistically significant (P < 0.05). Pathological examination results of lung tissues indicated that the effect of reducing alveolar catarrh and pulmonary fibrosis of AQP4-/- BLM group had an advantage over that of AQP4+/+ BLM group. Conclusion AQP4 gene knockout can attenuate the degree of Bleomycin induced pulmonary edema, alveolar inflammation, AQP4 may regulate bleomycin induced lung fibrosis via CysLT1R.
[Key words] Aquporin-4; Pulmonary fibrosis; Cysteinyl leukotriene receptor; Bleomycin
肺纤维化(pulmonary fibrosis,PF)是肺慢性病变的最终阶段,其发病机制并不清楚但可能与急性、持续或反复发生的肺损伤和炎症有关[1-2]。半胱氨酰白三烯(Cysteinyl leukotienes,CysLTs)是重要的炎性介质,主要通过CysLT1类受体(CysLT1R)和CysLT2类受体(CysLT2R)发挥作用[3]。临床研究发现特发性肺纤维化患者的肺匀浆中LTC4和LTB4水平显著增加[4]。使用CysLT1R拮抗剂1~2周后可抑制博莱霉素诱导的小鼠肺纤维化进程[5-6],提示LTs与肺纤维化的发病机制有关。水通道蛋白(aquaporins,AQPs)介导了多种类型细胞的跨膜水转运,而AQP4主要调节气道表面液体与气体湿化过程[7]。研究表明AQP4在慢性阻塞性肺病患者气道中表达越少,气道炎症程度越重[8],提示AQP4在呼吸系统的病理生理作用。但AQP4在肺纤维化形成过程中的影响,及与AQP4功能调节有关的CysLT受体亚型等问题,有待于进一步阐明。由于缺乏特异性的拮抗剂,对AQP4的生理作用及其调节机制仍缺乏深入的了解,水通道基因敲除的动物模型是目前研究AQP4功能的主要手段[9]。本研究利用AQP4敲除小鼠,通过博莱霉素气管内注射诱导的小鼠肺纤维化模型,观察AQP4对此过程中的作用及初步探讨AQP4与CysLT受体的相关性。
1 材料与方法
1.1 实验动物
野生型(AQP4+/+)和AQP4基因敲除(AQP4-/-)CD1成年健康雄性小鼠,25~30 g,由南京医科大学药理教研室提供,其遗传背景及鉴定见文献[10]。所有的动物饲养在温度控制的环境(22±1)℃下,12 h明暗循环,自由饮食和饮水。
1.2 主要药物、试剂及仪器
注射用盐酸博莱霉素A2(日本化药株式会社,批号191140,进口注册证号H20040205)、生理盐水(华东医药股份有限公司);兔抗小鼠CysLT1R、CysLT2R多克隆抗体由本研究室制备[11]。荧光显微镜(Olympus BX51)(Olympus DP70,日本Olympus公司);切割式匀浆器(Heidolph Diax 900,德国Heidolph公司);SDS-PAGE胶电泳转膜装置(BIO-RAD公司);ODYSSEY免疫印迹膜荧光成像系统(美国LI-COR Biosciences公司)。
1.3 肺纤维化模型的建立与样本处理
按文献报道的方法[12],予以小鼠10%水合氯醛腹腔麻醉,按1.5 mg/kg缓慢经气管注入博莱霉素(BLM),对照组用同样方法注入生理盐水。待动物清醒后常规饲养,每天记录小鼠的一般情况(体重、毛色、活动、呼吸等),给药12 d后处死,计算肺系数。右肺供组织学检查,左肺作免疫印迹用。
1.4 肺系数的计算
肺系数是反映肺炎症水肿程度的一个指标,计算公式:肺系数=(肺重/体重)×100(g/g),其值越高说明肺病变程度越重。
1.5 肺组织病理学观察
常规取肺组织固定、脱水包埋,制成4 μm切片行HE及Masson染色,光学显微镜下观察肺组织病理学改变。
1.6 Western blotting测定CysLT1R、CysLT2R蛋白
按报道的方法[13]提取小鼠肺组织蛋白,考马斯亮蓝法测定肺组织蛋白浓度。相应浓度和等量的样品蛋白经SDS-PAGE电泳转膜,漂洗封闭后,分别放入混有兔抗小鼠CysLT1多克隆受体(1∶500)、GAPDH(小鼠单克隆抗体1∶5000)及CysLT2多克隆抗体(1∶500)、GAPDH的一抗及二抗(1∶5000)进行免疫反应,膜漂洗后利用成像系统,以GAPDH为内参用Quality One软件,结果以CysLT1R、CysLT2R与GAPDH的条带光密度值相对百分比表示。
1.7 统计学方法
采用Prism 5 for Windows(美國Graph Pad软件公司)作统计分析,正态分布计量资料以均数±标准差(x±s)表示,以One-way ANOVA检验差异显著性,组间比较用Dunnett-t检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 小鼠体重及肺系数变化
AQP4+/+对照组、AQP4-/-对照组小鼠毛色润泽,体重在各时间点,比较差异均无统计学意义(P > 0.05)(图1);AQP4+/+BLM组小鼠活动减少,体重稍下降,而AQP4-/-BLM组小鼠体重随时间呈明显下降趋势。第12天时,AQP4+/+BLM组小鼠肺系数(14.65±1.92)为AQP4+/+对照组(6.97±1.54)的2.1倍(P < 0.01);AQP4-/-BLM组小鼠肺系数(10.99±1.66)为AQP4-/-对照组(6.19±2.09)的1.8倍(P < 0.01);与AQP4+/+BLM组小鼠比较,AQP4-/-BLM组小鼠肺系数明显降低(P < 0.05)(图2)。
2.2 肺组织病理学变化
对照组小鼠支气管黏膜上皮完好,管腔规则,周围无炎症细胞浸润(图3A)且未见有肺实质胶原沉积(图3B)。造模第12天,给药组小鼠支气管与血管周围有大量炎症细胞浸润及纤维组织增生,但AQP4-/-BLM组小鼠肺内损伤明显轻于AQP4+/+BLM组小鼠,炎症细胞浸润及纤维化程度也有所减轻。
2.3 肺组织CysLT1R、CysLT2R的表达
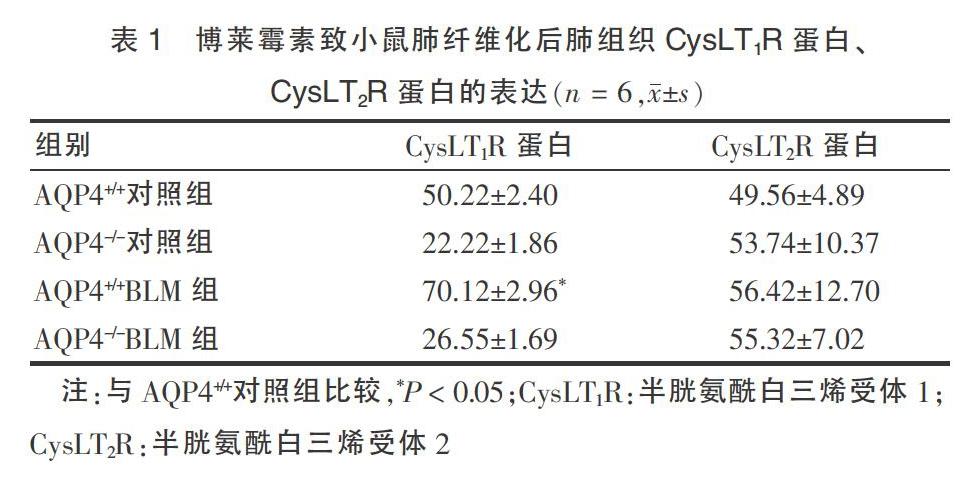
Western blotting结果显示,与AQP4+/+对照组比较,AQP4+/+BLM组小鼠CysLT1R表达显著增高,差异有统计学意义(P < 0.05),CysLT2R的表达稍有下降,但差异无统计学意义(P > 0.05);AQP4-/-BLM组小鼠CysLT1R表达较AQP4-/-对照组无明显增高(P > 0.05),CysLT2R表达稍有升高,但差异无统计学意义(P > 0.05)。见表1、图4。
3 讨论
肺纤维化伴随多种类型炎症细胞的渗透,炎症介质的释放,从而导致血管通透性的增加及慢性肺水肿[2,14-15]。研究发现经气管内灌注BLM可以造成小鼠肺纤维化,病理组织学和生理学的改变均与人类肺纤维化近似,因此常以该药制作肺纤维化模型[16-17]。气管内注射BLM后AQP4+/+、AQP4-/-小鼠的肺系数均增高,表明BLM成功诱导小鼠发生肺纤维化,组织病理学结果也证实这一结论。与AQP4+/+BLM组相比,AQP4-/-BLM组小鼠肺系数明显降低,纤维化程度也有所减轻,表明AQP4缺失可能减轻肺纤维化的症状。AQPl、AQP4双敲除小鼠肺内毛细血管与肺泡水通透性较野生型降低14~16倍[18]。重量检测的方法显示AQP4-/-小鼠肺泡毛细血管间水的渗透性明显下降[19]。本研究结果也提示AQP4在小鼠肺泡毛细血管间水转运过程中发挥重要作用,对BLM诱导的小鼠肺部炎症水肿有促进作用。
有文献报道在BLM诱导肺纤维化的小鼠模型中,靶向断裂胞浆磷脂酶A2阻断LTs的生成,可明显减轻肺纤维化的程度[20];BLM诱导的肺组织中CysLT1R mRNA表达增高,而CysLT2R mRNA表达降低,CysLT1R拮抗剂孟鲁司特可通过调节CysLT1R和CysLT2R的平衡来改善肺纤维化[21]。本研究发现AQP4+/+BLM组CysLT1R表达显著增高,与上述文献结果一致,推断AQP4可能通过调控CysLT1R参与肺纤维化的过程,但这一结论尚待进一步实验证实。而AQP4+/+BLM小鼠CysLT2R表达稍有增高但未有显著差异,尽管这种变化的原因尚不明确,但可能与与两种受体的相互作用有关。AQP4参与了气道炎症的病理生理过程[22],而肺纤维化是气道炎症之一,提示AQP4在小鼠肺纤维化炎症过程中的重要作用,关于AQP4在调节肺纤维化发生病理生理过程中的具体机制还需通过进一步的研究來证明。
综上所述,AQP4-/-可减轻BLM诱导的小鼠肺纤维化过程中的肺水肿,AQP4可能是通过调控CysLT1R参与此过程。本研究初步确定AQP4对小鼠肺纤维化过程的影响及可能的作用机制,为认识AQP4在呼吸系统中的作用提供参考。
[参考文献]
[1] Davies HR,Richeldi L. Idiopathic pulmonary fibrosis:current and future treatment options [J]. Am Respir Med,2002, 1(3):211-224.
[2] Ward PA,Hunninghake GW. Lung inflammation and fibrosis [J]. Am J Respir Crit Care Med,1998,157:S123-S129.
[3] Singh RK,Gupta S,Dastidar S,et al. Cysteinvl leukolrienes and their receptors:molecular and functional charaeteristics [J]. Pharmacology,2010,85(6):336-349.
[4] Wilborn J,Bailie M,Coffey M,et al. Constitutive activation of 5-lipoxygenase in the lungs of patients with idiopathic pulmonary brosis [J]. J Clin Invest,1996,97(8):1827-1836.
[5] Failla M,Genovese T,Mazzon E,et al. Pharmacological inhibition of leukotrienes in an animal model of bleomycin-induced acute lung injury [J]. Respir Res,2006,7:137-149.
[6] Izumo T,Kondo M,Nagai A. Cysteinyl-leukotriene 1 receptor antagonist attenuates bleomycin-induced pulmonary brosis in mice [J]. Life Sci,2007,80(20):1882-1886.
[7] Borok Z,Verkman AS. Role of aquaporin water channels in fluid transport in lung and airways [J]. J Appl Physiol,2002, 93(6):2199-2206.
[8] 孙忠民,朱柏,杨岚,等.AQP4在COPD支气管黏膜的表达及其与患者肺功能、气道黏膜炎症的相关性[J].西安交通大学学报:医学版,2008,29(2),193-195.
[9] Ma T,Yang B,Gillespie A,et al. Generation and phenotype of a transgenic knockout mouse lacking themercurial-insensitive water channelaquaporin-4 [J]. J Clin Invest,1997, 100(5):957-962.
[10] Fan Y,Zhang J,Sun XL,et al. Sex-and region-specific alterations of basal amino acid and monoamine metabolism in the brain of aquaporin-4 knockout mice [J]. Neurosci Res,2005,82(4):458-464.
[11] 陈丽萍,赵春贞,史文珍,等.半胱氨酰白三烯受体2多克隆抗体制备及其鉴定[J].浙江大学学报:医学版,2009, 38(6):591-597.
[12] Jiang C,Huang H,Liu J,et al. Effects of fasudil on bleomycin-induced pulmonary fibrosis in mice and on the biological behaviors in NIH3T3 mouse fibroblast cell line [J]. Physics Letters A,2014,37(9):671-676.
[13] Zhu LJ,Zhang WP,Wei EQ,et al. Aherations in expression of N-mathyl-D-aspartate receptor subunits in mice [J]. Journal of Medical Science,2002,31(2):68-71.
[14] Koike K,Chida M,Suzuki S,et al. Pulmonary fibrosis after endotoxin-induced permeability edema [J]. Nihon Kyobu Shikkan Gakkai Zasshi,1989,27(4):440-444.
[15] 崔雯雯,張彦芬,秘尧,等.脂多糖和石墨粉诱导小鼠急性肺损伤病理形态学比较[J].中国实验动物学报,2014, 22(5):22-26,31.
[16] Felix C,Jack G,Geoffrey J. Pulmonary fibrosis searching for model answers [J]. Am J Respir Cell Mol Biol,2005, 33(1):9-13.
[17] 杨聪颖,彭雄群,阳惠湘,等.不同剂量博莱霉素诱导小鼠肺纤维化的差异及动态变化[J].中国实验动物学报,2013,21(2):45-51,后插6-后插8.
[18] Ma T,Fukuda N,Song Y,et al. Lung fluid Transport in aquaporin-5 knockout mice [J]. J Clin Invest,2000,105(1):93-100.
[19] Song Y,Ma T,Matthay MA,et al. Role of aquaporin-4 in airspace-to capillary water permeability in intact mouse lung measured by a novel gravimetric method [J]. Gen Physial,2000,115(1):17-27.
[20] Nagase T,Uozumi N,Ishii S,et al. Potent inhibitor of cytosolic phospholipase A2,arachidonyl trifluoromethyl ketone,attenuates LPS-induced lung injury in mice [J]. Am J Physiol Lung Cell Mol Physiol,2003,284(5):L720- L726.
[21] Shimbori C,Shiota N,Okunishi H. Effects of montelukast,a cysteinyl-leukotriene type 1 receptor antagonist,on the pathogenesis of bleomycin-induced pulmonary fibrosis in mice [J]. Eur J Pharmacol,2011,650(1):424-430.
[22] 朱柏,杨岚,党晓敏,等.慢性阻塞性肺疾病支气管粘膜水通道4蛋白表达的变化及意义[J].中国综合临床,2008, 24(12):1228-1230.
(收稿日期:2015-12-20 本文编辑:苏 畅)

