宫颈鳞癌组织中血管生成拟态与HIF-1α、E-cadherin、Vimentin表达变化及意义
陈瑜,李争,王振国
(1河北北方学院,河北张家口075000;2中国人民解放军第309医院)
宫颈鳞癌组织中血管生成拟态与HIF-1α、E-cadherin、Vimentin表达变化及意义
陈瑜1,李争1,王振国2
(1河北北方学院,河北张家口075000;2中国人民解放军第309医院)
目的观察宫颈鳞癌(CSCC)组织中血管生成拟态(VM)与缺氧诱导因子1α(HIF-1α)及上皮间质转化(EMT)相关蛋白(E-cadherin和Vimentin)的表达,并探讨其临床意义。方法 收集CSCC组织标本43例(CSCC组)和正常宫颈组织切片20例(对照组),以HE、CD34-PAS双重染色检测VM情况,免疫组化法检测HIF-1α、E-cadherin、Vimentin,分析各指标间及其与临床病理特征的关系。结果 CSCC组16例存在VM,对照组无VM,P<0.05;CSCC组HIF-1α、E-cadherin、Vimentin阳性表达率分别为60.5%、37.2%、32.6%,对照组分别为20.0%、100%、0,P均<0.05。VM与CSCC分化程度、临床分期及淋巴结转移、脉管癌栓形成有关,HIF-1α、E-cadherin、Vimentin表达均与病理分级有关,Vimentin表达与淋巴结转移、脉管癌栓形成有关,HIF-1α表达与淋巴结转移、肿瘤直径有关,P均<0.05。CSCC组织中VM与HIF-1α、Vimentin表达呈正相关(r=0.426、0.697,P均<0.05),与E-cadherin表达呈负相关(r=-0.394,P<0.05);HIF-1α与E-cadherin表达呈负相关(r=-0.362,P<0.05),与Vimentin表达呈正相关(r=0.359,P<0.05);E-cadherin与Vimentin表达呈负相关(r=-0.330,P<0.05)。同一标本表达定位观察,发现存在VM者有56.2%(9/16)HIF-1α阳性时伴随E-cadherin阴性表达、Vimentin阳性表达,无VM者HIF-1α阳性时不存在(0/27)这样的对应关系,差异有统计学意义(χ2=15.959,P<0.05)。结论 VM、HIF-1α、E-cadherin和Vimentin的表达与CSCC的侵袭转移密切相关;高侵袭性CSCC中HIF-1α可能通过下调E-cadherin、上调Vimentin的表达诱导EMT,促进VM的形成。
血管生成拟态;缺氧诱导因子1α;上皮间质转化;E-钙黏蛋白;波形蛋白;宫颈鳞癌
子宫颈癌是目前全球女性第三大常见恶性肿瘤[1],其主要病理类型为鳞癌。众所周知,肿瘤的生长具有血管依赖性,但抗血管治疗效果又具局限性[2],因此寻找新的抗癌靶标显得十分重要。近年来,血管生成拟态(VM)作为肿瘤功能性微循环中传统内皮血管外的补充在恶性肿瘤中的研究越来越多,与肿瘤的侵袭、转移密切相关[3]。有研究发现,缺氧诱导因子1α(HIF-1α)、上皮间质转化(EMT)在VM形成及肿瘤侵袭转移中发挥重要作用[4]。本研究检测了VM、HIF-1α及EMT相关蛋白[E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)]在宫颈鳞癌(CSCC)组织中的表达,并分析各指标之间及其与CSCC临床病理特征的关系,为CSCC的研究提供新思路。
1 资料与方法
1.1临床资料收集中国人民解放军第309医院2011年8月~2015年3月行手术切除的CSCC患者43例(CSCC组),术前未行化疗、放疗及免疫治疗等肿瘤特异性治疗,术中取肿瘤组织制作石蜡标本。患者年龄25~77岁,其中≥50岁18例、<50岁25例;肿瘤直径>4 cm 11例,≤4 cm 32例;临床分期:Ⅰa~Ⅰb期27例,Ⅱa~Ⅱb期16例;组织学分级:低分化23例,中、高分化20例;伴淋巴结转移11例,有脉管癌栓形成29例。另取同期子宫肌瘤患者手术切除的正常宫颈组织标本20例作为对照组。
1.2检测方法
1.2.1VM采用HE、CD34-PAS双重染色法。首先进行CD34免疫组织化学染色,于DAB显色后显微镜下观察;待血管内皮细胞着色后,流水冲洗1 min,终止显色反应,蒸馏水水洗3遍。滴加PAS试剂盒试剂Ⅰ 0.5%高碘酸溶液1滴,染色10 min,流水冲洗1 min,蒸馏水水洗3遍;滴加试剂Ⅱ Schiff液1滴,闭光湿盒37 ℃恒温反应15 min(目测组织变红)终止,流水冲洗1 min。苏木素复染、分化、返蓝、脱水、透明、封片等步骤同常规染色。 VM的判定:CD34阳性颗粒表达于血管内皮细胞胞质(膜),PAS阳性表达于血管或类血管腔壁的基膜,呈紫红色或樱桃红色。由CD34阴性的肿瘤细胞(HE光镜下确认)围成的内有一层PAS阳性基膜样物质的不规则血管样结构,有时其内可见红细胞,管道周围无出血、坏死及明显的炎细胞,判定为VM。
1.2.2HIF-1α、Vimentin及E-cadherin采用免疫组化PV-6000两步染色法。HIF-1α抗体工作浓度为1∶100,Vimentin及E-cadherin抗体为即用型单抗。将石蜡组织3 μm厚连续切片,常规脱蜡、水化;高压热修复后自然冷却,以3%H2O2作用14 min,PBS冲洗2 min×3次;5%正常山羊血清封闭20 min;滴加一抗,4 ℃过夜或37 ℃温箱孵育75 min,PBS冲洗2 min×3次;滴加二抗,37 ℃温箱孵育20 min,PBS冲洗2 min×3次;DAB显色,苏木素复染、盐酸乙醇分化、氨水返蓝、梯度乙醇脱水、二甲苯透明、中性树胶封片。用已知阳性片作阳性对照,PBS代替一抗作阴性对照。HIF-1α、E-cadherin和Vimentin蛋白阳性颗粒分别表达于细胞核(质)、细胞膜(质)、细胞质,结果由2名病理医师双盲阅片。总积分=染色强度积分×阳性细胞比例积分。染色强度无色、浅黄色、棕黄色、棕褐色分别计为0、1、2、3分,阳性细胞数百分数0、>0~10%、>10%~50%、>50%~80%、>80%分别计为0、1、2、3、4分。两项得分相乘0~3为阴性,>3为阳性。
1.3统计学方法采用SPSS20.0统计软件。计数资料比较采用χ2检验或校正χ2检验及Fisher确切概率法,相关性检验采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1两组VM存在情况及HIF-1α、E-cadherin、Vimentin表达比较见表1。

表1 两组VM存在情况及HIF-1α、E-cadherin、Vimentin表达比较(例)
2.2VM存在情况及HIF-1α、E-cadherin、Vimentin表达与CSCC临床病理特征的关系见表2。
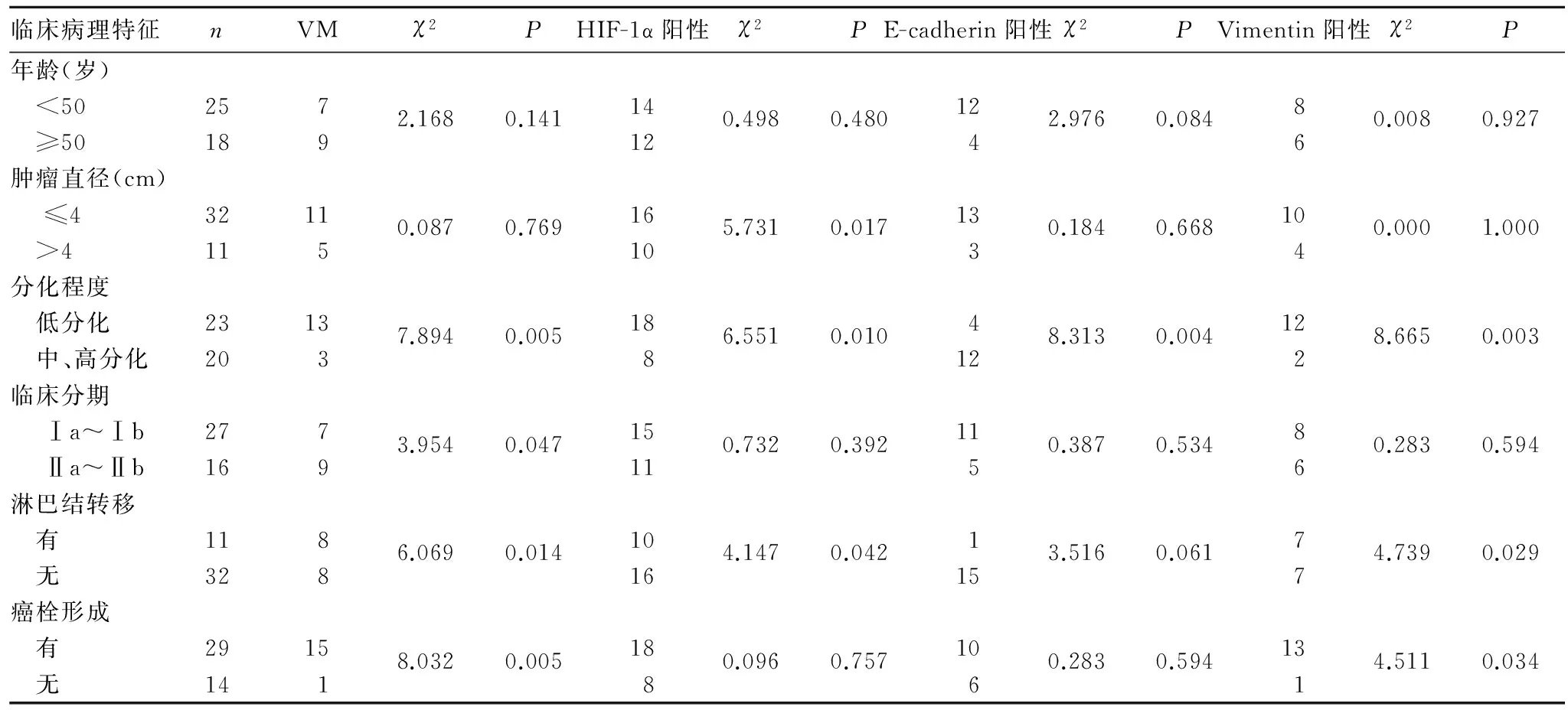
表2 VM存在情况及HIF-1α、E-cadherin、Vimentin表达与CSCC临床病理特征的关系[例(%)]
2.3CSCC组织中VM、HIF-1α、E-cadherin、Vimentin表达的关系CSCC组织中VM与HIF-1α、Vimentin表达呈正相关(r=0.426、0.697,P均<0.05),与E-cadherin表达呈负相关(r=-0.394,P<0.05);HIF-1α表达与E-cadherin表达呈负相关(r=-0.362,P<0.05),与Vimentin表达呈正相关(r=0.359,P<0.05);E-cadherin与Vimentin表达呈负相关(r=-0.330,P<0.05)。同一标本的表达定位观察发现,VM阳性患者中有56.2%(9/16)HIF-1α阳性时伴随着E-cadherin阴性表达、Vimentin阳性表达,VM阴性患者HIF-1α阳性时不存在(0/27)这样的对应关系,差异具有统计学意义(χ2=15.959,P<0.05)。
3 讨论
VM与传统的内皮血管不同,它不是由内皮细胞、而是由肿瘤细胞通过自身塑形及细胞外基质重塑围成的能够运输血液的类血管样管道,且与周围血管相连通,是功能性微循环的一部分[5]。在体外3 D培养,细胞形成互相连接的环状或网格状结构[6]。研究报道,在多种具有高侵袭性的肿瘤中均存在VM,且存在VM的肿瘤细胞迁移侵袭能力更强,患者预后更差[7]。本研究结果显示,CSCC组出现VM的频率高于对照组,在低分化、Ⅱ期CSCC患者癌组织中的频率高于中高分化、Ⅰ期患者,且随着脉管癌栓的转移、淋巴结转移而增高。其原因可能为高侵袭性CSCC中VM的管道仅为连接比较松散的肿瘤细胞和一层基膜,缺乏内皮细胞的屏障保护,使肿瘤细胞更容易脱落进入血液循环而发生转移;此外,形成VM的高侵袭性细胞通常具有多能胚胎样干细胞基因型,推断该种细胞形成VM的能力可能是其胚胎样表型的多能表现之一,其多能表型特征保障了肿瘤细胞的重塑、灌注、细胞活力和传播等机制[8]。
肿瘤难以调控的快速生长很容易造成其周围微环境的缺氧状态,HIF-1为肿瘤应对缺氧反应的重要因子,其亚单位HIF-1α更是直接受氧分压调节,可作为组织缺氧的内在标志。HIF-1α可靶向调控VEGF、GLUT1、碳酸酐酶Ⅸ等基因的转录过程,从而诱发肿瘤血管生成及糖酵解的耗能方式,使其更能适应低氧低能的环境[9],并能提高细胞抗凋亡、放疗抵抗的能力[10]。本研究中,CSCC组HIF-1α表达明显高于对照组,且随着CSCC肿瘤病理分级的提高、体积的增大、淋巴结的转移其阳性率也呈现出升高态势(P均<0.05)。可能因肿瘤恶性程度越高,其组织细胞分裂能力越强,生长越快,肿瘤体积也就越大,从而使肿瘤更易处于膨胀压力较高及缺氧的微环境,诱导HIF-1α的表达增高,使其在低氧环境中具有更强的生存力及转移能力。有研究报道,HIF-1α可通过VEGF激发的VE-cadherin/EphA2/PI3K/MMPs/Laminin-5γ2关键通路促进VM的形成[11]。在我们的研究中,VM与HIF-1α表达呈正相关关系,也恰恰支持了CSCC组织中HIF-1α可能促进VM形成这一微观机制。
EMT,即上皮细胞向间质细胞转化的多步骤过程,其中以上皮表型E-cadherin的丢失以及间质表型Vimentin的获得最为典型,可作为EMT过程的标志蛋白[12]。E-cadherin表达于上皮细胞的胞膜,与β-actin形成复合体增强细胞的黏附功能;Vimentin是典型表达于间质细胞的中间丝状体蛋白,可动员细胞游走。大量研究表明,E-cadherin的丢失以及Vimentin的获得使得肿瘤细胞失去极性,细胞间连接变得松散,细胞的运动迁徙、侵袭能力增强[13]。本研究结果发现,E-cadherin主要表达于正常宫颈组织及分化程度较高的CSCC胞膜,CSCC伴淋巴结转移者其阳性率降低;而Vimentin则不表达于正常宫颈上皮,其往往表达于分化程度较低的肿瘤细胞的胞质,相反随着淋巴结转移、脉管癌栓转移其阳性率增高;且二者在CSCC组织中的表达呈负相关。推测,CSCC可能发生了一定程度的伴随E-cadherin下调、Vimentin上调的EMT,促进其侵袭转移等恶性进展。另外,有报道EMT在促进VM的形成过程发挥重要作用[14],本结果中VM与EMT标志蛋白E-cadherin、Vimentin的表达具有负、正相关性与之相符,推测CSCC中可能也存在这一进展机制。
更有研究发现,缺氧及缺氧导致的HIF-1α可通过诱导肿瘤中伴随E-cadherin下调、Vimentin上调的EMT过程,促进VM的形成,促进肿瘤的侵袭和迁移[15]。我们的研究结果中, VM、HIF-1α及EMT标志蛋白(E-cadherin和Vimentin)表达分别相关,其表达均随着分化程度的降低、淋巴结的转移而发生相应变化;加之同一标本的表达定位观察发现,VM阳性患者有56.2%HIF-1α阳性时伴随着E-cadherin阴性表达、Vimentin阳性表达,VM阴性者HIF-1α阳性时不存在这样的对应关系。推断CSCC中可能也存在上述机制,协同促进其侵袭转移。另外,我们还发现HIF-1α在CSCC组织的阳性率较高为60.5%,而VM、E-cadherin、Vimentin阳性率分别为37.2%、37.2%、32.6%。结合相关文献[16,17]推断,肿瘤快速生长形成的缺氧微环境可能刺激大量鳞癌细胞HIF-1α过表达,但仅部分具有多能胚胎样干细胞基因型的细胞通过过表达的HIF-1α调控EMT的发生,进而使肿瘤细胞去分化为肿瘤干细胞样细胞,然后模仿内皮细胞样形态,其间伴随着一系列复杂的变化,最终连通于宿主血管形成VM,促进肿瘤的侵袭转移等恶性进展的出现。
总之,VM、HIF-1α及EMT均在CSCC的发展、侵袭转移过程发挥重要作用,其联合检测对高度侵袭性、高度恶性CSCC的诊断具有一定的指导意义。HIF-1α可能通过下调E-cadherin、上调Vimentin诱导EMT,促进VM的形成,可能成为CSCC治疗中配合抑制血管生成的新靶标,但其具体机制十分复杂且相互交锁,仍待更进一步研究。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[2] Zhang D, Sun B, Zhao X, et al. Twist1 expression induced by sunitinib accelerates tumor cell vasculogenic mimicry by increasing the population of CD133+cells in triple-negative breast cancer[J]. Mol Cancer, 2014,13:207.
[3] Lin P, Wang W, Sun BC, et al. Vasculogenic mimicry is a key prognostic factor for laryngeal squamous cell carcinoma: a new pattern of blood supply[J]. Chin Med J (Engl), 2012,125(19):3445-3449.
[4] Wang W, Lin P, Sun B, et al. Epithelial-mesenchymal transition regulated by EphA2 contributes to vasculogenic mimicry formation of head and neck squamous cell carcinoma[J]. Biomed Res Int, 2014,2014:803914.
[5] Fan YL, Zheng M, Tang YL, et al. A new perspective of vasculogenic mimicry: EMT and cancer stem cells[J]. Oncol Lett, 2013,6(5):1174-1180.
[6] Wan HY, Li QQ, Zhang Y, et al. MiR-124 represses vasculogenic mimicry and cell motility by targeting amotL1 in cervical cancer cells[J]. Cancer Lett, 2014,355(1):148-158.
[7] 郑旭, 孙保存, 赵秀兰, 等. 肺肉瘤样癌中血管生成拟态的形成及其与上皮间充质转化的关系[J]. 中国肿瘤临床,2013,40(8):431-435.
[8] Maniotis AJ, Folberg R, Hess A, et al. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry[J]. Am J Pathol, 1999,155(3):739-752.
[9] Mayer A, Hockel M, Schlischewsky N, et al. Lacking hypoxia-mediated downregulation of E-cadherin in cancers of the uterine cervix[J]. Br J Cancer, 2013,108(2):402-408.
[10] Fu Z, Chen D, Cheng H, et al. Hypoxia-inducible factor-1a protects cervical carcinoma cells from apoptosis induced by radiation via modulation of vascular endothelial growth factor and p53 under hypoxia[J]. Med Sci Monit, 2015,21(42):318-325.
[11] Paulis YW, Soetekouw PM, Verheul HM, et al. Signalling pathways in vasculogenic mimicry[J]. Biochim Biophys Acta, 2010,1806(1):18-28.
[12] Liu Z, Sun B, Qi L, et al. Zinc finger E-box binding homeobox 1 promotes vasculogenic mimicry in colorectal cancer through induction of epithelial-to-mesenchymal transition[J]. Cancer Sci, 2012,103(4):813-820.
[13] Qureshi R, Arora H, Rizvi MA. EMT in cervical cancer: Its role in tumour progression and response to therapy[J]. Cancer Let, 2015,356(2):321-331.
[14] Ma JL, Han SX, Zhu Q, et al. Role of Twist in vasculogenic mimicry formation in hypoxic hepatocellular carcinoma cells in vitro[J]. Biochem Biophys Res Commun, 2011,408(4):686-691.
[15] Hendrix MJ, Seftor EA, Hess AR, et al. Vasculogenic mimicry and tumour-cell plasticity: lessons from melanoma[J]. Nat Rev Cancer, 2003,3(6):411-421.
[16] Du J, Sun B, Zhao X, et al. Hypoxia promotes vasculogenic mimicry formation by inducing epithelial-mesenchymal transition in ovarian carcinoma[J]. Gynecol Oncol, 2014,133(3):575-583.
[17] Sun D, Sun B, Liu T, et al. Slug promoted vasculogenic mimicry in hepatocellular carcinoma[J]. J Cell Mol Med, 2013,17(8):1038-1047.
王振国(E-mail: guozhen1963@163.com)
10.3969/j.issn.1002-266X.2016.34.025
R737.33
B
1002-266X(2016)34-0065-04
2016-05-13)

