Id-1和MMP-2表达与结直肠癌临床病理特征及预后的关系
武雪亮,王立坤,薛军,杨东东,屈明,郭飞,杨瑞敏,马鹏程,刘博
(河北北方学院附属第一医院,河北张家口075000)
Id-1和MMP-2表达与结直肠癌临床病理特征及预后的关系
武雪亮,王立坤,薛军,杨东东,屈明,郭飞,杨瑞敏,马鹏程,刘博
(河北北方学院附属第一医院,河北张家口075000)
目的检测DNA结合分化抑制蛋白1(Id-1)和基质金属蛋白酶2(MMP-2)在结直肠癌组织中的表达,评价其与结直肠癌临床病理特征和预后的关系。方法 采用免疫组化法检测50例结直肠癌、30例腺瘤组织、50例癌旁正常组织中的Id-1和MMP-2,分析二者表达与临床病理特征和预后的关系。结果 在癌旁正常组织、腺瘤和癌组织中,Id-1阳性表达率分别为24.00%、43.33%、72.00%,MMP-2阳性表达率分别为22.00%、46.67%、78.00%,P均<0.01;Id-1和MMP-2表达与结直肠癌的浆膜浸润、TNM分期、肝转移、淋巴结转移和脉管转移有关,P均<0.05;在结直肠癌组织中,Id-1表达与MMP-2表达呈正相关(r=0.429,P=0.000)。Id-1阳性者中位生存时间为32个月、阴性者为43个月,MMP-2阳性者中位生存时间为28个月、阴性者为45个月,P均<0.05。Cox回归模型分析显示,Id-1和MMP-2表达为影响预后的相关因素(P均<0.05)。结论 结直肠癌组织中Id-1和MMP-2高表达,二者与结直肠癌的发生、转移和预后密切相关。
结直肠肿瘤;DNA结合分化抑制蛋白1;基质金属蛋白酶2;病理特征;预后
DNA结合分化抑制蛋白1(Id-1)是近年来研究较热的一种致癌基因[1,2],已证实其在乳腺癌、宫颈癌、食管癌、胰腺癌中高表达,且与肿瘤的发生、侵袭、转移和预后相关[3~5],但在结直肠癌方面的研究较少。基质金属蛋白酶2(MMP-2)是MMP家族中的重要成员,能打破基质的降解平衡,促进肿瘤细胞向周围组织浸润侵袭。2008年5月~2015年5月,我们观察了Id-1和MMP-2表达变化及其与结直肠癌临床病理特征的关系, 并分析二者作为结直肠癌预后独立影响因子的价值。
1 资料与方法
1.1临床资料收集同期河北北方学院附属第一医院手术切除的50例原发性结直肠癌组织、30例腺瘤组织、50例癌旁正常组织,术前未行放化疗。结直肠癌患者中,男29例、女21例,年龄33~71岁;TNM分期Ⅰ期3例,Ⅱ期10例,Ⅲ期22例,Ⅳ期15例。
1.2检测方法采用免疫组化染色。用4%甲醛溶液固定标本,石蜡包埋,4 μm厚度切片。兔抗人单克隆浓缩型Id-1抗体、鼠抗人MMP-2单克隆抗体均购于Abcam公司,二抗工作液和DAB显色剂均购于武汉博士德生物工程有限公司。按试剂盒说明操作,PBS代替一抗为阴性对照。Id-1和MMP-2均以细胞质中出现棕黄色颗粒为阳性细胞[6],根据着色细胞占视野细胞总数的百分比及着色细胞染色强弱评分。阳性细胞百分数<5%、5%~<25%、25%~<50%、50%~<75%、≥75%分别计为0、1、2、3、4分,着色强度按无着色、淡黄色、棕黄色和棕褐色分别计为0、1、2、3分。两者相乘,0为阴性,≥1为阳性表达。
1.3统计学方法采用SPSS17.0统计软件。计数资料以百分率表示,采用χ2检验,相关关系采用Pearson相关性分析;Kaplan-Meier法绘制生存曲线,行Long-rank检验分析;应用Cox回归模型对结直肠癌患者预后进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1不同结直肠组织中Id-1和MMP-2表达比较在癌旁正常组织、腺瘤、癌组织中,Id-1阳性表达率分别为24.00%、43.33%、72.00%;MMP-2阳性表达率分别为22.00%、46.67%、78.00%,P均<0.01。
2.2Id-1和MMP-2在结直肠癌中表达的关系相关性分析显示,Id-1和MMP-2在结直肠癌的表达呈正相关(r=0.429,P=0.000)。
2.3Id-1和MMP-2表达与结直肠癌临床病理特征的关系Id-1和MMP-2表达均与结直肠癌浆膜浸润、TNM分期、淋巴结转移、肝转移及脉管浸润有关(P均<0.05),而与患者的性别、年龄及肿瘤大小、分化程度等均无关(P均>0.05)。见表1。
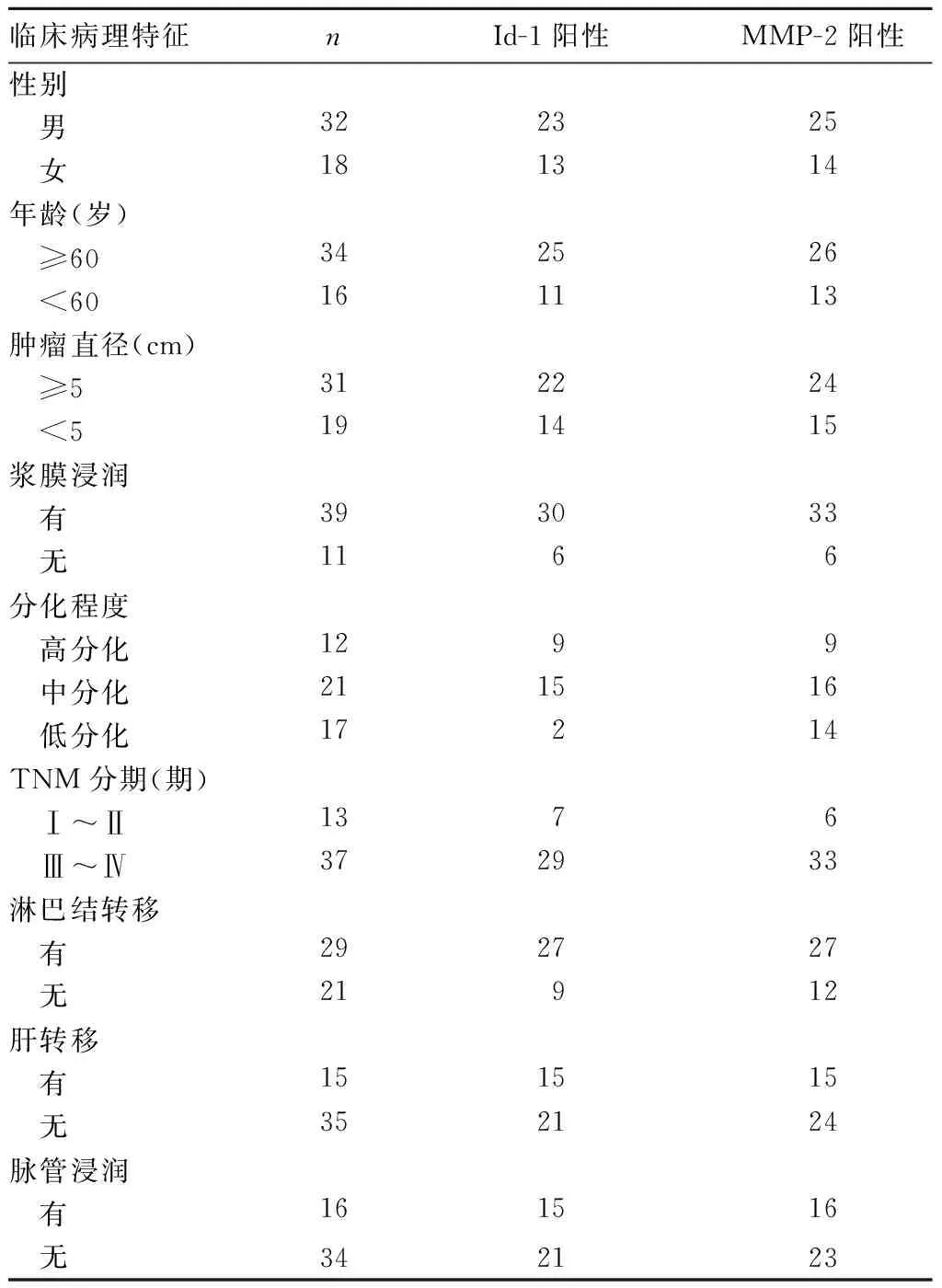
表1 Id-1和MMP-2表达与结直肠癌临床病理特征的关系(例)
2.4Id-1和MMP-2表达与预后的关系对50例结直肠癌患者随访至2015年5月31日,Id-1阳性者中位生存时间为32个月、阴性者为43个月,MMP-2阳性者中位生存时间为28个月、阴性者为45个月,两者生存时间比较有统计学差异(P=0.036,P=0.020)。Cox回归模型分析显示,Id-1(RR=1.193,P=0.002)和MMP-2(RR=3.488,P=0.031)表达为影响结直肠癌患者预后的独立因素。
3 讨论
Id-1系螺旋-环-螺旋(HLH)转录因子家族重要成员之一,广泛表达于哺乳动物的胚胎、生殖腺体及一些分化不成熟的组织细胞中。Id-1在正常组织中低表达或不表达,而在恶性肿瘤及体外培养的肿瘤细胞系中均高表达[7,8]。Id-1对细胞的增殖、分化起负性调控作用,其结构中的HLH区域能与碱性HLH蛋白(bHLH)结合形成无转录功能的异质二聚体;抑制bHLH与目标DNA结合,从而抑制细胞增殖分化。Id-1通过与转录因子E2A结合形成特异性复合物抑制E2A活化p21,激活CDK2诱导Rb蛋白磷酸化;而Rb蛋白的磷酸化在肿瘤增殖中发挥重要作用,能抑制细胞分裂周期中G1/S期停滞,促使细胞分裂周期顺利进行[9,10]。Id-1的异常高表达可激活VEGF及其受体(EGFR),从而释放促血管生成的自分泌信号,诱导肿瘤血管内皮细胞及微淋巴管形成,促进肿瘤的生长和侵袭[11]。本研究发现,Id-1在癌旁正常组织、腺瘤和癌组织中的表达逐渐增强,提示Id-1表达的上调在结直肠组织的癌变中发挥重要作用;且Id-1表达与结直肠癌的侵袭深度、淋巴结转移、肝转移及脉管浸润密切相关,提示Id-1表达的增强能促进癌细胞的浸润、转移等恶性生物学行为。
MMP-2是MMP家族中与恶性肿瘤联系最为密切的因子之一,能破坏基质的降解平衡、诱导癌细胞穿透细胞外基质与基底膜构成的屏障,同时降低细胞间的黏附力,促进癌细胞向周围组织浸润、侵袭;此外,MMP-2还能促使血管内皮生长因子大量释放,诱导肿瘤新生血管形成,为肿瘤细胞的增殖与浸润提供必要的营养基础与途径[12,13]。因此,MMP-2被广泛应用于肿瘤浸润、转移、预后不良的监测。本研究表明,MMP-2与结直肠癌的发生、进展、转移密切相关,这与王连等[14]研究结果一致。
我们进一步研究显示,Id-1和MMP-2在结直肠癌组织中的表达呈正相关。考虑其机制为Id-1能上调膜型基质金属蛋白酶-1(MT1-MMP)的表达水平,使MMP-2、MMP-9等过表达,促进基底膜的降解;而且,Id-1表达上调能促进TGF-β1表达,进而下调E-钙黏蛋白表达,诱导上皮细胞间质转化,导致细胞间极性消失、黏附力下降,使肿瘤细胞突破基底膜屏障;与MMP-2、MMP-9等具有协同作用,促进肿瘤的侵袭、浸润[13]。
此外,生存分析显示Id-1和MMP-2表达水平与总生存时间明显相关,表达越高,生存时间越短,预后越差;Cox回归模型分析显示,Id-1和MMP-2表达水平均为影响预后的独立因素。
综上所述,结直肠癌组织中Id-1和MMP-2高表达,并与其侵袭和转移密切相关,二者共同参与结直肠癌的发生、进展。因此,Id-1和MMP-2有望成为新的结直肠肿瘤监测指标,为临床诊治、预后监测及基因的精准化治疗提供重要的参考。
[1] Yang G, Zhang Y, Xiong J. Downregulation of Id-1 by small interfering RNA in gastric cancer inhibits cell growth via the Akt pathway[J]. Mol Med Report, 2012,5(4):1075-1079.
[2] Jang TJ, Jung KH, Choi EA. Id-1 gene downregulation by sulindac sulfide and itsupregulation during tumor development in gastric cancer[J]. Int J Cancer, 2006,118(6):1356-1363.
[3] Georgiadou D, Sergentanis TN, Sakellariou S, et al. VEGF and Id-1 in pancreatic adenocarcinoma:Prognostic significance and impact on angiogenesis[J]. Eur J Surg Oncology, 2014,40(10):1331-1337.
[4] Ma HY, Wei Y, Leng YM, et al. TGF-b1-induced expression of Id-1 is associated with tumor progression in gastric cancer[J]. Med Oncol, 2014,31(7):10-19.
[5] 马莉娟,何金彩,柴泽英,等.细胞分化抑制因子-1与细胞增殖核抗原Ki-67在宫颈癌中的表达及相关性研究[J].中国临床药理学杂志,2015,31(8):627-630.
[6] 李秀娟,赵轶峰,李明霞,等.食管鳞癌组织Nanog表达临床意义分析[J].中华肿瘤防治杂志,2014,21(24):1962-1965.
[7] Sun W, Guo MM, Han P, et al. Id-1 and the p65 subunit of NF-κB promote migration of nasopharyngeal carcinoma cells and are correlated with poor pmguosis[J]. Carcinogenesis, 2012,33(4):810-817.
[8] Li W, Zhang CH, Hong YL, et al. Inhibitor of DNABingding-1/inhibitor of differentiation-l(ID-1)is implicated in various aspects of gastric cancer cell biology[J]. Mol Biol Rep, 2012,39(3):3009-3015.
[9] 李建峰,扈玉华,董雅兰.分化抑制因子1、3及基质金属蛋白酶9在脑转移瘤组织中的表达及意义[J].中华实验外科杂志,2013,30(2):300-302.
[10] 刘旭剑,王小玲,冯建刚,等.Id-1,MMP-9及微血管密度与脊柱转移瘤术中出血量及肿瘤来源间的关系[J].中国脊柱脊髓杂,2012,22(8):678-681.
[11] Sharma P, Patel D, Chaudhary J. Id-1 and Id-3 expression is associated with increasing grade of prostate cancer:Id-3 preferentially regulates CDKNlB[J]. Cancer Med, 2012,1(2):187-197.
[12] 史汉蒙,司君利,崔伟丽,等.肿瘤相关巨噬细胞计数、基质金属蛋白酶-2及Ki-67的表达与结直肠癌预后的关系[J].中华消化杂志,2015,35(6):405-407.
[13] 武志,潘晓玲,仲洁.MMP-2和MMP-9在食管癌中表达的研究[J].国际肿瘤学杂志,2013,40(9):708-711.
[14] 王连,张煦,王玲.结直肠癌中WISP-1和MMP-2的表达及临床意义[J].临床与实验病理学杂志,2012,28(11):1246-1249.
[15] Yang J, Weinberg RA. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis[J]. Dev Cell, 2008,14(6):818-829.
Id-1 and MMP-2 expression in colorectal cancer and their relationship with clinicopathological characteristics and prognosis
WUXueliang,WANGLikun,XUEJun,YANGDongdong,QUMing,GUOFei,YANGRuimin,MAPengcheng,LIUBo
(TheFirstAffiliatedHospitalofHebeiNorthUniversity,Zhangjiakou075000,China)
ObjectiveTo detect the expression of Id-1 and matrix metalloproteinase-2 (MMP-2) in human colorectal adenocarcinoma tissues, and explore their relationships with clinicopathological characteristics and prognosis. Methods The expression levels of Id-1 and MMP-2 in 50 specimens of normal colorectal tissues, 30 specimens of colorectal adenoma tissues and 50 colorectal adenocarcinoma tissues were detected by immunohistochemistry, and subsequently the relationships between their expression and clinical-pathological features and prognosis were analyzed. ResultsThe positive expression rates of Id-1 in colorectal normal tissues, adenoma tissues and adenocarcinoma tissues were 24.00%, 43.33% and 72.00%, and the positive expression rates of MMP-2 in colorectal normal tissues, adenoma tissues and adenocarcinoma tissues were 24.00%, 43.33% and 72.00%, allP<0.01. The expression of Id-1 and MMP-2 was correlated with the depth of serosa invasion, TNM stages, liver metastasis, lymph node metastasis and vessel invasion, allP<0.05. The expression of Id-1 was positively correlated with the expression of MMP-2 in colorectal adenocarcinoma tissues (r=0.429,P=0.000). The median survival time of Id-1 positive expression and negative expression were 32 months and 43 months, and the median survival time of MMP-2 positive expression and negative expression were 28 months and 45 months, allP<0.05. Cox proportional hazards model analysis showed that the expression of Id-1 and MMP-2 was significantly correlated with the prognosis(allP<0.05). Conclusion Id-1 and MMP-2 is highly expressed in colorectal adenocarcinoma tissues and its expression is related to the occurrence, metastasis and prognosis of colorectal cancer.
colorectal neoplasms; Id-1; matrix metalloproteinase-2; pathological characteristics; prognosis
河北省卫计委医学科学研究重点课题计划(20150058);河北省科技支撑计划项目(152777237) ;河北省张家口市科技局指令性计划(1311055D)。
武雪亮(1984-),男,主治医师,硕士,主要研究方向为胃肠道肿瘤的基础与临床诊疗。E-mail: wxlwlk@163.com
简介:薛军(1965-),男,主任医师,硕士生导师,主要研究方向为胃肠道恶性肿瘤的基础与临床诊治。E-mail: yfyxuejun@163.com
10.3969/j.issn.1002-266X.2016.34.004
R735.37
A
1002-266X(2016)34-0011-03
2016-03-01)

