载纳米银海藻酸钙敷料的制备及体外细胞毒性、抗菌性能的检测*
林志群,赵大川,郎敏,柳学文,陈瀛,陈飞,黄宗海
(南方医科大学珠江医院普通外科,广州 510280)
1 引 言
海藻酸盐属于海洋生物资源,是一种无水D-甘露糖醛酸聚合物,其来源广泛、生物可降解、良好生物相容性使之有潜力成为优良的生物材料[1]。以海藻酸盐为原料研发的海藻酸钙纤维具有高吸收性、高透氧性、良好的生物相容性、止血性能及可降解吸收性等[2-3],这些特性使得海藻酸钙纤维非常适合开发用于医用敷料。
银作为抗菌剂使用由来已久,银离子、可溶性银化合物、表面积大的胶态银、纳米银等均具有杀灭细菌、真菌和霉菌的特性[4-6]。其中纳米银是以纳米技术为基础研制而成的新型抗菌产品,其依靠着量子效应、小尺寸效应和具有极大的比表面积[7],因而具有传统无机抗菌剂无法比拟的抗菌效果。此外,纳米银粒子具有很强的渗透性,能渗透到皮下组织,与切口接触后迅速持久地释放纳米银,快速有效地杀灭切口及缝线上的病原体。如今,以纳米银为基础的抗菌产品在临床上得到了广泛的应用。
因此,本研究结合海藻酸盐纤维及纳米银的特性,开发一种具有高吸收性可降解医用抗菌敷料。第一步在海藻酸盐溶液中加入羧甲基纤维素,并用湿法纺丝得到改性后的海藻酸钙羧甲基纤维复合物,最后利用浸渍富集法制备载纳米银海藻酸钙抗菌敷料。通过紫外-可见光分光光度计和扫描电子显微镜检测敷料的物理学表征,再结合细胞毒性及抗菌性能检测,筛选出合适浓度的载纳米银海藻酸钙抗菌敷料。
2 实验
2.1 实验试剂仪器
海藻酸钠、羧甲基纤维素钠购自爱尔兰贝朗公司,纳米银购自张家港耐尔纳米科技公司,LO2人正常肝细胞由南方医科大学珠江医院药剂科提供,实验菌株由南方医科大学珠江医院微生物研究所提供。紫外-可见光分光光度计:美国Thermo NanoDrop 2000,扫描电子显微镜:日本Jeol。
2.2 载纳米银海藻酸钙抗菌敷料的制备
将海藻酸钠、羧甲基纤维素纳按8.5:1.5比例溶于水中,高速搅拌,形成粘稠溶液,脱泡过滤后通过喷丝孔挤出到含有钙离子的凝固浴中,形成固态海藻酸钙羧甲基纤维长丝。该长丝经过拉伸、水洗、脱水干燥、卷曲形成纤维,纤维可梳理成网,制成海藻酸钙羧甲基纤维复合物,再利用浸渍富集法,制成质量分数为0.5、1、2、4%的载纳米银海藻酸钙羧甲基纤维素复合物,简称:载纳米银海藻酸钙抗菌敷料(slver nanoparticles-calcium alginate,AgNPs-Ca)。
2.3 敷料物理学表征检测
敷料在紫外和可见光的吸收特性由紫外-可见光分光光度计测定,检测波长范围200~800 nm;利用扫描电子显微镜观察载纳米银海藻酸钙敷料中纤维及纳米银的形态、分布情况。
2.4 细胞毒性检测
将100 μl浓度为6 X 104/mL的人正常肝细胞LO2细胞悬液接种于96孔培养板,细胞贴壁后弃原液,将普通敷料、海藻酸钙敷料、0.5% AgNPs-Ca、1% AgNPs-Ca、2% AgNPs-Ca、4% AgNPs-Ca、Ag+-Ca等7个组的样品浸提液各100 μl,置于细胞培养箱孵育24 h。采用CCK-8法测定LO2细胞培养的相对增殖率(RGR),评价材料的细胞毒性。
2.5 抗菌性能检测
2.5.1抑菌圈法 采用临床常见四种菌株,金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、白色念球菌作为实验用菌,将菌液均匀涂板后,并将制备四种浓度载纳米银海藻酸钙敷料剪成直径10 mm的圆片贴附于培养板上,放置于细菌培养箱培养24 h后计算抑菌圈大小。
2.5.2振荡抑菌法 将上述菌种配制成浓度3X104cfu/ml的菌液, 普通敷料、海藻酸钙敷料、0.5% AgNPs-Ca、1% AgNPs-Ca、2% AgNPs-Ca、4% AgNPs-Ca、Ag+-Ca等7个组的样品放置于菌液内振荡培养,分别于振荡前、振荡后1、2 h取菌液涂板,培养24 h后计数,并计算抑菌率。
抑菌率=(初始细菌浓度-第n小时细菌浓度)/初始细菌浓度×100%
3 结果与讨论
3.1 物理学表征检测
图1为载纳米银海藻酸钙敷料的紫外可见光吸收光谱,蓝色曲线代表载纳米银海藻酸钙敷料,红色曲线代表海藻酸钙敷料,从中可以看出,载纳米银海藻酸钙敷料水溶液的吸收峰位于416 nm处,此外其分布范围在350~550 nm之间。而未添加纳米银的海藻酸钙敷料的紫外光谱则没有特殊的吸收峰。纳米银Ag0的特征吸收峰位于400 nm附近,而按照粒径的不同,存在一定的蓝移或红移现象[8]。此吸收峰即为纳米银的吸收峰,说明载纳米银海藻酸钙敷料确实存在纳米银,而且在去离子水中能自由释放出纳米银,另外,其分布范围说明了海藻酸钙中纳米银具有较低的分散性。
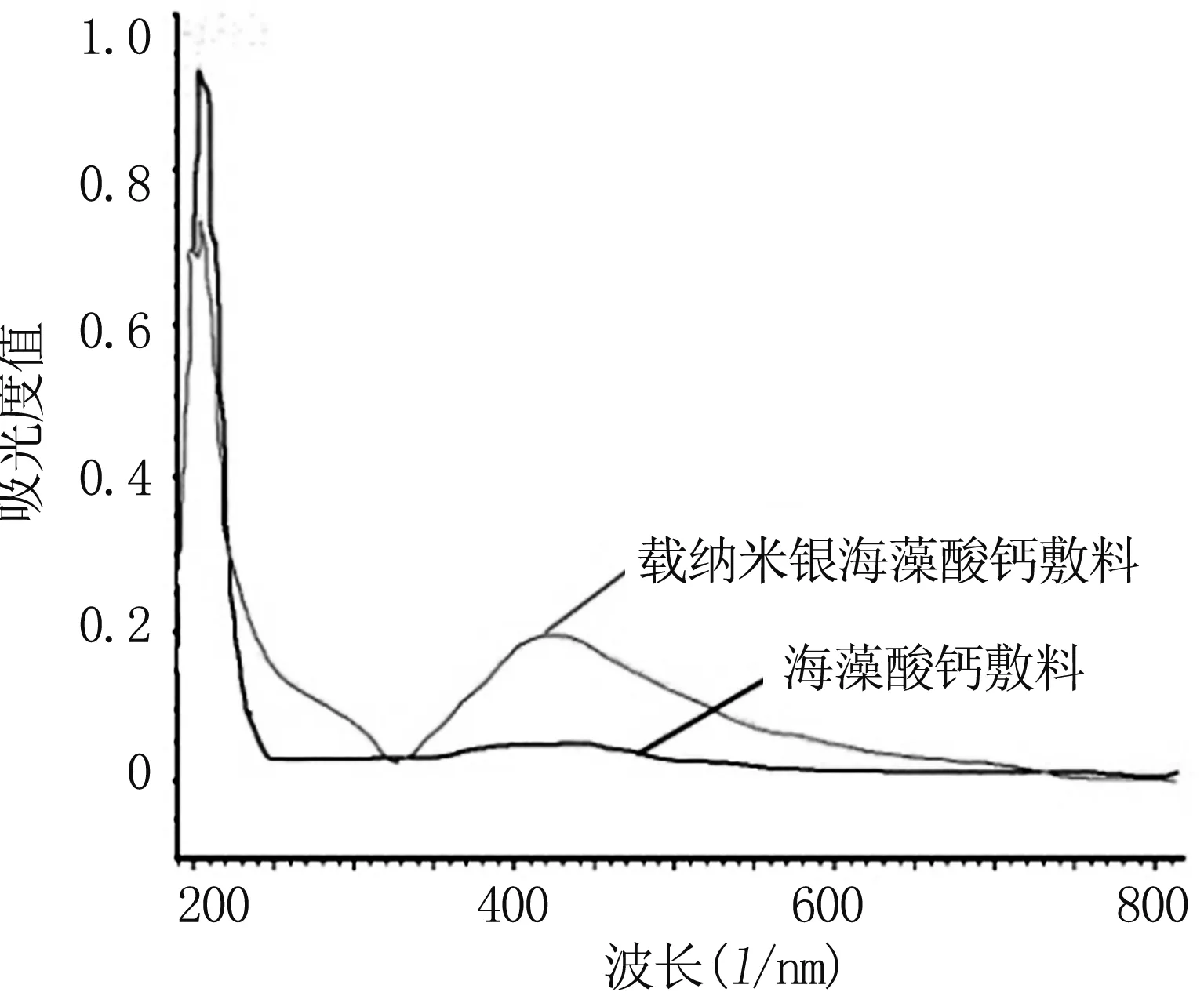
图1 载纳米银海藻酸钙敷料的紫外-可见光吸收光谱
图2a为50倍电子显微镜下的载纳米银海藻酸钙敷料,可以看出,敷料纤维致密,相互交织,纤维粗细大致相等。图2b为5000倍扫描电子显微镜下的载纳米银海藻酸钙敷料,敷料中纳米银呈规则的球形,粒径在80~100 nm之间,附着于海藻酸钙纤维表面及空隙之间。

图2 载纳米银海藻酸钙敷料的扫描电子显微镜照片
Fig2SEMphotographsofAgNPs-Cadressing
3.2 细胞毒性检测
培养24 h后, 普通敷料、海藻酸钙敷料组的细胞,贴壁生长好,细胞密度大,细胞呈长梭形,折光性强,细胞突充分伸展,可见核分裂细胞。0.5% AgNPs-Ca、1% AgNPs-Ca实验组贴壁生长好,细胞密度较大,大多数细胞成长梭形,可见少量细胞圆缩,细胞连接成单层,分裂相多见,两者未见明显区别。2% AgNPs-Ca实验组贴壁生长较差,细胞密度下降,少数成梭形细胞,可见明显的细胞圆缩,细胞状态较差。4% AgNPs-Ca、Ag+-Ca实验组细胞存在大量圆缩现象,细胞密度显著下降,核固缩,死亡细胞明显增多,少数贴壁细胞聚集成团。
CCK-8检测细胞增值率表明,海藻酸钙毒性分级为0级,0.5% AgNPs-Ca、1% AgNPs-Ca敷料为I级,无细胞毒性,2% AgNPs-Ca开始表现出轻度的细胞毒性,到了4% AgNPs-Ca和Ag+-Ca组,细胞毒性继续加大。从图3、表1中可以看出,敷料的细胞毒性与添加的纳米银呈浓度依赖性。当纳米银添加量少于1%时,载纳米银抗菌敷料表现出良好的生物相容性。而含银离子的成品敷料,在此次细胞增殖实验中,表现出中度的细胞毒性,细胞毒性为IV级。

注:与普通敷料组比较,*表示P<0.05,***表示P<0.001
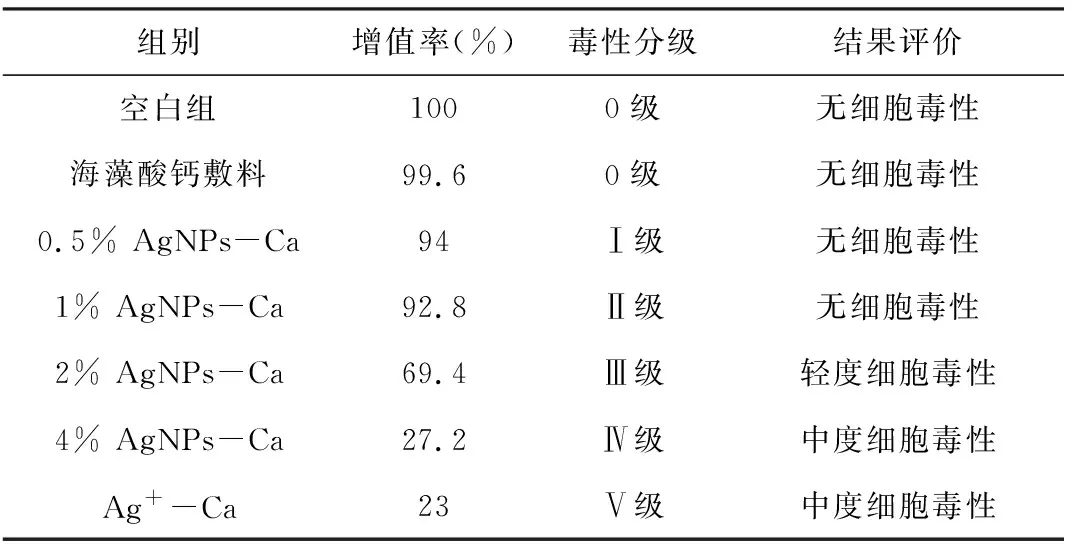
表1 各组敷料作用于LO2细胞的细胞相对增殖率及毒性评价
载纳米银海藻酸钙敷料的细胞毒性与纳米银呈浓度依赖性,并且与纳米银颗粒的直径成反比关系。暗视野镜检显示纳米银粒径越小,进入细胞的量越多[9]。原因在于纳米银粒径越小,相对表面积越大,分解释放的Ag+越多,细胞毒性越明显。不过也有研究认为纳米银粒径越小,越容易穿透细胞的膜性结构,可能只是一个单纯的物理效应[10]。此外,纳米银颗粒的细胞毒性还同时具有时间依赖性,这意味着同种浓度下,细胞与纳米银粒子接触时间越长,细胞毒性越明显,但是作为创面敷料,并不需要长期放置于体内,时间依赖性在敷料的应用影响不大。
0.5% AgNPs-Ca、1% AgNPs-Ca不影响人肝细胞LO2的增殖活性,细胞毒性为I级,均无细胞毒性,说明这两种含银量的海藻酸钙敷料具有良好的生物相容性,符合生物医用材料的基本要求。
3.3 抗菌性能检测
3.3.1抑菌圈法 抑菌圈提示未添加纳米银的海藻酸钙敷料在四个菌株中均未见明显抑菌圈,而添加了不同浓度纳米银的四组海藻酸钙敷料其抑菌圈大小呈浓度依赖性。在对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、白色念球菌四个菌株的抑菌圈中,0.5% AgNPs-Ca所产生的抑菌圈大小介于11.8~13.6 mm,1% AgNPs-Ca所产生的抑菌圈大小介于13.0~14.7 mm,2% AgNPs-Ca所产生的抑菌圈大小介于13.5~16.2 mm,4% AgNPs-Ca所产生的抑菌圈大小介于15.3~18.0 mm。抑菌圈检测法反映了敷料与微生物直接接触后的抑制性能,海藻酸钙作为敷料载体,本身并不具有抗菌性能,真正发挥抗菌作用的是吸附在纤维上的纳米银,其抗菌能力随纳米银浓度升高而增加。
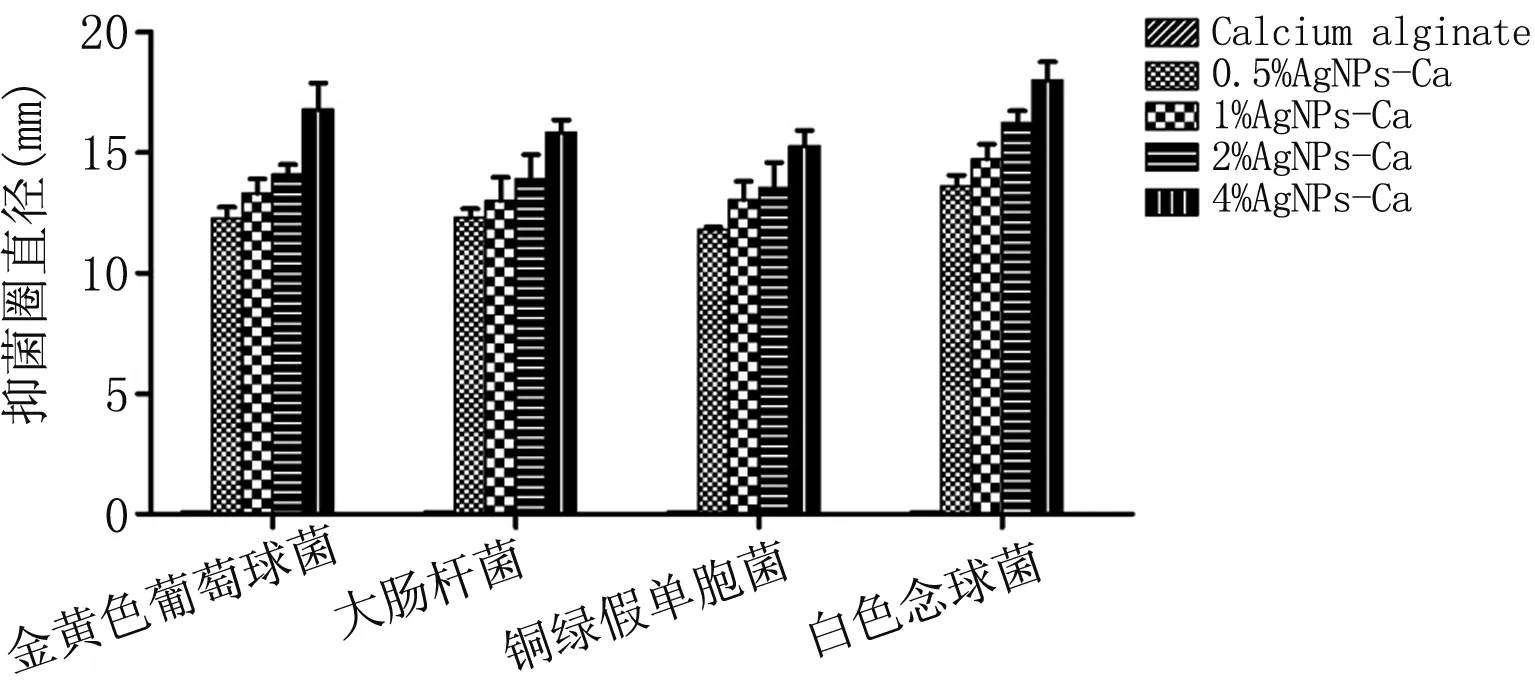
图4 五组敷料对金黄色葡萄球菌(SA)、大肠杆菌(E.Coli)、铜绿假单胞菌(PSA)、白色念球菌(CA)的抑菌圈柱形图比较(Mean±SD)
3.3.2振荡抑菌法 图5可以看出载纳米银海藻酸钙敷料对四个菌株的抗菌特性具有明显的浓度依赖性和时间依赖性。1 h时,低浓度的载纳米银海藻酸钙敷料对实验菌的抑制效果一般,但2 h时,几乎所有载纳米银海藻酸钙敷料对四个菌株的抑菌率均超过90%。4个浓度分组的AgNPs-Ca对于四个菌株都具有不错的抗菌性,且其抗菌性具有时间依赖性及浓度依赖性。4% AgNPs-Ca可抑制所有菌株的生长,在2 h内,抑菌率均超过98%,特别是对金黄色葡萄球菌与白色念球菌,1小时内即可将细菌完全抑制至无法检测出。1% AgNPs-Ca对金黄色葡萄球菌、大肠杆菌、白色念球菌的2 h抑制率超过97%。Ag+-Ca对大肠杆菌和铜绿假单胞菌的抑制作用类似于AgNPs-Ca 敷料,但是对金黄色葡萄球菌、白色念球菌的抑菌性明显不及AgNPs-Ca 敷料。单纯海藻酸钙敷料对金葡菌、白色念球菌和铜绿假单胞菌的在1h时表现出轻度的抑菌性能,而到了2 h抑菌率为0%。
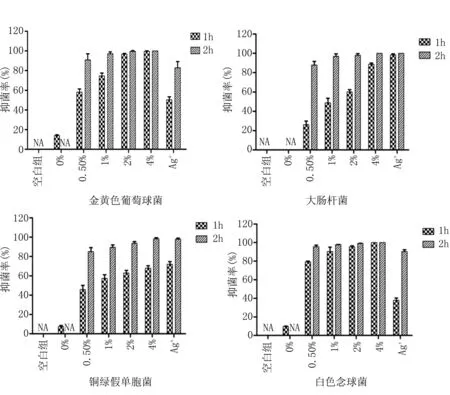
注:“NA”表示经计算后抑菌率小于0,视为无抑菌性能
经改性后的海藻酸钙羧甲基纤维复合物具有高吸收性,表面具有大量负电基团(-OH,-COOH等),可将纳米银吸附并结合于纤维表面,基于此制备成的载纳米银海藻酸钙敷料除了保持原纤维的高吸收性、可降解性外,在湿润环境中还能缓慢释放出纳米银粒子。纳米银颗粒呈超细状态,表面积极大,在溶液里能电离释出Ag+,Ag0→Ag++e-,所以,纳米银的抗菌活性与Ag+有关,后者可与菌体中酶蛋白的-SH迅速结合,使得以此为必要基团的酶失去活性,从而达到杀灭病菌,修复伤口的作用[11]。但研究发现纳米银的抗菌性能不单单依靠电离出Ag+,还因为纳米银的颗粒具有独特的小尺寸效应,加上有效浓度为纳摩尔级别的,而Ag+是微摩尔级的,可使纳米银轻松穿透菌体细胞膜,待细胞膜破损后Ag+便可自由进入[12-13]。最近也有报道认为决定纳米银抗菌活性的不是颗粒的晶体和物理学大小,而在于其流体尺寸[14]。在决定纳米银的穿膜效应中,颗粒的形状也是一个重要的因素,其中球形和六面体纳米银最容易穿透细菌细胞膜[15]。
本实验选择的菌株代表了临床常见的革兰阳性、阴性菌及真菌,这些菌株都被载纳米银海藻酸钙敷料明显抑制,其中,相比Ag+-Ca敷料,AgNPs-Ca对革兰阳性菌和真菌的抑制性能更好,这可能与AgNPs强大的穿透能力有关。海藻酸钙纤维1 h时表现出一定抑菌性能,这可能是海藻酸钙吸附了部分菌量,导致整体菌液浓度下降。对于海藻酸钙-纳米银复合材料来说,海藻酸钙具有的膨胀效应及吸附能力[16],使得微生物与纳米银粒子充分接触,可提供一种协同杀菌效应。
4 结论
本实验制备的载纳米银海藻酸钙抗菌敷料经表征检测证实纤维粗细大致相等,纳米银吸附均匀、粒径均一,分散性低。载银量1%的海藻酸钙敷料无明显细胞毒性,同时具有良好的抗菌性能,对临床四种常见菌株均有明显的抑制作用,是一个理想的载银浓度。

