食品中镉离子胶体金免疫层析快速检测方法的建立及应用
王亚楠,王晓斐,牛琳琳,雷 壮,张海棠,王自良,*
(1.河南科技学院动物科技学院,河南 新乡 453003;2.河南科技学院新科学院,河南 新乡 453003)
食品中镉离子胶体金免疫层析快速检测方法的建立及应用
王亚楠1,王晓斐2,牛琳琳1,雷壮1,张海棠1,王自良1,*
(1.河南科技学院动物科技学院,河南 新乡 453003;2.河南科技学院新科学院,河南 新乡 453003)
目的:建立更加灵敏、特异的食品镉离子胶体金免疫层析快速检测方法。方法:用1-(4-异硫氰苄基)乙烯基二胺-N,N,N’,N’-四乙酸(1-(4-isothiocyanobenzyl)ethylenediamine-N,N,N’,N’-tetraacetic acid,iEDTA)鳌合镉离子合成Cd2+-iEDTA半抗原,异硫氰酯法制备免疫原Cd2+-iEDTA-牛血清白蛋白(bovine serum albumin,BSA)和包被原Cd2+-iEDTA-鸡卵清蛋白(ovalbumin,OVA),电感耦合等离子体发射光谱法和聚丙烯酰胺凝胶法进行鉴定;用Cd2+-iEDTA-BSA免疫Balb/C小鼠,细胞融合技术筛选Cd2+-EDTA单克隆抗体(mAb)杂交瘤细胞株,体内诱生腹水法制备Cd2+-EDTA mAb;应用Cd2+-EDTA mAb建立Cd2+残留胶体金免疫层析快速检测方法(Cd2+-Strip),并测定其性能。结果:免疫原偶联成功,Cd2+-iEDTA-BSA中BSA与Cd2+的含量分别为7.1 mg/mL和191.7 μg/mL;筛选出1A3C11、2B7D8、2E10G9、4F3E7共4 株杂交瘤细胞,经9 次传代分泌抗体稳定,亲和力最高的2E10G9株亲和常数(Ka)为7.58×108L/mol,对Cd2+-iEDTA的半数抑制浓度为16.3 μg/L,与Hg2+-EDTA的交叉反应(cross-reaction,CR)率为18.6%,与其他重金属离子无CR;Cd2+-Strip的检测时间为10 min,检出限为5 μg/L,其检测结果与竞争ELISA试剂盒(Cd2+ELISA-Kit)、电感耦合等离子体发射光谱法符合率为100%。结论:制备出了亲和力高、特异性强的Cd2+mAb,建立了灵敏、特异、快速、简便的食品镉离子胶体金免疫层析快速检测方法。
镉离子;免疫原;单克隆抗体;胶体金免疫层析;快速检测
重金属污染残留给生态环境、食品安全和人类健康带来了严重危害,2012年发生在广西的龙江河镉污染事件[1]和2013年发生在湖南的大米镉超标事件[2],再次引发政府和社会对镉污染的广泛关注。镉离子(Cd2+)对人体具有肾脏[3]、肝脏[4]、心血管[5]、神经[6]、致癌[7]等多种毒性作用[8],已成为环境与食品污染的主要公害之一[9],联合国粮农组织和世界卫生组织将Cd2+列为第3位食品安全重点监控污染物[10],GB 2762—2005《食品中污染物限量》规定Cd2+最大残留限量标准,大米不大于200 μg/kg,面粉、杂粮及肉类不大于100 μg/kg,水果、鲜蛋不大于50 μg/kg。随着检测技术的快速发展,目前已建立的检测方法主要有火焰原子吸收法[11]、石墨炉原子吸收法[12]、电感耦合等离子体发射光谱(inductively coupled plasma-atomic emission spectroscopy,ICP-AES)法[13]、电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICPMS)法[14]等,但由于设备、技术、场地、成本等方面的制约,其应用受到了限制。胶体金免疫层析(gold immunochromatography assay,GICA)技术是近年来发展成熟的一项新兴检测技术,在食品安全快速检测领域发挥了重要作用,适用于大量样品筛检及进出口通关的快速检测。国外Darwish[15]、Kazuhiro[16]等研制出了相关产品,国内刘艳梅等[17]和本课题组成员张海棠等[18]研究报道了酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测方法,向军俭等[19]报道了GICA检测方法,检出限较高为100 μg/kg,且与Hg2+有较强的交叉反应(cross-reaction,CR)。本研究旨以筛选制备亲和力高、特异性强的Cd2+mAb为切入点,建立更加灵敏、特异的食品Cd2+污染残留GICA检测方法。
1 材料与方法
1.1材料与试剂
Balb/C小鼠 郑州大学医学院;鼠源NS0骨髓瘤细胞 农业部动物免疫学重点实验室;CdCl2(纯度99.9%) 美国Alfa Aesar公司;牛血清白蛋白(bovine serum albumin,BSA)、鸡卵清蛋白(ovalbumin,OVA) 美国Pierce公司;1-(4-异硫氰苄基)乙烯基二胺-N,N,N’,N’-四乙酸(1-(4-isothiocyanobenzyl)ethylenediamine-N,N,N’,N’-tetraacetic acid,iEDTA)上海同仁化学研究所;免疫原Cd2+-iEDTA-BSA、包被原Cd2+-iEDTA-OVA、兔抗鼠二抗(rabit anti mouse immunoglobulin G,RaMIgG)、Cd2+检测竞争ELISA试剂盒(Cd2+ELISA-Kit) 本课题组制备;弗氏完全佐剂(complete freund’s adjuvant,CFA)、弗氏不完全佐剂(incomplete freund’s adjuvant,IFA) 美国Sigma公司;细胞培养基RPMI-1640、HAT、HT、PEG-2000美国Gibco公司;氯金酸(HAuCl4·3H2O)、柠檬酸三钠(Na3C6H5O7·2H2O) 美国Pierce公司;硝酸纤维素膜(nitrocellulose filter membrane,NC)、玻璃纤维棉、样品垫 美国Millipore公司;其他试剂为分析级;实验用水为去离子水。
1.2仪器与设备
DU800型紫外扫描仪 德国Beckman公司;Optima 2100DV型ICP-AES仪 美国PE公司;Multiskan MK3酶标仪 美国Thermo公司;H-600透射电镜 日本Hitachi公司;JY-3000型电泳仪 北京君意东方电泳设备有限公司;X-only单向喷点仪、CM4000切槽仪 美国Biodot公司。
1.3方法
1.3.1免疫原合成

图1 免疫原合成路线Fig.1 Synthesis scheme of immunogen Cd2+-iEDTA-BSA
参照Kuang等[20]所述的异硫氰酯法加以改进合成免疫抗原Cd2+-iEDTA-BSA,如图1所示。
1.3.2免疫原鉴定
载体蛋白与Cd2+含量测定:紫外扫描仪在波长278 nm处测定免疫原中BSA的浓度;ICP-AES测定Cd2+含量。
聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)法鉴定:选择5%浓缩胶,10%分离胶,浓缩胶电压60 V,分离胶电压90 V,考马斯亮蓝染色,水煮快速脱色。
1.3.3Cd2+-EDTA mAb制备与特性分析
1.3.3.1Cd2+-EDTA mAb制备
选择细胞融合小鼠:用Cd2+-iEDTA-BSA按正常程序免疫5 周龄雌性Balb/C小鼠5 只,免疫5 次,时间间隔4 周,最后1 次免疫后第21天断尾采血分离血清,间接ELISA和间接竞争ELISA测定其效价与灵敏性,选择效价高且灵敏性好的小鼠用于细胞融合。
细胞融合与杂交瘤细胞株的筛选:按常规方法将免疫脾细胞与NS0瘤细胞以1∶10比例混合,在500 mL/L PEG-1500作用下进行融合、筛选和克隆化,待确定杂交瘤细胞已单克隆化,用间接ELISA和间接竞争ELISA进行阳性杂交瘤细胞筛选,建立细胞株,冻存于液氮备用。
Cd2+-EDTA mAb制备:体内诱生腹水法制备Cd2+-EDTA mAb,选择经产雌性Balb/C小鼠5 只,腹腔注射IFA 1 mL,12 d后腹腔注射杂交瘤细胞1×106个/只,10 d后待小鼠腹部明显膨大即可收集腹水,饱和硫酸盐法进行纯化。
1.3.3.2Cd2+mAb特性分析
稳定性分析:将筛选出的3 株杂交瘤细胞分别于1、10、20、30、40、50、60、90、120 d和150 d复苏、传代、制备腹水Cd2+-EDTA mAb,间接ELISA测定腹水抗体效价以确定杂交瘤细胞分泌抗体的稳定性。
亲和性分析:按照Nam等[21]所述Batty饱和法测定亲和常数(Ka),按公式(1)计算:

式中:Ka为亲和常数/(L/mol);n为每组中2 个包被抗原浓度的稀释倍数;[Ab’] t和[Ab]t分别为每组中2 个50% Amax所对应的抗体浓度,其中Ab’和Ab为抗体浓度/(mol/L);t为反应温度/℃。
灵敏性分析:间接竞争ELISA测定Cd2+-EDTA mAb对Cd2+-EDTA的半数抑制浓度(half maximal inhibitory concentration,IC50),确定其灵敏性。
特异性分析:间接竞争ELISA测定Cd2+-EDTA mAb对Pb2+、Hg2+、Cu2+、Zn2+、Mn2+、Mg2+、Ni2+、Fe3+、Cr3+、Al3+等金属离子与EDTA的螯合物及EDTA的CR,按照公式(2)计算CR率。

1.3.4Cd2+-Strip方法建立及性能测定
1.3.4.1Cd2+-Strip方法建立
胶体金的制备与鉴定:参照Daesub等[22]所述的柠檬酸钠还原法制备胶体金,用紫外扫描及透射电镜扫描,通过观察其颜色及粒径大小进行鉴定。
金标抗体的制备及单抗最佳用量的确定:采用Mey氏系列稳定法[23]制备金标抗体,取酶标板9 孔,每孔100 µL双蒸水铺底;第1孔加入质量浓度为1 mg/mL的Cd2+-EDTA mAb 100 µL,之后进行倍比至第8、9孔为空白对照(BC);每孔加入25 µL pH 8.5的胶体金溶液,室温反应10 min,加入100 g/L NaCl溶液100 µL,室温反应10 min,观察显色情况。对照孔与Cd2+-EDTA mAb量不足以稳定金溶胶的各孔呈现由红变蓝的聚沉现象,而Cd2+-EDTA mAb量达到或超过最低稳定量的各管仍保持红色不变,选择其中含Cd2+-EDTA mAb量最低的红色孔即为1 mL胶体金所需的Cd2+-EDTA mAb的量,在此基础上增加10%即为待标Cd2+-EDTA mAb的最佳用量。
金标抗体玻璃纤维棉的制备:用1%的BSA含0.05%吐温-20的磷酸盐缓冲液(phosphate buffer saline,PBS)浸泡玻璃纤维棉,晾干,将金标抗体用X-only单向喷点仪均匀喷洒于玻璃纤维棉上。
NC膜的制备:X-only单向喷点仪将质量浓度为1 mg/mL的免疫原Cd2+-iEDTA-BSA和质量浓度为1 mg/mL的RaMIgG点射于NC膜中央,形成间距0.5 cm的检测线(T线)和质控线(C线),自然干燥,密封,4 ℃保存备用。
免疫层析条件的优化:检测线(T线)Cd2+-iEDTABSA最佳工作质量浓度的确定,分别将Cd2+-iEDTA-BSA稀释为0.5、0.75、1.0、1.25、1.5 mg/mL系列质量浓度,在NC膜上划线,与同质量浓度金标抗体组装成试纸条,添加100 µL双蒸水进行检测,比较T线随质量浓度变化试纸条的显色情况和稳定性;质控线(C线)RaMIgG最佳工作质量浓度的确定,同样按上述方法进行。
试纸的组装:在支持板上首先黏贴上NC膜和吸水纸,此后依次黏贴上金标垫和样品垫,之后用切条机裁割,最后干燥、封闭,4 ℃保存备用。
Cd2+-EDTA标准品制备与待测样品预处理:由于所制备的Cd2+-EDTA mAb是针对镉离子螯合物(Cd2+-EDTA)的,取等体积的Cd2+标准品溶液(1 000 μg/L)与EDTA(1 mol/L)混合,静置10 min,使Cd2+螯合充分,之后用PBS稀释成所需质量浓度;液体样品如水样、尿样、血液样、牛奶样等,在液体样品中加入体积分数10%物质的量浓度为0.1 mol/L的EDTA鳌合剂,混合反应30 min,使Cd2+与EDTA充分鳌合,5 000 r/min离心10 min,取上清液进行检测;固体样品如土壤样、饲料样、组织样等,称取固体样品1.0 g于50 mL容量瓶内,加入1 mL水浸润后加入混酸溶液6 mL(3 mL浓磷酸和3 mL浓硫酸),加热至冒白烟,冷却后加入0.5 mL浓硝酸,继续加热至固体样品变白色、消解液呈黄绿色,用水冲洗,全部转移入50 mL离心管内,5 000 r/min离心10 min,将上清液移入50 mL容量瓶中,加入10 mL浓度为0.1 mol/L的EDTA鳌合剂溶液,混合反应30 min,定容至50 mL,5 000 r/min离心10 min,取上清液进行检测。
1.3.4.2Cd2+-Strip性能测定
灵敏性:用PBS配制1 000 μg/L的Cd2+溶液与1 mol/L的EDTA等体积混合,得到质量浓度为500 μg/L的Cd2+-EDTA溶液,用PBS稀释,配制终质量浓度分别为160.0、80.0、40.0、20.0、10.0、5.0、2.5、1.0 µg/L和0 µg/L的Cd2+-EDTA标准溶液,用于Cd2+-Strip测定,根据测定结果判断其灵敏性。实际检测时,将样品加到Cd2+-Strip样本垫上,室温反应10 min,观察显色结果。结果判定方法:T、C线均显示红色,样品呈阴性;T线不显示红色、C线显示红色,则呈阳性;T、C线均不显示红色,则表面检测卡失效。
稳定性:取不同批次的6 批Cd2+-Strip,分别在6 d对Cd2+-EDTA质量浓度为1.0、5.0、10.0、20.0 µg/L的水样、面粉样、猪肉样进行检测,检验其稳定性。
特异性:用PBS分别配制质量浓度为1 000 μg/L的Pb2+、Hg2+、Cu2+、Zn2+、Mn2+、Mg2+、Ni2+、Fe3+、Cr3+、Al3+标准品溶液,与1 mol/L的EDTA等体积混合,用PBS分别稀释至0、100、200、400、800、1 600 μg/L,用Cd2+-Strip进行测试,10 min后观察显色情况。
实际应用与复核实验:课题组分别从河南省新乡市、焦作市、安阳市采集水样98 份、面粉样36 份、猪肉样16 份,用Cd2+-Strip、Cd2+ELISA-Kit和ICP-AES进行检测,测定其准确率。
2 结果与分析
2.1免疫原鉴定
2.1.1BSA与Cd2+含量测定
紫外扫描仪于波长278 nm处测定Cd2+-iEDTA-BSA中BSA的质量浓度为7.1 mg/mL;ICP-AES测定其Cd2+含量为191.7 μg/mL,结果说明成功制备了免疫原。
2.1.2SDS-PAGE鉴定

图2 Cd2+-iEDTA-BSA的SDS-PAGE凝胶电泳图Fig.2 SDS-PAGE electrophoresis of Cd2+-iEDTA-BSA
如图2所示,Marker、BSA与Cd2+-iEDTA-BSA的电泳条带清晰,且BSA迁移距离明显大于免疫原Cd2+-iEDTA-BSA,说明Cd2+-iEDTA-BSA的分子质量大于BSA,证明成功制备了免疫原。
2.2Cd2+mAb制备
2.2.1细胞融合小鼠选择

图3 抗Cd的灵敏性测定(B)Fig.3 Titer (A) and sensitivity measurement (B) of anti-Cd2+pAb against Cd2+in serum2+多抗血清效价测定(A)、对Cd2+
如图3所示,5只免疫小鼠血清多克隆抗体(pAb)效价均达到了1∶(1×104),且4号小鼠效价最高达到了1∶(5.12×104),灵敏性也最好,IC50为26.7 μg/L,选用4号小鼠进行细胞融合。
2.2.2杂交瘤细胞株的建立
融合细胞经3 次克隆化后阳性率达100%,间接ELISA分别测定其IC50,筛选出4 株杂交瘤,分别命名为1A3C11、2B7D8、2E10G9、4F3E7。
2.3Cd2+mAb特性分析
2.3.1稳定性分析

图4 细胞传代腹水抗体效价变化Fig.4 The indirect ELISA titer of mAb secreted by hybridomas continually in ascites
如图4所示,经10 次冻存及复苏,9 次传代,杂交瘤分泌抗体稳定,腹水抗体效价均达到了105以上。
2.3.2亲和性分析

图5 亲和力测定Fig.5 Affinity measurement of anti-Cd2+-EDTA mAb
如图5所示,1A3C11、2B7D8、2E10G9、4F3E7的Ka分别为1.01×108、1.29×107、7.58×108、1.87×108L/mol,均为高亲和力抗体[24],其中2E10G9的亲和力最高。
2.3.3灵敏性分析

图6 灵敏性测定Fig.6 Sensitivity measurement of anti-Cd2+-EDTA mAb
如图6所示,抑制曲线的回归方程为y=-39.991x+ 98.476,由此可计算出亲和力最高的2E10G9株所产生的Cd2+-EDTA mAb对Cd2+-EDTA的IC50为16.6 μg/L,为高灵敏性抗体。
2.3.4特异性分析

表1 Cd2+-EDTA mAb CR率测定Table1 Cross-reactivity measurement of anti-Cd2+-EDTA mAb
如表1所示,Cd2+-EDTA mAb对Cd2+-EDTA的IC50为16.3 μg/L,对Hg2+-EDTA的IC50为87.63 μg/L,CR率为18.6%,对EDTA与其他类似化合物CR率均小于0.9%,对Cd2+-EDTA的检测基本不存在干扰现象。结果表明,本实验制备的Cd2+-EDTA mAb可特异性识别结合Cd2+-EDTA。
2.4胶体金质量鉴定
2.4.1紫外扫描鉴定
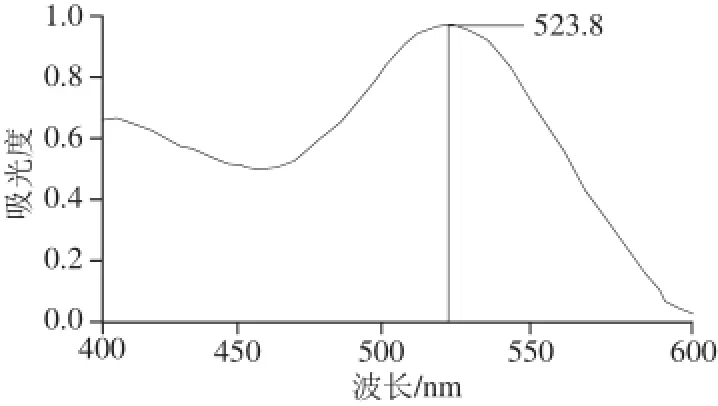
图7 胶体金紫外扫描图Fig.7 Absorption spectrum of colloidal gold
如图7所示,胶体金的最大吸收峰(λmax)位于523.8 nm,最大吸光度(Amax)为0.984,根据Zhou等[25]的研究结果,胶体金粒径为25 nm。
2.4.2透射电镜扫描鉴定

图8 胶体金电镜扫描结果Fig.8 Scanning electron microscopic observation of colloidal gold
如图8所示,所制备的胶体金在透射电镜下分布均匀,形状规则,随机测量100 个颗粒,粒径在(25±1.0)nm,与紫外扫描结果基本一致。
2.5金标抗体单抗最佳用量的确定
如表2所示,Cd2+-EDTA mAb与胶体金标记的适宜质量浓度为6.25 µg/mL,在此基础上增加10%,Cd2+-EDTA mAb最佳标记质量浓度为7.0 µg/mL胶体金。
2.6Cd2+-Strip性能测定
2.6.1灵敏性测定
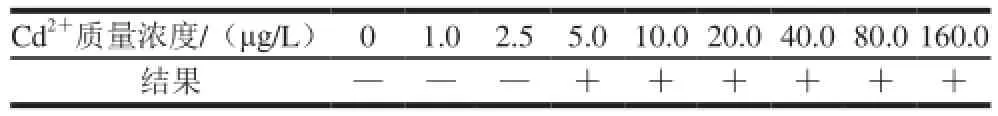
表3 Cd2+-Strip灵敏度测定(n=6)Table3 Sensitivity of Cd2+-Strip (n= 6)
由表3可知,Cd2+-Strip的检出限为5 µg/L。
2.6.2稳定性测定

表4 Cd-Strip稳定性测定(n=6)Table4 Stability measurement of Cd2+-Strip (n= 6)
如表4所示,不同批次的6 批Cd2+-Strip对水样、面粉样、猪肉样进行稳定性测定,检测结果完全一致,说明Cd2+-Strip的稳定性和重复性好。
2.6.3特异性测定
用Cd2+-Strip测定不同金属离子与EDTA螯合物反应情况,结果表明,除与Hg2+在质量浓度达到400 μg/L时有轻微CR外,与其他化合物无CR。
2.6.4符合性测定
如表5所示,发现98 份水样中阳性1 份,36 份面粉样中阳性3 份,16 份猪肉样中阳性1 份,3 种检测方法结果完全一致;6 份阳性样品用Cd2+-Strip半定量测定,用Cd2+ELISA-Kit和ICP-AES定量测定,Cd2+-Strip与Cd2+ELISA-Kit、ICP-AES的灵敏性相当,符合率为100%。

表5 Cd2+-Strip与Cd2+ELISA-Kit和ICP-AES检出实验结果的比较Table5 Results of parallel test of Cd2+-Strip and ELISA-kit
3 讨 论
3.1关于Cd2+mAb的质量性能
灵敏性是由抗体与其对应抗原反应的亲和力大小所决定的,实验所用2E10G9株杂交瘤细胞所分泌Cd2+-EDTA mAb的Ka为7.58×108L/mol,为高亲和力抗体。特异性是由抗体分子超变区空间结构与抗原决定簇之间的互补性决定的,本研究用iEDTA螯合Cd2+制备免疫原Cd2+-iEDTA-BSA,通过改变离子半径、空间构象来提高抗体特异性,用CR实验进行鉴定,Cd2+直径为0.203 nm,与Hg2+的直径仅相差0.035 nm,Cd2+-EDTA与Hg2+-EDTA的空间结构相差小于0.02 nm,因此Cd2+-EDTA与Hg2+-EDTA三维结构相似,因而两者具有轻微的CR,此结果与Sreepriya[24]、Jones[26]等研究结果一致。
3.2关于Cd2+-Strip的质量性能
本研究采用柠檬酸钠还原法制备胶体金,并采用紫外扫描、透射电镜扫描进行鉴定,粒径为25 nm,形状规则,分布均匀,物理吸附抗体能力强,减少了非特异性反应。采用Mey氏系列稳定法标记抗体,筛选确定了最适标记浓度,提高了抗体反应的稳定性。NC膜上的T线和C线是抗原抗体反应的所在部位,其孔径规格、黏附抗原抗体蛋白质能力及检测样品在NC膜上的迁移速率影响试纸质量,经多次实验,本研究选择带有背衬的AE180NC膜用于黏附Cd2+-iEDTA-BSA和RaMIgG,提高了反应的特异性,显色结果明显。
4 结 论
本研究采用分子交联技术成功合成Cd2+免疫原CdiEDTA-BSA,应用细胞融合技术研制出高效价、高亲和力、特异性强的Cd2+mAb,采用胶体金标记抗体模式,成功建立了食品Cd2+污染残留胶体金免疫层析快速检测方法,Cd2+-Strip具有快速(10 min)、灵敏(5 μg/L)、特异(除与Hg2+的CR率为18.6%,与其他重金属离子无CR)、简便(不需要任何仪器与附加试剂)的优点,具有广阔的市场前景和应用价值。
[1] 曾文伟, 石柱. “镉米”认知与区域优质稻产业发展对策[J]. 作物研究, 2015, 29(2): 185-187. DOI:10.3969/j.issn.1001-5280.2015.02.18.
[2] 董璟琦, 张红振, 王金南, 等. 龙江河突发环境事件河流镉污染化学形态模拟[J]. 中国环境科学, 2015, 35(10): 3046-3052. DOI:10.3969/ j.issn.1000-6923.2015.10.023.
[3] MARIA W, GERD S, THOMAS L, et al. Low-level cadmium exposure and effects on kidney function[J]. Journal of Occupational and Environmental Medicine, 2014, 71(12): 848-854. DOI:10.1136/ oemed-2014-102279.
[4] OMAR H, MICHAEL C, DAVID C, et al. Cadmium exposure and liver disease among US adults[J]. Journal of Gastrointestinal Surgery,2013, 17(7): 1265-1273. DOI:10.1007/s11605-013-2210-9.
[5] JUNENETTE L P, TODD S P, MELISSA J P, et al. Cadmium exposure in association with history of stroke and heart failure[J]. Environmental Research, 2010, 110(2): 199-206. DOI:10.1016/ j.envres.2009.12.004.
[6] LINDSEY A C, ANDREW H M, DANIEL J T, et al. Functional rehabilitation of cadmium-induced neurotoxicity despite persistent peripheral pathophysiology in the olfactory system[J]. Toxicological Science, 2012, 126(2): 534-544. DOI:10.1093/toxsci/kfs030.
[7] ANTHONY S, JENHIFER N S, CLEMENT G Y, et al. Cadmium chloride induces DNA damage and apoptosis of human liver carcinoma cells via oxidative stress[J]. International Journal of Environmental Research and Public Health, 2016, 13(1): 88. DOI:10.3390/ ijerph13010088.
[8] MONISHA J, TENZIN T, NARESH A, et al. Toxicity, mechanism and health effects of some heavy metals[J]. Interdisciplinary Toxicology,2014, 7(2): 60-72. DOI:10.2478/intox-2014-0009.
[9] LIU Y Z, XIAO T F, PHILIPPE C B, et al. Potential health risk in areas with high naturally-occurring cadmium background in southwestern China[J]. Ecotoxicology and Environmental Safety, 2015, 112(2): 122-131. DOI:10.1016/j.ecoenv.2014.10.022.
[10] ANATOLY N V, BORIS A K, VLADIMIR G P, et al. Some considerations concerning the theory of combined toxicity: a case study of subchronic experimental intoxication with cadmium and lead[J]. Food and Chemical Toxicology, 2014, 64(2): 144-156. DOI:10.1016/j.fct.2013.11.024.
[11] 晋海军, 徐铭键, 陈惠, 等. 火焰原子吸收法检测籽粒苋根中镉含量影响因素的响应面优化[J]. 分子植物育种, 2015, 24(9): 2100-2108. DOI:10.13271/j.mpb.013.002100.
[12] 傅亚平, 吴卫国. 湿法消解-石墨炉原子吸收光谱法测定大米中的镉[J]. 粮食与油脂, 2015, 28(10): 59-62. DOI:10.3969/ j.issn.1008-9578.2015.10.016.
[13] 刘璐, 杨祎, 曹庆芹, 等. 用电感耦合等离子体发射光谱法检测北方主栽板栗品种(系)矿质元素含量[J]. 北京农学院学报, 2015, 30(1): 4-9. DOI:10.13473/j.cnki.issn.1002-3186.2014.111.
[14] 高振杰, 高红霞, 刘英莉, 等. ICP-MS法测定5 种中药材粉剂中5 种重金属的含量[J]. 中国药房, 2015, 26(27): 3847-3849. DOI:10.6039/ j.issn.1001-0408.2015.27.37.
[15] DARWISH I A, BLAKE D A. Development and validation of a onestep immunoassay for determination of cadmium in human serum[J]. Analytical Chemistry, 2002, 74(1): 52-58. DOI:10.1021/ac010510r.
[16] KAZUHIRO S, NUNNARPAS Y. Cadmium purification and quantification using immunochromatography[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11): 4514-4519. DOI:10.1021/jf900155t.
[17] 刘艳梅, 钟辉, 黄建芳, 等. 直接竞争ELISA检测大米样品中的重金属镉[J]. 免疫学杂志, 2015, 31(6): 528-532. DOI:10.13431/j.cnki. immunol.j.20150112.
[18] 张海棠, 王申峰, 姜金庆, 等. 镉离子单克隆抗体的制备及其阻断ELISA检测方法的建立[J]. 中国生物制品学杂志, 2011, 24(2): 208-212. DOI:10.13200/j.cjb.2011.02.90.zhanght.016.
[19] 向军俭, 陈耀强, 唐勇, 等. 胶体金免疫层析法快速检测水样品中的镉离子[J]. 中国生物制品学杂志, 2010, 23(5): 529-532. DOI:10.13200/j.cjb.2010.05.87.xiangjj.011.
[20] KUANG H, XING C R, HAO C L, et al. Rapid and highly sensitive detection of lead ions in drinking water based on a strip immunosensor[J]. Sensors, 2013, 13(4): 4214-4224. DOI:10.3390/ s130404214.
[21] NAM G K, MYEONG A K, YOUNG I P, et al. Magnetic nanoparticle based purification and enzyme-linked immunosorbent assay using monoclonal antibody against enrofloxacin[J]. Journal of Veterinary Science, 2015, 16(4): 431-437. DOI:10.4142/jvs.2015.16.4.431.
[22] DAESUB S, GUNWOO H, WISSAM S, et al. Development and validation of a rapid immunochromatographic assay for detection of middle east respiratory syndrome coronavirus antigen in dromedary camels[J]. Journal of Clinical Microbiology, 2015, 53(4): 1178-1182. DOI:10.1128/JCM.03096-14.
[23] LIU X, XIANG J J, TANG Y, et al. Colloidal gold nanoparticle probe-based immunochromatographic assay for the rapid detection of chromium ions in water and serum samples[J]. Analytica Chimica Acta, 2012, 745: 99-105. DOI:10.1016/j.aca.2012.06.029.
[24] SREEPRIYA V, SHANTELL K, THOMAS T, et al. Detection of Cd (Ⅱ) using antibody-modified microcantilever sensors[J]. Ultramicroscopy, 2007, 107(12): 1123-1128. DOI:10.1016/ j.ultramic.2007.01.011.
[25] ZHOU C N, ZHANG X Y, HUANG X X, et al. Rapid detection of chloramphenicol residues in aquatic products using colloidal gold immunochromatographic assay[J]. Sensors, 2014, 14(11): 21872-21888. DOI:10.3390/s141121872.
[26] JONES R M, YU H, DELEHANTY J B, et al. Monoclonal antibodies that recognize minimal differences in the three-dimensional structures of metal-chelate complexes[J]. Bioconjugate Chemistry, 2002, 13(3): 408-415. DOI:10.1021/bc0155418.
Establishment and Preliminary Application of Colloidal Gold Immunochromatography for Detecting Heavy Metal Cadmium Ion in Foods
WANG Yanan1, WANG Xiaofei2, NIU Linlin1, LEI Zhuang1, ZHANG Haitang1, WANG Ziliang1,*
(1. College of Animal Science and Veterinary Medicine, Henan Institute of Science and Technology, Xinxiang 453003, China;2. Xinke College, Henan Institute of Science and Technology, Xinxiang 453003, China)
Objective: To establish a colloidal gold immunochromatographic assay (Cd2+-Strip) for detecting Cd2+residues in foods. Methods: Artificial hapten Cd2+-iEDTA was synthesized by using isotrhiocyanobenzyl-EDTA (iEDTA) to chelate Cd2+. The isothiocyanate method was used to conjugate Cd2+-iEDTA to BSA to obtain the artificial immunogen Cd2+-iEDTA-BSA. The coating antigen Cd2+-iEDTA-OVA was obtained in the same way. Both ICP-AES and SDS-PAGE were used to identify Cd2+-iEDTA-BSA. Balb/C mice were immunized with Cd2+-iEDTA-BSA and hybridoma lines that secreted anti-Cd2+-EDTA monoclonal antibody (mAb) were generated by cell fusion. A Cd2+test strip was established with Cd2+-EDTA mAb and its traits were tested. Results: Cd2+-iEDTA-BSA was synthesized successfully and its concentration of BSA and Cd2+was 7.1 mg/mL and 191.7 μg/mL respectively. Four hybridoma lines, namely 1A3C11, 2B7D8, 2E10G9,4F3E7, were screened out and 2E10G9 was found to be the best one. The dissociation constant (Ka) of 2E10G9 was 7.58 × 108L/mol and its sensitivity (IC50) was 16.3 μg/L, and it had little or no cross-reactivity with other metal ions, except for Hg2+-EDTA with 18.6%. The qualitative detection of Cd2+with the Cd2+test strip could be achieved in 10 minutes, with a limit of detection (LOD) of 5 μg/L. Its sensitivity was the same as that of competitive ELISA-Kit (Cd2+ELISA-Kit) and inductively coupled plasma atomic emission spectrometry (ICP-AES), and its coincidence rate was 100% as compared with Cd2+ELISA-Kit and ICP-AES. Conclusion: The high affinity and specificity Cd2+-EDTA mAb has successfully beengenerated and used to establish a Cd2+test strip with high sensitivity, specificity, rapidity and briefness. The test strip can be used for the rapid detection of Cd2+residues in foods.
cadmium ion; immunogen; monoclonal antibody; colloidal gold immunochromatographic assay; rapid detection
10.7506/spkx1002-6630-201618025
R392.33
A
1002-6630(2016)18-0152-07
王亚楠, 王晓斐, 牛琳琳, 等. 食品中镉离子胶体金免疫层析快速检测方法的建立及应用[J]. 食品科学, 2016, 37(18): 152-158. DOI:10.7506/spkx1002-6630-201618025. http://www.spkx.net.cn
WANG Yanan, WANG Xiaofei, NIU Linlin, et al. Establishment and preliminary application of colloidal gold immunochromatography for detecting heavy metal cadmium ion in foods[J]. Food Science, 2016, 37(18): 152-158. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618025. http://www.spkx.net.cn
2016-03-13
“十二五”国家科技支撑计划项目(2011BAK10B01;2014BAD13B05)
王亚楠(1989—),女,硕士研究生,研究方向为食品安全免疫检测。E-mail:792176339@qq.com
王自良(1966—),男,教授,博士,研究方向为免疫学与抗体工程。E-mail:wangziliang66@126.com

