蓝莓酒泥粗提物的制备及其生物活性
马艳弘,刘照亭,李亚辉,张宏志,黄开红
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;3.江苏丘陵地区镇江农业科学研究所,江苏 句容 212400)
蓝莓酒泥粗提物的制备及其生物活性
马艳弘1,2,刘照亭3,李亚辉1,张宏志1,黄开红1
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;3.江苏丘陵地区镇江农业科学研究所,江苏 句容 212400)
采用超声波辅助酶法提取制备蓝莓酒泥粗提物,研究粗提物的制备工艺并分析粗提物的抗氧化性及其对大鼠肝星状细胞HSC-T6细胞生长的影响。通过单因素试验和正交试验优化制备工艺,检测粗提物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、·OH的清除能力,并通过四甲基偶氮唑蓝增殖实验、Hoechst33258荧光染色、流式细胞术研究其对HSC-T6细胞增殖与凋亡的影响。结果表明:制备蓝莓酒泥粗提物的最佳超声条件为超声功率500 W、料液比1∶20(g/mL)、超声时间50 min、提取温度60 ℃,在此条件下多糖和花色苷的提取量分别为14.24 mg/g和6.13 mg/g。所制备的蓝莓酒泥粗提物对DPPH自由基和·OH具有一定的清除效果,并可显著抑制HSC-T6细胞增殖、诱导HSC-T6细胞凋亡,且在一定的质量浓度范围内,呈现出剂量-时间效应关系,表明蓝莓酒泥粗提物具有良好的抗氧化活性,并对HSC-T6细胞生长具有明显的抑制作用,具有潜在的抗肝纤维化能力。通过诱导HSC-T6细胞凋亡是蓝莓酒泥粗提物抑制细胞生长的作用途径之一。
蓝莓酒泥;制备;抗氧化;肝星状细胞HSC-T6
蓝莓属杜鹃花科(Ericaceae)、越橘属(Vaccinium spp.)植物,是21世纪功能性保健浆果,富含花青素、黄烷醇、酚酸等多种活性物质[1-2],有抗辐射、免疫调节、抗癌、抗氧化、抗炎、抗衰老、保护视力、软化血管等多种药理保健功能[3-7],堪称世界水果之王[8],被联合国粮农组织列为人类五大健康食品之一,具有极高的经济价值和开发前景。随着人们对蓝莓药理保健功能的认识,以蓝莓为原料的各种保健食品受到越来越多消费者的青睐。其中蓝莓酒因其营养丰富、酒体醇厚、色泽艳丽、口味绵长、香气宜人等特点而备受推崇[9]。
蓝莓酒泥为蓝莓酒酿造过程中沉积于罐底的废弃物,约占蓝莓酒产量的20%左右。据报道[10-12],酒泥中富含花青素、酵母多糖、超氧化物歧化酶(superoxide dismutase,SOD)、多酚等多种功能因子,具有很强的生物保健功能。但是目前80%的蓝莓酒泥直接排放,既容易造成环境污染又是对资源的极度浪费。随着蓝莓酒销量的不断提高,酒泥的产量也逐年增高,其开发利用已成为人们普遍关注的社会热点问题。明确其活性成分及生物功能对开发蓝莓酒泥功能食品具有重要意义。但目前有关蓝莓酒泥活性物质的高效制备与功能分析及其保健食品研发等方面的研究仍鲜见报道。
我国是肝病高发国家,有2 000多万的人群需要得到抗纤维化治疗,而通过食疗预防和治疗肝纤维化已经成为广大学者关注的焦点。据报道,氧化应激与肝纤维化密切相关[13],具有抗氧化活性的植物多糖和花青素均存在潜在的抗肝纤维化能力[14-15],且多糖与多糖、多糖与酚类、黄酮等物质在抗氧化、抗肿瘤、降血糖、调节免疫等方面具有协同增效作用[16-18]。因蓝莓酒泥中含有具有抗氧化活性的花色苷、多糖等物质,而肝星状细胞又为肝纤维化发生的中心环节,抑制其增殖并诱导其凋亡有利于肝纤维化的预防和治疗[15,19],因此本实验采用超声辅助技术联合酶解工艺制备同时含有蓝莓花色苷和多糖的蓝莓酒泥粗提物,探讨其抗氧化活性,并以大鼠肝星状细胞HSC-T6为模型,研究其对HSC-T6增殖、凋亡的影响,为降低酿酒副产物造成的环境污染,开发抗肝纤维化功能食品、提高蓝莓酒泥综合利用率提供理论依据。
1 材料与方法
1.1材料与试剂
蓝莓酒酒泥(兔眼蓝莓为原料的干红蓝莓酒酿造副产物) 江苏省句容万山红遍生物科技有限公司。
细胞株HSC-T6 上海拜力生物工程有限公司。
果胶酶HC(LALLZYME HC) 上海杰兔商贸有限公司;纤维素酶 宁夏和氏璧生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海源叶生物科技有限公司;·OH测定试剂盒 南京建成生物工程研究所;胎牛血清、PRMI 1640完全培养基 美国Gbico公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、0.25%胰蛋白酶 美国Hyclone公司;四甲基偶氮唑蓝(methylthiazoletetrazolium,MTT)、二甲基亚砜(dimethyl sulphoxide,DMSO) 美国Sigma公司;Hoechst33258染色液 碧云天生物技术研究所;Annexin V-FITC凋亡检测试剂盒 美国BD公司;无水乙醇、柠檬酸、盐酸、氯化钾、醋酸钠等均为分析纯试剂。
1.2仪器与设备
KH-500E超声波清洗器 昆山禾创超声仪器有限公司;FDU-1200型冷冻干燥机 日本东京理化器械株式会社;RE-5220型旋转蒸发仪 上海亚荣生化仪器;Epoch微孔板分光光度计 美国Bio Tek公司;细胞培养箱 美国Thermo Scientific公司;IX53倒置荧光显微镜 日本Olympus公司;BHC-1300IIA/B2型生物洁净安全柜 苏州净化设备有限公司;TDL-80-2C低速台式离心机 上海安亭科学仪器厂;MH-2微量振荡器其林贝尔公司;流失细胞仪 美国BD公司。
1.3方法
1.3.1蓝莓酒泥粗提物的制备
取蓝莓酒泥,3 000 r/min离心20 min,将沉淀真空冷冻干燥,粉碎,过80 目筛,称取5 g蓝莓酒泥冻干粉末,按照一定的固液比(g/mL)加水混合,再添加占干粉质量0.05%的果胶酶HC和0.4%的纤维素酶,混合均匀后用1%的柠檬酸溶液调节pH值至3,置于超声波细胞粉碎机,在超声功率500 W条件下、超声辅助提取不同时间,再于不同温度条件下静置提取1 h,然后离心过滤,滤渣再提取1 次,合并滤液,减压旋蒸浓缩后,再冷冻干燥即可得蓝莓酒泥粗提物。
1.3.2蓝莓酒泥花色苷和多糖含量的测定
多糖含量采用苯酚-硫酸法测定。以葡萄糖为标准品绘制标准曲线所得线性回归方程为:C=0.997A-0.000 7,R2=0.999 1,式中,C为葡萄糖质量浓度,A为吸光度。据标准曲线,计算样品多糖提取量。
花色苷含量采用pH示差法测定[20]。花青素提取量计算见公式(1)、(2):

式中:C为花色苷提取量/(mg/g);V为提取液总体积/mL;n为稀释倍数;Mr为矢车菊苏-3-葡萄糖苷相对分子质量,449.2;ε为矢车菊苏-3-葡萄糖苷的消光系数,26 900 L/moL;m为样品质量/g;l为光程,1 cm。
1.3.3蓝莓酒泥粗提物制备工艺单因素试验
以蓝莓花色苷和多糖提取量为考察目标,分别考察500 W超声功率条件下不同料液比和超声时间以及提取温度对蓝莓酒泥粗提物制备的影响。

表1 单因素试验设计Table1 One-factor-at-a-time design
1.3.4蓝莓酒泥粗提物制备工艺正交试验
在单因素试验基础上,以料液比、超声时间、提取温度为因素,采用L9(34)正交试验设计方案,以多糖提取量和花色苷提取量为考察指标,进一步优化蓝莓酒泥粗提物制备工艺,其因素水平见表2。

表2 L9(34)正交试验因素与水平Table2 Factors and their coded levels used for orthogonal array design
1.3.5体外抗氧化能力检测
1.3.5.1DPPH自由基清除能力测定
参照Atoui等[21]的测定方法。配制不同质量浓度的蓝莓酒泥粗提物溶液,各取2 mL于刻度试管,每管加2×10-4mol/L DPPH溶液2 mL,摇匀后避光放置30 min,取上清液,测定517 nm波长处的吸光度。实验设空白组、对照组、实验组。DPPH自由基清除率计算见公式(3):
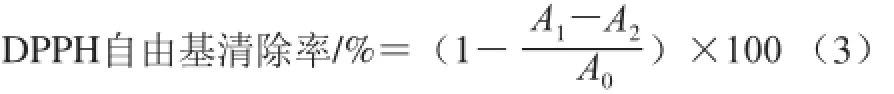
式中:A1为实验组吸光度;A2为对照组吸光度;A0为空白组吸光度。
1.3.5.2·OH清除能力测定
分别取500 μL不同质量浓度的蓝莓酒泥粗提物水溶液,按试剂盒说明书操作。其呈色与·OH的多少呈正比关系,即吸光度越小,样品对·OH的清除能力越强。·OH抑制能力计算见公式(4):

1.3.6HSC-T6细胞增殖抑制率测定
采用MTT比色法进行测定[22]。取对数生长期的HSC-T6细胞,胰酶消化后制成单细胞悬液,调整其密度为5×104个/mL,接种于96 孔板恒温培养24 h,再换无血清培养基继续孵育12 h,再加入蓝莓酒泥粗提物,使其终质量浓度分别为50、100、150、200、 250 μg/mL,待干预24、48、72 h后,每孔加入20 μL的MTT(5 mg/mL)溶液,继续培养4 h后吸去上清液,再加入150 μL DMSO,待结晶物充分溶解后用酶标仪在490 nm波长处测定各孔吸光度。重复3 次,计算细胞增殖抑制率和抑制率为50%时的粗提物浓度,即IC50值。细胞增殖抑制率见式(5):
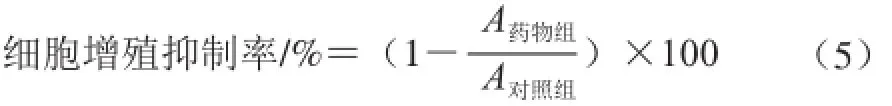
1.3.7Hoechst33258染色观察HSC-T6细胞形态
取对数生长期的HSC-T6细胞,胰酶消化后制成单细胞悬液,PRMI 1640培养液调整细胞密度为2×105个/mL,每孔200 μL接种于96 孔板,培养24 h后换无血清培养基继续孵育12 h,再加入蓝莓酒泥粗提物刺激,使终质量浓度分别为50、100、150、200、250 μg/mL,24 h后弃上清液,加入150 μL固定液固定,清洗,Hoechst33258染色液染色后,于荧光倒置显微镜观察细胞形态。
1.3.8流式细胞仪检测HSC-T6细胞凋亡率
取对数生长期的HSC-T6细胞,胰酶消化后制成单细胞悬液,用PRMI 1640培养基调整细胞密度为2.5×105个/mL,每孔2 mL接种于6 孔板,置于培养箱中培养24 h;待细胞贴壁后换无血清培养基继续孵育12 h,再分别加入含不同质量浓度(50、100、150、200、250 μg/mL)的蓝莓酒泥提取物的培养液各2 mL,以PRMI 1640培养液为空白对照,培养24 h;24 h后弃上清液,胰酶消化后制成单细胞悬液,使用预冷PBS清洗2 次,1000 r/min离心5 min,去上清液,按照Annexin V-FITC凋亡检测试剂盒操作指南处理后立即用流式细胞仪检测。
1.4数据分析
利用SPSS 18.0和Design-Expert V 8.0数据处理软件进行数据处理即统计分析。
2 结果与分析
2.1粗提物制备工艺的单因素试验结果

图1 料液比对蓝莓酒泥花色苷和多糖提取量的影响Fig.1 Effect of solid/liquid ratio on the extraction rates of anthocyanins and polysaccharides from blueberry wine lees
2.1.1料液比对蓝莓酒泥粗提物花色苷与多糖提取量的影响由图1可知,多糖和花色苷提取量随料液比的升高而大幅升高,但当料液比达到1∶30(g/mL)后,继续增大提取液体积,花色苷和多糖的溶出量增加缓慢而逐渐趋于平缓。可见提取液越多,物质的传质推动力越大,越有利于物质的浸出。但料液比达到一定值后,绝大部分花色苷与多糖物质已经溶出,继续增大溶剂量,提取量不仅不会显著提高,而且还会增大后续浓缩的难度,因此1∶30左右为制备蓝莓酒泥粗提物的最佳料液比。
2.1.2超声时间对蓝莓酒泥粗提物花色苷与多糖提取量的影响

图2 超声时间对蓝莓酒泥花色苷和多糖提取量的影响Fig.2 Effect of ultrasonication time on the extraction rates of anthocyanins and polysaccharides from blueberry wine lees
由图2可见,随着超声时间的延长,粗提物中多糖和花色苷的提取量均增大,花色苷提取量在超声时间大于40 min后基本平缓,而多糖提取量在超声时间大于50 min后增加速度已相对变缓。综合考虑将50 min左右作为制备蓝莓酒泥粗提物的适宜超声时间。
2.1.3提取温度对蓝莓酒泥粗提物花色苷与多糖提取量的影响
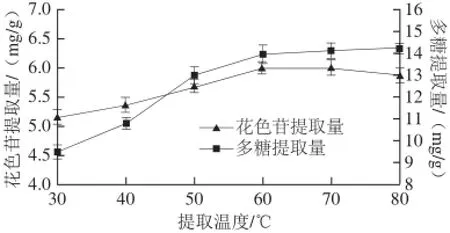
图3 提取温度对蓝莓酒泥花色苷和多糖提取量的影响Fig.3 Effect of extract temperature on the extraction rates of anthocyanins and polysaccharides from blueberry wine lees
由图3可见,小于60 ℃温度范围内多糖和花色苷提取量均随着提取温度的升高而提高,提取温度大于60 ℃后,多糖提取量逐渐趋于平缓而花色苷的提取量开始下降。原因是温度过高导致了少部分花色苷结构发生变化,使得提取量下降,因此综合比较可选60 ℃为蓝莓酒泥粗提取的制备温度,此温度条件下蓝莓酒泥粗提物中的多糖和花色苷含量均较高。
2.2粗提物制备工艺正交试验优化结果

表3 L49(3)正交试验设计及结果Table3 L49(3) orthogonal array arrangement and experimental results
在单因素试验基础上,采用L9(34)正交试验设计方案进一步优化蓝莓酒泥粗提物制备工艺。由表3极差分析结果可见:影响多糖提取量的主要因素是B(超声时间)和C(提取温度),其次是A(料液比),各因素对多糖提取率影响的主次顺次是B=C>A,最优组合为A3B2C3;影响花色苷提取量的主要因素是B(超声时间),其次是C(提取温度),A(料液比)的影响最小,各因素对花色苷提取量影响的主次顺次是B>C>A,最优组合为A2B2C2。
因2 个组合均不在正交表安排的试验中,故需按照上述工艺条件对2 个组合平行做3 次验证实验,并以未进行超声提取但其他条件相同的处理为对照,测定蓝莓酒泥中多糖和花色苷的提取量,结果发现未经超声处理的对照组多糖提取量为12.66 mg/g,花色苷提取量为4.87 mg/g,按照A2B2C2组合进行提取时,多糖和花色苷的提取量均最高,分别达14.28 mg/g和6.16 mg/g,该结果与表3中的2号组合A1B2C2的多糖提取量为14.24 mg/g、花色苷提取量为6.13 mg/g并无显著差异,考虑到料液比过大会增加后续浓缩成本,从经济节能的角度综合考虑,确定将A1B2C2确定为最佳组合。在此条件下制备的蓝莓酒泥粗提物,比未进行超声处理的多糖和花色苷提取量分别提高了12.48%和25.87%。
2.3蓝莓酒泥粗提物抗氧化活性分析
2.3.1蓝莓酒泥粗提物的DPPH自由基清除能力
由图4可知,蓝莓酒泥粗提物对DPPH自由基具有一定的清除作用,且随着质量浓度的提高,DPPH自由基清除率不断提高,当质量浓度达160 μg/mL时,其自由基清除率达80.54%,但其效果弱于阳性对照VC。

图4 粗提物的DPPH自由基清除能力Fig.4 DPPH radical scavenging capacity of crude extract from blueberry wine lees
2.3.2蓝莓酒泥粗提物的·OH清除能力

图5 粗提物的·OH清除能力Fig.5 Hydroxyl radical scavenging capacity of crude extract from blueberry wine lees
由图5可知,蓝莓酒泥粗提物对·OH清除作用较强,且随着质量浓度的提高,·OH清除率不断提高,当质量浓度达160 μg/mL时,·OH清除率达82.07%,与相同质量浓度的阳性对照VC的·OH清除率85.37%相比并无明显差异。
2.4蓝莓酒泥粗提物对HSC-T6细胞生长的抑制作用

图6 粗提物对HSC-T6细胞生长的抑制作用Fig.6 Inhibitory effect of crude extract from blueberry wine lees on HSC-T6 cells
如图6所示,MTT检测结果显示:50、100、150、200、250 μg/mL的蓝莓酒泥提取物均能抑制HSC-T6细胞增殖,且在一定的质量浓度范围内,呈现一定的剂量-时间效应关系。在24、48、72 h时,粗提物对细胞的生长抑制率分别达19.34%~67.66%、32.59%~84.37%、47.91%~91.49%,细胞的IC50分别为165.23、142.34、67.57 μg/mL。
2.5蓝莓酒泥粗提物对HSC-T6细胞凋亡的诱导作用

图7 细胞形态学观察结果(×100)Fig.7 Morphological observation of cells challenged for 24 h with the crude extract (× 100)
2.5.1荧光染色结果细胞经Hoechst33258染色后,荧光显微镜下观察
HSC-T6经不同质量浓度蓝莓酒泥粗提物刺激24 h后的细胞形态学变化,由图7可知,对照组的细胞形态均一,发出均匀淡蓝色荧光(图7未显示颜色),为正常活细胞。而各加药组部分细胞着色不均匀呈致密浓染、或出现细胞核固缩、断裂等典型凋亡特征。且随着粗提物质量浓度增大,贴壁细胞逐渐减少、颜色发白的凋亡细胞数量增加。可见,蓝莓酒泥粗提物会诱导HSC-T6细胞形态发生明显变化。
2.5.2细胞凋亡率检测结果
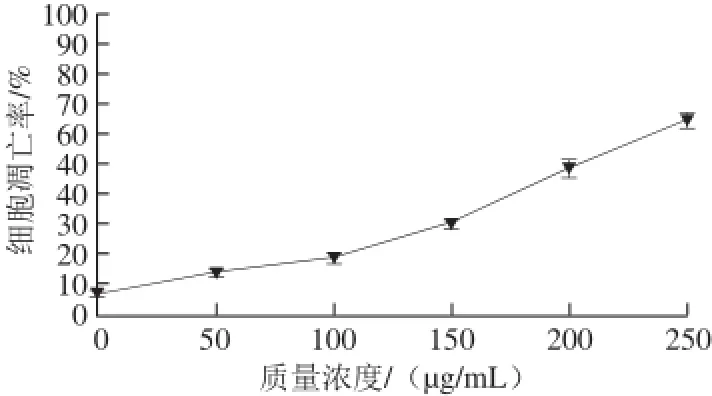
图8 蓝莓酒泥提取物对HSC-T6细胞凋亡率的影响Fig.8 Effect of crude extract from blueberry wine lees on apoptosis rates of HSC-T6 cells
由图8可知,蓝莓酒泥粗提物可显著诱导细胞凋亡,随着提取物质量浓度的增大,细胞凋亡率逐渐上升,细胞在蓝莓酒泥提取物质量浓度为50、100、150、200、250 μg/mL的(PRMI 1640培养液)环境中培养24 h,细胞的凋亡率分别达14.23%、19.44%、30.98%、49.31%、65.32%,与没有添加蓝莓酒泥粗提物的对照相凋亡率7.96%相比,均有显著提高。

图9 蓝莓酒泥提取物对HSC-T6细胞凋亡的荧光染色观察Fig.9 Apotosis induction in HSC-T6 cells by crude extract from blueberry wine lees observed by fluorescence staining
图9荧光染色观察结果与细胞凋亡率检测结果显示,蓝莓酒泥粗提物可通过诱导HSC-T6细胞凋亡来抑制其细胞增殖。
3 结 论
近年来超声波辅助提取技术因其可有效破碎植物细胞壁,具有活性物质溶出快、操作简便、提取时间短、产率高等优点在活性物质提取中得到了广泛应用[23-25]。本实验受中药多维组合药物可协同发挥疗效的启发,改变了以往单独提取花色苷或多糖等单一组分的思路,采用酶法超声辅助法制备同时具有花色苷和多糖的蓝莓酒泥粗提物,并通过单因素试验和正交试验优化制备工艺,结果表明各因素对粗提物制备工艺的影响主次顺序依次为超声时间>提物温度>料液比;最佳制备工艺为:按料液比1∶20混合,再添加占干粉质量0.05%的果胶酶HC和0.4%的纤维素酶,用1%的柠檬酸溶液调节pH值至3,于超声功率500 W条件下超声提取时间50 min、超声提取后于60 ℃条件下避光提取1 h,连续提取2 次。在此条件下蓝莓花色苷含量提取量达6.13 mg/g,多糖提取量达14.24 mg/g。
肝纤维化是危害人类健康的重要肝脏疾病,近年来其发病率在全球范围内持续升高,但迄今为止,仍然没有满意的治疗方法。大量研究[26-27]表明,自由基损伤是肝纤维化的重要发病机制之一。抗氧化剂能通过提高SOD、谷胱甘肽过氧化物酶等抗氧化酶活性从而有效降低自由基对机体造成的氧化损伤,抑制肝脏中胶原的合成与分泌,减缓或逆转肝纤维化的进程。因此探寻安全高效的抗氧化剂是治疗、预防肝纤维化的重要途径。本实验通过体外抗氧化活性检测发现,所制备的蓝莓酒泥粗提物具有明显自由基清除能力。质量浓度为160 μg/mL蓝莓酒泥粗提物对DPPH自由基和·OH的清除能力分别达80.54%和82.07%,尤其是其对·OH的清除能力几乎与VC的·OH清除能力相差无几。预示着蓝莓酒泥提取物具有较高的抗氧化活性,可能在肝纤维化的防治中发挥重要作用。
肝星状细胞的激活、增殖、分泌大量胶原被认为是肝纤维化病理机制的中心环节[28-29]。抑制肝星状细胞增殖并促进其凋亡通常会作为预防治疗肝纤维化的首选策略[30-31]。为了评价蓝莓酒泥粗提物对肝纤维化化的防治效果,本实验以活化的大鼠肝星状细胞HSC-T6为模型,分析了其对细胞增殖和凋亡的影响。结果发现该蓝莓酒泥粗提物还能显著抑制HSC-T6细胞的增殖,在24、48、72 h时,在50~250 μg/mL质量浓度范围内,抑制率呈现明显的剂量-时间效应关系;蓝莓酒泥粗提物作用于细胞的IC50分别为165.23、142.34、67.57 μg/mL。Hoechst33258染色结果与细胞凋亡率检测结果显示,通过诱导细胞凋亡是蓝莓酒泥粗提物抑制HSC-T6细胞增殖的作用途径之一。但其具体的作用机制仍需要继续深入研究。
综上所述,蓝莓酒泥粗提物具有一定的抗氧化能力,其在一定质量浓度范围内,能有效抑制肝星状细胞HSC-T6增殖,本实验以蓝莓酒泥为原料制备同时含有蓝莓花色苷和活性多糖的蓝莓酒泥粗提物,为蓝莓酒泥的开发利用提供了一条新的技术途径。制备蓝莓酒泥粗提物,既可为蓝莓酒加工副产物的高值化利用提供一条新的途径,又能为抗肝纤维化保健食品的开发应用提供新的原料来源。
[1] 胡雅馨, 李京, 惠伯棣. 蓝莓果实中主要营养及花青素成分的研究[J]. 食品科学, 2006, 27(10): 600-603. DOI:10.3321/ j.issn:1002-6630.2006.10.154.
[2] KONG J M, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64(5): 923-933. DOI:10.1016/S0031-9422(03)00438-2.
[3] 陈沙, 张凤英, 罗秋水, 等. 越橘抗紫外线和微波辐射作用的研究[J]. 中国食品学报, 2012, 12(1): 124-128. DOI:10.3969/ j.issn.1009-7848.2012.01.019.
[4] 郜海燕, 徐龙, 陈杭君, 等. 蓝莓采后品质调控和抗氧化研究进展[J]. 中国食品学报, 2013, 13(6): 1-7. DOI:10.16429/j.1009-7848.2013.06.007.
[5] WANG L S, STONER G D. Anthocyanins and their role in cancer prevention[J]. Cancer Letters, 2008, 269(2): 281-290. DOI:10.1016/ j.canlet.2008.05.020.
[6] WANG S Y, CHEN H, EHLENFELDT M K. Variation in antioxidant enzyme activities and nonenzyme components among cultivars of rabbiteye blueberries (Vaccinium ashei Reade) and V. ashei derivatives[J]. Food Chemistry, 2011, 129(1): 13-20. DOI:10.1016/ j.foodchem.2010.11.126.
[7] LACOMB A, WU V C H, WHITE J, et al. The antimicrobial properties of the lowbush blueberry (Vaccinium angustifolium) fractional components against foodborne pathogens and the conservation of probiotic Lactobacillus rhamnosus[J]. Food Microbiology, 2012,30(1): 124-131. DOI:10.1016/j.fm.2011.10.006.
[8] BREMER V, CRISOSTO G, CRISOSTO C H, et a1. San Joaquin Valley blueberries evaluated for quality at-tributes[J]. Califomia Agriculture, 2008, 62: 58-62. DOI:10.3733/ca.v062n03p91.
[9] SU Minsheng, CHIEN P J. Antioxidant activity, anthocyanins and phenolics of rabbiteye blueberry (Vaccinium ashei) fluid products as affected by fermentation[J]. Food Chemistry, 2007, 104: 182-187. DOI:10.1016/j.foodchem.2006.11.021.
[10] DEVESA R R, VECINO X, BARRAL M T, et al. Valorization of winery waste vs. the costs of not recycling[J]. Waste Management,2011, 31(11): 2327-2335. DOI:10.1016/j.wasman.2011.06.001.
[11] PEREZ-SERRADILLA J A, LUQUE-CASTRO M D. Role of lees in wine production: a review[J]. Food Chemistry, 2008, 111(2): 447-456. DOI:10.1016/j.foodchem.2008.04.019.
[12] NERANTZIS E T, TATARIDIS P. Integrated enology-utilization of winery by-products into high added value products[J]. Journal of Food Science and Technology, 2006, 43(3): 1-12.
[13] 李丰衣, 张琳, 聂为民. 氧化应激在肝纤维化发展过程中的作用[J]. 中华中医药学刊, 2012, 30(4): 720-722. DOI:10.13193/ j.archtcm.2012.04.50.lify.081.
[14] YANG Xingbin, YANG Su, GUO Yurong, et al. Compositional characterisation of soluble apple polysaccharides, and their antioxidant and hepatoprotective effects on acute CCl4-caused liver damage in mice[J]. Food Chemistry, 2013, 138(2): 1256-1264. DOI:10.1016/ j.foodchem.2012.10.030.
[15] CHOI J H, PIL H Y , CHOI C Y, et al. Anti-fibrotic effects of the anthocyanins isolated from the purple-fleshed sweet potato on hepatic fibrosis induced by dimethylnitrosamine administration in rats[J]. Food and Chemical Toxicology, 2010, 48(11): 3137-3143. DOI:10.1016/ j.fct.2010.08.009.
[16] 白海娜, 王振宇, 刘瑞海, 等. 白藜芦醇与黑木耳多糖协同清除ABTS自由基活性的研究[J]. 现代食品科技, 2014, 30(3): 64-68. DOI:10.13982/j.mfst.1673-9078.2014.03.043.
[17] 刘安军, 邓颖, 王雅静. 茶多糖及协同因子的降血糖作用研究[J]. 现代食品科技, 2012, 28(2): 139-141. DOI:10.13982/ j.mfst.1673-9078.2012.02.001.
[18] 谢好贵, 韦明钎, 陈美珍, 等. 3 种多糖复合体外抗肿瘤协同增效作用[J]. 食品科学, 2013, 34(15): 289-294. DOI:10.13982/ j.mfst.1673-9078.2012.02.001.
[19] FRIEDMAN S L. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008, 134(6): 1655-1669. DOI:10.1053/ j.gastro.2008.03.003.
[20] 宋德群, 孟宪军, 王晨阳. 蓝莓花色苷的pH示差法测定[J]. 沈阳农业大学学报, 2013, 44(2): 231-233. DOI:10.3969/j.issn.1000-1700.2013.02.019.
[21] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005, 89(1): 27-36. DOI:10.1016/j.foodchem.2004.01.075.
[22] 梁曾恩妮, 易有金, 郭雨桐, 等. 灵芝多糖联合5-FU对人结肠癌HCT-116细胞增殖及凋亡的影响[J]. 食品科学, 2012, 33(19): 310-313.
[23] 刘晓鹏, 姜宁, 向东山, 等. 库拉索芦荟多糖超声辅助提取工艺的研究[J]. 食品科学, 2008, 29(10): 286-289. DOI:10.3321/ j.issn:1002-6630.2008.10.064.
[24] ZHANG Lianfu, LIU Zelong. Optimization and comparison of ultrasound/microwave assisted extraction (UMAE) and ultrasonic assisted extraction (UAE) of lycopene from tomatoes[J]. Ultrasonics Sonochemistry, 2008, 15(5): 731-737. DOI:10.1016/ j.ultsonch.2007.12.001.
[25] 李亚辉, 马艳弘, 黄开红, 等. 响应面法优化复合酶提取芦荟多糖工艺及其抗氧化活性分析[J]. 食品科学, 2014, 35(18): 63-68. DOI:10.7506/spkx1002-6630-201418012.
[26] PINZANI M, ROMBOUTS K. Liver fibrosis: from the bench to clinical targets[J]. Digestive and Liver Disease, 2004, 36(4): 231-242. DOI:10.1016/j.dld.2004.01.003.
[27] HANADA S, HARADA M, KUMEMURA H, et al. Oxidative stress induces the endoplasmic reticulum stress and facilitates inclusion formation in cultured cells[J]. Journal of Hepatology, 2007, 47(1): 93-102. DOI:10.1016/j.jhep.2007.01.039.
[28] FRIEDMAN S L. Mechanisms of disease: mechanisms of hepatic fibrosis and therapeutic implications[J]. Nature Clinical Practice Gastroenterology and Hepatology, 2004, 1(2): 98-105. DOI:10.1038/ ncpgasthep0055.
[29] FRIEDMAN S L. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver[J]. Physiological Reviews, 2008, 88(1): 125-172. DOI:10.1152/physrev.00013.2007.
[30] PENG Longxi, FANG Buwu, WANG Yuan, et al. Expression of p53 in the effects of artesunate on induction of apoptosis and inhibition of proliferation in rat primary hepatic stellate cells[J]. PLoS ONE, 2011,6(10): 1-9. DOI:10.1371/journal.pone.0026500.
[31] MADAN K P, NAVEEN K P, DEVARAJ H, et al. Morin, a dietary flavonoid, exhibits anti-fibrotic effect and induces apoptosis activated hepatic stellate cells by suppressing canonical NF-KB signaling[J]. Biochimie, 2015, 110(8): 107-118. DOI:10.1016/j.biochi.2015.01.002.
Preparation and Biological Activities of Crude Extract from Blueberry Wine Lees
MA Yanhong1,2, LIU Zhaoting3, LI Yahui1, ZHANG Hongzhi1, HUANG Kaihong1
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;3. Zhenjiang Institute of Agricultural Sciences in Jiangsu Hilly Areas, Jurong 212400, China)
The study focused on the preparation of crude extract from blueberry wine lees by ultrasound-assisted enzymatic extraction. The antioxidant activity and growth inhibitory effect on HSC-T6 cells of the crude extract on were also evaluated. The optimization of the extraction conditions was performed using one-factor-at-a-time and orthogonal array design. Subsequently, 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical and hydroxyl radical scavenging capacities were measured to evaluate antioxidant activity, and the growth inhibitory effect of crude extracts on HSC-T6 cells was assessed by methylthiazoletetrazolium (MTT) colorimetric assay, Hoechst 33258 fluorescence staining, and flow cytometry. The optimal extraction conditions were determined as follows: ultrasonic power, 500 W; solid/liquid ratio,1:20 (g/mL); ultrasonication time, 50 min; and extraction temperature, 60 ℃. Under these conditions, the extraction rates of polysaccharides and anthocyanins reached 14.24 and 6.13 mg/g, respectively. The crude extract from blueberry wine lees showed good antioxidant activity and its inhibitory effect on the proliferation of HSC-T6 cells was found to be dose- and time-dependent. Therefore, the crude extract has high antioxidant activity and significant anti-hepatic fibrosis activity and it also can inhibit the growth of HSC-T6 cells in vitro, which is partly attributed to its ability to induce cell apoptosis.
blueberry wine lees; preparation; antioxidant activity; HSC-T6 cells
10.7506/spkx1002-6630-201618006
TS201.4
A
1002-6630(2016)18-0034-07
马艳弘, 刘照亭, 李亚辉, 等. 蓝莓酒泥粗提物的制备及其生物活性[J]. 食品科学, 2016, 37(18): 34-40. DOI:10.7506/ spkx1002-6630-201618006. http://www.spkx.net.cn
MA Yanhong, LIU Zhaoting, LI Yahui, et al. Preparation and biological activities of crude extract from blueberry wine lees[J]. Food Science, 2016, 37(18): 34-40. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618006. http://www.spkx.net.cn
2015-11-21
江苏省自然科学基金项目(BK2012786);江苏省重点研发计划(现代农业)项目(BE2015350);江南大学食品科学与技术国家重点实验室开放课题(SKLF-KF-201504)
马艳弘(1972—),女,副研究员,博士,研究方向为营养与食品功能因子、农副产品综合利用。E-mail:ma_yhhyy@126.com

