复合重组磷脂酶用于大豆油脱胶的工艺优化
程 实,王长坤,张 梁,*,李 赢,石贵阳,杨盛荣,陈国安
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.无锡江大百泰科技有限公司,江苏 无锡 214122)
复合重组磷脂酶用于大豆油脱胶的工艺优化
程实1,2,王长坤1,2,张梁1,2,*,李赢2,石贵阳2,杨盛荣3,陈国安3
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.无锡江大百泰科技有限公司,江苏 无锡 214122)
利用实验室前期构建的重组大肠杆菌所产磷脂酶A1(phospholipase A1,PLA1)和磷脂酶C(phospholipase C,PLC)进行大豆油酶法脱胶研究,探讨自主开发重组酶进行酶法脱胶的可行性。以诺维信商品酶Lecitase Ultra™为对照,研究酶法脱胶反应温度、反应pH值、反应时间、搅拌速率、复合磷脂酶添加量工艺参数对大豆油脱胶的影响,并采用正交试验对脱胶工艺条件进行优化。研究结果表明,大豆油复合酶法脱胶的最佳工艺参数为:反应温度45 ℃、反应pH 6.5、反应时间3 h、搅拌速率300 r/min、PLA1和PLC添加量分别为7 940 U/kg和23 130 U/kg。复合磷脂酶对大豆油脱胶的效果与诺维信商品酶Lecitase Ultra™基本一致,大豆油磷含量可降至5 mg/kg以下,能够满足物理精炼的要求,为进一步开发具有知识产权的食品级油脂脱胶用酶制剂产品提供了理论依据。
重组大肠杆菌;复合磷脂酶;大豆油;酶法脱胶;正交试验
在油脂加工工艺中,油脂脱胶是油脂精炼过程中一道重要的工序,脱胶主要是脱除毛油中的磷脂,良好的脱胶效果是油脂物理精炼的前提,若脱胶不完全,则会加重后续工艺的负担,造成设备结焦损坏,影响精炼的经济效益和油脂产品的质量[1]。
油脂中的磷脂主要分为水化磷脂和非水化磷脂两大类,传统脱胶方法如水化脱胶等可以除去水化磷脂,但很难除去非水化磷脂。而酶法脱胶技术通过添加磷脂酶,使非水化磷脂水解成溶血性磷脂,溶血性磷脂具有良好的亲水性,可以利用水化方法去除。此法减少了精炼过程中酸碱的用量和废水的排放量,提高了生产效率,降低了经济成本[2-3]。如今随着人们对环保要求的进一步提高和酶工程技术的飞速发展,尤其利用现代生物技术开发出一些具有更优性能的酶[4-5],酶法脱胶日益显示出明显优势和发展潜力。
油脂脱胶工业中应用最为广泛的是磷脂酶A1(phospholipase A1,PLA1)和磷脂酶C(phospholipase C,PLC),近年来该领域的研究主要包括对产磷脂酶微生物的筛选和构建[6-7],以及对新型磷脂酶脱胶工艺条件的优化[8]。磷脂酶应用于油脂脱胶的研究受到越来越多的关注,尤其是可以利用发酵法对微生物来源的磷脂酶进行大规模生产以后[9],国外方面越来越深入地研究了磷脂酶的植物油脱胶应用[10-12],并开发出了多种脱胶效果理想的磷脂酶,主要有诺维信公司推出的Lecitase Novo[13]和Lecitase Ultra[14],以及帝斯曼公司生产的PLC产品Purifine[15]等。国内也有一些自主研发的磷脂酶应用于油脂脱胶的研究[16],但存在一些不足:大多数PLA1脱胶时间较长,至少需4 h;多数PLC因其只对磷脂酰胆碱和磷脂酰乙醇胺具有较高的特异性,而对磷脂酰肌醇等活性较低,致使脱胶不完全[17]。本研究使用实验室自主开发的重组磷脂酶PLA1[18]和PLC[19]复配后制成复合酶,并通过设计正交试验探索了复合酶对大豆毛油脱胶的最优条件,以期综合两种磷脂酶各自的脱胶优势,实现脱胶效率和脱胶效果的双重提升,从而为进一步完善酶法脱胶工艺及其工业应用提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1菌种
重组菌E. coli BL21(DE3)/pET28a-pla和E. coli BL21(DE3)/pET28a-plcH为本实验室保藏。
1.1.2培养基配制
PLA1发酵种子培养基:蛋白胨10 g/L,酵母粉5 g/L,葡萄糖8 g/L,25 mmol/L Na2HPO4,25 mmol/L KH2PO4,50 mmol/L NH4Cl,5 mmol/L Na2SO4,2 mmol/L MgSO4,自然pH值。1×105Pa高压灭菌20 min。
PLA1发酵诱导培养基:蛋白胨10 g/L,酵母粉5 g/L,甘油5 g/L,葡萄糖0.5 g/L,乳糖2 g/L,25 mmol/L Na2HPO4,25 mmol/L KH2PO4,50 mmol/L NH4Cl,5 mmol/L Na2SO4,2 mmol/L MgSO4,自然pH值,1×105Pa高压灭菌20 min。
LB(Luria-Bertani)培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L,自然pH值,1×105Pa高压灭菌20 min。
1.1.3原料与试剂
大豆毛油 中粮东海粮油工业有限公司;Lecitase Ultra™ 美国Novozymes公司;卡那霉素 美国Amresco公司;其他试剂均为国产分析纯。
1.2仪器与设备
V-1200分光光度计 尤尼科上海仪器有限公司;VCX-750型超声波细胞破碎仪 美国Sonic & Materials有限公司;HH-2型数显恒温水浴锅 江苏荣华仪器制造有限公司;CT16RE型高速冷冻离心机 日立中国有限公司;强力电动搅拌器 常州市国华电器有限公司;KSW型马弗炉 上海电理仪器厂。
1.3方法
1.3.1粗酶液的制备
将E. coli BL21(DE3)/pET28a-pla菌株活化后接种至含卡纳霉素(终质量浓度100 mg/L)的种子培养基,37 ℃、200 r/min的摇床振荡培养8~10 h;按5%接种量转接至含卡纳霉素(终质量浓度100 mg/L)的发酵诱导培养基,37 ℃、200 r/min的摇床培养24 h,取发酵液于6 000 r/min离心3 min,收集离心上清液即为PLA1粗酶液[18]。
将E. coli BL21(DE3)/pET28a-plcH菌株活化后接入到30 mL含卡纳霉素(终质量浓度100 mg/L)的LB培养基中,于37 ℃、200 r/min振荡培养10 h,以5%转接量接种至50 mL含卡纳霉素(终质量浓度100 mg/L)的LB培养基中,37 ℃、200 r/min培养4 h后,添加乳糖至终质量浓度为0.05 g/L,在25 ℃、150 r/min诱导培养14 h。取发酵液于6 000 r/min离心10 min,收集细胞,并用25 mmol/L pH 7.4 Tris-HCl缓冲液重悬进行超声破碎。破碎液经8 000 r/min离心20 min,收集上清液,即为PLC粗酶液[19]。
PLA1和PLC粗酶液的实测酶活性[20-21]分别为662 U/mL和826 U/mL。其中,PLA1酶活单位定义为:pH 7.0、40 ℃条件下,每分钟产生1 μmol棕榈酸所需的酶量;PLC酶活单位定义为:pH 7.2、37 ℃条件下,每分钟水解对硝基磷酸胆碱产生1 nmol对硝基苯酚所需的酶量。
1.3.2磷含量测定
取油样约5 mL,在10 000 r/min条件下离心10 min,取3 g上层油样测定磷含量,油脂中磷含量的测定参照GB/T 5537—2008《粮油检验:磷脂含量的测定》。
1.3.3油相pH值的测定
取酸处理后的油水混合物40 g置于50 mL离心管,5 000 r/min离心10 min,弃去上层油相,向沉淀中加入5 mL蒸馏水,充分搅拌混合后,5 000 r/min离心10 min,取离心管中水相测定pH值,采用油相pH 5左右时的经验校正公式计算出油相pH值,油相pH值为离心管中水相测定pH值减去0.3。
1.3.4酶法脱胶工艺
准确称取50 g大豆毛油于250 mL具塞三角烧瓶中,水浴加热至80 ℃,加入质量分数为45%的柠檬酸60 μL,在80 ℃水浴500 r/min条件下进行酸处理20 min。结束后冷却至预设的温度,加入质量分数4% NaOH溶液混匀调节pH值,再加入蒸馏水和磷脂酶的粗酶液,于10 000 r/min高剪切混合1 min。然后在一定的搅拌速率和温度条件下进行酶解脱胶,定时取样,将样品放于90 ℃热水中灭酶10 min,再进行含磷量分析。酶添加量定义为每千克大豆毛油脱胶所加入PLA1或PLC的酶活单位,单位为U/kg。
1.3.5单一酶脱胶实验
分别研究PLA1、PLC和诺维信商品酶Lecitase Ultra™应用于大豆油酶法脱胶过程中,加水量、反应温度、反应pH值、反应时间、搅拌速率、酶添加量因素对脱胶效果的影响,并确定了PLA1、PLC及Lecitase Ultra™单一酶大豆毛油脱胶的最适反应条件。
1.3.6复合酶脱胶单因素试验
1.3.6.1反应温度对复合酶脱胶的影响
在复合酶体系中PLA1和PLC添加量分别13 240 U/kg和16 520 U/kg、pH 6.0、搅拌速率250 r/min的条件下,分别于35、40、45、50、55、60、65 ℃脱胶反应3 h后,取样测定脱胶后大豆油的含磷量,考察反应温度对复合酶脱胶效果的影响。
1.3.6.2反应pH值对复合酶脱胶的影响
在复合酶体系中PLA1和PLC添加量分别13 240 U/kg和16 520 U/kg、反应温度50 ℃、搅拌速率250 r/min条件下,pH值分别为4.5、5.0、5.5、6.0、6.5、7.0、7.5时,脱胶反应4 h,取样测定脱胶后大豆油的含磷量,考察反应pH值对复合酶脱胶效果的影响。
1.3.6.3反应时间对复合酶脱胶的影响
在复合酶体系中PLA1和PLC添加量分别13 240 U/kg和16 520 U/kg、反应温度50 ℃、反应pH 7.0、搅拌速率250 r/min的条件下进行脱胶实验,分别在脱胶反应0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h时取样测定大豆油磷含量,考察反应时间对复合酶脱胶效果的影响。
1.3.6.4搅拌速率对复合酶脱胶的影响
在复合酶体系中PLA1和PLC添加量分别13 240 U/kg和16 520 U/kg、反应温度50 ℃、反应pH 7.0、反应时间3 h的条件下,分别使用100、150、200、300、350、400 r/min的搅拌速率进行脱胶反应,反应结束后取样测定大豆油磷含量,考察搅拌速率对复合酶脱胶效果的影响。
1.3.6.5复合酶添加量对复合酶脱胶的影响
将酶活分别为662 U/mL和826 U/mL的PLA1和PLC粗酶液等体积混合后制成复合酶,在反应温度50 ℃、反应pH 7.0、反应时间3 h、搅拌速率300 r/min的条件下,分别加入0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL的复合酶液,对应体系中PLA1和PLC添加量分别为6 620 U/kg和8 260 U/kg(0.5 mL)、13 240 U/kg和16 520 U/kg(1.0 mL)、19 860 U/kg和24 780 U/kg(1.5 mL)、26 480 U/kg和33 040 U/kg(2.0 mL)、33 100 U/kg和41 300 U/kg(2.5 mL)、39 720 U/kg和49 560 U/kg(3.0 mL)、46 340 U/kg和57 820 U/kg(3.5 mL),进行脱胶实验,反应结束后取样测定大豆油磷含量,考察复合酶添加量对脱胶效果的影响。
1.3.6.6复合酶体积比对复合酶脱胶的影响
在复合酶添加总体积2 mL、反应温度50 ℃、反应pH 7.0、反应时间3 h、搅拌速率300 r/min的条件下,将酶活分别为662 U/mL和826 U/mL的PLA1和PLC粗酶液按照体积比1∶9、2∶8、3∶7、4∶5、5∶5、6∶4、7∶3、8∶2、9∶1混合,配成总体积2 mL的复合酶,考察复合酶体积比对脱胶效果的影响。
1.3.7正交试验
通过以上对复合酶脱胶条件的探索,为得到一个最佳的脱胶条件组合,选取反应温度、反应pH值、搅拌速率3 个因素作为变量,各自选取4 个水平,以脱胶油中磷含量作为脱胶效果考察指标,进行L16(43)正交试验,试验因素与水平见表1。

表1 L316(4)正交试验因素与水平Table1 Factors and levels used for L316(4) orthogonal array design
1.4数据处理
实验均做3 次以上平行,取平均值,数据使用Origin Pro 8.0软件作图,使用SPSS 17.0统计分析软件进行处理。不同平均值之间利用最小显著差异法进行差异显著性检验,实验数据误差以标准差表示。
2 结果与分析
2.1单一酶脱胶最适反应条件
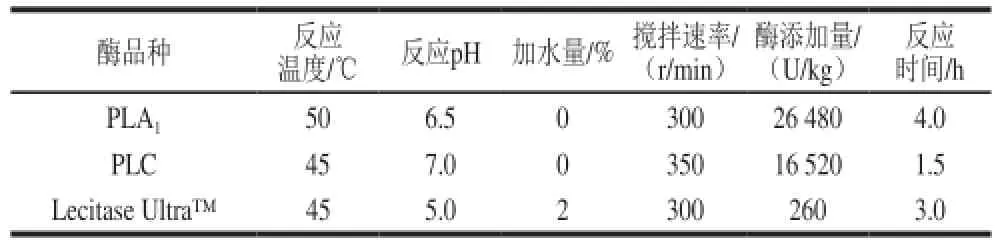
表2 不同磷脂酶大豆油脱胶的最适反应条件Table2 Optimal conditions for enzymatic degumming using different phospholipases
通过实验结果分析,分别确定了PLA1、PLC及Lecitase Ultra™应用于大豆毛油脱胶的最适反应条件,如表1所示。其中,在PLA1和PLC实验中,本研究得到结论是加水量(体积分数)为0%~4%的变化对脱胶效果无显著影响,分析原因主要是因为粗酶液所带入的含水量已使反应体系形成较大的油水界面面积,当继续添加蒸馏水(0%~4%)时,一方面可能会增大反应面积而提高催化效率,另一方面也可能会因加水量过多而形成乳化体系,导致部分水化磷脂无法脱除,上述两方面因素使得加水量的变化对脱胶效果无显著影响。故对于PLA1、PLC及其复合酶的脱胶实验均不再额外添加水。在上述各自最适反应条件下,PLA1、PLC以及Lecitase Ultra™的脱胶效果,如图1所示。
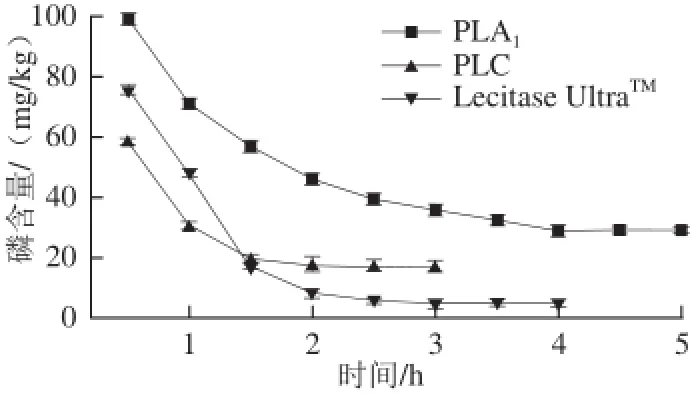
图1 不同磷脂酶大豆毛油酶法脱胶效果Fig.1 Degumming efficiency of different phospholipases
由图1可知,Lecitase Ultra™脱胶后油中磷含量降至5 mg/kg以下,脱胶效果理想,酶用量也较少。而PLA1和PLC脱胶后油中磷含量都在10 mg/kg以上,虽然随着反应时间的继续进行,其磷含量会有所下降,但下降幅度已不明显。说明单一使用PLA1、PLC无法达到和商品酶Lecitase Ultra™对大豆毛油相同的脱胶水平,脱胶处理后油脂的磷含量仍较高。
2.2复合酶脱胶单因素试验结果
2.2.1反应温度对复合酶脱胶的影响
由图2可见,在40~50 ℃时复合酶脱胶效果较好,50 ℃之后,随着反应温度的升高,磷含量呈上升趋势,说明酶逐渐失活,可知脱胶的最适温度范围在45~55 ℃之间,其中50 ℃时的磷含量下降为10.36 mg/kg,磷含量显著低于其他反应温度(P<0.05),故以下其他单因素试验的温度选择为50 ℃。

图2 反应温度对复合酶脱胶的影响Fig.2 Effects of reaction temperature on degumming efficiency with mixed phospholipases
2.2.2反应pH值对复合酶脱胶的影响
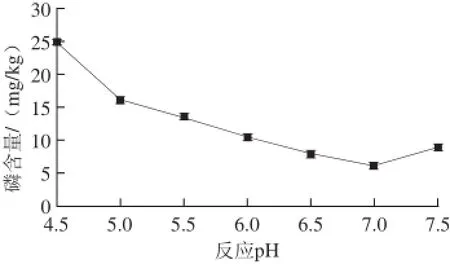
图3 反应pH值对复合酶脱胶的影响Fig.3 Effects of pH on degumming efficiency with mixed phospholipases
如图3所示,反应pH值对复合酶脱胶有较大影响,pH值过低或过高都不利于酶反应的进行,当pH值在6.0~7.5之间时,磷含量较低,脱胶效果较好,而在pH 7.0时磷含量达到最低,显著低于其他反应pH值(P<0.05),故选取7.0作为脱胶单因素试验的最适反应pH值。
2.2.3反应时间对复合酶脱胶的影响

图4 反应时间对复合酶脱胶的影响Fig.4 Effects of reaction time on degumming efficiency with mixed phospholipases
由图4可知,0.5~2.5 h内,油样磷含量明显下降,之后随着时间的延长,磷含量下降速率减缓,3 h后油样磷含量基本趋于稳定,虽然磷含量继续降低,但已不明显。为了酶反应的充分进行和脱胶效果的稳定,确定最适反应时间为3 h。

图5 搅拌速率对复合酶脱胶的影响Fig.5 Effects of stirring speed on degumming efficiency with mixed phospholipases
2.2.4搅拌速率对复合酶脱胶的影响由图5可见,在搅拌速率100~300 r/min范围内,随着搅拌速率的增加,磷含量明显下降,这是因为搅拌速率越大,水在油相中分散的越均匀,反应界面越大,当搅拌速率加快至300 r/min时,油中磷含量降至最低,显著低于其他搅拌速率条件下(P<0.05)。但继续加快搅拌速率时,磷含量开始逐渐增加,一方面可能是因为高速搅拌形成的强剪切力影响了酶的活性,另一方面可能是因为高速搅拌下形成的乳化体系会造成水化磷脂的残留,从而影响了脱胶效果。故综合考虑以下单因素试验中的搅拌速率定为300 r/min。
2.2.5复合酶添加量对复合酶脱胶的影响

图6 复合酶添加量对酶法脱胶的影响Fig.6 Effects of dosages of enzymes (PLA1and PLC) on degumming efficiency with mixed phospholipases
如图6所示,在相同的反应条件下,分别加入0.5、1.0、1.5、2.0 mL的复合酶,油脂磷含量变化显著(P<0.05),2 mL的复合酶可使油脂磷含量降至6.57 mg/kg,随着复合酶添加量的增加,脱胶后油脂的磷含量下降已不明显,故从经济性的角度考虑,取复合酶添加量为2.0 mL。
2.2.6复合酶体积比对复合酶脱胶的影响
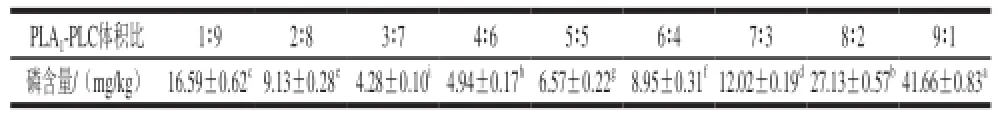
表3 复合酶体积比对复合酶脱胶的影响Table3 Effects of ratio of PLA1to PLC on degumming efficiency
由表3可知,复合酶体积比对复合酶脱胶效果有较大影响,当复合酶体系中PLA1-PLC体积比为3∶7,即复合酶中PLA1和PLC添加量分别为7 940 U/kg和23 130 U/kg时,油脂中磷含量降至最低。
2.3复合酶脱胶正交试验结果
在复合酶体系中PLA1和PLC添加量分别为7 940 U/kg和23 130 U/kg、反应时间3 h条件下,选取反应温度、反应pH值、搅拌速率3 个因素作为变量,各自选取4 个水平,以脱胶油中磷含量作为脱胶效果考察指标,选用L16(43)正交表安排试验,试验设计与结果见表4。

表4 正交试验设计与结果Table4 Design and results of orthogonal array experiments
通过表4中正交试验因素指标分析发现,3 个因素的脱胶效果影响顺序依次是反应温度>搅拌速率>反应pH值,由正交试验结果可以看出优化后的组合为A1B2C3,即反应温度45 ℃、反应pH 6.5、搅拌速率300 r/min,在此条件下,复合酶中PLA1和PLC添加量分别为7 940 U/kg和23 130 U/kg,进行大豆毛油脱胶实验,反应3 h后测定油中的磷含量为3.60 mg/kg。可以看出复合酶对大豆毛油的脱胶效果与诺维信商品酶Lecitase Ultra™基本一致。
3 结 论
本研究将重组大肠杆菌来源的复合磷脂酶应用于大豆毛油的脱胶。通过单因素和正交试验,确定了该复合酶用于大豆油脱胶的最优工艺条件为:反应温度45 ℃、反应pH 6.5、反应时间3 h,搅拌速率300 r/min,PLA1和PLC添加量分别7 940 U/kg和23 130 U/kg。结果显示使用PLA1和PLC复合酶用于大豆油脱胶,综合了两种磷脂酶各自的脱胶优势,实现了脱胶效率和脱胶效果的双重提升,经过脱胶的油脂磷含量为3.60 mg/kg,达到了油脂物理精炼的要求,与诺维信磷脂酶产品Lecitase Ultra™的脱胶效果基本一致。为进一步开发具有知识产权的食用油脱胶用酶制剂产品提供了理论依据。
[1] NARAYANA T, KAIMAL B, VALI S, et al. Origin of problems encountered in rice bran oil processing[J]. European Journal of Lipid Science and Technology, 2002, 104(4): 203-211. DOI:10.1002/1438-9312(200204)104:4<203::AID-EJLT203>3.0.CO;2-X.
[2] DIJKSTRA A. Enzymatic degumming[J]. European Journal of Lipid Science and Technology, 2010, 112(11): 1178-1189. DOI:10.1002/ ejlt.201000320.
[3] ROY S, RAO B, PRASAD R. Enzymatic degumming of rice bran oil[J]. Journal of the American Oil Chemists Society, 2002, 79(8): 845-846. DOI:10.1007/s11746-002-0568-5.
[4] FU J H, HUANG H Q, MENG K, et al. A novel cold-adapted phospholipase A1from Serratia sp xjF1: gene cloning, expression and characterization[J]. Enzyme and Microbial Technology, 2008, 42(2): 187-194. DOI:10.1016/j.enzmictec.2007.09.004.
[5] SONG J, KIM M, RHEE J. Cloning and expression of the gene encoding phospholipase A1from Serratia sp MK1 in Escherichia coli[J]. Journal of Biotechnology, 1999, 72(1/2): 103-114. DOI:10.1016/S0168-1656(99)00096-6.
[6] NISHIHARA M, KAMATA M, KOYAMA T, et al. New phospholipase A1-producing bacteria from a marine fish[J]. Marine Biotechnology, 2008,10(4): 382-387. DOI:10.1007/s10126-007-9074-5.
[7] 长崎咏子, 深泽彻也, 小野泰典. 新型磷脂酶C: 中国, CN101410513[P/OL].[2006-03-10]. http://d.g.wanfangdata.com.cn/Patent_ CN200680053785.2.aspx.
[8] BORA L. Characterization of novel phospholipase C from Bacillus licheniformis MTCC 7445 and its application in degumming of vegetable oils[J]. Applied Biochemistry and Microbiology, 2013,49(6): 555-561. DOI:10.1134/S0003683813060197.
[9] MARIA L D, VIND J, OXENBØLL K M, et al. Phospholipases and their industrial applications[J]. Applied Microbiology and Biotechnology, 2007, 74(2): 235. DOI:10.1007/s00253-006-0775-x.
[10] YANG J G, WANG Y H, YANG B, et al. Degumming of vegetable oil by a new microbial lipase[J]. Food Technology and Biotechnology,2006, 44(1): 101-104.
[11] LOEFFLER F, PLAINER H, SPROESSLER B, et al. Vegetable oil enzymatic degumming process by means of aspergillus phospholipase: US, US6001640[P]. 1999.
[12] CLAUSEN K. Enzymatic oil-degumming by a novel microbial phospholipase[J]. European Journal of Lipid Science and Technology, 2001, 103(6): 333-340. DOI:10.1002/1438-9312(200106)103:6<333::AID-EJLT333>3.0.CO;2-F.
[13] HASIDA M, TSUTSUMI N, HALKIER T, et al. Acidic phospholipase,production and methods using thereof: US, US6127137[P]. 2000.
[14] KELLENS M, de GREYT W. Enzymatic oil recuperation process: US,US8435766[P]. 2013.
[15] BARTON N. A new process for degumming: the use of phospholipase C to improve yields during refining of high phosphorus vegetable oils[C]//99th AOCS Annual Meeting & Expo. Seattle: 2008.
[16] HUANG S, LIANG M L, XU Y H, et al. Characteristics and vegetable oils degumming of recombinant phospholipase B[J]. Chemical Engineering Journal, 2014, 237: 23-28. DOI:10.1016/ j.cej.2013.09.109.
[17] 余榛榛, 常明, 刘睿杰, 等. 磷脂酶C在酶法脱胶中的研究进展[J]. 中国油脂, 2013, 38(7): 19-22. DOI:10.3969/ j.issn.1003-7969.2013.07.006.
[18] 延晋雷, 张梁, 顾正华, 等. 液化沙雷氏菌磷脂酶A1的克隆表达及乳糖自诱导发酵[J]. 生物工程学报, 2013, 29(6): 853-856.
[19] 赵金星, 张梁, 顾正华, 等. 重组大肠杆菌表达铜绿假单胞菌溶血性磷脂酶C[J]. 微生物学报, 2013, 53(3): 259-268.
[20] 高林. 微生物磷脂酶C检测方法的研究进展[J]. 安徽农业科学, 2010, 38(23): 12412-12413. DOI:10.3969/ j.issn.0517-6611.2010.23.038.
[21] 赵梦梦, 薛正莲, 黄祖耀, 等. 三种磷脂酶A1活力测定方法的比较[J].食品与发酵科技, 2012, 48(3): 74-77; 85. DOI:10.3969/j.issn.1674-506X.2012.03.020.
Optimization of Soybean Oil Degumming by Mixed Recombinant Phospholipases
CHENG Shi1,2, WANG Changkun1,2, ZHANG Liang1,2,*, LI Ying2, SHI Guiyang2, YANG Shengrong3, CHEN Guo’an3
(1. Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China;2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China;3. Wuxi Jiangda Baitai Technology Co. Ltd., Wuxi 214122, China)
Crude soybean oil was degummed by mixtures of recombinant phospholipases A1(PLA1) and phospholipase C (PLC), which were expressed successfully in the recombinant E. coli. by our laboratory. We investigated the effects of different parameters, including temperature, pH, reaction time, water dosage, stirring rate and enzyme dosage on degumming efficiency. Commercial PLA1(Lecitase Ultra™) was used for comparison. Then, these parameters were optimized by orthogonal array design. The optimal conditions were confirmed as follows: reaction temperature, 45 ℃; pH, 6.5; reaction time, 3 h; stirring speed, 300 r/min; PLA1dosage, 7 940 U/kg; and PLC dosage, 23 130 U/kg. The degumming efficiency obtained with the mixed recombinant enzymes was comparable to that obtained with Lecitase Ultra™. The final phosphorus content of degummed soybean oil was lower than 5 mg/kg, which met the requirements of physical refining. This study laid the foundation for developing food-grade enzyme preparations with self-owned intellectual property rights of cooking oil degumming.
recombinant E. coli; mixed phospholipases; soybean oil; enzymatic degumming; orthogonal array experiment
10.7506/spkx1002-6630-201618003
Q814.9
A
1002-6630(2016)18-0013-06
程实, 王长坤, 张梁, 等. 复合重组磷脂酶用于大豆油脱胶的工艺优化[J]. 食品科学, 2016, 37(18): 13-18. DOI:10.7506/ spkx1002-6630-201618003. http://www.spkx.net.cn
CHENG Shi, WANG Changkun, ZHANG Liang, et al. Optimization of soybean oil degumming by mixed recombinant phospholipases[J]. Food Science, 2016, 37(18): 13-18. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618003. http://www.spkx.net.cn
2016-03-16
国家高技术研究发展计划(863计划)项目(2011AA100905);教育部“新世纪优秀人才支持计划”项目(NCET-11-0665);江南大学食品科学与技术国家重点实验室自由探索课题项目(SKLF-ZZA-201201)
程实(1988—),男,博士研究生,研究方向为工业微生物学与酶工程。E-mail:jack11181@sina.com
张梁(1978—),男,教授,博士,研究方向为酶工程与技术和农业益生菌。E-mail:zhangl@jiangnan.edu.cn

