解淀粉芽孢杆菌GSBa-1产凝乳酶培养基组成的优化
腾军伟,杨贞耐
(北京工商大学食品添加剂与配料北京高校工程研究中心/食品质量与安全北京实验室,北京 100048)
解淀粉芽孢杆菌GSBa-1产凝乳酶培养基组成的优化
腾军伟,杨贞耐*
(北京工商大学食品添加剂与配料北京高校工程研究中心/食品质量与安全北京实验室,北京 100048)
从甜酒曲中分离筛选得到1株解淀粉芽孢杆菌菌株GSBa-1,为了提高该菌株液态发酵产凝乳酶的能力,采用单因素实验和响应面法优化其产酶培养基组成。通过单因素实验分析了碳源、氮源、金属盐、磷源对菌株GSBa-1产凝乳酶的影响,并采用响应面法对产酶培养基中麦芽糖、蛋白胨和酵母浸粉含量3个主要因素的优化组合进行了定量研究,确定解淀粉芽孢杆菌GSBa-1产凝乳酶的优化培养基组成为:麦芽糖1.93 g/L、蛋白胨10.89 g/L、酵母浸粉2.15 g/L。在此优化培养基培养条件下,该菌株产凝乳酶活力可达(562.57±7.67)Su/mL,接近理论预测值537.10 Su/mL,且平均误差为4.53%。优化后解淀粉芽孢杆菌GSBa-1产凝乳酶活力比基础培养基提高了1.88倍。
解淀粉芽孢杆菌GSBa-1;凝乳酶;响应面法;培养基组成
引用格式:腾军伟,杨贞耐.解淀粉芽孢杆菌GSBa-1产凝乳酶培养基组成的优化[J].食品科学技术学报,2016,34(4):31-38.
TENG Junwei,YANG Zhennai.Optimization by response surface methodology of medium composition for producing milk-clotting enzyme by Bacillus amyloliquefaciens GSBa-1[J].Journal of Food Science and Technology,2016,34(4):31-38.
凝乳酶(milk-clotting enzyme,MCE)是干酪生产中添加于原料乳而导致凝乳的必需酶,通常是经过牛犊第四胃(皱胃)的提取来制作。随着干酪产业的发展单纯靠宰杀牛犊的方法已经无法满足现代工业对凝乳酶的需求[1-2],因此,研究开发不同来源的凝乳酶已受到越来越多的关注[3]。凝乳酶主要包括动物源凝乳酶、植物源凝乳酶、微生物源凝乳酶等[4]。微生物具有的生长期短、成本低、易于人工控制培养等优点使得微生物源凝乳酶拥有广阔的发展前景[5]。近年来,对霉菌的固态发酵产酶方面的研究较多[6-8],而关于细菌液发酵的研究报道较少。其中在细菌凝乳酶的研究报道中主要涉及枯草芽孢杆菌[9]、蜡样芽孢杆菌[10]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[11]和地衣芽孢杆菌[12]等。细菌来源的凝乳酶具有的高蛋白水解能力使得其商业化应用存在障碍[13],因此,获得凝乳酶活力高同时蛋白水解活力低的细菌源凝乳酶是近年来凝乳酶研究开发的热点问题。
微生物繁殖发酵产酶过程中,培养基的营养成分组成也是影响产酶的关键因素[14],因此微生物发酵产酶时首先必须有满足其生长繁殖所需的碳源、氮源、矿物质离子和各种微量元素等[15];近年来,已有报道关于芽孢杆菌的培养基成分对其发酵过程的影响方面的研究[16-17],同时,研究表明,采用优化的培养基对于高效实现芽孢杆菌的高密度增殖并培养产酶至关重要[18]。目前,对于培养基的组成对解淀粉芽孢杆菌发酵产凝乳酶的影响的研究甚少[16,19]。江米酒发酵剂酒曲中微生物发酵代谢可产生凝乳酶[20-21]。江米酒是一种传统安全食品,采用其中筛选得到的菌株进行发酵产凝乳酶,无须考虑非酶类代谢产物的安全性问题[22]。本研究采用1株从甜酒曲中分离筛选得到的高产凝乳酶解淀粉芽孢杆菌菌株GSBa-1,重点研究了培养基组成对其产酶的影响,并采用响应面法优化其培养基组成,旨在提高该菌株的凝乳酶产量和活力,并希望能够为解淀粉芽孢杆菌GSBa-1发酵产凝乳酶的进一步开发利用提供技术参考。
1 材料与方法
1.1材料与仪器
解淀粉芽孢杆菌GSBa-1由本实验室分离纯化并冷冻保存;脱脂乳粉,澳大利亚进口;其他实验试剂均为分析纯;实验用水为超纯水;细菌基础培养基(LB):胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化钠10 g/L、琼脂粉15 g/L,于121℃高温灭菌20 min。细菌基础发酵培养基:胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化钠10 g/L,于121℃高温灭菌20 min。
HWS 12型恒温水浴加热锅,上海一恒科学实验装备有限公司;HZQ-Q型气浴恒温摇床,哈尔滨东联电子科技有限公司;CR21GⅢ型高速离心机,日本日立有限公司。
1.2实验方法
1.2.1种子液的制备
挑取-70℃冰箱中甘油管保藏的解淀粉芽孢杆菌GSBa-1,于LB固体平板划线活化,30℃条件下培养箱中培养24 h。挑取少量单一菌落接种到细菌发酵培养基中,于30℃、120 r/min条件下摇床培养14 h作为种子液。
1.2.2菌株发酵条件的确定
种子液按3%体积分数的比例接种到装有30 mL发酵培养基的100 mL三角瓶中,在30℃、120 r/min的培养条件下摇床回旋振荡培养18 h。
1.2.3凝乳酶活力的测定
选用Arima等[23]方法。准确量取5 mL 100 g/L的脱脂乳于35℃中保温5 min,加入0.5 mL解淀粉芽孢杆菌发酵粗酶液,使之迅速混匀,加入粗酶液时开始计时,准确记录脱脂乳凝固的时间(s)。发酵酶液活力的定义:将在40 min内凝固100 g/L的脱脂乳1 mL所要的凝乳酶量规定为一个索氏单位(Soxhelt unit,Su)。计算公式见式(1)。
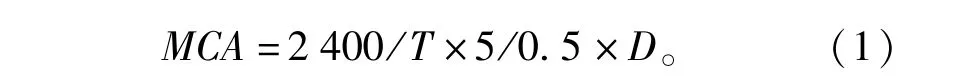
式(1)中,MCA为发酵液酶活力,Su/mL;T为凝乳时间,s;D为酶液稀释倍数。
1.2.4蛋白水解活力的测定
取2 mL 1.5%酪蛋白溶液于35℃保温5 min,加入0.5 mL预热的待测粗酶液,混匀,反应60 min,加入2 mL 8%的三氯乙酸终止反应,过滤后测定滤液在280 nm的吸光度(A280)。制备对照样品,先将预热的粗酶液同三氯乙酸混合,使酶液失活,再加入2 mL酪蛋白溶液在35℃中保温5 min,过滤后测定滤液在280 nm的吸光度。
本实验条件下,60 min引起A280增加0.001个单位所需的酶量为1个酶活力单位。计算公式见式(2)。

式(2)中,A280′为对照样品的吸光度;A280为水解后待测样品的吸光度。
1.2.5单因素实验
1.2.5.1碳源种类的确定
以1.1基础发酵培养基中酵母粉为唯一碳源和能源的基础上,分别添加质量浓度为5 g/L的果糖、麦芽糖、蔗糖、乳糖、葡萄糖、可用性淀粉,其他组成成分不变,以细菌基础发酵培养基作为对照,按照
1.2.2的条件进行培养,测定凝乳酶活力和蛋白水解活力,研究碳源种类对菌株产凝乳酶的影响。
1.2.5.2氮源种类的确定
以1.1基础发酵培养基中酵母粉为唯一氮源的基础上,分别添加10 g/L质量浓度的蛋白胨、大豆蛋白胨、牛肉粉、脱脂奶粉、硫酸铵、柠檬酸氨,其他组成成分不变,以基础发酵培养基为对照,按照
1.2.2的方法进行培养,测定凝乳酶活力和蛋白水解活力,研究氮源种类对菌株产凝乳酶的影响。
1.2.5.3酵母浸粉添加量的确定
分别将1.1基础发酵培养基中5 g/L的酵母粉调整为1,2,3,4,5,6,7,9,12,15 g/L,其他条件不变,按照1.3.2的方法进行培养,研究酵母浸粉添加量对菌株产凝乳酶的影响。
1.2.5.4金属离子种类的确定
改变1.1中基础发酵培养基中的氯化钠,换成相同条件的碳酸钙、氯化钙、氯化钾、硫酸镁、硫酸铜、硫酸锌、硫酸锰,其他成分不变,按照1.2.2的方法进行培养,研究不同金属盐对菌株产凝乳酶的影响。
1.2.5.5磷源种类的确定
在1.1基础发酵培养基里分别添加1 g/L的K2HPO4·3H2O、KH2PO4、Na2HPO4·12H2O、NaH2PO4,以不加磷源的基础培养基做对照,按照1.2.2的方法进行培养,研究不同磷源对菌株产凝乳酶的影响。
1.2.6响应面试验
根据单因素实验结果,选取麦芽糖、蛋白胨和酵母浸粉3个因素,以MCA为响应值,依据Box-Behnken软件进行中心组合试验,设计3因素3水平的响应面试验,结果见表1。每组试验重复3次。
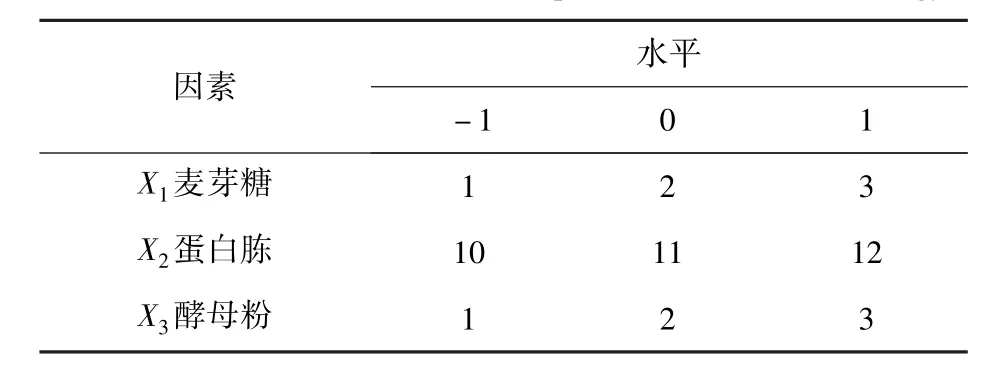
表1 响应面试验因素水平Tab.1 Factors and levels of response surface methodology
1.2.7数据分析
采用Design-Expert 8.0.5.0软件对实验数据进行处理,并进行显著性分析。
2 结果与分析
2.1单因素实验结果分析
2.1.1碳源对解淀粉芽孢杆菌GSBa-1凝乳酶产量的影响
碳源为微生物生长和代谢提供最主要的碳素和能量。不同碳源种类对菌株产酶活力的影响见图1。从图1可以看出,与对照组基础培养基以酵母浸粉为唯一碳源相比,再添加其他碳源有助于凝乳酶活力的提高,尤其是添加麦芽糖和可溶性淀粉时凝乳酶的活力比较高。研究结果和纳豆芽孢杆菌产凝乳酶类似[24],特别是添加麦芽糖时凝乳酶的凝乳活力与蛋白水解活力比值(C/P)最高,因此选择麦芽糖作为较佳碳源。碳源质量浓度对菌株产酶活力亦有较大影响,对麦芽糖较佳添加量的进一步研究结果(图2)表明,麦芽糖添加量对凝乳酶活力的影响呈现出低促高抑的现象,可能是由于高质量浓度的麦芽糖会导致酶的钝化或培养基的营养失衡,从而影响微生物产酶[25]。当质量浓度为2 g/L时,凝乳酶活力最高,因此,产酶培养基中麦芽糖的较佳添加量为2 g/L。
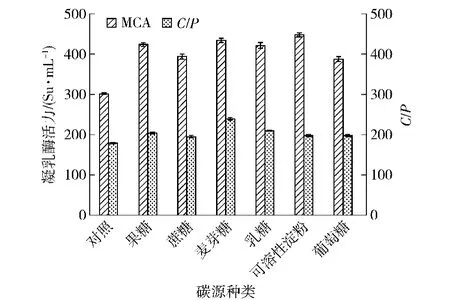
图1 碳源对菌株GSBa-1产凝乳酶活力的影响Fig.1 Effect of carbon sources on production of MCE by strain GSBa-1

图2 麦芽糖质量浓度对菌株GSBa-1产凝乳酶活力的影响Fig.2 Effect of maltose mass concentration on production of MCE by strain GSBa-1
2.1.2氮源对解淀粉芽孢杆菌GSBa-1凝乳酶产量的影响
氮源主要为微生物细胞生长和代谢提供氮素及能量。不同氮源种类对菌株发酵产酶活力的影响结果如图3。从图3可以看出,与对照组相比,当添加有机氮源蛋白胨与牛肉膏时对解淀粉芽孢杆菌GSBa-1产凝乳酶有促进作用;添加无机氮源则对菌株产酶有明显的抑制作用,且添加硫酸铵和柠檬酸铵时,菌体基本不生长,测得发酵液凝乳活力为0,研究结果和叶为标等[26]的类似。当添加有机氮源如蛋白胨时,凝乳酶活力最高,同时酶的蛋白水解活力最低,因此,选择蛋白胨为较佳氮源。氮源质量浓度对菌株发酵产凝乳酶量有重要影响,对蛋白胨添加量的研究结果(图4)表明,随着蛋白胨质量浓度的增加,酶的凝乳活力逐渐提高,当质量浓度增加到11 g/L时,凝乳活力达到最大值,之后随着蛋白胨浓度的继续增大,凝乳活力不断降低。因此,选取11 g/L作为蛋白胨的较佳质量浓度。

图3 氮源对菌株GSBa-1产凝乳酶活力的影响Fig.3 Effect of nitrogen sources on production of MCE by strain GSBa-1

图4 蛋白胨质量浓度对菌株GSBa-1产凝乳酶活力的影响Fig.4 Effect of peptone mass concentration on production of MCE by strain GSBa-1
2.1.3酵母浸粉对解淀粉芽孢杆菌GSBa-1凝乳酶产量的影响
酵母浸粉为微生物生长和代谢提供碳源和氮源,其质量浓度对菌株发酵产酶活力有重要影响,实验结果见图5。由图5可以看出,酵母浸粉添加量对凝乳酶活力也呈现出低促高抑的现象,且当质量浓度是2 g/L时,发酵液凝乳活力达到最大值。由于酵母浸粉中含有嘌呤和嘧啶碱基以及B族维生素等,它们有利于微生物的生长繁殖和酶的合成,但是浓度过高反而会影响产酶[27]。当培养基中酵母浸粉的质量浓度大于2 g/L时,凝乳酶的活力几乎呈线性下降。因此,酵母浸粉的较佳添加量为2 g/L。
2.1.4金属盐对解淀粉芽孢杆菌GSBa-1凝乳酶产量的影响
金属盐是影响微生物生长繁殖和凝乳酶合成的重要因素,不同金属盐种类对菌株发酵产酶活力的影响见图6。由图6可以看出,与对照组相比,添加镁盐对产酶稍有促进作用,钠盐和钾盐有一定的抑制作用,而其他金属盐包括氯化钙和碳酸钙均对产酶具有明显的抑制作用。李建涛等[16]报道,氯化钙对一株从土壤中分离得到的解淀粉芽孢杆菌产凝乳酶有显著的抑制作用,而碳酸钙却具有促进产酶的作用,可见不同来源的解淀粉芽孢杆菌菌株所产凝乳酶,其酶学性质也不同。本研究的解淀粉芽孢杆菌GSBa-1产凝乳酶的酶促反应过程中可能不需要金属离子的辅助,因此,该菌株的发酵产酶基础培养基中可以不添加金属盐。

图5 酵母粉质量浓度对菌株GSBa-1产凝乳酶活力的影响Fig.5 Effect of yeast mass concentration on production of MCE by strain GSBa-1

图6 金属盐对菌株GSBa-1产凝乳酶活力的影响Fig.6 Effect of metal salts on production of MCE by strain GSBa-1
2.1.5磷源对解淀粉芽孢杆菌GSBa-1凝乳酶产量的影响
磷源不仅提供磷源离子,还能影响培养基的pH值。不同磷源种类对菌株发酵产酶活力的影响如图7。由图7可以看出,与对照相比,添加不同磷源时均对菌株GSBa-1产酶有不同程度的抑制作用。不同磷源对另一株解淀粉芽孢杆菌也具有抑制作用,可能是因为加入磷源会降低发酵液的pH值,进而降低该菌株产凝乳酶活性[16]。因此,菌株GSBa-1发酵产酶基础培养基中不需要加入磷源。

图7 磷源对菌株GSBa-1产凝乳酶活力的影响Fig.7 Effect of phosphorus sources on production of MCE by strain GSBa-1
2.2响应面试验结果及分析
2.2.1响应面试验结果
依据Box-Behnken试验设计方法进行3因素3水平的响应面试验,共安排17个小组,其中12组为分析点,5个为试验零点。零点试验共进行5次,用以估计误差。试验设计方案及结果见表2。

表2 Box-Behnken试验设计和结果Tab.2 Box-Behnken design and experimental results
2.2.2回归模型的建立及显著性分析
根据Design-Expert(Version8.0.5.0)软件对表2数据及结果进行多元回归拟合分析,得到菌株GSBa-1凝乳活力(Y)对麦芽糖质量浓度(X1)、蛋白胨质量浓度(X2)和酵母浸粉质量浓度(X3)3个因素的二次多项式回归模型,见式(3):

方差分析和各因素的显著性见表3。从表3可以看出,模型的p值远远小于0.01,说明该模型是高度显著的,与实际试验拟合较好。本试验中决定系数R2=0.959 7,说明优化产凝乳酶活力的实验值与模型回归值有良好的一致性。其中校正系数R2Adj=0.907 8,说明该模型能够很好地解释0.907 8的响应值变化,失拟项F为3.49,p为0.129 2,大于0.05,表明模型失拟项不显著,能很好地说明该方程充分反映了实际细菌发酵产酶情况。因此,该模型拟合程度良好,可以用此模型来分析和预测营养条件对提高解淀粉芽孢杆菌GSBa-1产凝乳酶活力的影响。回归方程的各项方差分析结果说明,各营养因素对促进解淀粉芽孢杆菌产凝乳酶活力的影响顺序由大到小为:酵母浸粉质量浓度、蛋白胨质量浓度、麦芽糖质量浓度。其中,X2、X3、X2X3、影响比较显著。

表3 Box-Behnken设计方差分析Tab.3 ANOVA analysis of Box-Behnken
2.2.3响应面和等高值线分析
采用Design-Expert(Version 8.0.5.0)软件对表2数据进行二次多元回归拟合分析,得到的二次回归方程响应曲面和等高值线如图8~10。从其等高值线图可以看出,麦芽糖与蛋白胨添加量、麦芽糖与酵母浸粉添加量及蛋白胨与酵母浸粉添加量的交互作用均表现显著。从响应面图上可以看出,酵母浸粉添加量对发酵液凝乳酶活力的促进作用最大,表现为曲面最陡;蛋白胨添加量对发酵液凝乳酶活力的促进作用其次;麦芽糖添加量对发酵液凝乳酶活力的促进作用较小,其曲面最为平缓。通过响应面及等高线图可以直观地看出,不同营养因素对解淀粉芽孢杆菌GSBa-1产凝乳酶的影响。

图8 麦芽糖和蛋白胨质量浓度对菌株GSBa-1产凝乳酶活力影响的曲面图及等高值线Fig.8 Response surface and contour plots showing effects of maltose concentration and peptone concentration on production of MCA by strain GSBa-1
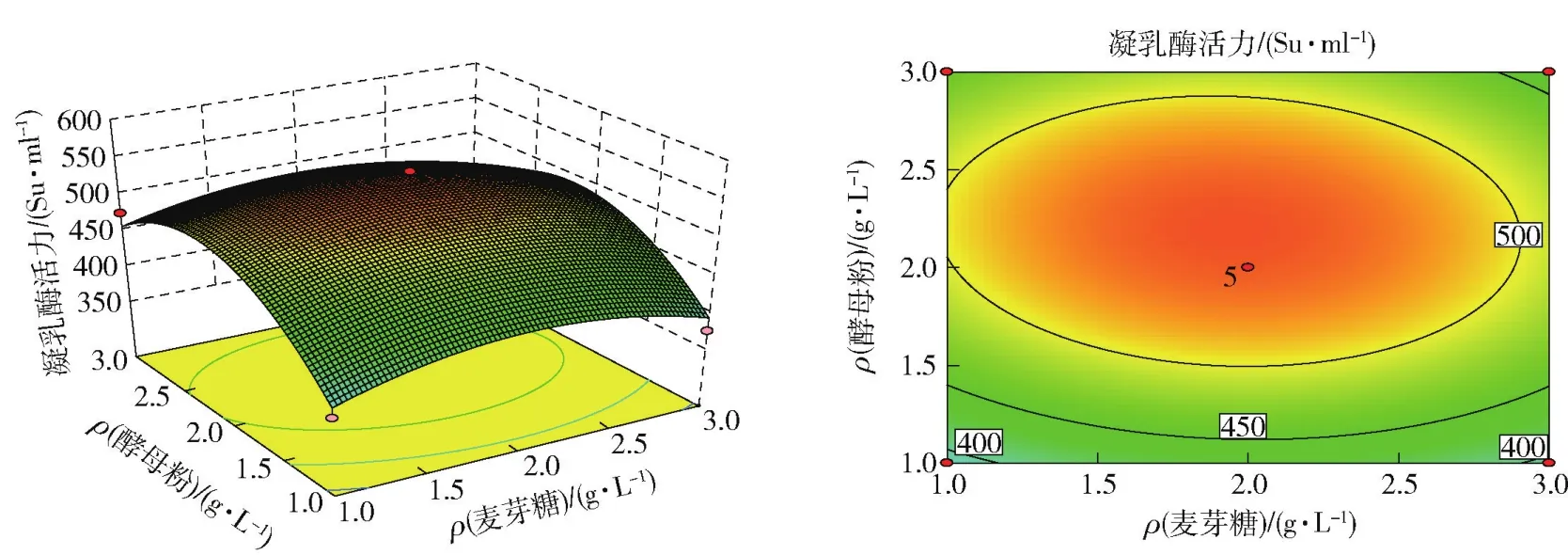
图9 麦芽糖和酵母粉质量浓度对菌株GSBa-1产凝乳酶活力影响的曲面图及等高值线Fig.9 Response surface and contour plots showing effects of maltose concentration and yeast concentration on production of MCA by strain GSBa-1

图10 蛋白胨和酵母粉质量浓度对菌株GSBa-1产凝乳酶活力影响的曲面图及等高值线Fig.10 Response surface and contour plots showing effects of peptone concentration and yeast concentration on production of MCA by strain GSBa-1
2.2.4营养条件的优化组合及验证
由等高值线图和响应面图可知,回归模型存在最大值。通过响应面软件分析得到解淀粉芽孢杆菌GSBa-1发酵产酶的优化培养基组成条件:麦芽糖质量浓度1.93 g/L、蛋白胨质量浓度10.89 g/L、酵母浸粉质量浓度2.15 g/L,此条件下理论预测最大凝乳酶活力为537.10 Su/mL。为了验证结果的可靠性,将采取响应面分析法得到的优化培养条件进行3次平行实验,结果显示,凝乳酶活力为(562.57± 7.67)Su/mL,且实验平均误差4.53%,表明使用响应面法优化得到的模型参数准确可靠。
3 结 论
通过单因素实验研究了培养基营养成分组成对解淀粉芽孢杆菌GSBa-1产凝乳酶的影响,并采用Box-Behnken软件进行中心组合设计及响应面分析,建立了解淀粉芽孢杆菌GSBa-1发酵产酶条件的二次多项数学模型。经检验证明,该模型是合理可靠的,能够较好地预测解淀粉芽孢杆菌GSBa-1产凝乳酶活力。利用模型的响应面及其等高值线,对影响产凝乳酶的主要培养基组分即麦芽糖、蛋白胨和酵母浸粉质量浓度等3个关键营养因素及其相互作用进行了探讨,证明三因素彼此之间均存在显著的交互作用。通过模型分析得到优化工艺参数为:麦芽糖质量浓度1.93 g/L、蛋白胨质量浓度10.89 g/L、酵母粉质量浓度2.15 g/L。利用此优化培养基,经30℃、120 r/min摇床培养18 h,发酵液中凝乳酶活力可达(562.57±7.67)Su/mL。本研究表明,用响应面法优化菌株GSBa-1发酵产凝乳酶培养基组成,较大幅度提高了菌株产凝乳酶活力。
[1] 杨贞耐,张健.干酪质量安全问题与控制技术[J].食品科学技术学报,2015,33(6):11-17.
YANG Z N,ZHANG J.Research advances and development trends in cheese safety and quality control[J]. Journal of Food Science and Technology,2015,33(6): 11-17.
[2] 高岩,王景会,李玉秋,等.枯草芽孢杆菌凝乳酶的酶学性质[J].吉林农业大学学报,2012,34(4):385-390.
[3] 孙宝国,曹雁平,李健,等.食品科学研究前沿动态[J].食品科学技术学报,2014,32(2):1-11.
SUN B G,CAO Y P,LI J,et al.Frontier dynamic of food science research[J].Journal of Food Science and Technology,2014,32(2):1-11.
[4] 郑丽,王昕,王景会,等.重组毕赤酵母产凝乳酶发酵参数优化的研究[J].食品科技,2012,37(3):16-21.
[5] 周俊清,林亲录,赵谋明.微生物源凝乳酶的研究进展[J].中国食品添加剂,2004(2):6-9.
[6] 韩玲玲,潘道东.根霉产凝乳酶的固态发酵条件优化[J].食品科学,2010,31(9):156-160.
[7] 李倬林,邵淑娟,李铁柱,等.响应面法优化微小毛霉固态发酵生产凝乳酶工艺研究[J].食品工业科技,2012,33(4):248-254.
[8] 吴进菊,徐尔尼,陈卫,等.酒曲根霉F34菌株凝乳酶的初步纯化及部分酶学性质的研究[J].食品工业科技,2008,29(9):135-137.
[9] KAKOLI D,PRETESH G,SAURABH S,et al.Production of milk-clotting protease from Bacillus subtilis[J]. Appl Biochemistry and Biotechnology,2009,158(3):761 -772.
[10] 周俊清.凝乳酶优良菌株的选诱及酶活特性的研究[D].长沙:湖南农业大学,2005.
[11] HE X L,REN F Z,GUO H Y,et al.Purification and properties of a milk-clotting enzyme produced by Bacillus amyloliquefaciens D4[J].Korean J Chem Eng,2011,28(1):203-208.
[12] 宋曦,甘伯中,贺晓玲,等.天祝放牧牦牛生活环境土壤中一株产凝乳酶细菌的分离与鉴定[J].食品科学,2009,30(11):158-162.
[13] RAO L K,MATHUR D K.Studies on the production of bacterial rennet in a pilot plant fermentor[J].Biotechnol Bioeng,1975,17(9):1349-1356.
[14] LIU Binglan,TZENG Yewmin.Optimization of growth medium for the production of spores from Bacillus thuringiensis response surface methodology[J].Bioprocess Engineering,1998,18:413-418.
[15] 宋文君.L-异亮氨酸高产菌的选育及其发酵条件研究[D].天津:天津科技大学,2003,11:13-14.
[16] 李建涛,陈历俊,姜铁民.响应面法优化解淀粉芽孢杆菌发酵产凝乳酶的工艺条件[J].中国乳品工业,2012,40(6):26-30.
[17] 陈羽,冯镇,张宏伟,等.响应面法优化芽孢杆菌FC96培养基组分的研究[J].食品科技,2011,36(6):30-35.
[18] QUARATINO D,CIAFFI M,FEDERICI E.Response surface methodology study of laccase production in Panustigrinus liquid cultures[J].Biochemical Engineering Journal,2008,39(2):236-245.
[19] ZHANG Weibing,HE Xiaoling,LIU Hongna,et al. Statistical optimization of culture conditions for milkclotting enzyme production by Bacillus amyloliquefaciens using wheat bran-an agro-industry waste[J].Indian J Microbiol,2013,53(4):492-495.
[20] 刘振民,骆承庠.江米酒乳凝固机理研究[J].食品科学,2000,21(7):13-15.
[21] WANG Y P,CHENG Q L,AHMED Z,et al.Purification and partial characterization of milk-clotting enzyme extracted from glutinous rice wine mash liquor[J].Korean Journal of Chemical Engineering,2009,26(5): 1313-1318.
[22] ZHAO Xiao,WANG Ji,ZHENG Zhe,et al.Production of a milk-clotting enzyme by glutinous rice fermentation and partial characterization of the enzyme[J].Journal of Food Biochemistry,2015,39(1):70-79.
[23] ARIMA K,YU J,IWASSAKI S.Milk-clotting enzyme from Mucor pusillus var.Lindt[J].Method in Enzymology,1970,19:446-459.
[24] SHIEH C J,PHAN T L A,SHIH I L.Milk-clotting enzymes produced by culture of Bacillus subtilis natto[J]. Biochemical Engineering Journal,2009,43(1):85-91.
[25] DING Z Y,LIU S P,GU Z H,et al.Production of milkclotting enzyme by Bacillus subtilis B1 from wheat bran[J].African Journal of Biotechnology,2011,10:9370-9378.
[26] 叶为标,吴进菊,陈卫平,等.根霉产凝乳酶发酵条件的研究[J].食品研究与开发,2007,28(8):53-55.
[27] THAKUR M S,KARANTH N G,NAND K.Production of fun-gal rennet by mucor miehei using solid state fermentation[J].Appl Microbiol Biotechnol,1990,32(4): 409-413.
Optimization by Response Surface Methodology of Medium Composition for Producing Milk-clotting Enzyme by Bacillus Amyloliquefaciens GSBa-1
TENG Junwei,YANG Zhennai*
(Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients/Beijing Laboratory of Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
A Bacillus amyloliquefaciens strain GSBa-1 was isolated from sweet Jiuqu.In order to improve the ability of producing a milk-clotting enzyme(MCE)by liquid fermentation of strain GSBa-1,the single factor test and response surface methodology were employed to optimize the composition of the medium used.The single factor experiment was carried out to analyze the influence of different carbon source,nitrogen source,metal salt and phosphorus source on production of MCE by strain GSBa-1.Then the Box-Behnken design based RSM experiment was used to study the optimum combination of three main factors such as the content of maltose,peptone and yeast extract powder in the medium.The optimal medium composition for producing MCE by GSBa-1 was as follows:maltose 1.93 g/L,peptone 10.89 g/L,and yeast extract powder 2.15 g/L.When the optimal culture medium was used,MCE activity was up to(562.57±7.67)Su/mL,which is similar as the theoretical prediction value of 537.10 Su/mL with an average error of 4.53%.After optimization of the medium composition,the MCE activity produced by strain GSBa-1 increased by 1.88 times compared with that of the basal medium.
Bacillus amyloliquefaciens strain GSBa-1;milk-clotting enzyme;response surface methodology;medium composition
TS252.1;TS201.3
A
10.3969/j.issn.2095-6002.2016.04.006
2095-6002(2016)04-0031-08
(责任编辑:叶红波)
20160223
国家自然科学基金面上项目(31371804);北京市百千万人才工程资助项目(B类)。
腾军伟,男,硕士研究生,研究方向为乳品生物技术;
*杨贞耐,男,教授,博士,主要从事乳品加工及其交叉学科理论及应用方面的研究。通信作者。

