北虫草培养残基中虫草素的提取纯化及抗肿瘤活性
陈丽冰,吴光旭,程 薇,范秀芝,史德芳,石 猛,高 虹,*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064;2.长江大学生命科学学院,湖北荆州 434025;3.湖北新冠食品科技有限公司,湖北黄石 435200)
北虫草培养残基中虫草素的提取纯化及抗肿瘤活性
陈丽冰1,2,吴光旭2,程 薇1,范秀芝1,史德芳1,石 猛3,高 虹1,*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064;2.长江大学生命科学学院,湖北荆州 434025;3.湖北新冠食品科技有限公司,湖北黄石 435200)
以北虫草固体培养残基为实验材料,比较闪式提取、超声波提取和超高压提取培养残基中虫草素的效果,用陶瓷膜过滤提取液,获得虫草素粗提液,利用高速逆流色谱分离制备虫草素,通过LC-MS/MS对产物结构进行鉴定,并验证了虫草素对小鼠S180肉瘤的抑制作用。结果显示,超高压提取培养基中虫草素较好,高速逆流色谱分离纯化条件是以V(乙酸乙酯)∶V(正丁醇)∶V(水)= 2∶3∶5的两相溶剂系统,上相为固定相,下相为流动相,流速3.0 mL/min,主机转速900 r/min,分离温度28℃,以此分离条件经一步洗脱,高速逆流色谱收集馏分,其中峰Ⅲ产物经HPLC检测纯度达97.6%,结构经LC-MS/MS鉴定为虫草素。从100 g北虫草培养残基中可制备得虫草素181.90 mg,并对其活性验证发现剂量为100 mg/kg时小鼠S180肉瘤瘤重抑制率为64.48%。
北虫草培养基;虫草素;提取;高速逆流色谱;抗肿瘤活性
CHEN Libing,WU Guangxu,CHENG Wei,et al.Extraction,purification,and antitumor activity of cordycepin from Cordyceps militaris residue medium[J].Journal of Food Science and Technology,2016,34(4):73-79.
北虫草(Cordyceps militaris L.)是一种近些年很受人们喜爱的食用菌,与著名的中药冬虫夏草有相似的药理活性[1-3]。随着市场需求的上升,人工栽培北虫草的技术不断成熟并广泛应用于市场,随之产生的问题是采收子实体后的残留培养基被废弃于环境中导致腐败变酸发臭造成污染。经研究表明北虫草培养残基中存在的虫草素高于子实体中的含量,而虫草素具有抗肿瘤、抗衰老、免疫调节等作用[4-6],具有可观的医疗商用价值。因此,建立虫草素成分的高效分离纯化方法具有重要意义。
虫草素的分离纯化研究报道虽然多,但是工艺工序复杂、收率低、实验成本高,对工业生产虫草素参考价值不大。高速逆流色谱(high speed counter-current chromatography,HSCCC)是一种液-液色谱分离技术[7-8],具有样品无损失、无污染、高效、快速、制备量大等优点,因此这项技术被广泛应用于天然生物活性成分的分离制备[9]。本研究采用超高压设备对北虫草培养残基进行水提,水提液经陶瓷膜除杂后冻干,得虫草素粗提物,并以此粗提物进行HSCCC分离纯化,经一步成功分离得到高纯度的虫草素,同时对其抗肿瘤活性进行了验证,以期为虫草素原料开发、分离、制备提供一定的理论依据。
1 材料与仪器
1.1材料与试剂
以大米为主要原料培养北虫草后的剩余基质,经确认为同一批次的大米培养基,由湖北新冠食品科技有限公司提供。虫草素标准品,上海金穗生物科技有限公司;高效液相色谱分析用乙腈和甲醇均为色谱纯,上海霍尼韦尔公司;乙酸乙酯、正己烷、氯仿、乙醇、正丁醇、甲醇及冰乙酸均为分析纯,国药集团化学试剂公司;蒸馏水、超纯水实验室自制。
1 mL一次性注射器、0.45 μm微孔滤膜、注射用环磷酰胺(CTX),江苏恒瑞医药股份有限公司;RPMI-1640和胎牛血清,美国Gibco公司;昆明种小鼠,湖北省实验动物研究中心;S180小鼠腹水瘤细胞,中国科学院典型培养物保藏委员会细胞库。
1.2仪器与设备
TBE-300B型高速逆流色谱仪,配20 mL进样圈,TBP5002型柱塞式泵,TBD2000型检测器和DC -0506型低温恒温循环器,上海同田生化技术有限公司;LC-20A型高效液相色谱仪,日本岛津公司,配SPD-M20A型检测器,LC-20AT型泵,20 μL定量圈;1100型液相色谱/质谱联用仪(LC-MSDTRAP-XCT),美国Agilent公司;HPP.L1-600/3型超高压处理设备,天津华泰森淼生物工程技术有限公司;Thermo 3111型二氧化碳培养箱,美国Thermo Scientific公司;Multiskan MK3型酶联免疫检测仪,上海雷勃生物技术有限公司;JHBE-50T型闪式提取器,河南金鼐科技发展有限公司;另需陶瓷膜分离设备,冻干机,微型植物粉碎机,双频数控超声波提取器,电子天平,旋转蒸发仪,离心机等。
2 实验方法
2.1虫草素制备工艺流程
收集新鲜北虫草培养残基筛选后切成大小均匀的小块,放入烘箱内60℃烘干后,用植物粉碎机粉碎,过筛。称取一定质量的培养基粉末用超高压提取,离心,收集上清液,利用陶瓷膜初步除杂,所得透过液真空旋转蒸发浓缩后真空冷冻干燥得到虫草素粗提物。最后利用高速逆流色谱纯化分离虫草素粗提物,重结晶得虫草素纯品。
2.2原料处理
将相同批次的北虫草大米培养残基收集切片后并于60℃热风干燥至含水率低于5%,使用植物粉碎机进行粉碎,过筛,置于干燥阴凉处密封保存备用。
2.3比较不同提取方式下北虫草培养残基中虫草素含量
2.3.1超高压提取法
称量一定质量粉碎后过20目筛的培养基粉末于超高压提取容器中后按照液料比为70∶1 mL/g(即蒸馏水体积与培养基粗粉质量的比例)加入蒸馏水,搅拌均匀使其充分润湿,放入真空封装机中抽真空确保容器中无气泡,再放入超高压的处理室,在处理室中加入加载介质自来水,用深度尺检测液面高度合适为止,取走深度尺后将柱塞推至加压位置,关上超高压主机防护门,开始加压。超高压处理条件采用经过预实验优化后的工艺条件:压力400 MPa,处理时间15 min,迅速卸压,处理完毕得到提取处理液。提取液离心以后将上清液收集,残渣再用相同液料比加入蒸馏水进行第2次超高压提取,工艺条件与第1次的提取参数相同,提取后离心得第2次上清液,合并上清液。取适量上清液过0.45 μm微孔滤膜,得到滤液至1.5 mL棕色进样瓶中,供高效液相色谱法分析测得提取液中虫草素含量。
2.3.2超声波水提取法[10]
准确称取0.5 g北虫草培养残基粉末置于装有80 mL蒸馏水的100 mL烧杯中,在超声波功率500 W,频率26 kHz条件下提取3 h冷却后用100 mL容量瓶定容。取样液离心过滤,收集1.5 mL滤液于棕色进样瓶中,供高效液相色谱法分析测得提取液中虫草素含量。
2.3.3闪式提取法
称量北虫草培养残基10 g(精确至0.01 g)于闪式提取容器中,以料液比1∶35(即m(残基)∶V(水)= 1 g∶35 mL)加入蒸馏水,在转速8000r/min下闪式提取12 min,提取液在6 000 r/min下离心10 min,残渣同法再提取一次,合并上清液。取适量上清液过0.45 um微孔滤膜,得到滤液至1.5 mL棕色进样瓶中,供高效液相色谱法分析测得提取液中虫草素含量。
2.4陶瓷膜除杂
[11],将超高压提取液离心后,取上清液过150 ku陶瓷膜,在频率30%~40%,压强0.02~0.1 MPa,温度23~30℃条件下保留透过液,再次过15 ku陶瓷膜除杂,频率、压力和温度与第一次保持一致。经过初步除杂的透过液浓缩后冻干得到虫草素粗提取。
2.5高效液相色谱法定量测定虫草素
采用高效液相色谱法对超高压提取清液中虫草素的含量进行了测定,色谱条件为:色谱柱C18柱(250 mm×2.6 mm,5 μm);预柱为ODS(10 mm× 4.6 mm,5 μm);流动相为V(乙腈)∶V(水)=5∶95;体积流速1 mL/min;进样量10 μL;紫外检测波长260 nm;柱温35℃。
标准曲线的绘制:准确称取虫草素标准品10 mg于100 mL容量瓶中,用流动相溶解并定容作为标准液,质量浓度为100 μg/mL。准确吸取100 μg/ mL的虫草素母液0.1,0.2,0.5,1.0,2.0,5.0 mL于10 mL容量瓶中,用水定容、摇匀。按参考色谱条件测定,以虫草素质量浓度1.00,2.00,5.00,10.00,20.00,50.00 μg/mL为横坐标,相应的峰面积为纵坐标绘制标准曲线,求线性回归方程。
2.6高速逆流色谱分离制备
2.6.1溶剂系统的选择
采用高速逆流色谱分离制备样品时,最关键的环节是溶剂系统的选择。溶剂系统选择的原则主要在于首先不造成样品的分解或变性;样品在体系中要有足够大的溶解度;溶剂系统稳定,固定相保留率最好在50%~70%;最后样品在两相溶剂体系中的分配系数合适,最好是1。常见的溶剂系统根据极性可以分为三大类:疏水性、中等疏水性和亲水性体系。可以通过待分离物质的性质来寻找合适的溶剂系统,体系中各组分的组成和比例可根据样品的溶解度来筛选。通过分析虫草素的极性、溶解度、酸碱度等理化性质,本研究应用经典体系之一的乙酸乙酯体系,也是亲水性体系来分离制备虫草素。
2.6.2分配系数的测定[12]
称取1~2 mg粗提物加入分层的两相溶剂体系中,充分混匀分层后,取上相1 mL经高效液相色谱(HPLC)检测,上相峰面积记录为A1;取下相1mL经HPLC检测,下相峰面积记录为A2,分配系数K值计算公式:K=A1/A2。
2.6.3样品溶液的制备
准确称取虫草素粗提物样品400 mg于试管中,加入10 mL上相和10 mL下相使其溶解,超声脱气,用于HSCCC分离。
2.6.4HSCCC的操作流程
按比例配置溶剂体系倒入分液漏斗中,将其反复多次振荡摇匀,静置约10 min,即出现明显分层,后将两相分别移入干净干燥的两个试剂瓶中,放置超声震动仪中超声脱气20 min后放至室温。提前打开恒温循环水浴锅预热,设置主机温度28℃,然后以流速30 mL/min泵入上相(固定相),再停泵以主机转速900 r/min,流速3 mL/min泵入下相,在出液端用干净的量筒接液并计算体系的固定相保留率。当体系达到动力学平衡后开启检测器,基线稳定后开始手动注入提前用各10 mL体积上、下相溶解的虫草素粗提样品,开启检测器,检测波长254 nm,同时进行图谱采集,根据记录信号的出峰情况手动收集组分。
2.7虫草素结构鉴定
虫草素结构用5975C质谱仪鉴定,质谱条件参考文献[13]:电喷雾离子源(electrospray ionization,ESI),正离子模式;离子源温度325℃;毛细管电压3 500 V;毛细管出口电压109.8 V;多反应监测模式(MRM);虫草素252[M+H]+。
2.8动物饲养与模型建立
昆明小鼠:60只SPF级,雌雄各半,4~6周龄,体重18~22 g,购自湖北省实验动物研究中心[合格证号:SYXK(鄂)2008-0014]。保持饲养房室温18~22℃,相对湿度50%~60%,自然光照,以全价营养饲料喂养,自由进食、饮水。
小鼠S180肿瘤模型建立:收集对数生长期S180小鼠腹水瘤细胞,用无菌生理盐水稀释,将密度调整为(2~3)×106个/mL,制成细胞悬液。随机选取小鼠10只,每只腹腔注射细胞悬液0.4 mL。约1周后,小鼠腹部明显涨大、凸起,将小鼠颈椎脱臼处死,于超净台内无菌抽取乳白色腹水液。用生理盐水稀释,调整细胞数为(1~2)×107个/mL。随机选取小鼠50只,雌雄各半,取0.2 mL接种于每只小鼠右上肢腋部皮下处。瘤细胞悬液接种前,均用0.4%台盼蓝染色,计算活细胞数为90%以上。从抽取腹水开始,至最后一只小鼠接种完毕,总时间需控制在1 h以内。
分组给药:接种24 h后,将小鼠随机分为5组,每组10只,雌雄各半。具体给药分组如下:阴性对照组A:蒸馏水(100 mL/(kg·d),ig)+生理盐水(100 mL/(kg·d),ip)。阳性对照组B:蒸馏水(100 mL/(kg·d),ig)+环磷酰胺(20 mg/(kg·d),ip)。高剂量组C:虫草素(100 mg/(kg·d),ig)+生理盐水(100 mL/(kg·d),ip)。中剂量组D:虫草素(50mg/(kg·d),ig)+生理盐水(100 mL/(kg·d),ip)。低剂量组E:虫草素(25 mg/(kg·d),ig)+生理盐水(100 mL/(kg·d),ip)。按照以上给药剂量和途径,连续饲喂21 d(注:ip腹腔注射,ig灌胃)。
2.9抑瘤率的测定
末次给药、禁食24 h后,颈椎脱臼法处死小鼠,完整剥离瘤块并称重,并按式(1)计算瘤重抑制率(IR)。
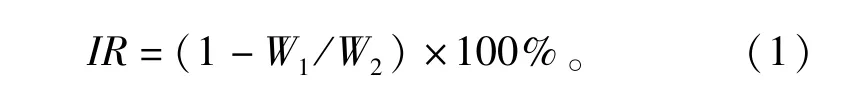
式(1)中,W1为实验组平均瘤重,g;W2为对照组平均瘤重,g。
3 结果与分析
3.1标准曲线的建立
标准曲线浓度为1.00,2.00,5.00,10.00,20.00和50.00 μg/mL,按参考色谱条件测定,以虫草素质量浓度为横坐标,相应的峰面积为纵坐标绘制标准曲线(图1)。二者的函数关系为:y=27 523x+7165.5,R2=0.999 6,表明在1~50 mg/L的浓度范围内,虫草素的峰面积与标样浓度之间呈良好的线性关系。

图1 虫草素标准曲线Fig.1 Standard carve of cordycepin
3.23种不同提取方式下北虫草培养残基中虫草素含量
通过比较超高压提取、闪式提取和超声波提取北虫草培养残基中虫草素,得出不同提取方式下虫草素含量,结果见表1。

表1 3种方法提取北虫草培养残基中虫草素的得率Tab.1 Extraction yield of cordycepin from Cordyceps militaris medium by three methods
由表1可知,超高压提取法提取北虫草培养残基中的虫草素得率最高,且提取时间上明显比超声波提取缩短,优于闪式提取和超声波提取,因此采用超高压提取虫草素的方法是高效可靠的。
3.3陶瓷膜过滤超高压提取液实验
虫草素标准品HPLC色谱见图2。超高压提取液在通过陶瓷膜前后的高效液相色谱图分别为图3和图4。从色谱图中可以看出,超高压提取液中物质很杂,特别是高效液相色谱图前面部分有很多杂质峰,但尽管如此,在14.610 min仍有一很高的色谱峰,其保留时间与标准色谱图(图2)相一致,这就是虫草素,峰表显示含量为44.86%。由于虫草素粗提品含有较多的杂质,直接用于高速逆流色谱进行分离纯化难度比较大,于是将超高压提取液先后通过150 ku和15 ku陶瓷膜进行除杂。采用高效液相色谱法对陶瓷膜透过液中虫草素的含量进行了测定,图谱显示色谱图前面的杂质峰有减少,为后续HSCCC纯化减少了难度,且含量提高到了49.56%。本研究试验数据显示,10 g北虫草培养残基粉末超高压提取后直接浓缩冻干后得到粗提物2.161 g,而经过陶瓷膜除杂后再冻干得到的粗提物为0.763 g,可知,通过陶瓷膜截留了液体中大部分悬浮颗粒和引起浊度升高的大分子胶体物质及其他杂质,在较短的时间内有效并充分地除去杂质,得到质量较好纯度较高的虫草素粗品。

图2 虫草素标准品的HPLC色谱Fig.2 HPLC chromatogram of cordycepin standard
3.4高速逆流色谱分离条件选择
HSCCC分离的样品在两相溶剂体系中合适的分配系数K值为0.67~1.50[14],当K值过小时,峰之间的分离度较差;当K值过大时,出峰时间太长且峰形变宽[15]。根据分离化合物特性,考察了虫草素在6个溶剂系统中的K值,结果见表2。
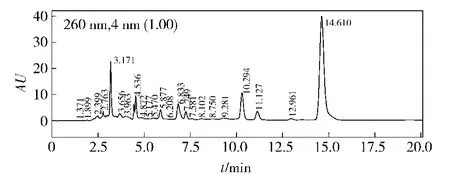
图3 超高压提取后虫草素的HPLC色谱Fig.3 HPLC chromatogram of cordycepin extracted by ultra high pressure

图4 超高压提取液透过陶瓷膜后虫草素的HPLC色谱Fig.4 HPLC chromatogram of cordycepin filtrated by ultrafiltration ceramic membranes
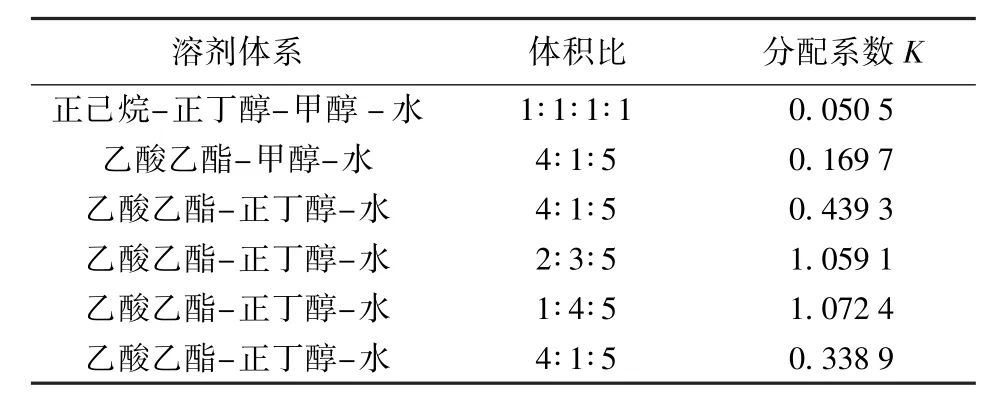
表2 不同溶剂系统的分配系数Tab.2 Partition coefficient of different solvent systems
由表2可知,虫草素在V(乙酸乙酯)∶V(正丁醇)∶V(水)=1∶4∶5和2∶3∶5的溶剂系统中的K值分别为1.072 4和1.059 1,K值均在合适范围内,但在体积比为1∶4∶5时,虫草素与其他化合物不能完全分离且谱图峰形未达到基线分离,且固定相保留率仅为40.67%。因此选择V(乙酸乙酯)∶V(正丁醇)∶V(水)=2∶3∶5分离虫草素。
在逆流色谱中,分离温度、主机转速和流动相流速影响固定相保留率和组分的分配系数。在主机转速为900 r/min,流动相流速为3.0 mL/min条件下考察了不同温度(15,20,25,30,35℃)对虫草素固定相保留率和分配系数的影响,结果发现,分离温度为28℃时固定相保留率为52.7%,分离时间小于3 h。实验从400 mg虫草素粗品中可制备得虫草素11.10 mg。HSCCC色谱图见图5,根据色谱图接收3个流分,即“Ⅰ”,“Ⅱ”和“III”。
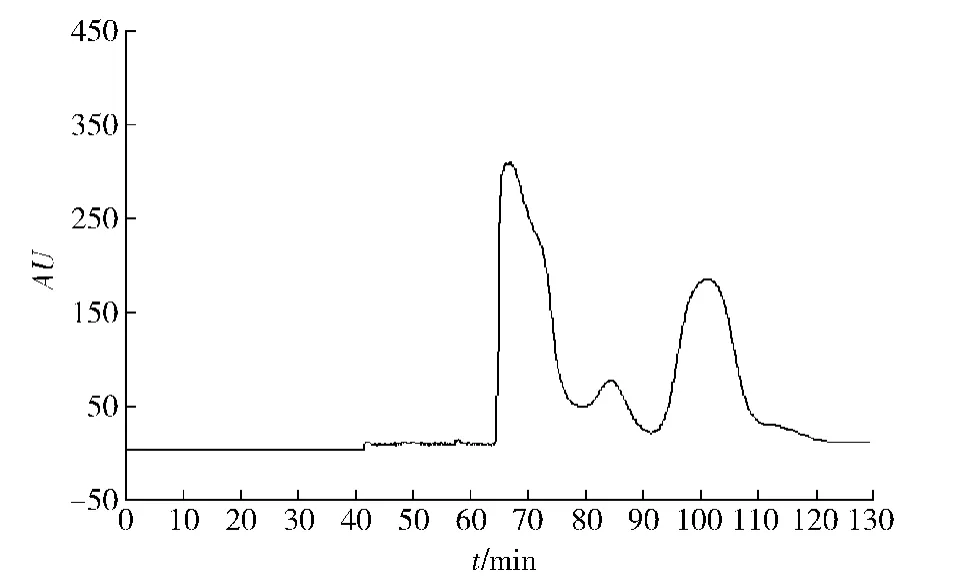
图5 虫草素粗提物的HSCCC色谱Fig.5 High speed counter-current chromatograms of cordycepin
3.5产物纯度和化合物结构的鉴定
HSCCC分离所得流分“III”经HPLC检验并与虫草素标准品比较,见图6,峰纯度为97.6%。对HSCCC分离得到的化合物在m/z 50~1 000范围内进行质谱扫描,得到该化合物的质谱图见图7和m/z 251.8[M+ H]+,说明化合物的分子量为251,与虫草素的分子量相同。进一步将m/z=251.8 u作为母离子进行二级质谱分析,得到m/z 135.8 u等碎片离子,这与文献[16-17]报道一致,证明分离的化合物为虫草素。
3.6抗肿瘤活性研究
按照2.8所述选择小鼠S180肿瘤模型对高速逆流色谱分离制备的虫草素的体内抗肿瘤活性进行研究,具体实验结果如表3。
由表3可知,通过高速逆流色谱从北虫草固体培养残基中分离制备得到的虫草素对小鼠S180移植瘤有较强的抑制效果,随剂量增加抑瘤效果增强,且通过与阳性对照药物进行比对,高剂量组的抑瘤率高于抗肿瘤药CTX,体内试验直观的表明了虫草素良好的抑瘤效果。
4 结 论
本研究通过比较闪式提取、超声波提取和超高压提取北虫草固体培养残基中虫草素,发现超高压提取虫草素得率更高、能耗更小以及效率更高。超高压提取北虫草中虫草素的工艺参数为:超高压提取压力400 MPa,料液比1∶70,粉碎度20目,保压时间12 min,提取2次。在此工艺条件下提取400 g北虫草培养残基中虫草素得超高压提取液经过陶瓷膜初步除杂,真空浓缩后冷冻干燥得到虫草素粗提物26.22 g,研究表明超高压提取虫草素是一种高效可靠的方法。
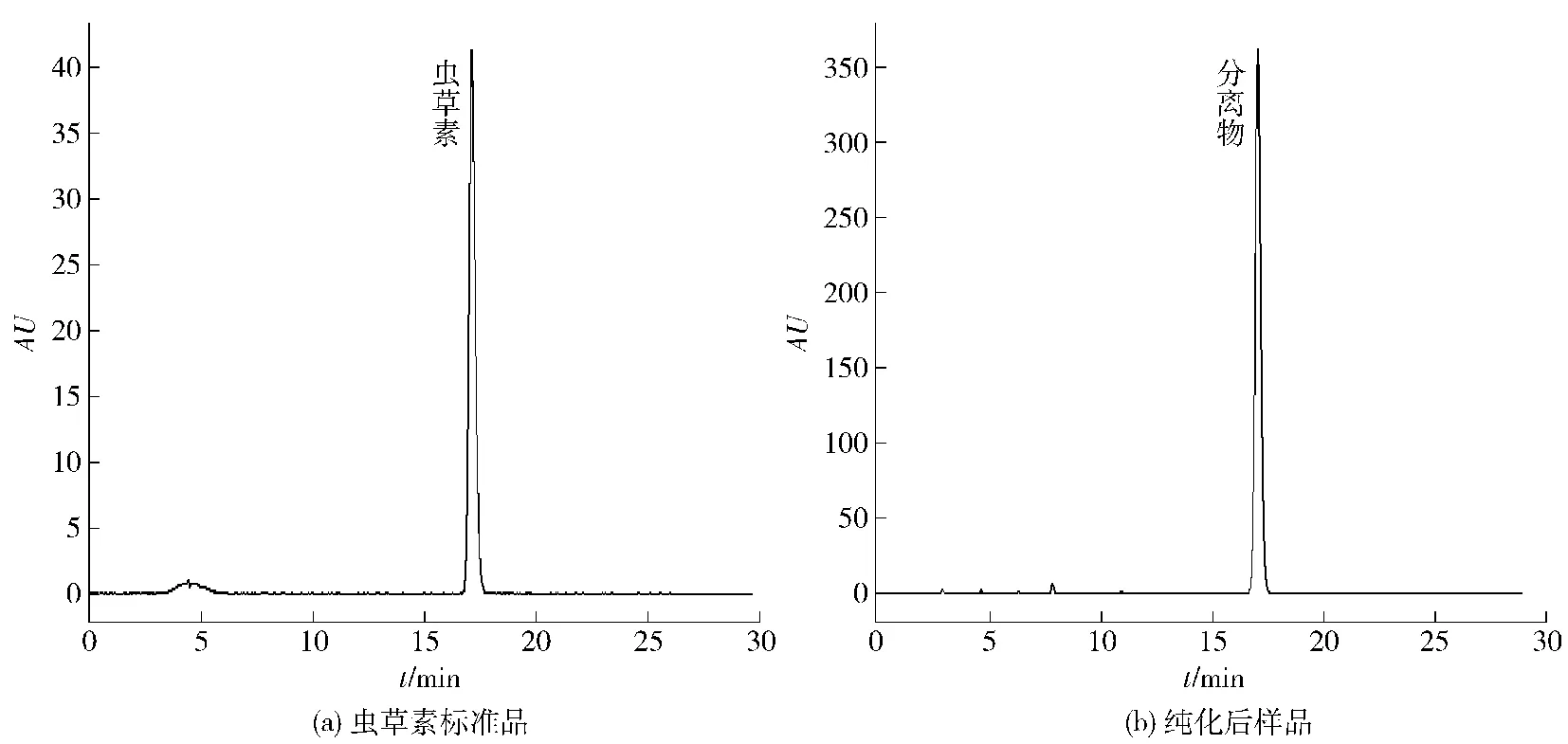
图6 标准品和HSCCC分离纯化后样品的HPLC分析Fig.6 HPLC chromatograms of stand and HSCCC purified supernatant
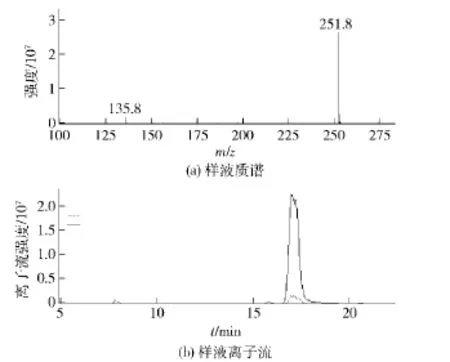
图7 HSCCC分离样液的LC-MS/MS提取质谱和离子流Fig.7 LC-MS/MS selection chromatogram and mass spectrum of HSCCC purified supernatant

表3 虫草素对小鼠S180肉瘤的瘤重抑制率Tab.3 Tumor weight inhibition of cordycepin in mouse S180
对虫草素粗提物进行了高速逆流色谱分离纯化,选择V(乙酸乙酯)∶V(正丁醇)∶V(水)=2∶3∶5作为虫草素分离体系。从400 mg虫草素粗品中得到虫草素11.10 mg且纯度达到97.6%,提供了一种快速制备高纯度虫草素的方法。
通过小鼠S180体内试验发现从北虫草固体培养基中富集纯化的虫草素具有较强的抗肿瘤活性,当单独使用虫草素剂量为100 mg/(kg·d-1)时,对小鼠S180肉瘤抑制率达到64.48%,明显高于抗肿瘤药物环磷酰胺的抑制率。本研究不仅充分证明北虫草固体培养残基可以作为抗肿瘤药物或保健品的较佳原料,同时也为培养基的开发与利用提供了参考依据。
参考文献:
[1] LIU Zhu,LIANG Zongqi,LIU Aiying.Effect of the components of medium on increasing the content of cordycepin[J].Journal of Fungal Research,2003,1(1):9.
[2] HUANG Lanfang,LIANG Yizeng,GUO Fangqiu,et al. Simultaneous separation and determination of active components in Cordyceps sinensis and Cordyceps militaris by LC/ESI-MS[J].Journal of Pharmaceutical and Biomedical Analysis,2003,33(5):1155-1162.
[3] CHA J Y,AHN H Y,CHO Y S,et al.Protective effect of cordycepin-enriched Cordyceps militaris on alcoholic hepatotoxicity in Sprague-Dawley rats[J].Food and Chemical Toxicology,2013,60(10):52-57.
[4] TULI H S,SANDHU S S,SHARMA A K.Pharmacological and therapeutic potential of cordyceps with special reference to cordycepin[J].3 Biotech,2014,4(1):1-12.
[5] TULI H S,SHARMA A K,SANDHU S S,et al. Cordycepin:a bioactive metabolite with therapeutic potential[J].Life Sciences,2013,93(23):863-869.
[6] 李娟,王颜红,王世成,等.HPLC测定人工蛹虫草培养基中的虫草素[J].光谱实验室,2012,29(6):3300-3304.
LI J,WANG Y H,WANG S C,et al.Determination of cordycepin in cultured Cordyceps medium by HPLC[J]. Chinese Journal of Spectroscopy Laboratory,2012,29(6):3300-3304.
[7] ADRIAN W,EUGENE P M,CONSTANCE M M,et al. Preparative separation of isomeric sulfophthalic acids by conventional and pH-zone-refining counter-current chromatography[J].Journal Chromatography A,2002,966:111-118.
[8] LI Huabin,CHEN Feng,ZHANG Tianyou,et al.Preparative isolation and purification of lutein from the microalga Chlorella vulgaris by high-speed counter-current chromatography[J].Journal Chromatography A,2001,905(1-2):151-155.
[9] BERTHOD A.Countercurrent chromatography,the support-free liquid stationary phase,comprehensive analytical chemistry[M].Amsterdam:Elsevier Science B V,2002:201-260.
[10] 中华人民共和国农业部.虫草制品中虫草素和腺苷的测定高效液相色谱法:NY/T 2116—2012[S].北京:中国标准出版社,2012.
[11] 陈建行,刘鹭,孙颜君,等.酪蛋白胶束粉的陶瓷膜分离生产工艺[J].农业工程学报,2013,29(9):256-266. CHEN J H,LIU L,SUN Y J,et al.Pilot scale production process of micellar casein concentrate powder[J]. Transactions of the Chinese Society of Agricultural Engineering,2013,29(9):256-266.
[12] 刘永玲,陈涛,陈晨,等.半制备型高速逆流色谱分离制备铁棒锤根中的一种咪唑生物碱[J].色谱,2014,32(5):543-546.
LIU Y L,CHEN T,CHEN C,et al.Isolation and preparation of an imidazole alkaloid from radix of Aconitum pendulum Busch by semi-preparative high-speed countercurrent chromatography[J].Chinese Journal of Chromatography,2014,32(5):543-546.
[13] 黄兰芳,郭方遒,梁逸曾,等.HPLC-ESI-MS测定冬虫夏草和蚕蛹虫草中腺苷和虫草素含量[J].中国中药杂志,2004,29(8):762-764.
HUANG L F,GUO F Q,LIANG Y C,et al.Determination of adenosine and cordycepin in Cordyceps sinensis and C.militarris with HPLC-ESI-MS[J].China Journal of Chinese Materia Medica,2004,29(8):762-764.
[14] 曹学丽.高速逆流色谱分离技术及应用[M].北京:化学工业出版社,2005:40-42.
[15] CONWAY W D,PETROSKI R J.Modern counter-currentchromatography[M].Washington:American Chemical Society,1995:78-86.
[16] 刘静明,钟裕容,杨智,等.蛹虫草化学成分分析[J].中国中药杂志,1989,14(10):32-33.
[17] 陈顺志,褚景芝.虫草素及2'-脱氧腺苷的超导核磁共振与红外光谱鉴别[J].中国抗生素杂志,1996,21(1/2):9-12.
Extraction,Purification,and Antitumor Activity of Cordycepin from Cordyceps Militaris Residue Medium
CHEN Libing1,2,WU Guangxu2,CHENG Wei1,FAN Xiuzhi1,SHI Defang1,SHI Meng3,GAO Hong1,*
(1.Research Institute of Agricultural Products Processing and Nuclear-Agricultural Technology,Hubei Academy of Agricultural Sciences,Wuhan 430064,China;2.College of Life Science,Yangtze University,Jingzhou 434025,China;3.Hubei Xinguan Food Science and Technology Co Ltd,Huangshi 435200,China)
Flash extraction,ultrasonic extraction,and ultra-high pressure extraction technology were used to extract cordycepin from Cordyceps militaris residue medium.The extracting solution was filtered with ceramic membrane and cordycepin was separated and prepared by using high-speed countercurrent chromatography(HSCCC).The product structure was identified by LC-MS/MS.Antitumor activity of cordycepin was tested in mice S180 tumor.The results showed that ultra-high pressure extraction technology was better for cordycepin extraction.Combining a two-phase solvent system composed of ethyl acetate-n-butanol-water(2∶3∶5,V/V/V)with high-speed counter-current chromatography(HSCCC),the cordycepin was purified at 28℃with flow rate of 3.0 mL/min and revolution speed was 900 r/min,while the upper phase was stationary phase and the lower phase was mobile phase.Cordycepin identified was identified by LC-MS/MS and the purity of cordycepin was 97.6%.About 181.90 mg of cordycepin was obtained from 100 g of Cordyceps militaris residue medium.The inhibition rate of cordycepin was 64.48% at doses of 100 mg in vitro test.
Cordyceps militaris medium;cordycepin;extraction;high speed counter-current chromatography;antitumor activity
TS209;R284.2
A
10.3969/j.issn.2095-6002.2016.04.013
2095-6002(2016)04-0073-07引用格式:陈丽冰,吴光旭,程薇,等.北虫草培养残基中虫草素的提取纯化及抗肿瘤活性[J].食品科学技术学报,2016,34(4):73-79.
(责任编辑:李 宁)
20150429
公益性行业(农业)专项(201303080);湖北省科技支撑计划项目(2015BBA205);湖北省农业科技创新中心资助项目(2016-620-000-001-033)。
陈丽冰,女,硕士研究生,研究方向为食品生物技术;
*高 虹,男,研究员,博士,主要从事食药用菌深加工和功能食品开发方面的研究。通信作者。

