茶鲜叶中有机磷农药残留分析
刘腾飞,董明辉,*,张 丽,杨代凤,顾俊荣
(1.江苏太湖地区农业科学研究所农产品质量认证中心,江苏苏州 215155;2.苏州市职业大学教育与人文学院,江苏苏州 215104)
茶鲜叶中有机磷农药残留分析
刘腾飞1,董明辉1,*,张 丽2,杨代凤1,顾俊荣1
(1.江苏太湖地区农业科学研究所农产品质量认证中心,江苏苏州 215155;2.苏州市职业大学教育与人文学院,江苏苏州 215104)
为监测茶鲜叶中有机磷农药残留污染状况,应用超声波提取、分散固相萃取净化、气相色谱检测,建立了一种简单、快速测定茶鲜叶中7种有机磷农药(敌敌畏、乐果、毒死蜱、甲基对硫磷、马拉硫磷、杀螟硫磷和三唑磷)残留的分析方法。样品采用φ(乙酸)=1%的乙腈溶液超声提取,乙二胺-N-丙基硅烷、十八烷基硅烷键合硅胶和石墨化炭黑混合吸附剂分散萃取净化,DB-1701毛细管柱程序升温分离,火焰光度检测器测定,基质外标法定量。结果表明,在0.01~4.00 mg·L-1范围内,7种有机磷农药的峰面积与其浓度呈良好的线性关系,相关系数均大于0.998,方法的检出限为0.003 4~0.013 6 mg·kg-1,定量限为0.012~0.046 mg·kg-1,加标回收率为77.7%~98.2%,相对标准偏差(n=5)为2.4%~8.7%。该方法操作简单、结果可靠、溶剂用量少,对检测条件要求低,适用于茶鲜叶中7种有机磷农药残留的检测。
茶鲜叶;有机磷农药;分散固相萃取;气相色谱
LIU Tengfei,DONG Minghui,ZHANG Li,et al.Determination of organophosphorus pesticide residues in fresh tea leaves[J].Journal of Food Science and Technology,2016,34(4):66-72.
茶鲜叶是从茶树新梢上采摘下来的鲜活的芽或叶,作为加工各类成品茶的原料,其质量优劣、安全与否直接影响到茶叶产品的质量安全,特别是近年来的农药残留问题,已成为影响茶叶质量安全的重要因素之一。目前,有关茶叶农药残留的分析研究已有不少报道,但主要集中在成茶上,对茶鲜叶中的残留研究的较少。由于茶鲜叶提取物中含有比成茶更多的干扰物质,例如简单儿茶素等多酚类及叶绿醇等色素类,因此文献报道的茶叶中农药残留的检测方法[1-3]不能直接用于茶鲜叶基质的测定。国内虽有一些关于茶鲜叶农药残留的研究报道,但仅涉及六六六、滴滴涕等有机氯农药以及少数几种菊酯类农药的检测[4-5],对茶鲜叶中有机磷农药的检测尚未见报道,而且在茶鲜叶农药残留提取过程中,上述报道主要运用传统的振荡提取、均质提取、液液萃取等方法,净化方式则主要使用浓硫酸磺化法和柱层析净化法,操作烦琐,耗费时间,溶剂用量大,已无法满足现代茶叶农药残留快速分析的要求。
分散固相萃取(dispersive solid phase extraction,DSPE)是2003年美国农业部的Anastassiades等提出的一种简便、快速、高效、经济的样品前处理技术,它利用直接在试样的提取液中加入的吸附剂填料对基质中干扰杂质(色素、甾醇、糖类、有机酸等)的吸附作用,达到除杂净化的目的。该技术适用性强、应用范围广,根据样品的性质及目标物的特点,可以选择适合的提取溶剂和吸附剂填料,以满足不同基质的分析需要。与传统的固相萃取、柱层析等净化方法相比[6-9],DSPE可省去装柱、过柱及大量溶剂洗脱等操作,样品制备速度快、分析成本低、回收率高、结果准确,目前已在食品[10-12]农药残留检测中得到了广泛应用。
本文将DSPE方法用于茶鲜叶样品前处理,结合气相色谱-火焰光度法(GC-FPD)检测,建立了茶鲜叶中敌敌畏、乐果、毒死蜱、甲基对硫磷、马拉硫磷、杀螟硫磷和三唑磷7种有机磷农药残留的分析方法。该方法的建立对茶叶有机磷农药的过程监测,从源头控制茶叶有机磷农药残留,提高饮茶安全性提供了一定的参考。
1 材料与方法
1.1材料与试剂
有机磷农药标准溶液包括:敌敌畏、乐果、毒死蜱、甲基对硫磷、马拉硫磷、杀螟硫磷、三唑磷,质量浓度1 000 mg·L-1,农业部环境保护科研监测所。乙二胺-N-丙基硅烷(primary secondary amine,PSA)、石墨化炭黑(graphitized carbon black,GCB),中国Agela Technologies公司。十八烷基硅烷键合硅胶(octadecylsilane bonded silica,C18),美国Sepax Technologies公司。乙腈、丙酮、乙酸、无水乙酸钠、无水MgSO4(620℃灼烧4 h)均为分析纯,上海国药集团化学试剂有限公司。
茶鲜叶样品取自苏州东洞庭山碧螺春茶园。
1.2仪器与设备
7890A型气相色谱仪(配FPD检测器),美国Agilent公司;KQ-500DE型超声波清洗器,昆山超声仪器公司;TG16-WS型高速离心机,湖南湘仪实验仪器公司;HSC-24B型氮吹仪,天津恒奥科技公司;VM-10型涡旋振荡器,韩国Daihan Scientific公司。
1.3实验方法
1.3.1标准溶液配制
分别移取1 000 mg·L-1的7种有机磷农药标准品1.0 mL于20 mL容量瓶中,用丙酮定容,配成浓度为50 mg·L-1的单标溶液。根据各农药在FPD检测器上的响应,取敌敌畏单标溶液0.5 mL,乐果、三唑磷单标溶液各2.0 mL,其余有机磷单标溶液各1.0 mL于10 mL容量瓶中,用丙酮定容,得混合标准储备液,放置4℃冰箱待用。
1.3.2样品前处理
取茶鲜叶样品搅碎并混合均匀,称取5.0 g(精确至0.1 g),于50 mL聚四氟乙烯离心管中,加入10 mL φ(乙酸)=1%的乙腈溶液和2 g无水乙酸钠混匀,超声提取15 min,加入1 g无水硫酸镁,涡旋2 min,9 000 r/min条件下离心4 min。取4 mL上层提取液于装有0.15 g C18,0.15 g PSA,0.12 g GCB和0.3 g无水硫酸镁的离心管中,涡旋2 min,于9 000 r·min-1条件下离心5 min。取2.0 mL上清液于刻度试管中,50℃水浴条件下氮吹至近干,用丙酮定容至1.0 mL,在混合器上混匀,过0.22 μm有机系滤膜上机检测。
1.3.3色谱条件
色谱柱DB-1701(30 m×0.32 mm×0.25 μm);进样口温度220℃;升温程序为90℃保持1 min,以20℃·min-1升至200℃保持9 min,以30℃·min-1升至245℃保持8 min;FPD温度245℃;载气为高纯氮气,流速3.0 mL·min-1(恒流速);氢气流速75 mL·min-1;空气流速100 mL·min-1;进样量1.0 μL,不分流进样。
2 结果与分析
2.1提取条件的选择
乙腈对不同极性有机磷农药溶解度好,提取效率高,且对样品基质中的蜡类、脂肪等非极性成分提取能力弱,能够有效减少提取液中杂质[13],故以乙腈为提取溶剂,考虑到7种供试有机磷农药具有弱酸性,本试验在茶鲜叶样品中添加100 μL 7种供试农药的混合标准储备液,比较了乙腈、乙酸-乙腈(φ(乙酸)=1%)溶液对测定结果的影响,见表1。

表1 不同提取溶剂的回收率结果Tab.1 Recoveries of different extraction solvents%
根据表1结果,2种提取溶剂对7种供试农药的提取效率相当,分别为72.3%~92.2%,75.8%~93.8%,均满足分析方法的要求,但乙酸-乙腈(φ(乙酸)=1%)样品溶液的杂质较少、色谱图背景干扰小,且试验间平行性较好,故本实验采用乙酸-乙腈溶液(φ(乙酸)=1%)作为提取溶剂。实验将提取溶剂用量确定为10 mL,即体积相当于2倍量的样品质量,既保证了目标农药的充分提取,又节省试剂,减少环境污染。
2.2提取方式的选择
实验比较了振荡、匀浆和超声三种常见提取方式,振荡提取操作简便,但要达到较好的回收率所需时间较长,一般需要1~2 h,效率较低。匀浆提取速度快、效果好,单个样品只需几分钟,但大量样品时须逐个提取,时间长,效率低,而且连续提取时高速匀浆机的刀头清理不干净,容易造成样品间的交叉污染,影响检测结果的准确性。而超声提取操作简单,速度快,所需时间小于30 min,且提取过程无需人员看守,可同时处理大批量样品,因此本实验采用超声提取方式。
由于超声波在运行过程中会产生热量,长时间的超声会造成有机磷农药的分解,降低分析的灵敏度和准确度,考察了5~20 min的超声时间对茶鲜叶添加100 μL 7种供试有机磷农药混合标准储备液后的提取效果,实验平行3次,见图1。
由图1可知,当超声时间为10~20 min时茶鲜叶中7种有机磷农药的回收率均在70%以上,且平行性较好,为节省前处理时间并保证提取效果,选择超声时间为15 min。

图1 超声时间对茶鲜叶中7种有机磷农药的回收率影响Fig.1 Effects of ultrasonic time on recovery rates of 7 organophosphorus pesticides in fresh tea leaves
2.3净化条件的选择
实验采用DSPE方式作为去除杂质的净化手段,由于茶鲜叶中含有甾醇、脂肪酸、油类、蜡类等杂质,且色素含量高,故选用PSA、C18和GCB混合吸附剂分散净化,PSA用于去除提取液中的糖类、脂肪酸和极性色素,C18用于除去甾醇和其他非极性干扰物,GCB能够强烈吸附色素类物质,对基质的颜色净化效果较好[14-15]。
各种净化剂在去除杂质的同时也可能对目标农药产生吸附,取4.0 mL空白茶鲜叶样品提取液,加入100 μL 7种有机磷农药混合标准储备液,混匀后经不同质量C18、PSA和GCB涡旋净化,处理后的回收率数据见表2。
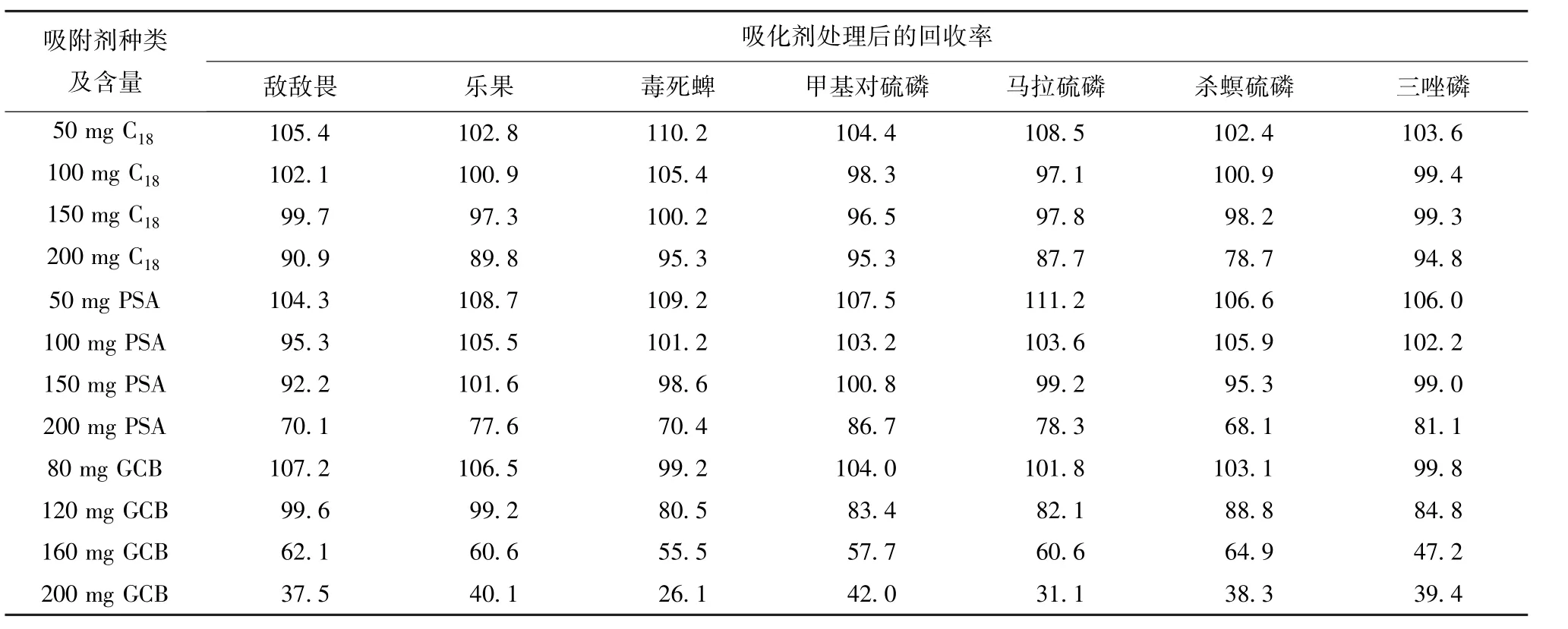
表2 7种有机磷农药经C18,PSA和GCB净化剂处理后的回收率Tab.2 Recoveries of 7 organophosphorus pesticides after purified by C18,PSA,and GCB%
由表2可以看出,C18、PSA和GCB 3种净化剂对农药的吸附保留能力随用量的增加而逐渐增强,其中C18对目标农药的吸附保留随用量的增加变化较小,但是当C18用量大于150 mg时,杀螟硫磷的回收率低于80%;PSA对目标农药的吸附相对较强,当用量大于150 mg时,敌敌畏、乐果、毒死蜱、马拉硫磷和杀螟硫磷的回收率均已小于80%;3种净化剂中,GCB对目标农药的吸附较大,当用量大于120 mg时,目标农药的回收率已小于65%,当用量为120 mg时,净化后的样品溶液颜色较浅,整体回收率较好。
综合考虑净化剂去杂质特性和对目标农药的吸附情况,本研究选择加入150 mg C18、150 mg PSA和120 mg GCB进行分散固相萃取净化,对茶鲜叶空白样品和加标样品进行分析,结果见图2和图3。

图2 茶鲜叶空白样品色谱Fig.2 Gas chromatogram of fresh tea leaves

图3 茶鲜叶加标样品色谱Fig.3 Gas chromatogram of fresh tea leaves with fortified organophosphorus pesticides
由图2和图3可以看出,在该净化条件下,7种有机磷农药出峰处无明显的干扰杂峰,表明本方法的净化条件选择合适。
2.4基质效应
由于采用GC法分析样品中的农药残留时极易受到基质效应的影响[16],故对相同浓度的丙酮混合标准溶液和基质匹配标准溶液进行了对比检测,结果见图4。
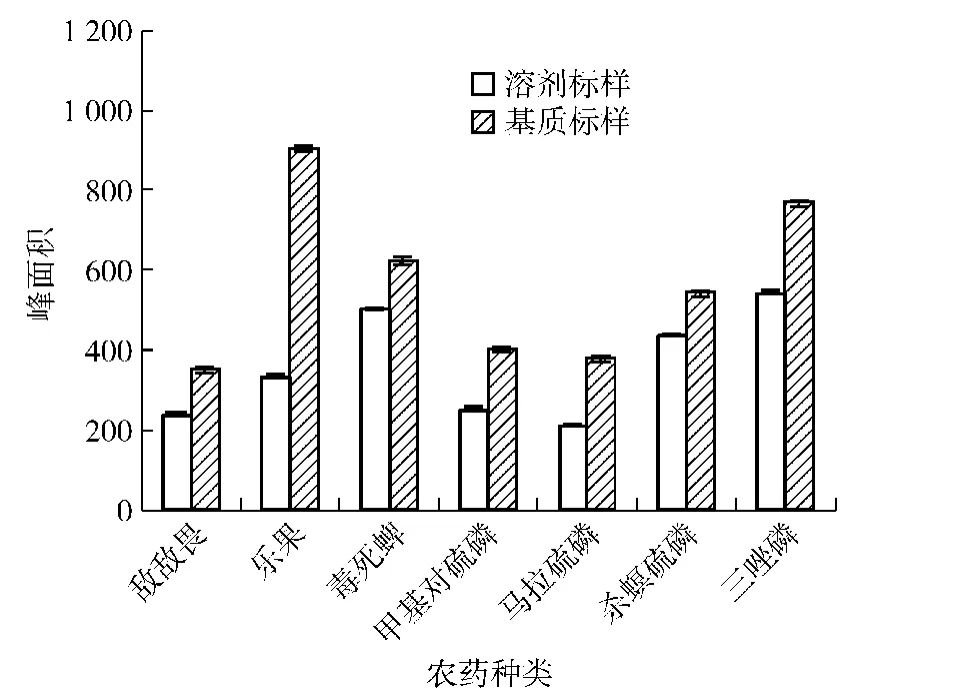
图4 7种有机磷农药在茶鲜叶中的基质效应Fig.4 Matrix effect of 7 organophosphorus pesticides in fresh tea leaves
由图4可知,这7种有机磷农药基质匹配标准溶液的峰面积均明显高于丙酮混合标准溶液的峰面积,表明在检测茶鲜叶中这7种有机磷农药时存在基质增强效应。故在使用外标法定量时,采用空白样品的净化液稀释标样,以消除基质干扰,减少误差。
2.5线性范围和检出限
取7种有机磷农药混合标准储备液,以空白茶鲜叶样品的净化液为溶剂,分别配制敌敌畏质量浓度为0.010,0.025,0.050,0.250,0.500,1.000 mg·L-1,乐果、三唑磷质量浓度为0.04,0.10,0.20,1.00,2.00,4.00 mg·L-1及毒死蜱、甲基对硫磷、马拉硫磷、杀螟硫磷质量浓度为0.02,0.05,0.10,0.50,1.00,2.00 mg·L-1的基质匹配系列标准溶液,在选定色谱条件下测定,以各农药组分的峰面积(y)对质量浓度(x,mg·L-1)绘制标准曲线,线性范围、回归方程和相关系数见表3。表3结果表明7种有机磷农药在各自浓度范围内线性良好,相关系数(r)均大于0.998。以最低添加水平色谱图中3倍噪声为检出限(limit of detection,LOD),10倍噪声为定量限(limit of quantification,LOQ),7种有机磷农药在茶鲜叶中的LOD和LOQ结果也见表3。

表3 7种有机磷农药的标准曲线、线性范围、相关系数、检出限和定量限Tab.3 Linear equations,linear ranges,correlation coefficients,LOD,and LOQ for 7 organophosphorus pesticides
2.6方法的准确度和精密度
称取5.0 g茶鲜叶空白样品3份,分别加入50,100,500 μL 1.3.1中7种有机磷农药混合标准储备液(各农药添加水平见表4),充分混匀,静置1 h,按照1.3.2样品前处理和1.3.3色谱条件测定,对每个添加水平作5个平行,考察方法的准确度和精密度,结果见表4。7种有机磷农药在茶鲜叶中的平均回收率为77.7%~98.2%,相对标准偏差为2.4%~8.7%(n=5),均符合农药残留分析的要求[17]。

表4 方法的精密度和加标回收率结果Tab.4 Precision and recovery of method
2.7实际样品分析
利用本研究建的分析方法,检测了从苏州东洞庭山碧螺春茶园随机采集的16份茶鲜叶中敌敌畏、乐果、毒死蜱、甲基对硫磷、马拉硫磷、杀螟硫磷和三唑磷的残留量。结果表明,在16份茶鲜叶样品中均未检出这7种农药残留。
3 结 论
采用φ(乙酸)=1%的乙腈溶液超声提取,PSA、C18和GCB 3种混合吸附剂分散萃取净化,GCFPD检测,建立了同时测定茶鲜叶中7种有机磷农药残留的分析方法,方法的准确度、精密度和灵敏度均满足残留分析的要求。在0.025~1.0 mg/kg的添加水平下,7种有机磷农药的平均回收率为77.7%~98.2%,相对标准偏差(n=5)为2.4%~8.7%,检出限为0.003 4~0.013 6 mg·kg-1,定量限为0.012~0.046 mg·kg-1。该方法操作简便,分析快速,准确可靠,采用GC-FPD作为DSPE方法后续的分析仪器,价格便宜,操作维护简单,易于掌握普及,非常适合在广大基层检测机构推广,为茶叶有机磷农药的过程监测和源头监督检验提供了技术支撑。不过,该方法是以碧螺春绿茶鲜叶为研究对象,对其他品种茶鲜叶是否具有较好的实用性还有待进一步研究。
[1] WU L,HU M,LI Z,et al.Dynamic microwave-assisted extraction online coupled with single drop microextraction of organophosphorus pesticides in tea samples[J].Journal of Chromatography A,2015,1407:42-51.
[2] WANG Xiuhong,CHENG Jing,ZHOU Hongbin,et al. Development of a simple combining apparatus to perform a magnetic stirring-assisted dispersive liquid-liquid microextraction and its application for the analysis of carbamate and organophosphorus pesticides in tea drinks[J].Analytica Chimica Acta,2013,787(13):71-77.
[3] 陈士恒,章晴,史晓梅,等.超声提取-分散固相萃取-气相色谱法测定绿茶中有机磷类农药残留[J].食品科学技术学报,2014,32(5):63-68.
CHEN S H,ZHANG Q,SHI X M,et al.Determination of 13 organophosphorus pesticides residues in green tea by ultrasonic assisted extraction-dispersive solid phase extraction-gas chromatography[J].Journal of Food Science and Technology,2014,32(5):63-68.
[4] 侯如燕,宛晓春,朱旭君.茶鲜叶中拟除虫菊酯类农药残留的检测方法[J].食品与发酵工业,2008,34(8): 137-140.
HOU R Y,WAN X C,ZHU X J.A novel method for determination pyrethroid pesticides in fresh tea leaves with GC-μECD[J].Food and Fermentation Industries,2008,34(8):137-140.
[5] 蒋志斌.气相色谱法测定新鲜茶叶中有机氯农药残留量[J].彭城职业大学学报,2002,17(1):97-99.
[6] 梅文泉,董宝生,刘宏程,等.固相萃取-气相色谱法测定茶叶中多种有机磷农药残留量[J].分析科学学报,2011,27(1):97-100.
MEI W Q,DONG B S,LIU H C,et al.Determination of multi-residues of organophosphorus pesticides in tea by solid phase extraction and gas chromatography[J].Journal of Analytical Science,2011,27(1):97-100.
[7] ANASTASSIADES M,LEHOTAY S J,STAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and“dispersive solidphase extraction”for the determination of pesticide residues in produce[J].Journal of AOAC International,2003,86(2):412-431.
[8] MOINFAR S,HOSSEINI M R.Development of dispersive liquid-liquid microextraction method for the analysis of organophosphorus pesticides in tea[J].Journal of Hazardous Materials,2009,169(1/3):907-911.
[9] ZHENG Xiaoyan,HE Lijun,DUAN Yajing,et al.Poly(ionic liquid)immobilized magnetic nanoparticles as new adsorbent for extraction and enrichment of organophosphorus pesticides from tea drinks[J].Journal of Chromatography A,2014(1358):39-45.
[10] CIEE'SLIK E,SADOWSKA-ROCIEK A,RUIZ J M,et al.Evaluation of QuEChERS method for the determination of organochlorine pesticide residues in selected groups of fruits[J].Food Chemistry,2011,125(2): 773-778.
[11] KAEWSUYA P,BREWER W E,WONG J,et al.Automated QuEChERS tips for analysis of pesticide residues in fruits and vegetables by GC-MS[J].Journal of Agricultural and Food Chemistry,2013,61(10): 2299-2314.
[12] ALBERT A,KRAMER A,SCHEEREN S,et al.Rapid and quantitative analysis of pesticides in fruits by QuEChERS pretreatment and low-temperature plasma desorption/ionization orbitrap mass spectrometry[J]. Analytical Methods,2014,6(15):5463-5471.
[13] MAšTOVSKÁ K,LEHOTAY S J.Evaluation of common organic solvents for gas chromatographic analysis and stability of multiclass pesticide residues[J].Journal of Chromatography A,2004,1040(2):259-272.
[14] 尹鹏,陈红平,刘新,等.5种分散吸附剂对茶叶乙腈提取液组分的吸附作用研究[J].分析试验室,2013,32(6):54-58.
YIN P,CHEN H P,LIU X,et al.Study on effect of five dispersive solid adsorbents on the components of tea extracts by acetonitrile[J].Chinese Journal of Analysis Laboratory,2013,32(6):54-58.
[15] 叶江雷,金贵娥,庄婉娥,等.分散固相萃取净化茶叶中20种农药残留量的GC-μECD测定[J].分析试验室,2011,30(10):115-119.
YE J L,JIN G E,ZHUANG W E,et al.Determination of 20 pesticide residues in tea by DSPE and GC-μECD[J].Chinese Journal of Analysis Laboratory,2011,30(10):115-119.
[16] POOLE C F.Matrix-induced response enhancement in pesticide residue analysis by gas chromatography[J]. Journal of Chromatography A,2007,1158(1/2): 241-250.
[17] 中华人民共和国农业部.农药残留试验准则:NY/T 788—2004[S].北京:中国农业出版社,2004.
Determination of Organophosphorus Pesticide Residues in Fresh Tea Leaves
LIU Tengfei1,DONG Minghui1,*,ZHANG Li2,YANG Daifeng1,GU Junrong1
(1.Quality Certification Center of Agricultural products,Jiangsu Taihu Area Institute of Agricultural Sciences,Suzhou 215155,China;2.College of Education and Humanity,Suzhou Vocational University,Suzhou 215104,China)
To investigate the pollution of organophosphorus pesticides in fresh tea leaves,a simple and rapid analytical method was established for simultaneous determination of seven organophosphorus pesticides(dichlorvos,dimethoate,chlorpyrifos,methyl parathion,malathion,fenitrothion,and triazophos)in fresh tea leaves by ultrasound assisted extraction and dispersive solid phase extraction(DSPE)coupled with gas chromatography.The samples were ultrasonically extracted with acetonitrile(containing 1%acetic acid).Subsequently,the extract was cleaned-up by using primary secondary amine,octadecylsilane bonded silica and graphitized carbon black as adsorbents according to the method of DSPE.Then,the residues were determined by a heated DB-1701 capillary column with flame photometric detector,and quantified using the matrix-matched external standard method.Good linearities between concentrations and peak areas were achieved in the concentration range of 0.01-4.00 mg·L-1for target pesticides,with correlation coefficients higher than 0.998.The average recoveries of target pesticides in fresh tea leaves were 77.7%-98.2%with relative standard deviations(n=5)ranging from 2.4%to 8.7%. The limits of detection for target organophosphorus pesticides were 0.003 4-0.013 6 mg·kg-1and the limits of quantification were 0.012-0.046 mg·kg-1.The method was simple,accurate,solvent saving and without special instrument making it suitable for simultaneous determination of seven organophosphorus pesticides in fresh tea leaves.
fresh tea leaves;organophosphorus pesticides;dispersive solid phase extraction;gas chromatography
TS272.7
A
10.3969/j.issn.2095-6002.2016.04.012
2095-6002(2016)04-0066-07引用格式:刘腾飞,董明辉,张丽,等.茶鲜叶中有机磷农药残留分析[J].食品科学技术学报,2016,34(4):66-72.
(责任编辑:李 宁)
20150819
江苏省农业科技自主创新基金项目(CX(14)2102);苏州市科技支撑项目(SNG201442);苏州市应用基础研究项目(SNY201518)。
刘腾飞,男,助理研究员,硕士,主要从事农产品质量安全分析研究;
*董明辉,男,研究员,博士,主要从事农产品质量与控制技术研究。通信作者。

