飞蝗Argonaute1的分子特性及生物学功能
王艳丽,杨美玲,宋天琪,马恩波,张建珍
(1山西大学应用生物学研究所,太原 030006;2山西大学生命科学学院,太原 030006;3中国科学院动物研究所,北京 100101)
飞蝗Argonaute1的分子特性及生物学功能
王艳丽1,2,杨美玲3,宋天琪1,马恩波1,张建珍1
(1山西大学应用生物学研究所,太原 030006;2山西大学生命科学学院,太原 030006;3中国科学院动物研究所,北京 100101)
【目的】MicroRNAs(miRNAs)是一类长度约22 nt的非编码RNA,通过转录后调控的方式在多种生命活动中发挥重要功能。Argonaute1(AGO1)蛋白作为miRNA沉默复合物(miRNA silencing complex RISC)的重要组成部分,在miRNA调控通路中起着关键作用。论文旨在研究AGO1的生物学功能及其对飞蝗(Locusta moratoria)生长发育的影响,为探索昆虫miRNA的生物合成和农业害虫的有效控制提供理论依据。【方法】采用生物信息学方法在飞蝗转录组数据库中获得LmAGO1 cDNA序列;使用在线蛋白翻译软件(ExPASy)对LmAGO1进行蛋白翻译,利用SMART分析LmAGO1蛋白的功能结构域;选取家蚕(Bombyx mori)、果蝇(Drosophila melanogaster)和赤拟谷盗(Tribolium castaneum)等模式昆虫的同源序列与LmAGO1氨基酸序列进行聚类分析,采用Phyml软件构建昆虫AGO蛋白的系统发育树;为了进一步研究LmAGO1在飞蝗生长发育过程中的作用,使用T7 RiboMAXTM Express RNAi System体外合成LmAGO1的dsRNA,在飞蝗4龄第2天和5龄第2天若虫期连续两次注射dsRNA进行干扰,同时注射dsGFP作为对照。分别收集注射dsRNA后48 h和72 h的整虫样品提取RNA,反转录为cDNA。通过实时荧光定量PCR(RT-qPCR)检测LmAGO1在不同时间点的干扰效率并观察虫体的发育表型。同时,为了检测LmAGO1沉默是否会影响miRNA的生物合成,采用RT-qPCR对飞蝗体内5个高丰度miRNA表达进行定量分析。【结果】LmAGO1蛋白含845个氨基酸,具有典型的AGO蛋白家族保守结构域,即位于213—348位点的PAZ结构域和502—804位点的PIWI结构域。聚类分析表明,LmAGO1蛋白与其他昆虫的AGO1蛋白聚为一类。通过AGO1氨基酸序列同源比对结果显示LmAGO1与模式昆虫果蝇、家蚕AGO1的氨基酸序列一致度高达82.2%和86.9%。RNAi结果表明,虫体注射dsLmAGO1 48 h和72 h后,与对照组相比,LmAGO1表达量均显著降低,干扰效率分别为88.1%和93.0%;进一步观察试虫生长发育的表型特征,与对照组相比,飞蝗4龄期注射dsLmAGO1后其生长发育并没有出现明显异常,待蜕皮发育至下一龄期(即5龄期)时,出现大量死亡,死亡率为89.3%;荧光定量PCR结果显示注射dsLmAGO1 48 h后,飞蝗体内miRNA-252和miRNA-8的表达显著下降,干扰72 h后miRNA-7、let 7、miRNA-252、miRNA-8的表达均显著下降。【结论】飞蝗AGO1除参与RSIC的形成以外,还可能参与miRNA的剪切加工过程进而调控飞蝗的正常发育。
飞蝗;miRNA;Argonaute1;RNA干扰;生物学功能
0 引言
【研究意义】miRNA是存在于生物体内长约22 nt的内源性非编码RNA,可以在转录后水平对靶基因进行调控。AGO1蛋白与miRNA相结合形成RISC,对靶标基因mRNA进行切割或抑制其翻译[1],从而影响靶基因的表达。飞蝗(Locusta migratoria)隶属于直翅目,蝗总科,飞蝗属,广泛分布于欧洲、亚洲、非洲及澳洲等地,是重要的农业害虫。目前蝗灾防治策略主要采取农药防治,但长期的化学防治已导致飞蝗抗药性的产生和农业生态环境的破坏,因此亟需发展高效且对生态环境友好的防治策略。随着分子生物学的发展,筛选分子靶标,利用RNA干扰技术控制害虫的生长发育是农业植保领域新的发展方向。探索LmAGO1的生物学功能及对miRNA生物合成的影响,对于筛选分子靶标,开展害虫绿色防控具有重要意义。【前人研究进展】miRNA的发现使传统的“中心法则”得到补充与完善[2]。自1993年在秀丽隐杆线虫(Caenorhabditis elegans)中发现第一个miRNA-Lin4后,越来越多的研究表明miRNA在生物体的生命活动中具有重要意义,其参与调控生物体细胞分化、增殖、衰老、代谢、病毒防御、胚胎发育以及免疫应答等重要过程[3-4]。WEI等[5]首次使用高通量测序法对飞蝗小RNA进行鉴定,此工作极大推动了非模式昆虫小RNA的研究。此后,笔者课题组对飞蝗多个组织及不同发育时期的小RNA进行系统性鉴定,发现基因组扩大对于小RNA的倍增起到关键作用[6]。miRNA在基因转录和转录后调控中起着重要的作用,进一步的深入研究表明miRNA可调控飞蝗的蜕皮发育及型变[7-8]。miRNA行使其调控功能需要与AGO蛋白形成RISC复合体来调控靶基因的表达。AGO蛋白是miRNA执行功能的重要因子,其一般定位于细胞质中,该蛋白首先在植物中被发现,其家族在进化上高度保守,其数量在不同物种具有差异,例如水稻(Oryza sativa)中有19个、拟南芥(Arabidopsis thaliana)中有10个、人(Homo sapiens)中发现8个、家蚕(Bombyx mori)中发现4个、果蝇(Drosophila melanogaster)中存在5个[9-10]。AGO蛋白主要由4个部分组成,分别为N末端、PAZ(Piwi-Argonaute-Zwille)结构域、MID结构域和PIWI(P-element Induced Wimpy Testis)结构域。此外,在AGO蛋白中还有两个负责连接N端PAZ结构域的Linker1(L1)以及连接PAZ和MID结构域的Linker2(L2)[11]。AGO蛋白是组成RISC复合物的主要成分,通过抑制或阻断靶标基因的表达,参与基因的转录后水平调控[12-14]。DIEDERICHS等[15]研究发现在哺乳动物中AGO2具有核酸内切酶活性,通过剪切产生ac-pre-miRNA,并参与成熟体miRNA的合成过程,内源性AGO2蛋白的减少会降低ac-pre-miRNA乃至成熟体miRNA的形成。【本研究切入点】AGO蛋白不仅作为RISC复合物重要组分,也可作为核酸内切酶参与成熟体miRNA形成,这一功能仅在哺乳动物中有报道[15]。昆虫中AGO蛋白是否也具有核酸内切酶的功能并参与成熟体miRNA形成目前尚不清楚,需要进行深入探索。【拟解决的关键问题】基于上述文献结果,提出假设:飞蝗AGO1可能具有类似于哺乳动物核酸内切酶的生物学功能。因此,本文以飞蝗为研究对象,获得飞蝗AGO1(LmAGO1)cDNA序列,采用RNA干扰技术沉默LmAGO1,检测LmAGO1在不同时间点的沉默效率以及对飞蝗体内5个高丰度miRNA表达的影响,探索AGO1在miRNA合成中的作用以及对飞蝗生长发育的影响,为昆虫miRNA的合成机制和新分子靶标筛选提供依据。
1 材料与方法
试验于2014—2015年在中国科学院动物研究所完成。
1.1材料
供试飞蝗(2005年4月采自河北黄骅)为室内连续多代饲养。饲养条件:室温(28—30)℃,相对湿度15%—25%,光周期14L∶10D;虫体饲养在通风良好的木笼(25 cm×25 cm×25 cm)中,以麦苗和麦麸饲喂。
1.2LmAGO1结构功能域及分子进化分析
通过飞蝗转录组信息预测,得到LmAGO1的cDNA序列,使用在线蛋白翻译软件(ExPASy)对AGO1进行蛋白翻译。使用蛋白保守结构域分析软件SMART对LmAGO1蛋白功能结构域进行鉴定。使用GENEDOC软件将LmAGO1蛋白与其对应的果蝇和家蚕同源AGO1蛋白进行多序列比对,并使用EMBOSS软件包中的needle程序进行基于全局比对(Global alignment)策略的氨基酸序列相似度计算。根据LmAGO基因序列,运用NCBI的BLAST工具对AGO基因序列进行同源搜索和比对,下载来源于其他物种的同源序列,使用Phyml软件中的最大似然法和JTT模型构建系统进化树,进行1 000次bootstrap自举检验。
1.3LmAGO1的干扰及荧光定量PCR检测
1.3.1引物设计依据LmAGO1序列,利用Primer5.0软件设计RNA干扰及荧光定量PCR(RT-qPCR)引物,文中所用引物如表1所示。
1.3.2LmAGO1双链合成及RNA干扰使用T7 RiboMAXTMExpress RNAi System(Promega)合成AGO1和GFP(绿色荧光蛋白基因)的双链RNA[16],经琼脂糖凝胶电泳检测条带单一且无降解产物,可以用作后续的干扰试验。合成的双链用无RNA酶的水稀释到5 μg·μL-1,选择飞蝗4龄第2天的若虫,在其第2和第3腹节处用微量注射器注射10 μg dsRNA,待其发育至5龄第2天时,再注射一次等剂量的dsRNA。试验组(dsLmAGO1)为28头若虫,对照组(dsGFP)为26头若虫。注射dsRNA后,每天观察并记录表型。
1.3.3RT-qPCR定量检测收取整虫样本,用Trizol分别提取第一次干扰后48及72 h富含miRNA的总RNA,使用M-MLV Reverse Transcriptase(Promega)及Oligo(dT)-primed反转录cDNA,使用MiRcute miRNA cDNA第一链合成试剂盒(天根)合成miRNA cDNA,每个处理组设置4个生物学重复。分别使用RealMaster Mix SYBR Green(天根)和MiRcute miRNA荧光定量检测试剂盒(天根)对AGO1及miRNA进行荧光定量PCR检测分析。运用2-∆∆CT对定量数据进行处理,使用SPSS15.0数据统计软件中的Independent samples T-test方法分析差异显著性。

表1 LmAGO1 RNAi干扰双链合成引物以及RT-qPCR定量引物Table 1 Primers used for AGO1 dsRNA synthesis and AGO1 RT-qPCR
2 结果
2.1LmAGO1结构域及其系统发育分析
对AGO1序列分析结果显示LmAGO1蛋白含有845个氨基酸,使用SMART软件预测该蛋白含有1个起止于153—205位点的DUF结构域和2个典型的保守结构域,分别为位于213—348 位点的PAZ结构域和502—804位点的PIWI结构域。这2个保守的结构域是AGO蛋白行使切割功能的活性中心(图1-A)。
AGO1氨基酸序列同源比对结果显示LmAGO1与DmAGO1、BmAGO1氨基酸序列的序列一致度较高,分别为82.2%和86.9%。比对结果显示,LmAGO1与果蝇和家蚕的AGO1氨基酸序列均具有DUF结构域(黑色框区域)、PAZ结构域(红色框区域)和PIWI结构域(蓝色框区域)(图1-B)。
系统发育分析结果显示,AGO1和AGO2蛋白被明显地分为两支,在AGO1分支中,飞蝗与灰飞虱(Laodelphax striatella)、褐飞虱(Nilaparvata lugens)的亲缘关系最近,并与家蚕、果蝇、埃及伊蚊(Aedes aegypti)、赤拟谷盗(Tribolium castaneum)、秀丽隐杆线虫聚为一簇,均聚为AGO1家族,表明所鉴定的飞蝗AGO蛋白属于AGO1类型(图1-C)。
2.2LmAGO1功能分析
利用荧光定量PCR技术检测了RNAi AGO1后LmAGO1的干扰效率,发现LmAGO1在dsRNA注射后48 h和72 h的干扰效率均很高,分别达到88.1%和93.0%(图2)。
进一步观察了RNAi干扰AGO1后,飞蝗生长和发育的表型特征,发现飞蝗在4龄第2天注射dsRNA后的生长发育表型与对照组相比无明显变化,但当其蜕至下一龄期(即5龄期)第3天时,飞蝗开始出现死亡,死亡率高达89.3%,而对照组的死亡率仅为11.2%(图3)。


图1 LmAGO1的功能结构域及系统进化分析Fig. 1 Domain organization and phylogenetic analysis of LmAGO1
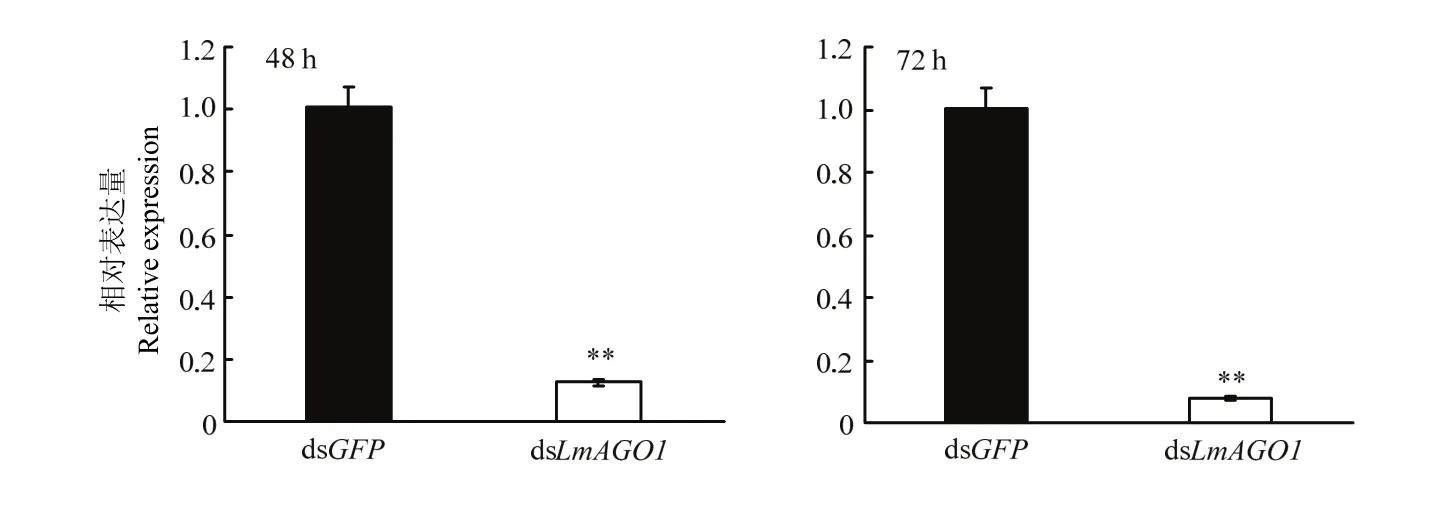
图2 荧光定量PCR分析LmAGO1的干扰效率Fig. 2 The silencing efficiency analysis of LmAGO1 by RT-qPCR
2.3LmAGO1基因干扰后miRNA的表达分析
为了证明AGO1沉默是否影响了miRNA的表达,选取5个飞蝗体内高丰度的miRNAs进行了荧光定量PCR检测。发现AGO1基因干扰48 h后,被检测的miRNAs中miRNA-252和miRNA-8的表达显著下降(图4-A);干扰72 h后miRNA-7、let7、miRNA-252、miRNA-8的表达均显著下降(图4-B)。
3 讨论
目前昆虫中的AGO主要分为Argonaute和PIWI两个家族[17]。AGO1和AGO2均属于Argonaute家族,参与RISC复合物的加工。在昆虫中AGO1主要负责miRNA介导的基因沉默,而AGO2主要负责siRNA介导的基因沉默[18-19]。通过系统进化分析,发现昆虫AGO1成员之间在进化树上的枝长较短,而AGO2成员之间的枝长较长。蛋白质序列的比对分析发现LmAGO1与DmAGO1、BmAGO1一致度分别为82.2%和86.9%,LmAGO2与DmAGO2、BmAGO2一致度分别为37.5%和29.5%。这些结果表明昆虫中AGO1家族的基因序列分化程度较小,较AGO2家族更为保守。

图3 AGO1 RNA干扰后对飞蝗发育的影响Fig. 3 The effect of LmAGO1 RNAi on locust development
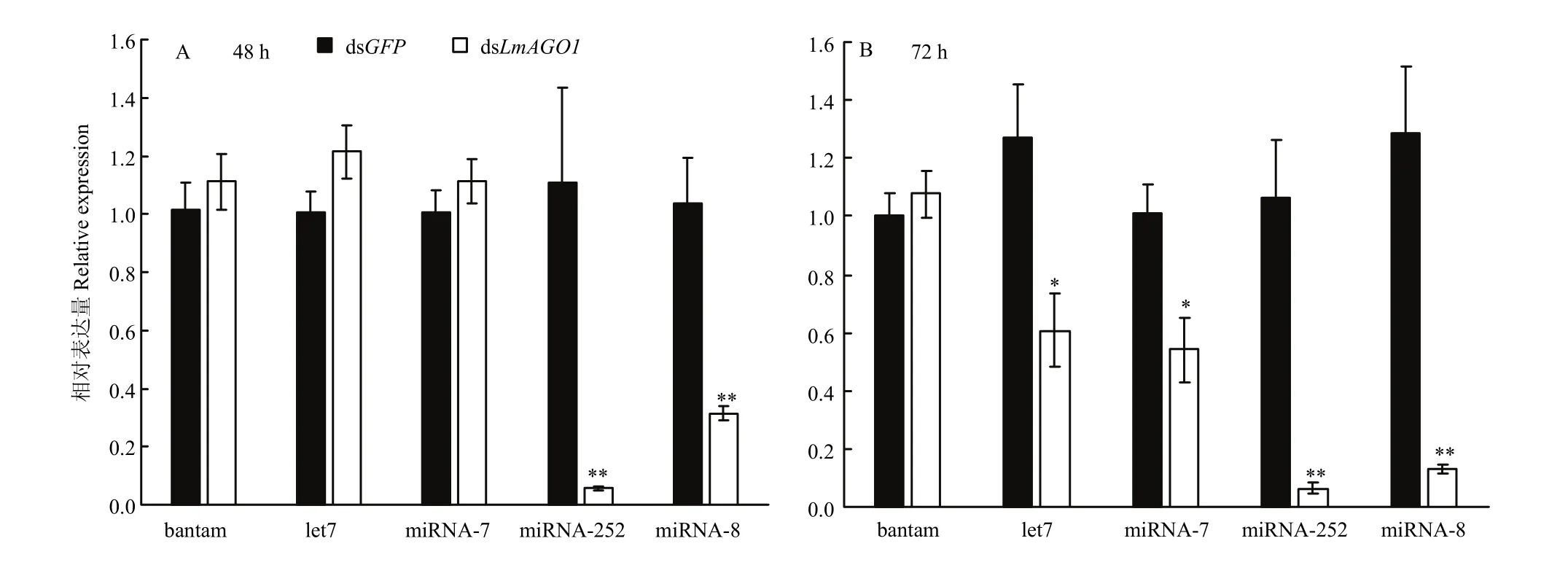
图4 荧光定量PCR分析AGO1基因干扰后miRNAs的表达情况Fig. 4 The expression of miRNAs after dsLmAGO1 injection by RT-qPCR
AGO1对飞蝗正常发育非常重要。本研究中4龄第2天注射dsLmAGO1进行RNA干扰后并未引起飞蝗死亡,但飞蝗蜕皮发育至5龄初期继续注射dsLmAGO1后,飞蝗出现了大量死亡。在果蝇脂肪体中miR-8能够调节抗菌肽Drosomycin和Diptericin进而维持免疫平衡[20]。miR-252能够调节登革热病毒包膜蛋白的表达,在白纹伊蚊(Aedes albopictus)起到细胞内抗病毒的作用[21]。因此,推测LmAGO1基因缺失后引起的大量死亡可能与其后续影响miRNA的合成有关,从而影响到飞蝗免疫稳态维持和病毒防御应答。由于AGO1基因缺失后对miRNA合成的影响具有时间效应,并不是即时发生的,当miRNA的量减少到一定程度时会影响飞蝗的正常发育,所以在AGO1被注射后,飞蝗蜕皮发育至下个龄期才引起大量死亡。已有研究发现AGO1缺失会显著降低飞蝗Vg蛋白的转录和卵泡上皮的正常发育,从而影响卵母细胞成熟和卵巢的形成[22]。在果蝇中AGO1缺失后导致其卵母细胞和生殖细胞的形成和分化异常[23],同时有文献报道果蝇胚胎期缺乏AGO1会使其胚胎发育异常致死[24]。与AGO1密切相关的miRNAs的表达受到抑制后也会产生类似于AGO1缺失后的发育异常。抑制miR-184的表达同样能够使得果蝇早期胎发育异常[25]。在红带袖蝶(Heliconius melpomene)中,翅发育相关基因座HmYb中的两个miRNA能够控制翅的颜色形成及着色分布[26]。据此推测AGO1对昆虫生长发育影响是多方面的,LmAGO1不仅可通过调控miRNA的表达影响若虫期的发育,导致飞蝗大量死亡,同时也可能影响其卵期发育及成虫期多个器官的发育。
LmAGO1被干扰后,一些高丰度表达的成熟体miRNAs的合成量显著减少。研究结果显示,被检测的miRNAs表达与AGO1的表达呈正相关性,AGO1被沉默的时间越久,miRNAs表达下调的数量越多,表明AGO1在飞蝗miRNAs合成过程中起着重要作用,内源性AGO1表达下调抑制了成熟miRNA的合成与表达。DIEDERICHS等发现人的AGO2蛋白具有核酸内切酶的活性,可以将pre-miRNA剪切为ac-pre-miRNA,然后形成成熟体miRNA,AGO2突变后显著抑制了成熟体miRNA的合成[15,27],本研究结果与此一致。已有研究表明人的AGO1、AGO2均参与了miRNA通路的合成和加工[28],人的AGO1是由AGO2基因倍增以后产生的,AGO2是更古老的参与miRNA加工的Argonaute家族成员[29],因此推测昆虫中参与miRNA合成的AGO1可能与人的AGO2是同源基因。本研究结果表明AGO1基因沉默后显著影响了一些高丰度miRNA的合成,miRNA的合成紊乱导致其靶基因失调并影响虫体的正常发育,推测飞蝗AGO1也可能与人类AGO2一样具有核酸内切酶的活性。另一方面,AGO1的沉默可导致其蛋白量减少,影响了RISC复合体的形成以及miRNA的正常调控功能。这两方面的原因都有可能导致沉默该基因后,飞蝗出现大量死亡的现象,但飞蝗致死是上述两方面的原因共同影响还是单方面原因起主要作用,还需要今后的深入研究。
近年来,由于害虫抗药性的产生、杀虫剂的残留以及生物多样性的不断减少等原因,传统的杀虫剂已经不能满足现代农业发展的需要,亟待开发绿色环保的新型杀虫剂。LmAGO1蛋白作为miRNA行使功能的重要因子,在其生长发育过程中起着十分重要的作用,AGO1的缺失会导致飞蝗的大量死亡,因此利用RNAi技术将AGO1进行沉默可以为研发有效的生物环境友好型杀虫剂提供重要的理论依据。
4 结论
通过对AGO1蛋白进行系统发育分析及对飞蝗基因组中的AGO1蛋白进行鉴定,研究了飞蝗与其他昆虫AGO蛋白的系统进化关系;经体内注射dsRNA方法沉默飞蝗LmAGO1,发现干扰LmAGO1后可导致飞蝗死亡;进一步对AGO1生物学功能进行分析,明确了LmAGO1在miRNA合成与表达中的作用以及对飞蝗生长发育的影响。研究可为筛选新的分子靶标,开展基于RNA干扰的害虫防治新技术体系提供理论与实践依据。
References
[1] CHENDRIMADA T P, GREGORY R I, KUMARASWAMY E,NORMAN J, COOCH N, NISHIKURA K, SHIEKHATTAR R. TRBP recruits the Dicer complex to Ago2 for microRNA processing and gene silencing. Nature, 2005, 436(7051): 740-744.
[2] AMBROS V. The evolution of our thinking about microRNAs. Nature Medicine, 2008, 14(10): 1036-1040.
[3] LIN H R, GANEM D. Viral microRNA target allows insight into the role of translation in governing microRNA target accessibility. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(13): 5148-5153.
[4] 刘仕平, 吴小燕, 张丹宇, 黄亚玺, 王伟, 赵萍, 夏庆友. 家蚕microRNA7靶基因Bmhairy的鉴定和转录表达模式. 中国农业科学, 2016, 49(1): 195-204.
LIU S P, WU X Y, ZHANG D Y, HUANG Y X, WANG W, ZHAO P,XIA Q Y. Identification of Bmhairy as the target of bmo-miR-7 and its transcriptional expression profiles in the silkworm (Bombyx mori). Scientia Agricultura Sinica, 2016, 49(1): 195-204. (in Chinese)
[5] WEI Y Y, CHEN S, YANG P C, MA Z Y, KANG L. Characterization and comparative profiling of the small RNA transcriptomes in two phases of locust. Genome Biology, 2009, 10(1): R6.
[6] WANG Y L, JIANG F, WANG H M, SONG T Q, WEI Y Y, YANG M
L, ZHANG J Z, KANG L. Evidence for the expression of abundant microRNAs in the locust genome. Scientific Reports, 2015, 5: 13608.
[7] WANG Y L, YANG M L, JIANG F, ZHANG J Z, KANG L. MicroRNA-dependent development revealed by RNA interferencemediated gene silencing of LmDicer1 in the migratory locust. Insect Science, 2013, 20(1): 53-60.
[8] YANG M L, WEI Y Y, JIANG F, WANG Y L, GUO X J, HE J,KANG L. MicroRNA-133 inhibits behavioral aggregation bycontrolling dopamine synthesis in locusts. PLoS Genetics, 2014, 10(2): e1004206.
[9] HOCK J, MEISTER G. The Argonaute protein family. Genome Biology, 2008, 9(2): Article 210.
[10] WANG G H, JIANG L, ZHU L, CHENG T C, NIU W H, YAN Y F,XIA Q Y. Characterization of Argonaute family members in the silkworm, Bombyx mori. Insect Science, 2013, 20(1): 78-91.
[11] KUHN C D, JOSHUA-TOR L. Eukaryotic Argonautes come into focus. Trends in Biochemical Sciences, 2013, 38(5): 263-271.
[12] FERREIRA R, SANTOS T, AMAR A, GONG A, CHEN T C,TAHARA S M, GIANNOTTA S L, HOFMAN F M. Argonaute-2 promotes miR-18a entry in human brain endothelial cells. Journal of the American Heart Association, 2014, 3(3): e000968.
[13] GARCIA-RUIZ H, CARBONELL A, HOYER J S, FAHLGREN N,GILBERT K B, TAKEDA A, GIAMPETRUZZI A, GARCIA RUIZ M T, MCGINN M G, LOWERY N, MARTINEZ BALADEJO M T,CARRINGTON J C. Roles and programming of Arabidopsis ARGONAUTE proteins during Turnip mosaic virus infection. PLoS Pathogens, 2015, 11(3): e1004755.
[14] HUTVAGNER G, SIMARD M J. Argonaute proteins: key players in RNA silencing. Nature Reviews Molecular Cell Biology, 2008, 9(1): 22-32.
[15] DIEDERICHS S, HABER D A. Dual role for Argonautes in microRNA processing and posttranscriptional regulation of microRNA expression. Cell, 2007, 131(6): 1097-1108.
[16] 余志涛, 刘晓健, 马恩波, 郭亚平, 张建珍. 中华稻蝗几丁质合成酶1基因的mRNA表达及功能. 中国农业科学, 2012, 45(5): 877-884.
YU Z T, LIU X J, MA E B, GUO Y P, ZHANG J Z. mRNA expression and physiological function of chitin synthase1 from Oxya chinensis(Thunberg). Scientia Agricultura Sinica, 2012, 45(5): 877-884. (in Chinese)
[17] SASAKI T, SHIOHAMA A, MINOSHIMA S, SHIMIZU N. Identification of eight members of the Argonaute family in the human genome. Genomics, 2003, 82(3): 323-330.
[18] LUCAS K, RAIKHEL A S. Insect microRNAs: Biogenesis,expression profiling and biological functions. Insect Biochemistry and Molecular Biology, 2013, 43(1): 24-38.
[19] OKAMURA K, ISHIZUKA A, SIOMI H, SIOMI M C. Distinct roles for Argonaute proteins in small RNA-directed RNA cleavage pathways. Genes & Development, 2004, 18(14): 1655-1666.
[20] CHOI I K, HYUN S. Conserved microRNA miR-8 in fat body regulates innate immune homeostasis in Drosophila. Developmental and Comparative Immunology, 2012, 37(1): 50-54.
[21] YAN H, ZHOU Y, LIU Y, DENG Y, PUTHIYAKUNNON S, CHEN X. miR-252 of the Asian tiger mosquito Aedes albopictus regulates dengue virus replication by suppressing the expression of the dengue virus envelope protein. Journal of Medical Virology, 2014, 86(8): 1428-1436.
[22] SONG J S, GUO W, JIANG F, KANG L, ZHOU S T. Argonaute 1 is indispensable for juvenile hormone mediated oogenesis in the migratory locust, Locusta migratoria. Insect Biochemistry and Molecular Biology, 2013, 43(9): 879-887.
[23] YANG J S, SMIBERT P, WESTHOLM J O, JEE D, MAURIN T, LAI E C. Intertwined pathways for Argonaute-mediated microRNA biogenesis in Drosophila. Nucleic Acids Research, 2014, 42(3): 1987-2002.
[24] KATAOKA Y, TAKEICHI M, UEMURA T. Developmental roles and molecular characterization of a Drosophila homologue of Arbidopsis Argonaute1, the founder of a novel gene superfamily. Genes to Cell,2001, 6(6): 313-325.
[25] IOVINO N, PANE A, GAUL U. miR-184 has multiple roles in Drosophila female germline development. Developmental Cell, 2009,17(1): 123-133.
[26] SURRIDGE A K, LOPEZ-GOMOLLON S, MOXON S, MAROJA L S, RATHJEN T, NADEAU N J, DALMAY T, JIGGINS C D. Characterisation and expression of microRNAs in developing wings of the neotropical butterfly Heliconius melpomene. BMC Genomic,2011, 12: 62.
[27] YANG J S, LAI E C. Dicer-independent, Ago2-mediated microRNA biogenesis in vertebrates. Cell Cycle, 2010, 9(22): 4455-4460.
[28] WANG D, ZHANG Z, O'LOUGHLIN E, LEE T, HOUEL S,O'CARROLL D, TARAKHOVSKY A, AHN N G, YI R. Quantitative functions of Argonaute proteins in mammalian development. Genes & Development, 2012, 26(7): 693-704.
[29] MURPHY D, DANCIS B, BROWN J R. The evolution of core proteins involved in microRNA biogenesis. BMC Evolutionary Biology, 2008, 8: 92.
(责任编辑岳梅)
Molecular Characterization and Biological Function of Argonaute1 in Locusta migratoria
WANG Yan-li1,2, YANG Mei-ling3, SONG Tian-qi1, MA En-bo1, ZHANG Jian-zhen1
(1Research Institute of Applied Biology, Shanxi University, Taiyuan 030006;2College of Life Science, Shanxi University,Taiyuan 030006;3Institute of Zoology, Chinese Academy of Sciences, Beijing 100101)
【Objective】 MicroRNAs (miRNAs) are small (approximately 22 nt), noncoding RNA molecules that play important roles through post-transcriptional regulation in a wide range of biological process. As an essential component ofmiRNA silencing complex (RISC), Argonaute1 (AGO1) protein plays a key role in miRNA regulatory pathway. The purpose of this study is to explore the biological function of LmAGO1, and determine its impacts on growth and development in the migratory locust. These results will provide an important theoretical basis for biogenesis mechanism of insect miRNAs and effective pest control. 【Method】 The cDNA sequence of LmAGO1 was identified from the locust transcriptome database by using bioinformatics approaches, and was translated into protein sequence using online protein translation software (ExPASy). The conserved domains were analyzed by SMART based on the deduced protein sequence. A phylogenetic tree of insect AGO was constructed with the locust AGO1, the homologous amino acid sequences from Bombyx mori, Drosophila melanogaster,Tribolium castaneum and other insects using the Phyml program. The double-strand RNAs (dsRNAs) of AGO1 gene were synthesized in vitro using T7 RiboMAXTMExpress RNAi System. The RNA interference (RNAi) experiment was preformed to explore the biological function of LmAGO1 during growth and development in locusts. The dsLmAGO1 was injected into the locust nymphs on day 2 of the 4th-instar and 5th-instar stages, respectively. The injection of dsGFP was used as the control. At the 48 h and 72 h after dsRNA injection, the whole body of locust nymphs was collected for total RNA isolation and cDNA synthesis. The reverse transcript quantitative PCR (RT-qPCR) analyses of the LmAGO1 were performed to determine the gene silencing efficiency. In order to evaluate the influences of the LmAGO1 RNAi on miRNA biogenesis, the five abundantly expressed miRNAs were selected to quantify their expression level by using RT-qPCR after dsLmAGO1 injection.【Result】 The amino acid analysis showed that LmAGO1 protein of locust contains 845 amino acids and has the typical AGO protein family conserved domains, including PAZ (Piwi-Argonaute-Zwille) domain which is located in the region from nucleotide 213 to 348 and PIWI (P-element Induced Wimpy Testis) domain which is located in the region from nucleotide 502 to 804. The phylogenetic analysis showed that LmAGO1 was clustered with the AGO1s of other insect species. The multiple protein sequence alignments indicated that the amino acid sequence identity is 82.2% between LmAGO1and DmAGO1, and is 86.9% between LmAGO1 and BmAGO1, respectively; RNAi results showed that the expression of LmAGO1 was significantly reduced at 48 h and 72 h after dsLmAGO1 injection into locust nymphs. The silencing efficiency of LmAGO1 was 88.1% and 93.0%, respectively. The locust nymphs with dsLmAGO1 treatment did not show any obvious phenotypic defects at the 4th-instar stage. However, compared with dsGFP injected control, the dsLmAGO1 treatment resulted in a high mortality at the 5th-instar stage. A total of 89.3% locust nymphs were dead in dsLmAGO1 injected group. The RT-qPCR results of LmAGO1 showed that LmAGO1 was significantly silenced at 48 h and 72 h after dsRNA injection. Moreover, the expression analysis of miRNA results indicated that the expression levels of miRNA-252 and miRNA-8 were significantly decreased at 48 h after dsLmAGO1 treatments, and that the expressions of miRNA-7, let-7, miRNA-252 and miRNA-8 were significantly down-regulated at 72 h after dsLmAGO1 treatments.【Conclusion】Besides the role in RSIC formation, LmAGO1 can enhance the processing of miRNA maturation and regulate the normal development in the migratory locust.
Locusta moratoria; miRNA; AGO1; RNAi; biological function
2016-05-23;接受日期:2016-08-05
国家自然科学基金(31472051,31272380)、山西省自然科学基金(2014011028-3)
联系方式:王艳丽,E-mail:wangyanli110327@163.com。通信作者张建珍,E-mail:zjz@sxu.edu.cn

