不同年份冷水胁迫下水稻抽穗期和产量性状的QTL分析
杨洛淼,孙 健,赵宏伟,王敬国,刘化龙,邹德堂
(东北农业大学农学院水稻研究所,哈尔滨 150030)
不同年份冷水胁迫下水稻抽穗期和产量性状的QTL分析
杨洛淼,孙健,赵宏伟,王敬国,刘化龙,邹德堂
(东北农业大学农学院水稻研究所,哈尔滨 150030)
【目的】水稻抽穗期、结实率、千粒重和单株粒重跟产量密切相关,且受低温影响较大。在冷水胁迫下检测控制水稻抽穗期、结实率、千粒重和单株粒重的QTL,为水稻孕穗期耐冷遗传机制及分子标记辅助育种提供理论依据。【方法】以粳稻优质品种东农422和耐冷品种空育131为亲本构建的190个重组自交系解析表型变异,构建了覆盖12条染色体,155个SSR标记的遗传连锁图。连续3年在水稻孕穗期进行冷水灌溉处理,考察始穗期、齐穗期、结实率、千粒重和单株粒重5个性状,利用SPSS18.0和GGEbiplot进行表型分析,利用QTLnetwork2.0,采用逐步联合分析法定位和性状相关的QTL,用超几何函数评价QTL间的相关性。【结果】冷水胁迫下,亲本和RIL群体抽穗期推迟,结实率明显降低,千粒重和单株粒重相继降低。始穗期、齐穗期和结实率互为正相关,结实率、千粒重和单株粒重也互为正相关。共有71个加性QTL被检测到,37个跟耐冷性有关,其中单环境分析检测到28个,贡献率大于10%以上的QTL有11个,单处理联合分析共检测到10个和耐冷有关的QTL,贡献率大于10%的QTL有6个。这17个贡献率大于10%且和耐冷性有关的QTL对性状具有增效作用。多环境联合分析检测到12个QTL,平均贡献率仅为3.56%,其中5个QTL参与了环境互作。检测到的20对上位性QTL中,有2个主效QTL区间参与了上位性互作,对性状的遗传起到重要作用。QTL相关性分析表明,控制始穗期,齐穗期和结实率的QTL具有相关性,结实率的QTL也同千粒重、单株粒重的QTL相关。经图谱比较分析,研究发现的部分QTL与前人研究处于相同染色体片段上,其中,qIHD7-2、qFHD7-2、qFHD7-1和qIHD7-1是在多环境下检测到的稳定存在的QTL,同时,qIHD7-1、qIHD7-2、qFHD7-1、qSSR7-1和qSSR7-2和耐冷性有关,这些QTL位点可为水稻抗冷分子育种提供依据。【结论】冷水胁迫下,结实率分别同抽穗期、千粒重和单株粒重存在相似的遗传机制,而抽穗期和千粒重、单株穗重的遗传相互独立。相比而言,冷水胁迫下选择结实率高的品种要比选择其余3个性状困难。
水稻;冷水胁迫;抽穗期;产量性状;QTL
0 引言
【研究意义】冷害是制约水稻(Oryza sativa L.)生长的因素之一[1],且对水稻的形态指标造成一定影响[2]。水稻产量除了受粒重、分蘖数、每穗粒数影响之外,还受开花时间的影响[3]。抽穗期是水稻品种区域和季节适应性的主要决定因素[4],冷害的发生会造成抽穗和开花时间的延迟[5],使千粒重和结实率降低,从而造成产量损失[6-7]。因此,掌握低温条件下水稻农艺性状的遗传基础对水稻高效育种具有重要意义。【前人研究进展】抽穗时间被认为是孕穗期低温冷害研究中的重要性状[8],穗伸出度和单株结实率是孕穗开花期自然低温胁迫反应最敏感的性状指标[9],穗长、实粒数、瘪粒数、总粒数、穗长、小穗育性和千粒重在孕穗期遭受低温冷害时,呈现出性状差异显著[10-13]。但孕穗期低温冷害下的QTL研究常以结实率或空壳率作为评价指标,KUROKI等[14]将和结实率相关的耐冷QTL定位到第8染色体198 kb范围内。SAITO等[15]将Ctb1定位于56 kb内,包含7个候选基因。而TAKEUCHI等[16]在评价结实率的同时,分析了抽穗期和茎秆长度与耐冷的相关性,并做了QTL分析。韩龙植等[17]在低温环境下定位到5个主效QTL,对秆长、穗长、穗粒数和穗抽出度有增效作用,且与水稻耐冷性有一定的相关性。【本研究切入点】水稻孕穗期耐冷性具有复杂的遗传机理,前人利用不同作图群体和鉴定方法对水稻孕穗期耐冷性进行了QTL研究,但多数研究仅以结实率作为研究对象,缺乏对冷水胁迫下与水稻产量相关农艺性状的QTL报道。同时,自花作物有较高程度的基因和环境互作[18],而数量性状又极易受环境影响[19]。徐福荣等[9]指出,在水稻孕穗开花期耐冷性自然鉴定评价中,必须进行多年多点的鉴定评价。因为多环境的验证能够提高数据分析和QTL定位的精确度和可信性。但有关多环境QTL研究报道中并未明确指出环境因子与性状之间的关系,而GGEbipiolt软件[20]可以反映各性状在不同环境下的稳定性,解决QTL与环境互作手段单一的问题,同时能评价不同性状间的相关程度。超几何函数的应用能够从不同性状QTL之间的角度揭示性状间的遗传相关性[21-22]。从而能很好地反应冷水胁迫下性状的表型变异和遗传基础。【拟解决的关键问题】本研究利用东农422和空育131构建的190个重组自交系材料,在连续3年的环境条件下,设置对照和冷水胁迫2个处理,在孕穗期进行冷水灌溉,对水稻的始穗期、齐穗期及成熟后的结实率、千粒重和单株粒重进行考察,利用GGEbipiolt评价不同环境对各性状的影响及性状间的相关性。同时从单环境、单处理和多环境联合分析的角度检测控制性状表达的加性QTL、上位性QTL及QTL与环境的互作,探明孕穗期冷水胁迫下农艺性状的耐冷性,并探讨QTL之间的相关程度,为水稻孕穗期耐冷性的分子育种提供参考。
1 材料与方法
1.1材料
以优质高产的粳稻品种东农422(DN422)为母本,耐冷性强的粳稻品种空育131(KY131)为父本配置杂交组合,通过“单粒传”得到包含190个家系的F6代重组自交系群体作为作图群体,表型考察分别为F6、F7和F8群体。
1.2田间试验与性状调查
2013—2015年连续3年在哈尔滨市东北农业大学试验基地(北纬47°98′,东经128°08′,海拔128 m)分别进行正常灌溉(命名为E1、E3和E5)和3个孕穗期冷水灌溉(命名为E2、E4和E6)处理。播种期分别为4月17日、20日和25日,移栽期分别为5月21日、25日和29日。3年的平均气温、降雨量和日照时数均与正常年份相同。试验地土壤全氮0.23%,碱解氮216.4 mg·kg-1、全钾2.32%、速效钾167.4 mg·kg-1、总磷0.16%和磷27 mg·kg-1。小区行长3 m,双行区,行距30 cm,穴距10 cm,重复2次。冷水灌溉参考MATSUNAGA[23]的方法,略有改动。从早熟株系开始出现幼穗分化,便用17℃恒温冷水均匀地灌溉,直到晚熟株系全部出穗为止停止灌溉,水深20 cm。17℃水源用地下井水(8—10℃)和晒水池水(22—24℃)混合而成,采用流动灌溉,以维持田间整体水温。正常灌溉用晒水池水,3年孕穗期空气温度均在24℃左右。记录10%抽穗的始穗期(initial heading date,IHD)和80%抽穗的齐穗期(full heading date,FHD),成熟时每个株系取中间10株,考察单株结实率(seed setting rate,SSR)、千粒重(thousand grain weight,TGW)和单株粒重(grain weight per plant,PGW)。并计算对应指标的冷水反应指数(cold-water response index,CRI),CRI=冷水处理下的性状值/正常灌溉下的性状值。
1.3数据分析
亲本间差异用t检验判别,利用SPSS18.0对RIL群体进行均值(Mean)、标准差(SD)的分析,利用一般线性模型(GLM)进行方差分析(ANOVA),环境和基因型作为固定因子,各性状值作为因变量,用于方差分析的数据输入。
用GGEbiplot评价环境和性状间的相关性,进行双标图分析,用图中指标向量和相邻指标间的夹角余弦值判断指标间的相关性。该软件主要用于研究基因型(性状)与环境互作的关系,主要基于以下计算模型:
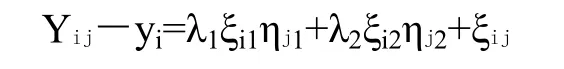
其中,Yij是i基因型(性状)在j环境下的均值,yi是在j环境下所有基因型(性状)的平均值,λ1ξi1ηj1和λ2ξi2ηj2中,λ1和λ2分别称为第一主成分和第二主成分的显著性,ξi1和ξi2分别为对i基因型(性状)第一主成分和第二主成分的值,ηj1和ηj2分别为对j环境第一主成分和第二主成分的值,ξij是对j环境的i基因型(性状)的模型剩余值[20]。
广义遗传力的计算参考HOSSEINI等[24]的公式。

式中,σG2、σGE2和σE2分别为遗传方差、基因型与环境互作的方差和误差方差,r和n分别为重复数和环境数。
1.4遗传连锁图的构建和QTL定位
采用改良CTAB法[25]提取DNA。从水稻基因组(http//www.gramene.org)中获得1 000对SSR引物序列。引物由上海生工生物工程有限公司合成。利用两亲本间有多态性的173对引物对F6代190个单株DNA的进行PCR扩增,最终确定多态性好的SSR标记165对。去除10个偏分离标记,剩余155个SSR标记用于构建连锁图谱。利用Mapchart 2.2绘制遗传连锁图谱,QTLNetwork2.0的混合线性模型复合区间作图法(mixed composite interval mapping,MICM)进行QTL定位,Permutation次数设置为1 000次,用Monte carlomrekov chain(MCMC)算法估计QTL效应,Gibbs取样规模设置为20 000,以1 cM的步长对全基因组进行QTL扫描,用逐步联合的QTL检测方法进行检测,分为(1)单环境检测,(2)单处理联合检测(相同处理联合3年数据),(3)多环境的联合检测。QTL命名遵循MCCOUCH等[26]的原则。
对性状的QTL之间的关系确定使用超几何概率函数[21],该公式由PATERSON等[27]提出。
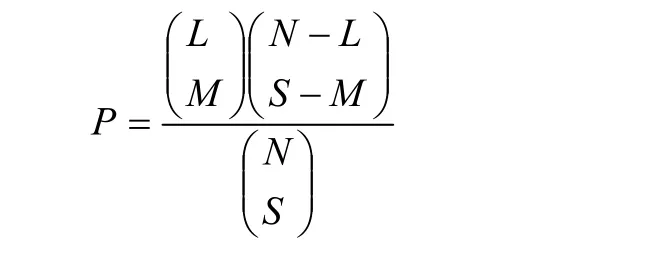
式中,N为图谱总长的2倍除以要比较的2个性状QTL置信区间平均数之和,M指两性状重合的QTL数目(两性状QTL置信区间大于50%重叠的QTL数目),L是QTL数目较多的性状检测到的QTL数目,S是QTL数目较少的性状检测到的QTL数目[22]。
2 结果
2.1亲本和群体各性状的表型分析
冷水胁迫和正常灌溉下,分别对亲本及重组自交系材料的IHD、FHD、SSR、TGW和PGW进行统计分析,结果(表1)表明,冷水处理下,与对照相比,IHD和FHD均发生推迟,且FHD延迟程度较大,SSR、TGW和PGW也相继下降。总之,空育131受冷水胁迫程度小于东农422,其中IHD和FHD表现较为明显。在冷水反应指数方面,对抽穗期来说,CRI越大表示抽穗延迟越严重,对SSR、TGW和PGW来说,CRI越小表示受冷害影响越严重。对比两亲本5个性状的CRI,可以看到,冷水胁迫下,敏感程度最大的性状为SSR。t检验结果发现,两亲本在6个环境下,各性状的差异均达显著水平。冷水胁迫下,群体均值在5个性状上均受到影响,其中,IHD和FHD发生延迟,SSR、TGW和PGE均降低。表明水稻花期对水温较为敏感,从而影响结实,导致产量下降。5个性状在不同环境的群体表现均发生一定程度的超亲分离,且变异范围较大,这对于等位基因分布在双亲中是有利的。多环境联合分析遗传力(表2)发现,IHD为91.45%,FHD遗传力为98.42%,SSR为89.97%,TGW为20.8%,PGW为87.44%。由此可知,除了SSR,其余性状的遗传变异度较大,具有好的选择潜力,容易取得好的育种效果。
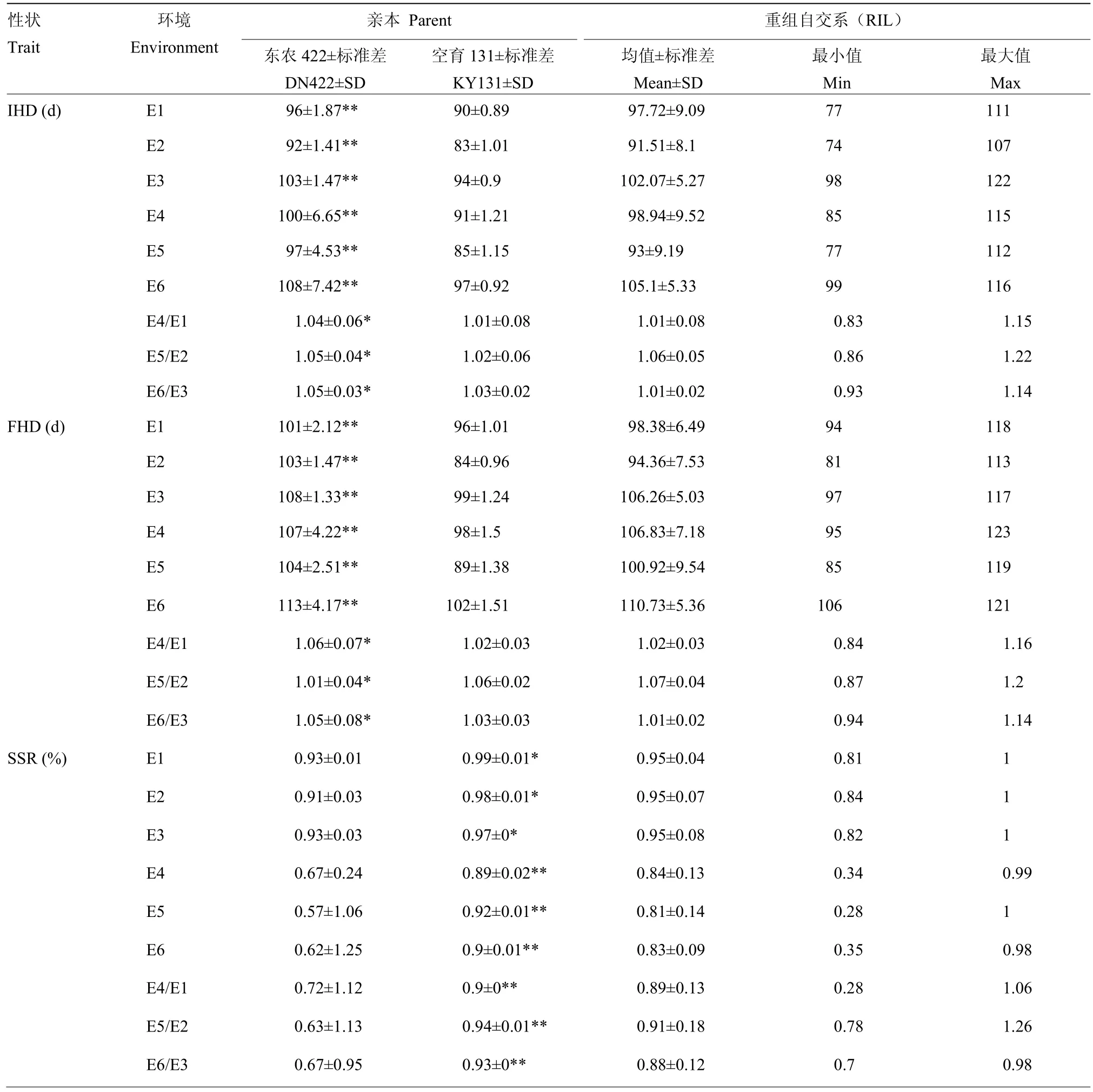
表1 不同环境始穗期、齐穗期、结实率、千粒重和单株粒重的表型分析Table 1 Performance of IHD, FHD, SSR, TGW and PGW under different environments
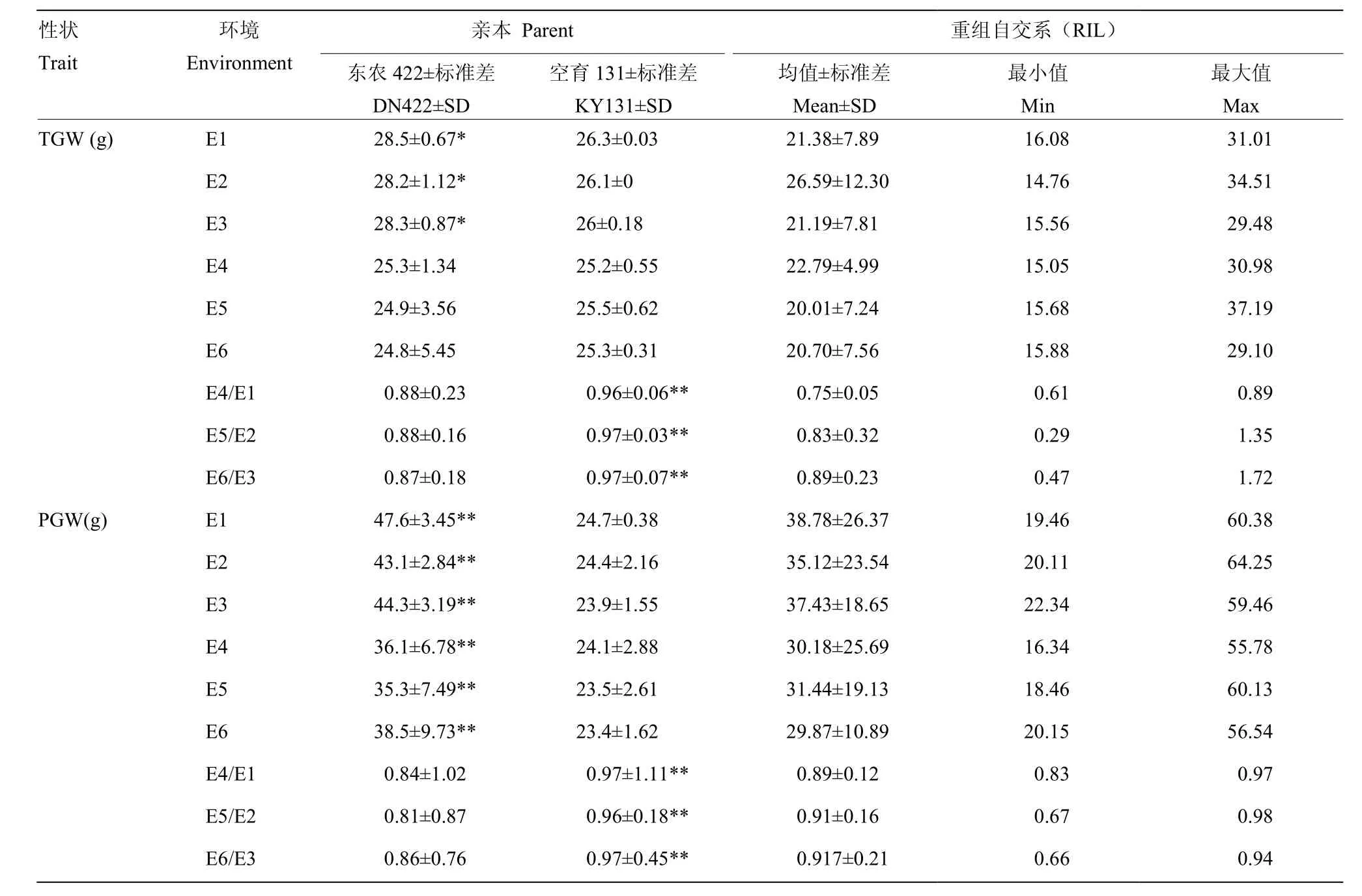
续表1 Continued table 1
由图1可知,第一主成分效应为43.8%,第二主成分效应为37.7%,总效应为81.5%,反映各环境81.5%的真实情况,5个性状落在4个扇形区的3个区域中,在E6条件下,IHD和FHD的值最高,在E2条件下,TGW和PGW的值最高,在E3条件下,结实率表现最好。在E1和E5条件下,没有性状落入区域中,说明这5个性状在这两个环境下表现不是最好。由图2可知,在环境充分得到反应的情况下,IHD、FHD和SSR之间的夹角小于90度,说明3个指标之间表现为正相关,同时,SSR和TGW、PGW为正相关,相关程度高。而TGW、PGW分别和IHD、FHD的夹角均大于90度,说明TGW、PGW和抽穗期呈负相关关系。
2.2遗传连锁图谱的构建和QTL分析
2.2.1遗传图谱的构建利用155对SSR引物对两亲本衍生的后代进行基因型鉴定,最终构建了图谱总长2 337 cM,覆盖水稻12条染色体,标记间平均距离为15.1 cM的遗传连锁图谱。
2.2.2加性QTL分析5个性状共检测到44个QTL(表3,图3),分布在第1、2、6、7、8和12染色体,有28个增效等位基因来自DN422,16个增效等位基因来自KY131,贡献率变化范围为4.15%—33.72%,其中,贡献率大于10%以上的QTL占40.9%,主要来自位于第7染色体的RM1362—RM1306和RM1306—RM70。其中,RM1362—RM1306检测到13个QTL,平均单个QTL解释的表型变异为18.21%,RM1360—RM70检测到的10个QTL平均贡献率为12.33%。RM247—RM27552内8个QTL的平均贡献率为10.27%。其中,IHD在6个环境中均检测到1个QTL,其中3个QTL位于区间RM1362—RM1306,分别在E1、E5、E6环境检测到,2个在RM1306—RM70检测到,来自于E2和E4。MALOSETTI等[28]和MESSMER等[29]表明,单一的环境并不能准确地描述QTL的效应和位置,且缺乏稳定性,因此,这些位于同一区间控制同一性状且在不同环境检测到的QTL可以认为是稳定表达的QTL。其中,有29个(65.9%)QTL在冷水胁迫和冷水反应指数上检测到,SSR仅在冷水处理下检测到3个QTL,其中2个位于区间RM1362—RM1306,另一个位于RM247—RM260,说明冷水处理对SSR的影响较大,改变了群体间的表型变化程度,增加了变异。TGW的QTL主要位于RM336—RM1362,相对于PGW来说,遗传范围狭窄。其中qIHD7-1、qIHD7-2、qFHD7-1、qSSR7-1和qSSR7-2在冷水处理、正常灌溉和冷水反应指数下同时被检测到,说明这5个QTL和耐冷性相关程度密切,另外,IHD、FHD均未在2013年检测到冷水反应指数相关的QTL,SSR在2014年未检测到冷水反应指数的QTL,说明冷水反应指数在阐述耐冷性QTL方面还受到年际的影响。
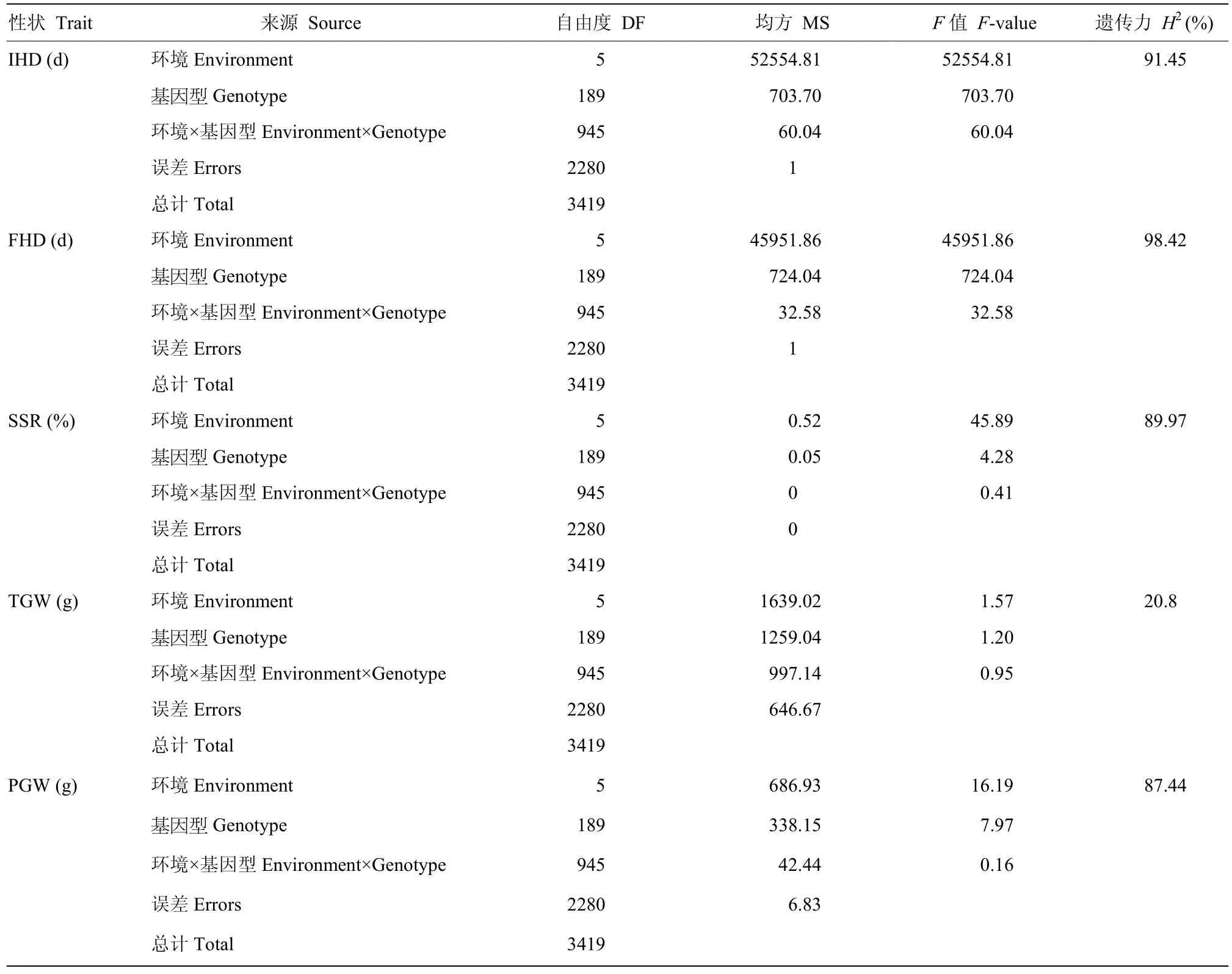
表2 始穗期、齐穗期、结实率、千粒重和单株粒重的方差分析及遗传力估计Table 2 Analysis of variance and estimates of heritability for IHD, FHD, SSR, TGW and PGW
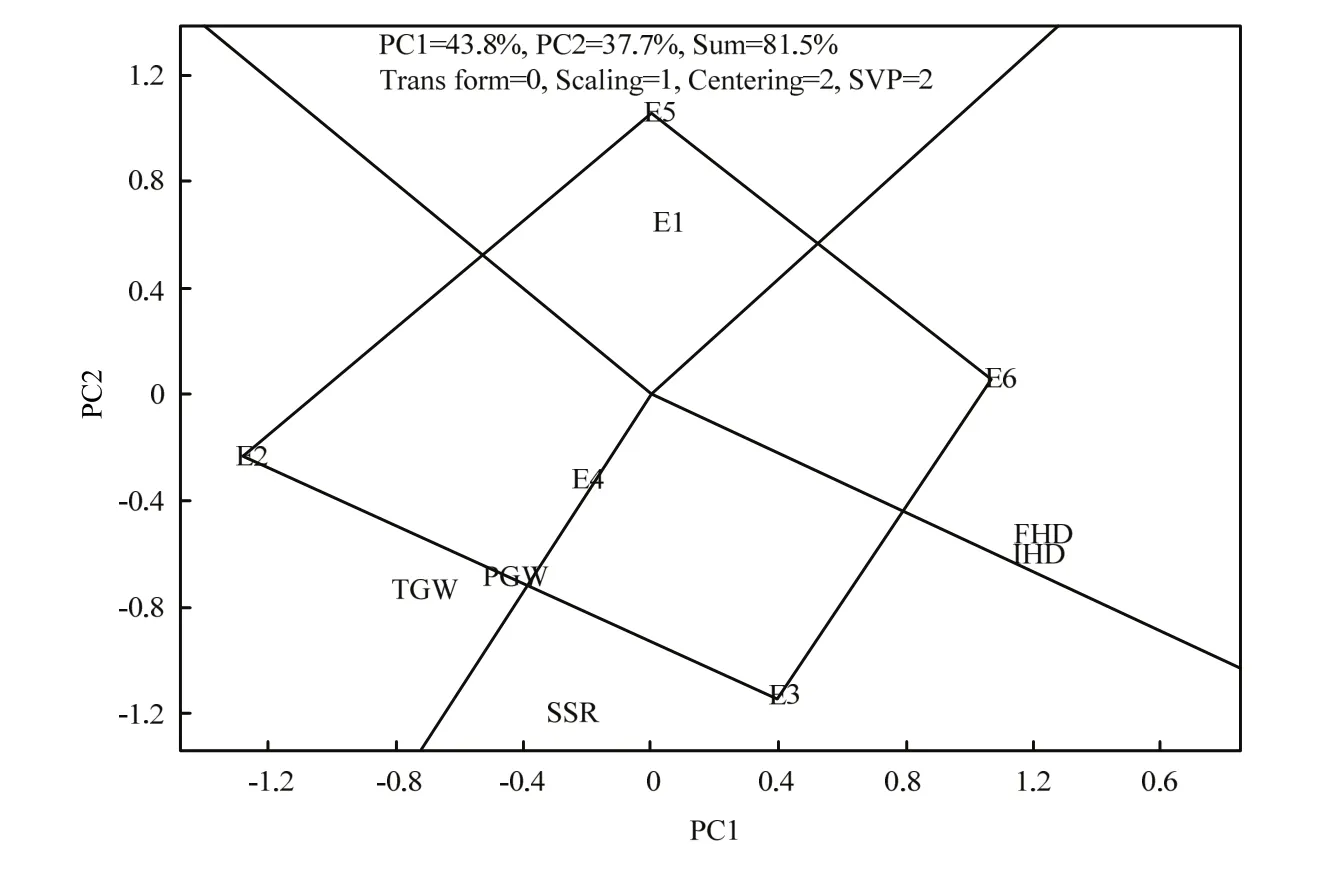
图1 不同环境与始穗期、齐穗期、结实率、千粒重和单株粒重的关系图Fig. 1 Correlation between environment and IHD, FHD, SSR,TGW and PGW
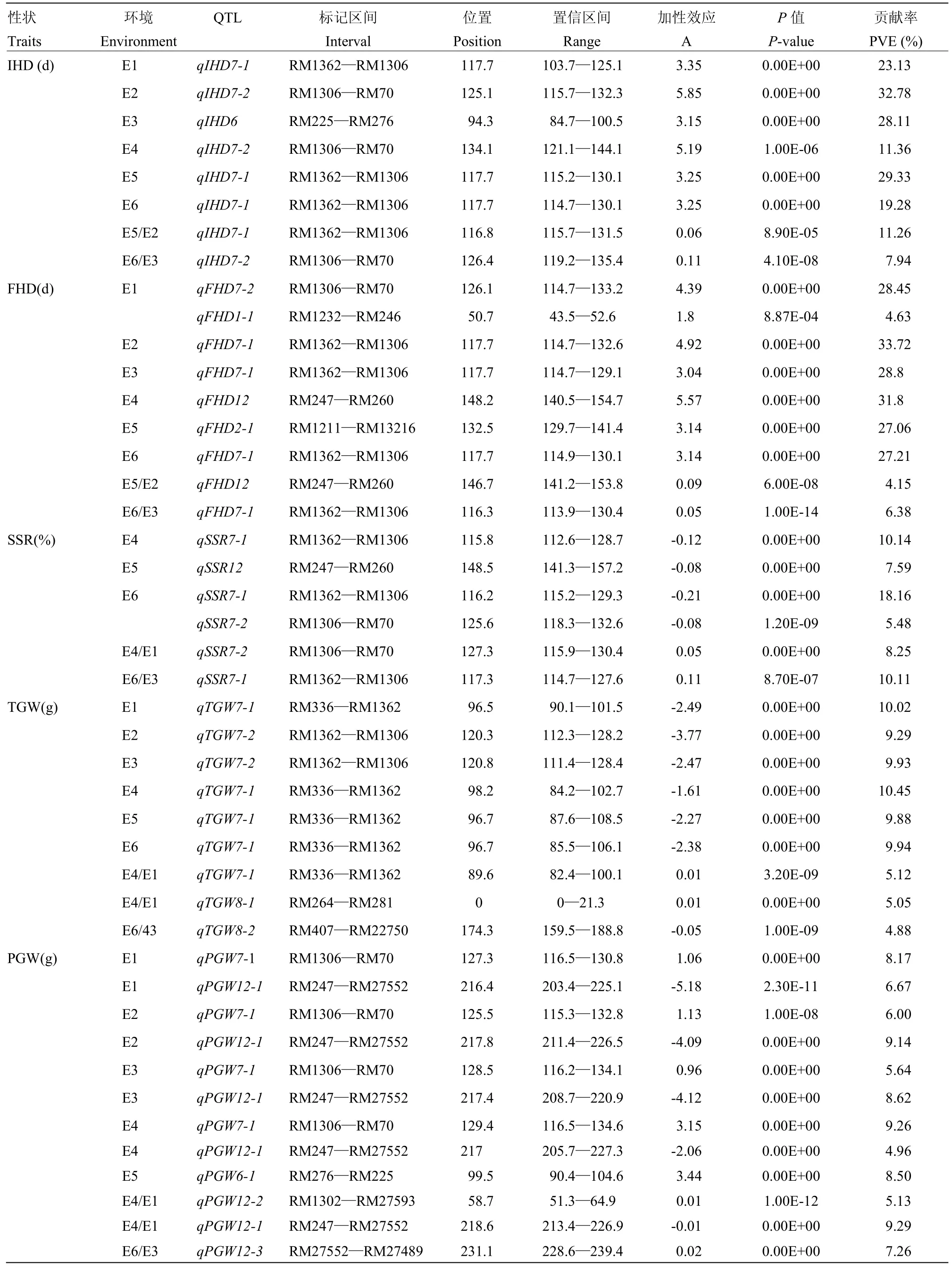
表3 单环境下水稻始穗期、齐穗期、结实率、千粒重和单株粒重的QTL及其遗传效应Table 3 QTL and their gentic effects of IHD, FHD, SSR, TGW and PGW at the single-environment in rice
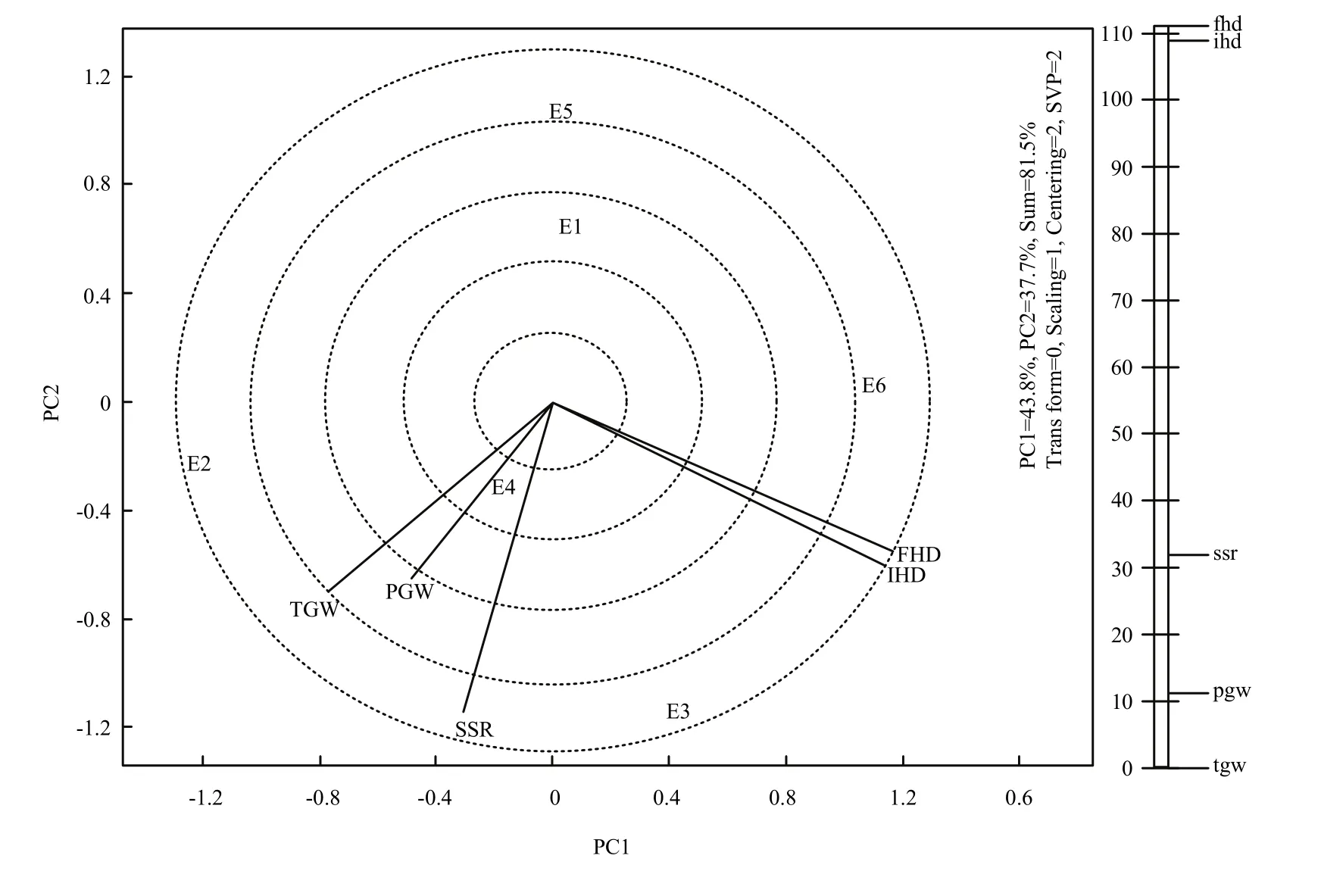
图2 不同环境下始穗期、齐穗期、结实率、千粒重和单株粒重的相关系数Fig. 2 Correlation coefficient among IHD, FHD, SSR,TGW and PGW in different environments
在冷水处理和正常灌溉下共检测到15个QTL(表4,图3),分布在第1、2、6、7和12染色体,除了TGW和PGW外,其他性状QTL的等位基因均来自于DN422。其中,冷水处理下检测到QTL数为10个,单个QTL贡献率介于5.19%—21.33%,延迟始穗期和齐穗期的平均天数分别为1.18和1.57 d,增加结实率0.19%,减少千粒重2.06 g,增加单株粒重1.02 g。且RM1362—RM1306同时检测到控制IHD、FHD、SSR和TGW的QTL,说明冷水胁迫对这4个性状的变异具有相似的影响。通过联合单处理分析,在冷水灌溉下检测到的QTL和耐冷性有关。
全部环境联合分析结果详见表5,共检测到12个QTL(表5,图3),分布于第2、3和7染色体。66.7%的QTL增效等位基因来自KY131。其中,第2染色体上的RM1211—RM13216控制IHD和FHD的表达,但二者的等位基因来源却不同,RM1306—RM70控制IHD和PGW的表达,等位基因来源相同。对比单环境检测到的QTL可以发现,平均贡献率仅为3.56%。同时,仅有35.7%的QTL检测到显著的QTL与环境互作,且仅有RM1306—RM70区间里的4个QTL同时在6个环境条件下存在QTL和环境互作关系。对比前面结果可知,多数出现在单环境和单处理下的QTL,也同时在多环境联合检测下定位到。如位于第7染色体上,标记区间RM1362—RM1306和RM1306—RM70检测到的QTL稳定性很强,这些控制同一性状,位于同一区间不同位点的QTL很可能是同一个QTL,而控制不同性状且位于该区间的QTL可能具有QTL的多效性。
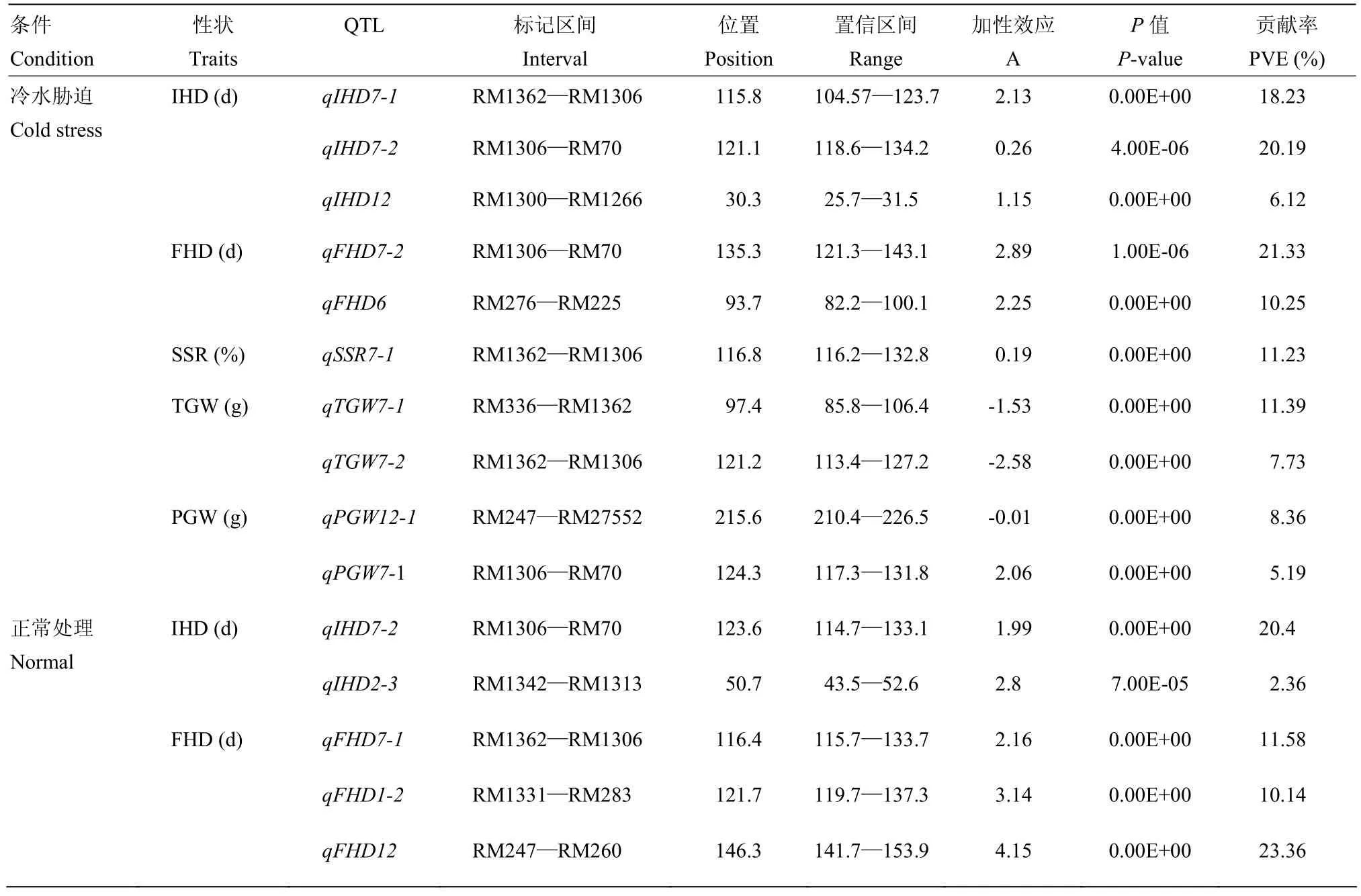
表4 单处理下水稻始穗期、齐穗期、结实率、千粒重和单株穗重的QTL及其遗传效应Table 4 QTL and their gentic effects of IHD, FHD, SSR, TGW and PGW at the single-treatment in rice

表5 全部环境联合分析下水稻始穗期、齐穗期、结实率、千粒重和单株粒重的QTL及其遗传效应Table 5 QTL and their gentic effects of IHD, FHD, SSR, TGW and PGW at the Joint QTLs combining data of all environments in rice
2.2.3上位性QTL分析单环境下,对上位性互作进行检测(表6),共检测到上位性互作位点20对,其中IHD有4对,分别在E1、E2、E5和E6条件下检测到,平均贡献率为0.95%,FHD有9对上位性位点,分别在E1、E3、E5和E6条件下检测到,平均贡献率为0.65%,SSR有2对,在E4和E5条件下检测到,平均贡献率为0.58%,TGW有2对,在E4和E5条件下检测到,PGW有3对,在E3、E4和E5条件下检测到。其中,位于RM1362—RM1306的QTL是控制IHD、FHD、SSR的主效QTL,在上位性互作中,分别参与了位于第1染色体上的qFHD1和第6染色体上的qFHD6的互作,2个互作对控制齐穗期表达,均表现为延迟齐穗期,延迟天数分别为1.14和1.37 d,还参与了位于第1染色体的qSSR1的互作,该互作对参与结实率表达,减少结实率2.16%。TGW和PGW也有主效QTL区间参与互作,这些有主效QTL参与的上位性互作对产生的上位性效应均小于加性效应。

图3 始穗期、齐穗期、结实率、千粒重和单株粒重QTL的连锁分布图Fig. 3 Distribution of QTL on linkage map for IHD, FHD, SSR, TGW and PGW
2.2.4基于性状的QTL间的相关分析通过单环境,单处理和多环境联合检测,累计QTL数为71个,除了RM1371—RM7、RM517—RM545、RM225—RM276和RM247—RM260检测到的QTL没有多效性之外,其余标记区间均出现多效性。研究利用超几何函数来评价QTL之间的关系,结果表明,始穗期和齐穗期QTL之间的相关性达到显著水平(P=0.01)。结实率QTL和始穗期、齐穗期QTL的相关性水平显著(P=0.02),和千粒重(P=0.04)和单株粒重(P=0.05)QTL的相关性均显著,说明千粒重和单株粒重的的高低和结实率在遗传上有紧密的连锁关系,而冷水处理推迟了抽穗时间,也严重减少了结实率,两者关系呈正相关,这从性状相关和QTL相关两方面得到了验证。
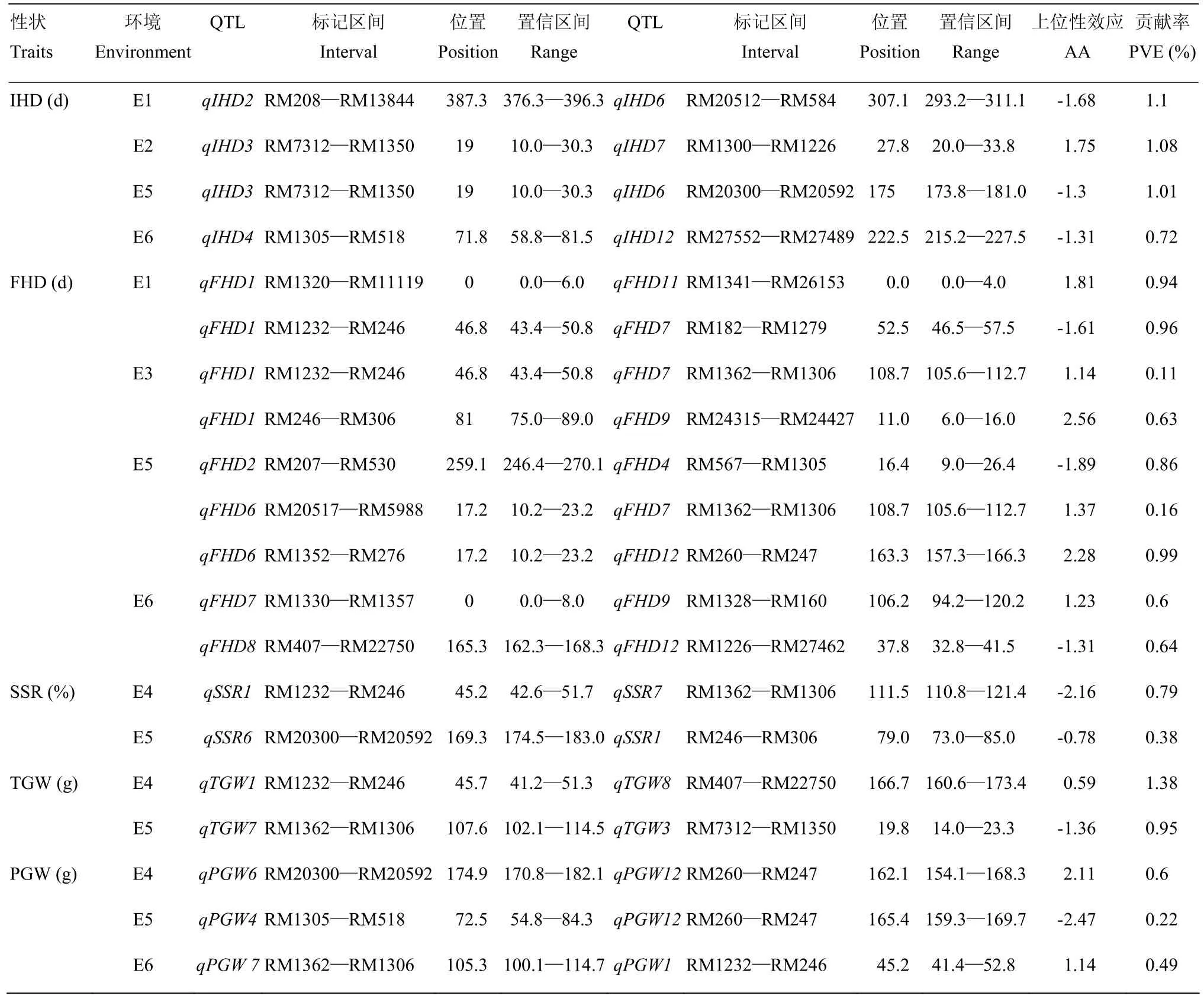
表6 单环境分析下水稻始穗期、齐穗期、结实率、千粒重和单株粒重的上位性QTL及其遗传效应Table 6 Epistatic QTL and their gentic effects of IHD, FHD, SSR, TGW and PGW at the single-environment in rice
3 讨论
3.1表型稳定性分析
本研究在连续3年环境下对始穗期、抽穗期、结实率、千粒重和单株粒重进行了统计,其中2015年,始穗期和齐穗期整体延迟,正常灌溉下,始穗期较2013年和2014年分别延迟7和9 d,而齐穗期分别延迟7和5 d;冷水处理下,始穗期延迟分别为8和11 d,齐穗期延迟分别为6和9 d,这可能跟2015年播种移栽时期气温低对苗期影响有关。同时,结实率受水温影响较大,千粒重和单株粒重同结实率呈正相关,也受到冷水胁迫。GGE双标图对于二维数据的分析应用广泛[20],研究利用不同环境和性状构建了二维双标图,揭示了不同环境下性状的稳定性,图1很好地反映了冷水胁迫和对照条件下性状的稳定性和差异,始穗期和齐穗期在E6环境下表现出整体推迟严重的现象,结实率在E3年值较高,而千粒重和单株粒重则在E2下表现最好,整体来看,5个性状在冷水胁迫下的值均低于对照,且同一性状在不同环境下表现出差异,这可能跟年际间环境差异有关,因此研究环境因子对性状的影响尤为重要,这可能是导致同一性状在不同环境下QTL表达存在差异的原因之一。
3.2低温对QTL评价的影响
本研究共检测到QTL数为71个,其中37个(52.1%)QTL在冷水胁迫或冷水反应指数下检测到,这些QTL表现出对冷水强的适应性。12个QTL在多环境联合分析下检测到,仅有5个QTL与环境发生互作。其中,qIHD7-1、qIHD7-2、qFHD7-1、qSSR7-1和qSSR7-2同时在正常灌溉,冷水处理和冷水反映指数下检测到,这些QTL可以反应性状的耐冷性,且贡献率较大,是进行耐冷性研究很好的选择。在研究的5个性状中,结实率受冷水影响最大,这与前人研究结果一致[30]。为了鉴定QTL的稳定性,本研究采用MESSMER等[29]的QTL逐步联合分析方法,在单环境分析下,与耐冷有关的QTL数为28个,单处理(冷水胁迫)分析下检测到的QTL数为10个,其中qIHD7-1和qIHD7-2在单环境和单处理分析下同时检测到,为冷水胁迫下稳定表达的QTL。而全部环境联合分析检测到的QTL,qIHD7-2、qFHD7-2和qPH7-2在单环境和单处理下也检测到。总的来说,不同处理和年际间,可重复检测的QTL数要大于单处理或单年际检测到的QTL数。相同性状在不同环境中的QTL会存在较大差异[31],这可以在本研究中得到证实。但本研究检测到的稳定QTL数不多,可能原因是年际间田间温度和光照等因子存在差异,因此要研究冷水灌溉下水稻农艺性状的遗传特性,在冷水环境下进行鉴定和改良是好的选择。
3.3抽穗期、结实率、千粒重和单株粒重QTL的研究比较
控制相关性状的QTL通常被定位在同一或相似的染色体区域[32],经过相同标记和图谱比较,本研究检测到的一些QTL与前人位于相邻位置,控制抽穗的qDTH-7[33]与本研究的RM1306具有相同标记,控制粒宽的QTL[34]和本研究的qIHD3位于共同区域,在RM1306—RM70,存在开花[35]和花序[36-38]有关的研究结果。在RM1362—RM1306,和水稻生长发育相关的CYP714B1和CYP714B2[39]也被发现。本研究检测到的和抽穗期,结实率相关的QTL在RM1362—RM1306和RM1306—RM70多次检测到,可能是稳定表达的区间,千粒重和单株粒重也分别在这两个区间多次检测到,总的来说,抽穗期检测到的QTL分布广泛,始穗期和齐穗期关联程度较大。而千粒重和单株粒重的QTL关联度不大,在RM27489—RM415,存在和结实率,齐穗期和单株粒重的QTL,在RM336—RM1362,存在与结实率、始穗期和千粒重的QTL。由此可见,这些多效性标记区间包含丰富的遗传背景,可控制多性状表达,可以通过杂交建立次级群体,在该区间进行遗传分解,找出具体控制某一性状表达的QTL片段。但这些研究并未针对耐冷性开展,因此,本研究在多环境下研究了抽穗期和产量性状的耐冷性,结果表明,抽穗期和结实率受冷水胁迫影响较大。利用结实率开展水稻耐冷方面的报道很多[40-43],定位到的QTL主要分布在染色体第2、3、7、8和10染色体上,在已报道的水稻耐冷性研究中,不同时期耐冷性QTL分布在水稻12条染色体上(qCT-1、qCTS-1-c、qCT-1、qCTB2a、qSDW2、qCSH2、qLTG3-1、qLVG3、qCTS4-1、qCTS4-3、Ctb1、OSAOXla、qLTG-5、qRCT6b、qLVG6、qLTG-7、qLVG7-2、qCIVG7-2、qCTB8、qCTS8-2a、qCTS8-2b、Clr9、Cisc(t)、ferll、dcll、qLT12、qCTS12),其中只有qCTB2a、ferll、Ctb1和qCTB8跟结实率有关,本研究检测到的稳定表达的耐冷性QTL在多年得到验证,包括qSSR7-1和qSSR7-2,分别位于RM1362—RM1306和RM1306—RM70,且均检测到QTL与环境的互作,其中RM1362—RM1306经过RAPD(http://rapdb.dna.affrc.go.jp)图谱比较发现,该区间包含6个注释基因(Os07g0681200、Os07g0681250、Os07g0681300、Os07g0681350、Os07g0681400和Os07g0681500),其中,Os07g0681300对赤霉素的内稳态起调节作用,Os07g0681400起钙离子调节作用,这些基因可能跟耐冷性发生变化有关,可以作为下一步研究对象。而研究中检测到可稳定表达的和抽穗期相关的主效耐冷QTL(qIHD7-1、qIHD7-2和qFHD7-1)可以作为冷水胁迫下分子育种的参考,为选择不同生育期的水稻育种提供相应遗传背景。
4 结论
冷水胁迫下,水稻抽穗时间延迟,结实率、千粒重和单株粒重下降,结实率分别同抽穗期,千粒重和单株粒重存在相似的遗传机制,而抽穗期和千粒重、单株穗重的遗传相互独立。相比而言,冷水胁迫下选育结实率高的品种比选育抽穗期、千粒重和单株粒重困难。
References
[1] GAO J P, CHAO D Y, LIN H X. Toward understanding molecular mechanisms of abiotic stress responses in rice. Rice, 2008, 1(1): 36-51.
[2] FUKAO T, XIONG L. Genetic mechanisms conferring adaptation to submergence and drought in rice: Simple or complex? Current Opinion in Plant Biology, 2013, 16(2): 196-204.
[3] WEI X, XU J, GUO H, JIANG L, CHEN S, YU C, ZHOU Z, HU P,ZHAI H, WAN J. DTH8 suppresses flowering in rice, influencing plant height and yield potential simultaneously. Plant Physiology,2010, 153(4): 1747-1758.
[4] YU S, LI J, XU C, TAN Y, LI X, ZHANG Q. Identification of quantitative trait loci and epistatic interactions for plant height and heading date in rice. Theoretical and Applied Genetics, 2002, 104(4): 619-625.
[5] LAFITTE H, ISMAIL A, BENNETT J. Abiotic stress tolerance in rice for Asia: Progress and the future// FISCHER T, TURNER N, ANGUS J, MCINTYRE L, ROBERTSON M, BORRELL A. New Directions for A Diverse Planet: Proceedings of the 4th International Crop Science Congress. Brisbane, Australia, 2004.
[6] Satake T. Sterile-type cool injury in paddy rice plants. Climate & Rice,1976: 281-300.
[7] 王国骄, 马殿荣, 苗微, 王嘉宇, 陈温福. 长期冷水胁迫对杂草稻和栽培稻农艺性状的影响. 沈阳农业大学学报, 2013, 44(1): 1-6.
WANG G J, MA D R, MIAO W, WANG J Y, CHEN W F. Effects of long-term cold water stress on agronomic characters in weedy and cultivated rice. Journal of Shenyang Agricultural University, 2013,44(1): 1-6. (in Chinese)
[8] 徐福荣, 汤翠凤, 余腾琼, 阿新祥, 张恩来, 杨雅云, 张墩宇, 董超,彭新禧, 戴陆园. 低纬高原和高纬平原粳稻主要耐冷相关性状的遗传分析. 中国水稻科学, 2009, 23(5): 481-488.
XU F R, TANG C F, YU T Q, A X X, ZHANG E L, YANG Y Y,ZHANG D Y, DONG C, PENG X X, DAI L Y. Genetic analysis of main characteristics related to cold tolerance in japonica rice from low-latitude plateau and high-latitude plain. Chinese Journal of Rice Science, 2009, 23(5): 481-488. (in Chinese)
[9] 徐福荣, 余腾琼, 汤翠凤, 阿新祥, 樊传章, 胡意良, 张敦宇, 董超,戴陆园. 粳稻十和田/昆明小白谷重组自交系群体主要农艺性状的低温反应. 中国农业科学, 2008, 41(11): 3437-3447.
XU F R, YU T Q, TANG C F, A X X, FAN C Z, HU Y L, ZHANG D Y, DONG C, DAI L Y. Low-temperature response to major agronomic traits by using recombinant inbred line (RIL) populations derived from Towada/Kunmingxiaobaigu Scientia Agricultura Sinica, 2008,41(11): 3437-3447. (in Chinese)
[10] ZENG Y, YANG S, CUI H, YANG X J, XU L, DU J, PU X Y, LI Z C,CHENG Z Q, HUANG X Q. QTLs of cold tolerance-related traits at the booting stage for NIL-RILs in rice revealed by SSR. Genes & Genomics, 2009, 31(2): 143-154.
[11] 谢勇武, 杨树明, 曾亚文, 杨涛, 普晓英, 杜鹃, 赵春艳, 张明喜.粳稻 02428× 02428c重组自交系孕穗期耐冷性QTL分析. 中国水稻科学, 2011, 25(6): 681-684.
XIE Y W, YANG S M, ZENG Y W, YANG T, PU X Y, DU J, ZHAO C Y, ZHANG M X. QTL analysis of cold tolerance in Japonica rice using recombinant inbred lines from 02428×02428c at booting stage. Chinese Journal of Rice Science, 2011, 25(6): 681-684. (in Chinese)
[12] YE C, FUKAI S, GODWIN I, REINKE R, SNELL P, SCHILLER J,BASNAYAKE J. Cold tolerance in rice varieties at different growth stages. Crop and Pasture Science, 2009, 60(4): 328-338.
[13] 李海波, 侯守贵, 于广星, 王友芬, 陈盈, 王宁, 赵琦, 付亮, 张红艳, 邢亚南. 孕穗抽穗期低温对水稻植株, 产量性状及脯氨酸含量的影响. 中国农学通报, 2011, 27(1): 63-68.
LI H B, HOU S G, YU G X, WANG Y F, CHEN Y, WANG N, ZHAO Q, FU L, ZHANG H Y, XING Y N. Effects of low temperature stresses on the characters of plant, yield and the proline contents in rice leaves at booting and heading stages. Chinese Agricultural Science Bulletin, 2011, 27(1): 63-68. (in Chinese)
[14] KUROKI M, SAITO K, MATSUBA S, YOKOGAMI N, SHIMIZU H, ANDO I, SATO Y. A quantitative trait locus for cold tolerance at the booting stage on rice chromosome 8. Theoretical and Applied Genetics, 2007, 115(5): 593-600.
[15] SAITO K, HAYANO SAITO Y, KUROKI M, SATO Y. Map-based cloning of the rice cold tolerance gene Ctb1. Plant Science, 2010,179(1): 97-102.
[16] TAKEUCHI Y, HAYASAKA H, CHIBA B, TANAKA I, SHIMANO T, YAMAGISHI M, NAGANO K, SASAKI T, YANO M. Mapping quantitative trait loci controlling cool-temperature tolerance at booting stage in temperate japonica rice. Breeding Science, 2001, 51(3): 191-197.
[17] 韩龙植, 乔永利, 张三元, 曹桂兰, 叶昌荣, 徐福荣, 戴陆园, 芮钟斗, 高熙宗. 不同生长环境下水稻主要农艺性状的QTL分析. 中国农业科学, 2005, 38(6): 1080-1087.
HANG L Z, QIAO Y L, ZHANG S Y, CAO G L, YE C R, XU F R,DAI L Y, RUI Z D, GAO X Z. QTL analysis of some agronomic traits in rice under different growing environments. Scientia Agricultura Sinica, 2005, 38(6): 1080-1087. (in Chinese)
[18] IMAM A, ALLARD R W. Population studies in predominantly self-pollinated species: VI. Genetic variability between and within natural populations of wild oats from differing habitats in California. Genetics, 1965, 51(1): 49-62.
[19] LI Z, YU S, LAFITTE H, HUANG N, COURTOIS B, HITTALMANI S, VIJAYAKUMAR C, LIU G, WANG G, SHASHIDHAR H. QTL× environment interactions in rice: I. Heading date and plant height. Theoretical and Applied Genetics, 2003, 108(1): 141-153.
[20] YAN W. GGEbiplot-a Windows application for graphical analysis of multienvironment trial data and other types of two-way data. Agronomy Journal, 2001, 93(5): 1111-1118.
[21] LARSEN R J, MARX M L. An Introduction to Probability and Its Applications. America: Prentice-Hall, 1985.
[22] PELEG Z, FAHIMA T, KRUGMAN T, ABBO S, YAKIR D, KOROL A B, SARANGA Y. Genomic dissection of drought resistance in durum wheat× wild emmer wheat recombinant inbreed line population. Plant, Cell & Environment, 2009, 32(7): 758-779.
[23] MATSUNAGA K. Establishment of an evaluation method for cold tolerance at the booting stage of rice using deep water irrigation system and development of highly cold-tolerant rice varieties by combining cold tolerance genes. Miyagi Prefectural Furukawa Agricultural Experiment Station, 2005, 4: 1-78.
[24] HOSSEINI M, HOUSHMAND S, MOHAMADI S, TARANG A,KHODAMBASHI M, RAHIMSOROUSH H. Detection of QTLs with main, epistatic and QTL× environment interaction effects for rice grain appearance quality traits using two populations of backcross inbred lines (BILs). Field Crops Research, 2012, 135: 97-106.
[25] DOYLE J J. Isolation of plant DNA from fresh tissue. Focus, 1990,12: 13-15.
[26] MCCOUCH S, CHO Y, YANO M, PAUL E, BLINSTRUB M,MORISHIMA H, KINOSHITA T. Report on QTL nomenclature. Rice Genetics Newsletter, 1997, 14 (11): 11-131.
[27] PATERSON A H, LIN Y R, LI Z, SCHERTZ K F. Convergent domestication of cereal crops by independent mutations at corresponding genetic loci. Science, 1995, 269 (5231): 1714.
[28] MALOSETTI M, RIBAUT J M, VARGAS M, CROSSA J, VAN EEUWIJK F A. A multi-trait multi-environment QTL mixed model with an application to drought and nitrogen stress trials in maize (Zea mays L.). Euphytica, 2008, 161(1/2): 241-257.
[29] MESSMER R, FRACHEBOUD Y, BÄNZIGER M, VARGAS M,STAMP P, RIBAUT J M. Drought stress and tropical maize: QTL-by-environment interactions and stability of QTLs across environments for yield components and secondary traits. Theoretical and Applied Genetics, 2009, 119(5): 913-930.
[30] XU F, YU T, TANG C, Xin X A, FAN C, HU Y, ZHANG D, Chao D,DAI L. Low-temperature response to major agronomic traits by using recombinant inbred line (RIL) populations derived from Towada× Kunmingxiaobaigu. Agricultural Sciences in China, 2009, 8(11): 1301-1311.
[31] PATERSON A H, DAMON S, HEWITT J D, ZAMIR D,RABINOWITCH H D, LINCOLN S E, LANDER E S, TANKSLEY S D. Mendelian factors underlying quantitative traits in tomato: comparison across species, generations, and environments. Genetics,1991, 127(1): 181-197.
[32] XIAO J, LI J, YUAN L, TANKSLEY S D. Identification of QTLs affecting traits of agronomic importance in a recombinant inbred population derived from a subspecific rice cross. Theoretical and Applied Genetics, 1996, 92(2): 230-244.
[33] FUJINO K, SEKIGUCHI H. Identification of QTLs conferring genetic variation for heading date among rice varieties at the northern-limit of rice cultivation. Breeding Science, 2005, 55(2): 141-146.
[34] RABIEI B, VALIZADEH M, GHAREYAZIE B, MOGHADDAM M,ALI A. Identification of QTLs for rice grain size and shape of Iranian cultivars using SSR markers. Euphytica, 2004, 137(3): 325-332.
[35] FORNARA F, PAŘENICOVÁ L, FALASCA G, PELUCCHI N,MASIERO S, CIANNAMEA S, LOPEZ-DEE Z, ALTAMURA M M,COLOMBO L, KATER M M. Functional characterization of OsMADS18, a member of the AP1/SQUA subfamily of MADS box genes. Plant Physiology, 2004, 135(4): 2207-2219.
[36] NIU N, LIANG W, YANG X, JIN W, WILSON Z A, HU J, ZHANG D. EAT1 promotes tapetal cell death by regulating aspartic proteases during male reproductive development in rice. Nature Communications,2013, 4: 1445.
[37] ABE Y, MIEDA K, ANDO T, KONO I, YANO M, KITANO H,IWASAKI Y. The SMALL AND ROUND SEED1 (SRS1/DEP2) gene is involved in the regulation of seed size in rice. Genes & Genetic Systems, 2010, 85(5): 327-339.
[38] NI D H, LI J, DUAN Y B, YANG Y C, WEI P C, XU R F, LI C R,LIANG D D, LI H, SONG F S. Identification and utilization of cleistogamy gene cl7 (t) in rice (Oryza sativa L.). Journal of Experimental Botany, 2014, 65(8): 2107-2117.
[39] MAGOME H, NOMURA T, HANADA A, TAKEDA K N, OHNISHI T, SHINMA Y, KATSUMATA T, KAWAIDE H, KAMIYA Y,YAMAGUCHI S. CYP714B1 and CYP714B2 encode gibberellin 13-oxidases that reduce gibberellin activity in rice. Proceedings of the National Academy of Sciences of the USA, 2013, 110(5): 1947-1952.
[40] YE C, FUKAI S, GODWIN I, KOH H, REINKE R, ZHOU Y,LAMBRIDES C, JIANG W, SNELL P, REDONA E. A QTL controlling low temperature induced spikelet sterility at booting stage in rice. Euphytica, 2010, 176(3): 291-301.
[41] SUH J, JEUNG J, LEE J, CHOI Y, YEA J, VIRK P, MACKILL D,JENA K. Identification and analysis of QTLs controlling cold tolerance at the reproductive stage and validation of effective QTLs in cold-tolerant genotypes of rice (Oryza sativa L.). Theoretical and Applied Genetics, 2010, 120(5): 985-995.
[42] SHIRASAWA S, ENDO T, NAKAGOMI K, YAMAGUCHI M,NISHIO T. Delimitation of a QTL region controlling cold tolerance at booting stage of a cultivar,‘Lijiangxintuanheigu', in rice, Oryza sativa L.. Theoretical and Applied Genetics, 2012, 124(5): 937-946.
[43] JENA K, KIM S, SUH J, YANG C, KIM Y. Identification of cold-tolerant breeding lines by quantitative trait loci associated with cold tolerance in rice. Crop Science, 2012, 52(2): 517-523.
(责任编辑李莉)
QTL Analysis of Heading Date and Yield Traits in Japonica Rice Under Cold Water Stress in Different Years
YANG Luo-miao, SUN Jian, ZHAO Hong-wei, WANG Jing-guo, LIU Hua-long, ZOU De-tang
(Rice Research Institute, College of Agricultural, Northeast Agricultural University, Harbin 150030)
【Objective】Heading date, seed setting rate, thousand grain weight and grain weight per plant are traits associated with yield and these traits are greatly influenced by cold water. Therefore, the QTL analysis of heading date, seed setting rate,thousand grain weight and grain weight per plant of rice under cold water stress were conducted in the present study in order to provide a scientific basis for the rice genetic mechanism of cold tolerance and molecular marker assisted breeding. 【Method】Totally 190 recombinant inbred line (RIL) populations derived from two rice varieties (Dongnong 422 and Kongyu131) were used as materials under cold water irrigation at booting stage, a linkage map was constructed using 155 SSR markers. The correlation analysis on the initial heading (IHD) date, full heading (FHD) date, seed setting rate, thousand grain weight and grain weight perplant were conducted to detect (QTL) these traits by stepwise joint QTL mapping method. The correlations between QTLs of different traits were determined by using the hypergeometric probability function. 【Result】 IHD and FHD were postponed under cold water irrigation in two parents and RIL. Seed setting rate, thousand grain weight and grain weight per plant had significant changes. Those traits had a positive or a negative correlation. A total of 71 QTLs were detected by using stepwise joint QTL mapping method, among them, 37 QTL were associated with cold tolerance, among them, 28 were detected under singleenvironment, 11 QTL explained beyond 10% of phenotypic variance, 10 QTL were detected under the single-treatment, 6 QTL explained beyond 10% of phenotypic variance, all 17 QTL were associated with cold tolerance. Five QTL had significant QE interaction under the Joint QTLs combining data of all environments. Twenty pairs of additive×additive epistasis were detected,and two main-effect QTL had epistatic interaction. Hypergeometric probability function showed that QTL was associated among those traits. By comparing the mapping results, some of the detected QTLs were in the same or adjacent chromosomal regions of previously reported QTLs, which include qIHD7-2, qFHD7-2, qFHD7-1 and qIHD7-1. These four QTL were stable in different environments, meanwhile, qIHD7-1, qIHD7-2, qFHD7-1, qSSR7-1 and qSSR7-2 were associated with cold tolerance. These QTL loci may provide a basis for molecular breeding for cold resistance in rice.【Conclusion】Seed setting rate has similar genetic mechanism with heading date, thousand grain weight and grain weight per plant under cold water stress. However, heading date,thousand grain weight and grain weight per plant are independently inherited. Meanwhile, it is more harder to breed the rice has high seed setting rate than heading date, thousand grain weight and grain weight per plant under cold water stress.
Japonica rice; cold water stress; heading data; yield traits; QTL
2016-04-21;接受日期:2016-07-13
黑龙江省重大科技招标基金项目(GA14B102-02)
联系方式:杨洛淼,E-mail:yaochang616@163.com。通信作者邹德堂,E-mail:zoudtneau@126.com

