小麦-长穗偃麦草7E抗赤霉病易位系培育
张璐璐,陈士强,李海凤,刘慧萍,4,戴 毅,4,高 勇,陈建民
(1扬州大学生物科学与技术学院,江苏扬州 225009;2江苏里下河地区农业科学研究所,江苏扬州 225007;3扬州市职业大学,江苏扬州 225012;4江苏省农业生物学重点实验室,南京 210014)
小麦-长穗偃麦草7E抗赤霉病易位系培育
张璐璐1,陈士强2,李海凤3,刘慧萍1,4,戴毅1,4,高勇1,陈建民1
(1扬州大学生物科学与技术学院,江苏扬州 225009;2江苏里下河地区农业科学研究所,江苏扬州 225007;3扬州市职业大学,江苏扬州 225012;4江苏省农业生物学重点实验室,南京 210014)
【目的】将二倍体长穗偃麦草7E染色体导入主栽小麦背景,培育小麦-长穗偃麦草7E染色体抗赤霉病易位系,为小麦抗赤霉病遗传改良利用外源优良基因提供新种质。【方法】利用中国春-长穗偃麦草7E代换系DS7E(7B)与扬麦16杂交的F2种子进行60Co辐射(30 000 rad)和种植,表现型选择收获存活M1植株的种子,从M2连续通过表型农艺性状选择、单花滴注法进行赤霉病抗性鉴定和长穗偃麦草7E染色体或染色体臂特异分子标记PCR扩增筛选,最后在M4代对中选材料以长穗偃麦草基因组DNA为探针进行基因组原位杂交(genomic in situ hybridization,GISH)证实。【结果】M1选择了赤霉病发病率不同的13个单株进行繁殖。利用前期开发的长穗偃麦草7E染色体和7EL、7ES特异标记检测13株的后代M2单株,获得含有长穗偃麦草7EL片段7株和7ES片段14株;对21株M2衍生的222个M3植株进行特异标记检测,共选择含有长穗偃麦草7EL片段13株和7ES片段3株;利用来自12株M3的后代(M4)进行GISH,共9株M3的后代具有小麦-长穗偃麦草易位染色体,体细胞染色体2n=42。2株M3的后代显示附加2条长穗偃麦草染色体短臂,体细胞染色体2n=44。连续多年多途径的筛选,获得4份材料,3份材料均为长穗偃麦草7E染色体长臂易位系,命名为TW-7EL1、TW-7EL2和TW-7EL3。1份为7E染色体短臂附加系,命名为W-DA7ES,最后所获得的材料是源自M1代2个单株。连续3年赤霉病抗性鉴定结果表明长穗偃麦草7EL易位系抗性高,发病率明显低于中国春和扬麦16,与苏麦3号相当,而7ES附加系的赤霉病抗性明显较低,发病率明显高于7EL易位系。【结论】通过赤霉病抗性鉴定、染色体特异分子标记筛选和GISH证实相结合培育了小麦-长穗偃麦草7EL抗赤霉病易位系,长穗偃麦草易位片段鉴定快速和准确。二倍体长穗偃麦草7E染色体长臂中含有抗小麦赤霉病的基因。
小麦;长穗偃麦草;赤霉病;易位系
0 引言
【研究意义】小麦(Triticum aestivum L.)是世界上最早栽培的农作物之一,也是总产量仅次于玉米的第二大粮食作物。由禾谷镰刀菌(Fusarium graminearum)引起的小麦赤霉病(Fusarium head blight,FHB)是一种世界性病害,严重影响了小麦产量和品质,而且感染麦粒中禾谷镰刀菌的次生代谢产物,严重威胁人类的健康[1]。中国是小麦赤霉病受害面积最大的国家,近年来更有不断扩大受害面积的趋势,除长江中下游及东北三江平原外,在豫、鲁、陕等地也有发展,在全国每年受害面积约700万hm2,占小麦种植面积的四分之一,每年因赤霉病损失产量约200万—300万吨[2]。随着小麦育种中少数亲本的反复使用和耕作制度的变化,栽培小麦种内遗传变异急剧减少,继续在栽培小麦种内挖掘新的优良种质效果有限,使得小麦高产优质抗病育种进展不尽人意。为了拓宽小麦的遗传变异类型,提高小麦的育种效率,通过远缘杂交从小麦近缘野生种中引入有益基因,并利用这些有益基因培育小麦新品种,已成为人们的共识和小麦新品种选育的重要途径。【前人研究进展】小麦的野生近缘物种是小麦宝贵的基因资源库。二倍体长穗偃麦草(Thinopyrum elongatum (Host) A. Löve,2n=2x=14,EE),具有抗盐、抗旱、大穗、多花、优质、繁殖能力和适应性强、抗病虫害等许多优良性状[3-5]。利用RFLP等标记确定长穗偃麦草的E组7条染色体分别与小麦染色体A、B、D组7个部分同源群具有部分同源关系,表明长穗偃麦草E基因组与小麦A、B、D基因组的遗传分化程度相对较小[6]。因此,在普通小麦遗传改良中可以方便地利用长穗偃麦草的遗传基础。通过对小麦-长穗偃麦草全套附加系赤霉病接种鉴定发现,1E染色体上存在赤霉病抗性基因[7],硬粒小麦-长穗偃麦草1E染色体附加系的研究中也认为1E染色体上存在赤霉病抗性基因[8];除此之外,研究表明在7E染色体也具有赤霉病抗性基因,并将该抗性基因定位在7E长臂上[9-11]。培育小麦附加系、代换系和易位系是利用外源种质改良小麦的一条重要途径,其中,易位系以其导入外源染色体小片段仅含优良目标基因的优点,它比附加系及代换系在作物育种中的意义更重大。易位系可以直接作为品种在生产上推广利用,例如小麦-黑麦1BL/1RS易位系携有多种小麦叶部病害的抗性基因,同时具有广泛的适应性和高产的遗传效应,被广泛应用于世界各国栽培小麦的品种改良中[12-13]。目前,主要是通过远缘杂交材料经辐射[14-17]、ph1b[18-19]、组织培养[20]、杀配子染色体[21]等途径使染色体发生断裂后发生错误重接而培育易位系。通过众多科学家多年研究获得小麦与多个近缘种的易位系,如小麦与簇毛麦[22]、小麦与大赖草[23]、小麦与黑麦[24]、小麦与中间偃麦草[25-26]以及小麦与百萨偃麦草[27]等物种间染色体易位系。其中,电离辐射容易诱导染色体断裂重接而产生各种染色体结构变异,是易位系培育的常用方法[28]。在获得的小麦-长穗偃麦草易位系中,偃麦草染色体是来源于十倍体长穗偃麦草(Th. ponticurn, 2n = 70)的一对部分同源染色体7ell和7el2,与7E染色体具有部分同源性[29]。赤霉病抗性研究表明7el1的代换系和易位系均没有抗性,而臂间易位(7DS·7el2L)具有抗性[30]。利用ph1b突变体与7DS·7el2L臂间易位杂交,将其中的抗赤霉病基因(Fhb7)定位于7el2的长臂上,并获得聚合了Fhb1与Fhb7 2个抗赤霉病基因的育种材料[31]。【本研究切入点】综上所述,小麦与多个近缘种产生的易位系中多数是以中国春小麦为背景,在抗赤霉病育种中作为亲本的可利用性不高。二倍体长穗偃麦草也具有赤霉病抗性,研究表明其抗性基因位于1E和7E染色体[7-11],但未见在主栽小麦背景培育7E染色体易位系的成功报道。【拟解决的关键问题】本研究利用60Co辐射处理小麦-长穗偃麦草7E代换系DS7E(7B)与扬麦16杂交的F2种子,在辐射后代的繁殖过程中,首先进行表现型筛选,选择赤霉病抗性相对较强又具有长穗偃麦草相关特征的单株种植,继续进行赤霉病抗性和农艺性状选择,在此基础上利用长穗偃麦草7E染色体特异标记对获选单株进行PCR检测,最后通过基因组荧光原位杂交(genomic in situ hybridization,GISH)进行小麦-长穗偃麦草抗赤霉病易位系确认。利用赤霉病抗性鉴定、分子标记筛选和GISH确认3种方法相结合培育小麦-长穗偃麦草抗赤霉病易位系的途径,选择目标明确,选择效率高,培育周期短,为小麦异源易位系的培育提供了有效途径。所获小麦-长穗偃麦草7E抗赤霉病易位系为小麦品种改良和小片段易位系的研究提供了新种质或基础材料。
1 材料与方法
1.1植物材料
所用材料包括长穗偃麦草(Th. elongatum,2n=2x=14)、中国春-长穗偃麦草7E附加系(DA7E)、7E长臂附加系(DA7EL)、7E短臂附加系(DA7ES),中国春-长穗偃麦草7E代换系(DS7E(7B))、扬麦16(Y16)、中国春(CS)、苏麦3号(SU3)和安农8455(AN8455)。扬麦16、苏麦3号和安农8455引自江苏里下河地区农业科学研究所,其他材料由加拿大农业部Ottawa研究中心的Dr.FEDAK研究员提供。
1.2长穗偃麦草特异标记筛选
提取供试材料的基因组DNA[32],通过PCR进行分子标记筛选。用于染色体或染色体臂鉴定的分子标记为笔者前期开发的长穗偃麦草特异标记[33-35]。PCR反应体系为模板DNA(100 ng·μL-1)1 μL、上游引物和下游引物各1 μL(10 µmol·L-1)、10×PCR缓冲液2.5 μL、2.5 mmol·L-1的dNTP 2 μL、5 U·μL-1的Taq酶0.3 μL,ddH2O定容至25 μL。PCR反应过程为94℃ 5 min;94℃ 45 s,根据不同引物在50—60℃退火1 min,72℃ 90 s,35个循环,72℃ 10 min。扩增产物利用1%琼脂糖凝胶电泳进行检测。
1.3易位系培育途径
利用扬麦16与DS7E(7B)杂交,60Co辐射(辐射剂量为30 000 rad)F2种子,收获成活M1植株自交种子为M2群体。从M2开始进行农艺性状、赤霉病抗性和染色体特异分子标记的筛选,各世代的中选植株均单株收获进行繁殖,最后对含有7E染色体特异标记扩增的M4抗性材料进行基因组原位杂交,获得小麦-长穗偃麦草7E抗赤霉病易位系(图1)。
1.4赤霉病抗性鉴定
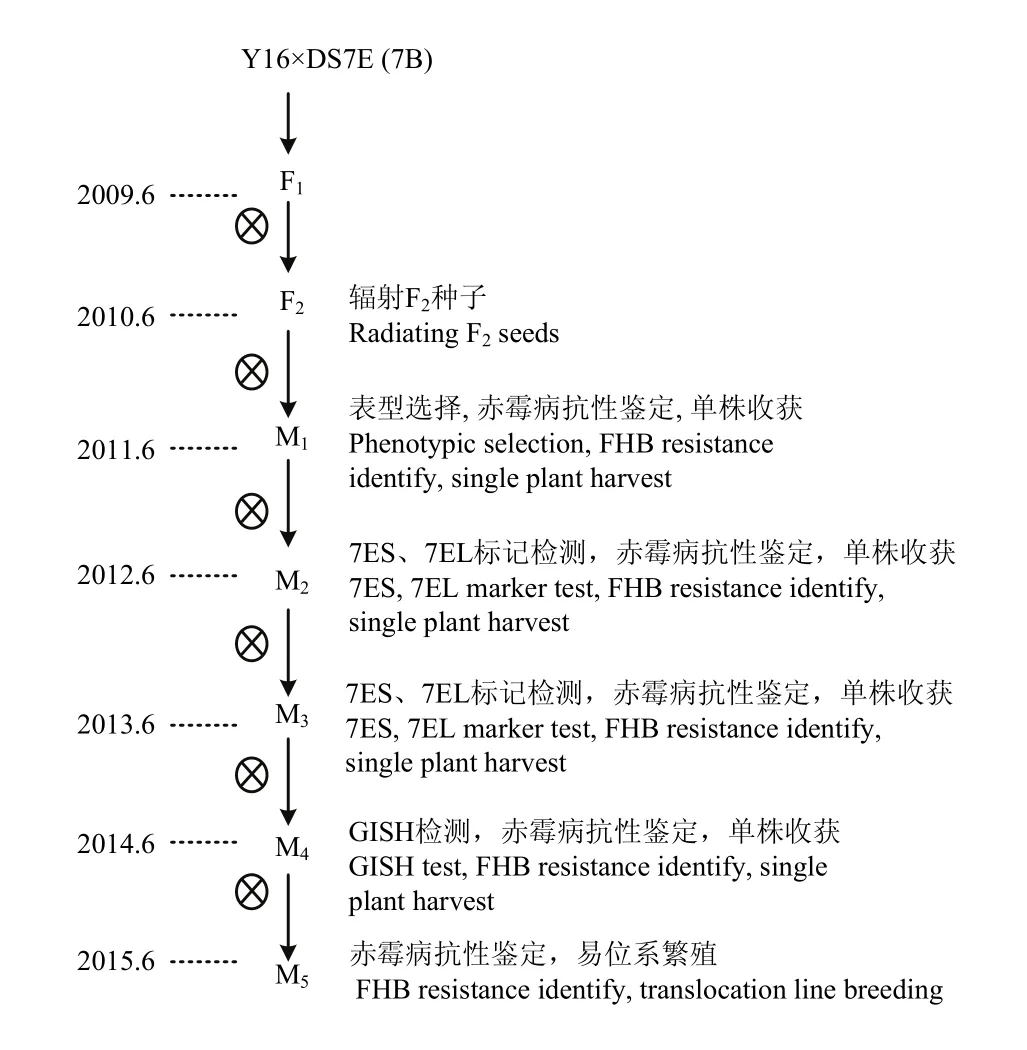
图1 辐射法培育小麦-长穗偃麦草抗赤霉病易位系Fig. 1 Development of wheat -Th. elongatum translocation lines with FBH resistance by radiation
对辐射后的各世代均进行赤霉病抗性选择,选择的M1单株赤霉病抗性表现不同,但具有长穗偃麦草的特征,M2以后的单株选择要求既具有7E染色体特异分子标记扩增,而赤霉病抗性表现又要好。M1赤霉病抗性以自然发病率(病穗率)进行筛选,从M2开始采用单花滴注法进行赤霉病的抗性鉴定,接种21 d后调查发病情况。发病结果调查以单株为单位,汇总各单株结果平均后作为整行的抗性表现。发病率以病小穗数除以总小穗数的病小穗率表示。
1.5基因组原位杂交
细胞学制片方法参考GILL等[36]的方法并稍加改进。将经前处理和固定后的根尖洗涤后在2%的醋酸洋红中浸泡24 h以上,制片时切下根尖分生组织于载玻片上,滴加45%的醋酸进行压片,选择染色体分散好的制片,-70℃冷冻后揭开盖玻片,系列酒精脱水处理保存备用。按照ZHANG等[37]的方法进行基因组原位杂交,以二倍体长穗偃麦草基因组DNA通过缺口平移法进行地高辛标记作为探针,中国春基因组DNA为封阻,具体比例为探针总浓度:封阻总浓度=1∶50,在安装有CCD相机的Olympus荧光显微镜下观察杂交信号并拍照。
2 结果
2.1长穗偃麦草特异分子标记的筛选
利用扬州大学陈建民教授实验室开发的标记[33-35]对中国春-长穗偃麦草7E附加系(DA7E)、7E长臂附加系(DA7EL)、7E短臂附加系(DA7ES)、二倍体长穗偃麦草(2X)以及中国春(CS)、扬麦16(Y16)进行PCR特异性扩增,进一步对7E染色体、7ES、7EL染色体臂的标记进行选择。共选择7E染色体标记4个(7E染色体标记对7EL、7ES同样扩增),7EL标记11个,7ES标记6个,标记名称及序列见表1。
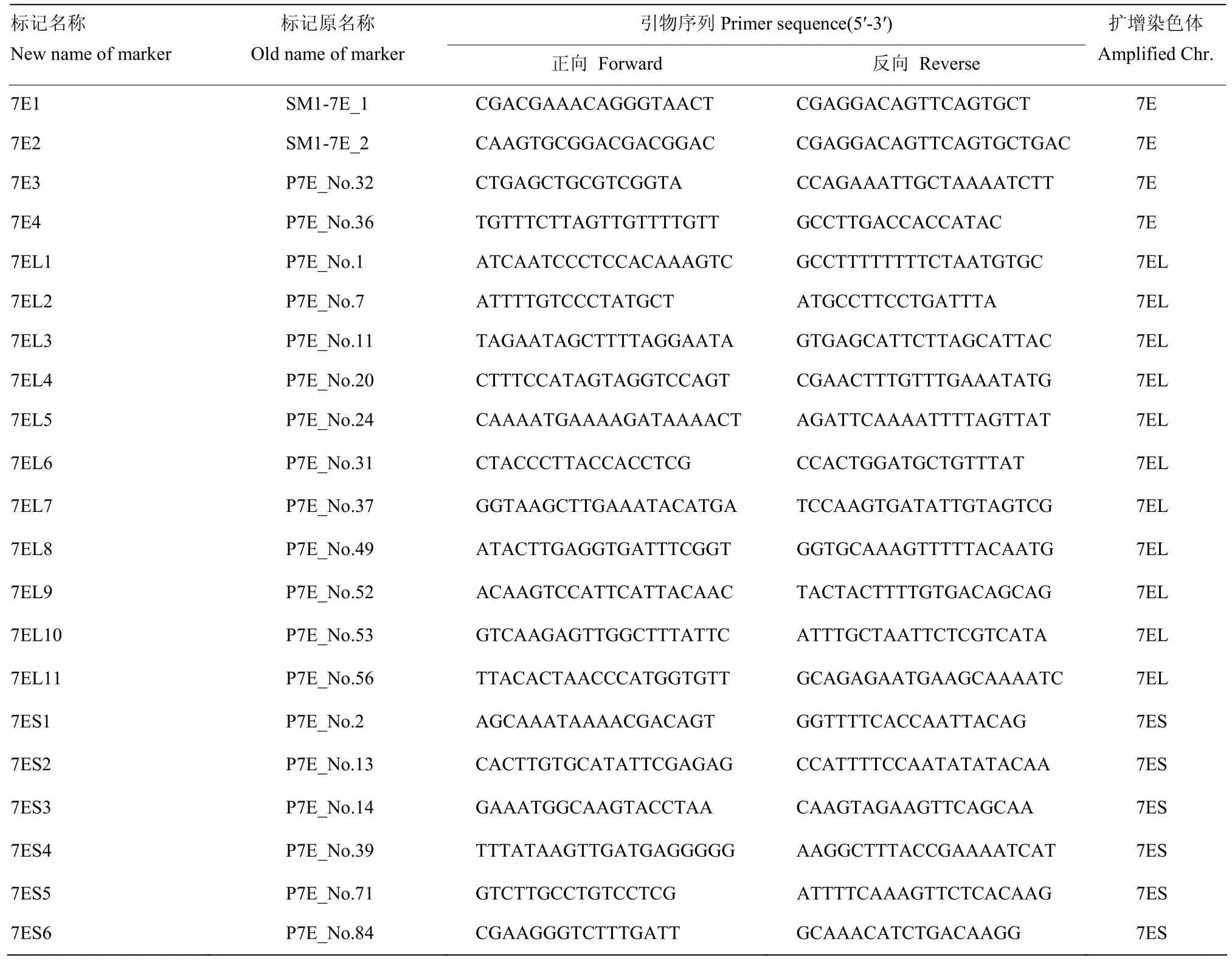
表1 小麦-长穗偃麦草7E染色体易位系鉴定所用分子标记Table 1 Molecular marker for identifying wheat- Th. elongatum 7E chromosome translocation lines
2.2基于特异分子标记选择目标单株
在M1选择了具有长穗偃麦草特征、株型比较好、赤霉病发病率不同的13个单株。利用7E染色体和7E染色体长臂及短臂标记对13个株行中M2单株进行PCR检测,部分结果如图2所示。第1株行出现2株 7E扩增,未见臂的扩增。第2株行出现5株7E扩增,出现3株7ES扩增。第3株行出现3株7E扩增,出现3株7EL扩增。根据PCR检测和表现型结果,分别选择其中可能含有长穗偃麦草7EL片段7株和长穗偃麦草7ES片段14株,次年株行种植M3。
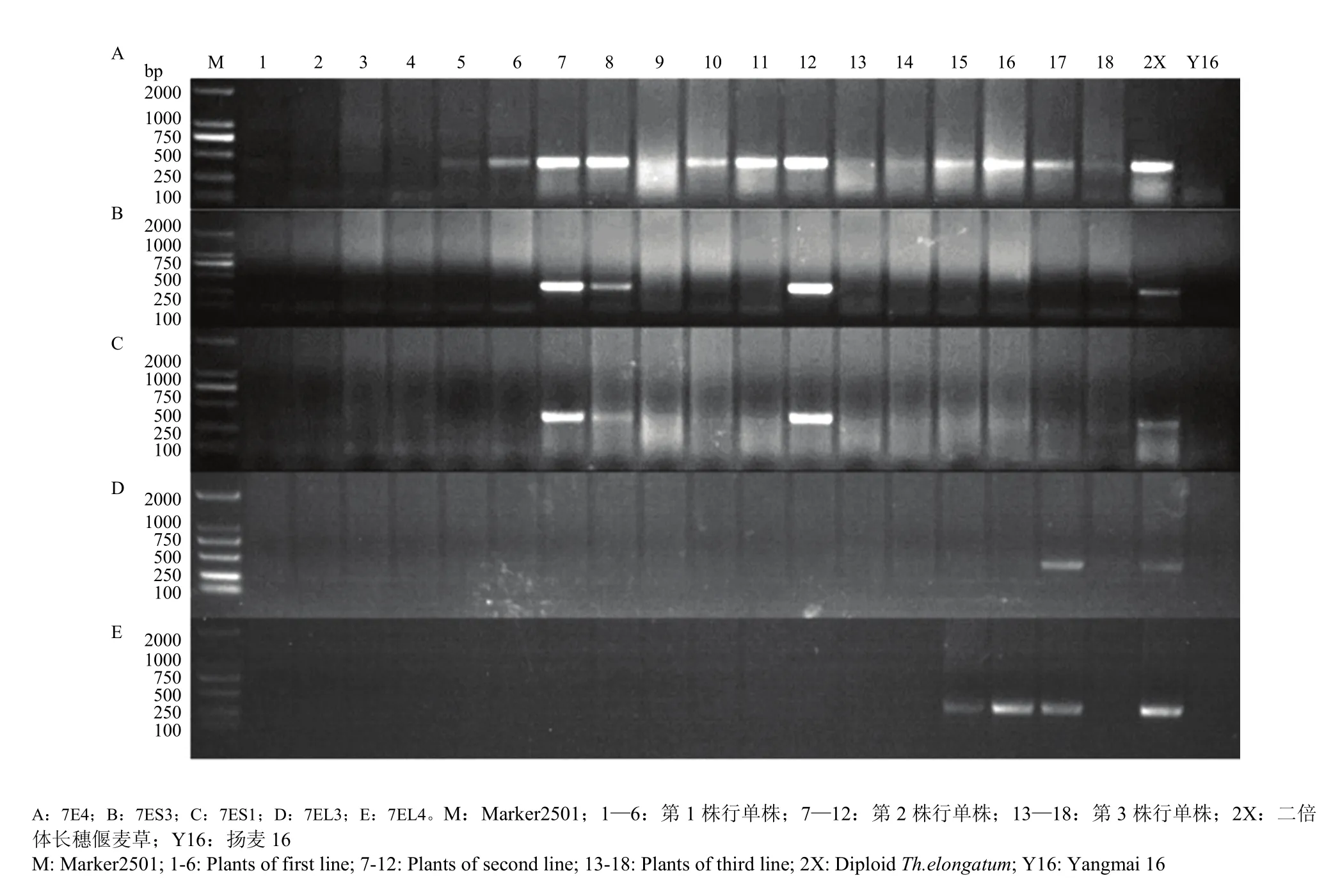
图2 M2单株分子标记检测结果Fig. 2 The PCR detection results of molecular markers for M2plants
利用7E染色体和7EL、7ES特异标记对21株M2衍生的222个M3植株的DNA进行检测,依据2个以上标记扩增和表现型的标准,共获得含有长穗偃麦草7EL片段13株,含有长穗偃麦草7ES片段3株(图3和图4)。不难看出,尽管上代选择具有7ES片段的单株比较多,但一代自交繁殖后,继续选择得到的短臂单株变少了。当7E染色体与小麦染色体发生易位后,向后代的传递比较稳定,而单独存在的染色体臂向后代的传递可能比较容易丢失。
2.3扩增分子标记单株的赤霉病抗性鉴定
对获得标记扩增的M2、M3单株利用单花滴注法进行赤霉病抗性鉴定,选择具有赤霉病抗性和分子标记扩增的单株进行繁殖,对M4单株同样进行赤霉病抗性鉴定。由表2可见,最后获得的材料可追溯到M1代2个单株,赤霉病发病率明显不同。这两个单株在衍生后代过程中,一般上代具有特异标记扩增并赤霉病抗性好的单株,下代的赤霉病抗性表现也好并具有特异标记扩增,赤霉病抗性和特异标记具有共分离特征。标记筛选区别了7EL和7ES染色体组成的单株,这些单株也表现了赤霉病抗性的差别,连续3年的接种鉴定表明,具7EL植株组成的株行赤霉病抗性每年均好于中国春、扬麦16和安农8455,与苏麦3号相当,而且也好于具7ES植株组成的株行,意味着7EL具有抗赤霉病的基因。

图3 M3单株7EL分子标记检测Fig. 3 The PCR results of 7EL-specific molecular markers for M3plants
2.4基因组原位杂交(GISH)检测和易位系的特征
对于M2、M3中连续2年均有分子标记扩增和赤霉病抗性较高单株衍生的后代(M4),可认为带有长穗偃麦草7E染色体。这些特异标记扩增的单株中,7E染色体有3种存在方式,完整的7E染色体、小麦染色体与7E的易位染色体以及7EL或7ES的附加染色体臂。利用经7EL特异分子标记检测过的12株M3代的后代进行GISH,共9株的后代具有小麦-长穗偃麦草易位染色体,体细胞染色体2n=42。这些植株来源于3个M2单株,分别命名为TW-7EL1、TW-7EL2和TW-7EL3(T:易位;W:小麦;7EL:长穗偃麦草7E染色体长臂;数字:易位系序号)。TW-7EL1和TW-7EL2易位系均为整臂易位(图5-A)。而TW-7EL3易位系中即存在整臂易位也存在小片段易位染色体,还在分离中。选择经7ES分子标记验证过的2株M3后代进行GISH,结果显示附加2条长穗偃麦草染色体短臂,是来自1个M2单株后代,命名为W-AD7ES1,体细胞染色体2n=44(图5-B),未见完整的7E染色体。

图4 M3单株7ES分子标记检测Fig. 4 The PCR results of 7ES-specific molecular markers for M3plants
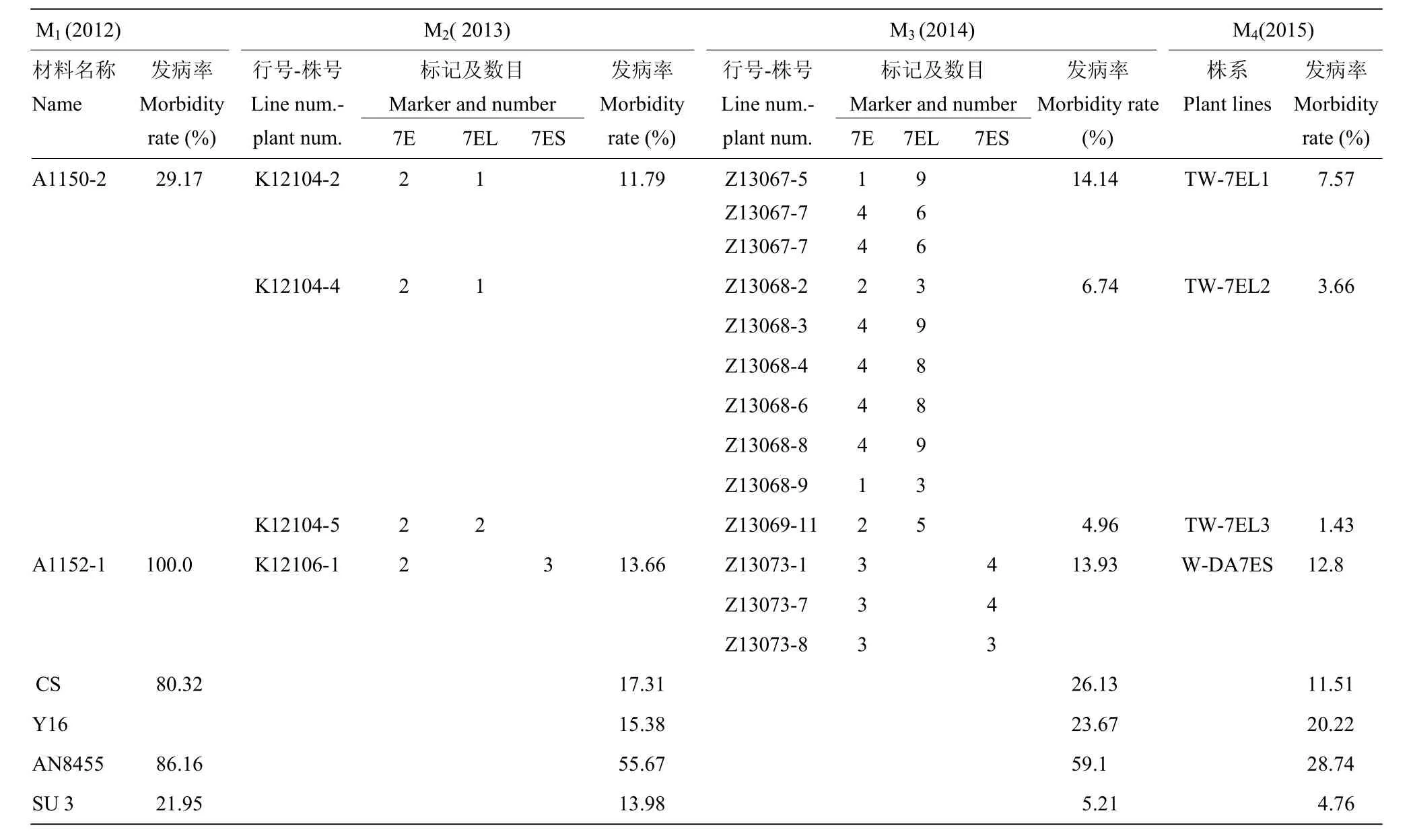
表2 小麦-长穗偃麦草易位系系谱及不同世代的标记检测和赤霉病抗性鉴定Table 2 The pedigree, marker detection and FBH resistance identification for translocation lines in different generations
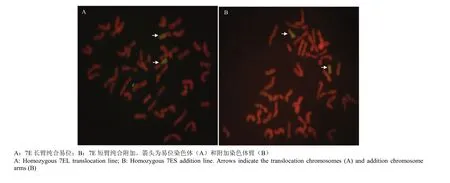
图5 小麦-长穗偃麦草7E染色体易位系的GISH结果Fig. 5 GISH result of wheat-Th.elongatum 7E chromosome translocation lines
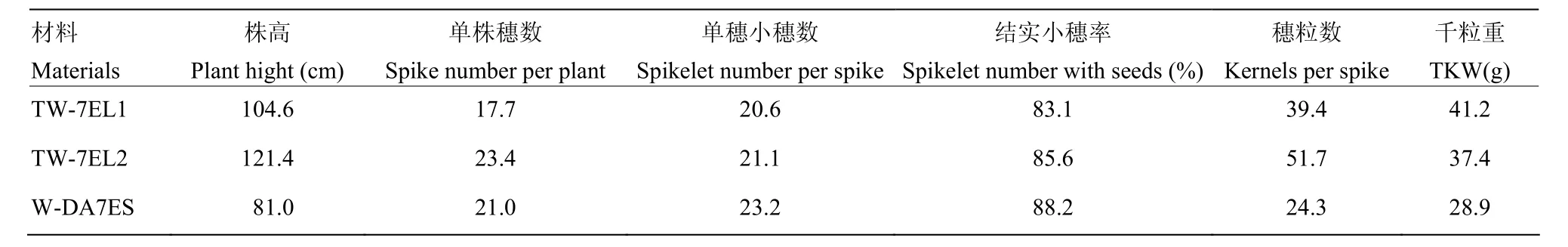
表3 7EL易位系和7ES附加系的主要农艺性状Table 3 The main agronomic traits of 7EL translocation lines and 7ES addition line
对GISH检测的小麦-长穗偃麦草纯合易位系和附加系进行农艺性状的考察(表3)。小麦-长穗偃麦草7EL易位系株高与中国春类似,而长穗偃麦草7ES附加系株高与Y16接近。易位系和附加系间的穗长、花药成熟情况也呈现明显的差别。由图6可以看出,7EL易位系的穗长较7ES附加系长,且小穗之间间距较大。穗型类似于中国春,7ES附加系的部分花药短小且干瘪,没有花粉,呈不育的状态,而7EL易位系的花药硕大饱满,与中国春类似。
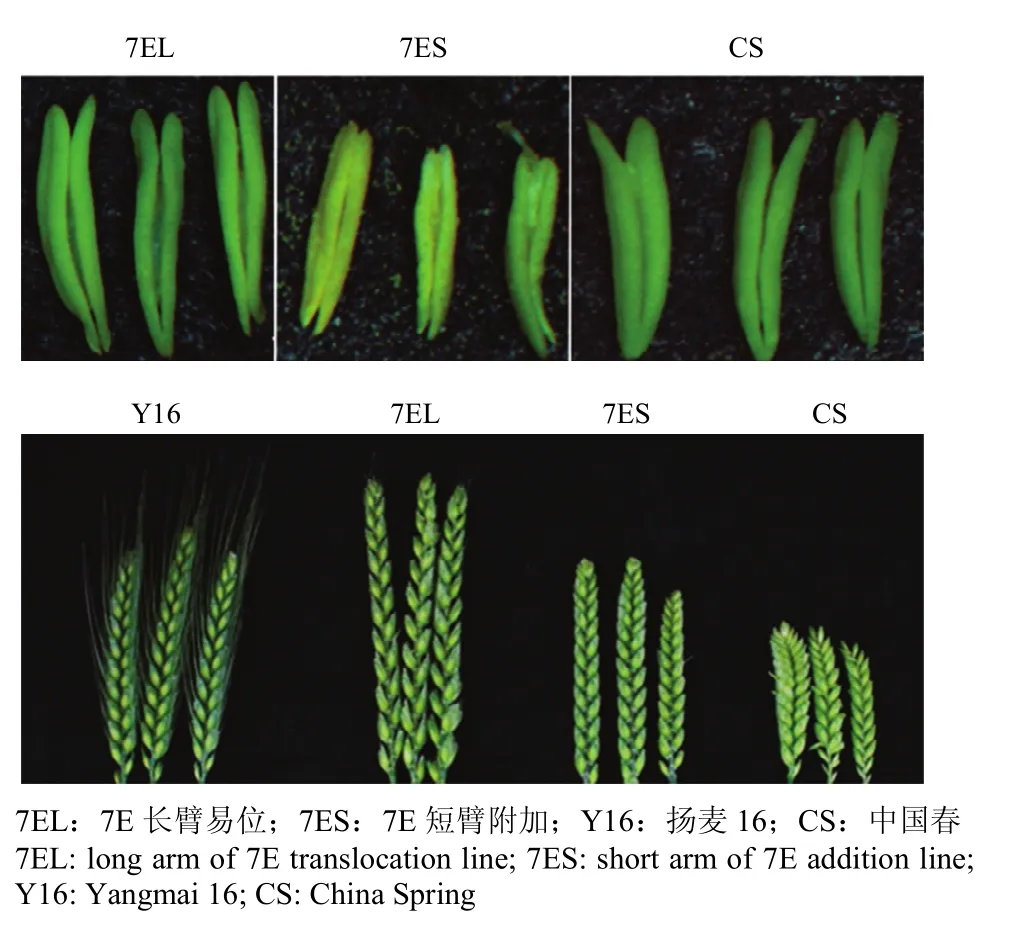
图6 小麦-长穗偃麦草7EL易位系及7ES附加系的花药和穗子Fig. 6 The spikes and anthers of 7EL translocation lines and 7ES addition line
3 讨论
3.1赤霉病抗性基因所在染色体臂
长穗偃麦草是小麦属的近缘野生种,是小麦远缘杂交育种的重要亲本材料,一直被认为是小麦遗传改良重要的外源基因库。目前研究表明其染色体上携带对赤霉病具有很好抗性的基因。刘登才等[7]利用染色体附加系为材料研究发现,其赤霉病抗性主要归功于1E染色体的作用,同时3E、4E和6E染色体可能有作用微弱的基因存在。通过研究还发现赤霉病的抗性基因位于长穗偃麦草的7E染色体上,并定位于7E长臂上[9-11],但有人通过单花滴注法接种7E的2个端体附加系,则将抗赤霉病的基因定位在7E短臂上[38-39]。
通过2年标记选择,本研究获得稳定的带有长穗偃麦草7E染色体的材料,分别来自不同的M2单株,GISH结果明显分为小麦-长穗偃麦草7EL易位系和7ES附加系。对这些材料连续3年的禾谷镰刀菌接种进行赤霉病抗性筛选,结果表明,长穗偃麦草7EL易位系的赤霉病抗性相对于长穗偃麦草7ES附加系要好,也比亲本的抗性好,这与以往的研究结果一致[9-11],支持抗赤霉病基因位于长穗偃麦草7E染色体长臂上。
3.2小片段易位系的获得
利用电离辐射是诱导染色体异源易位的一种有效方法[15]。辐射后染色体的断裂是随机的,既有本身染色体也有外源染色体,本研究的辐射后代中未见完整的7E染色体充分证实了这一点。通过辐射培育易位系的频率很高,BIE等[16]通过电离辐射普通小麦-簇毛麦双二倍体的花粉,然后将这些花粉授于中国春小麦,从61份M1材料中检测到普通小麦——簇毛麦间易位染色体98条,易位出现频率高达72.1%。根据本研究所获易位系的系谱分析,小麦-长穗偃麦草7EL易位系和7ES附加系就是来自2株M1,通过这2株M1后代的分子标记检测和抗性鉴定而最后获得。
通过GISH检验,发现获得的都是染色体的整臂易位系和附加系,并未出现小片段易位。利用种子进行辐射,电离辐射的主要效应是诱导染色体一次断裂,而且染色体断裂也最容易发生在着丝粒区域或着丝粒附近,因而产生的易位主要是整臂易位和较大的末端易位,中间插入易位的频率很低[15,22-23,40-41]。另一种原因是辐射的剂量不够大,导致染色体臂断裂的频率不高;第三点可能是辐射的放射源种类问题,利用快中子对小麦-黑麦双二倍体与普通小麦品种绵阳11杂交种子进行辐射,获得小麦-黑麦外源小片段易位、外源大片段易位和罗伯逊易位,随着辐射剂量的增加,小片段易位的频率也增加[24]。所以,想要获得小片段的易位系,可以对获得的整臂易位系通过辐射成熟中花粉进行授粉,使外源染色体二次断裂和重接,从其杂交后代中进行选择[17]。
本研究采用60Co辐射种子,将田间赤霉病抗性鉴定、分子标记筛选和基因组原位杂交验证3种方法相结合,培育小麦-长穗偃麦草抗赤易位系。该培育方法有较多优点,目标染色体明确,标记选择效率高,培育周期短,为小麦异源易位系的创建提供了有效途径。在易位系培育的标记检测过程中,先用7E染色体特异标记对所有单株进行检测,再对阳性单株进行长穗偃麦草7EL、7ES特异标记检测。理论上染色体特异引物检测出的植株,有3种情况:标记所在的片段是长臂、标记所在的片段是短臂,或者是长、短臂都有。在分子标记的检测中,理论上染色体标记检测的植株总数和7EL、7ES标记分别检测的总数应该相等,而实际上7EL、7ES标记分别检测的植株总数每代总是小于染色体标记检测的总数。有时染色体标记能检测的单株,7EL或7ES标记却无法检测到。究其原因,在开发分子标记的时候,用的是正常附加系、代换系和亲本的DNA,标记在染色体上的物理位置不清楚。而经过辐射诱变处理的小麦植株中,染色体因断裂-重接而发生缺失、倒位、易位等一系列结构畸变,在DNA水平上则表现为DNA片段的重排而产生碱基序列变异,而且这种变化会持续几秒甚至若干年,有的染色体损伤可以修复,而有的损伤可能进一步加重[42-44]。PCR能扩增的片段相对于整条染色体来说只是一段很微小的DNA,电离辐射的次级效应将使这个很小的区段在易位系和附加系培育过程中可能发生持续的变异而产生遗传多样性,加上标记扩增的区段不同,导致某些区段用染色体标记能检测,而利用染色体臂标记分别检测却未能检测[45]。本研究是利用分子标记检测和赤霉病抗性鉴定相结合的方法对后代进行选择,最后获得的是整臂易位系,一些小片段的易位在选择过程中因没有扩增分子标记而被淘汰。开发更多的染色体特异标记并确定它们在染色体上的位置,对辐射后代小片段易位系的选择具有重要作用。
3.3小麦-长穗偃麦草7EL易位系的应用
小麦异源易位系是小麦遗传改良中最有用的资源,尤其是小片段的易位系可以直接作为亲本与小麦杂交,丰富小麦基因库,在小麦育种中发挥重要的作用。本研究所获小麦-长穗偃麦草7EL易位系,属于Robertsonian易位,是小麦与其他近缘种培育的易位系中常见类型[12-13,27,46-50],是向小麦导入外源遗传物质的一种优良遗传中间材料和染色体研究材料,一直是小麦遗传育种研究者青睐的特殊种质。抗赤霉病基因(Fhb7)定位于7el2L上,并聚合了Fhb1与Fhb7 2个抗赤霉病基因[31]就是利用7DS·7el2L臂间易位材料。利用所获得的整臂易位系,继续辐射,可获得大量的结构变异体,如获得7E染色体不同长度片段的缺失变异体,就可以进行分子标记在7E染色体上物理定位,也可以获得小麦-长穗偃麦草7E小片段易位系和与其连锁的分子标记,在此基础上进一步筛选抗赤霉病的小片段易位系。也可作为亲本参与抗赤霉病小麦的培育,在杂交后代中,农艺性状的选择可按常规进行,而赤霉病抗性早代可借助分子标记辅助选择,保留农艺性状良好并具有长穗偃麦草7EL标记的单株进行繁殖,在高世代后再进行赤霉病抗性鉴定,可以节省早代赤霉病抗性鉴定,培育具有长穗偃麦草抗赤霉病基因的小麦高产品种。
4 结论
利用60Co(30 000 rad)辐射扬麦16与小麦-长穗偃麦草代换系DS7E(7B)杂交的F2种子,通过染色体特异分子标记筛选和基因组原位杂交验证,从衍生的M4代中获得长穗偃麦草7E长臂易位系和短臂附加系,连续3年的赤霉病抗性鉴定表明7EL易位系的赤霉病抗性明显高于7ES附加系,表明赤霉病抗性基因位于7EL。通过赤霉病抗性鉴定、染色体特异分子标记筛选和GISH证实相结合从辐射后代中培育小麦-近缘种染色体易位系,易位片段鉴定快速和准确,培育周期短。
References
[1] DUVEILLER E, MEZZALAMA M, MURAKAMI J, LEWIS J, BAN T. Global fusarium networking. Cereal Research Communications,2008, 36: 11-19.
[2] 姚金保, 陆维忠. 中国小麦抗赤霉病育种的研究进展. 江苏农业科学学报, 2000, 16(4): 242-248.
YAO J B, LU W Z. Research advances in wheat breeding for scab resistance in China. Jiangsu Journal of Agricultural Sciences, 2000,16(4): 242-248. (in Chinese)
[3] DVORAK J, EDGE M, ROSS K. On the evolution of the adaptation of Lophopyrum elongatum to growth in saline environments. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(11): 3805-3809.
[4] ZHONG G Y, DVORAK J. Chromosomal control of the tolerance of gradually and suddenly imposed salt stress in the Lophopyrum elongatum and wheat, Triticum aestivum L.genomes. Theoretical and Applied Genetics, 1995, 90(2): 229-236.
[5] ZHANG X Y, DONG Y S, WANG R R C. Characterization of genomes and chromosomes in partial amphiploids of the hybrid Triticum aestivum × Thinopyrum ponticum by in situ hybridization,isozyme analysis, and RAPD. Genome, 1996, 39(6): 1062-1071.
[6] 刘树兵, 贾继增, 王洪刚, 孔令让, 周荣华. 利用生化及分子标记确定长穗偃麦草(Elytrigia elongatum, EE.2n=14)染色体与小麦染色体的部分同源性. 遗传学报, 1999, 26(1): 37-42.
LIU S B, JIA J Z, WANG H G. KONG L R, ZHOU R H. Identification of homoeology between the Elytrigia elongatum (2n=14, EE) and wheat chromosomes using biochemical and molecular markers. Journal of Genetics and Genomics, 1999, 26(1): 37-42. (in Chinese)
[7] 刘登才, 郑有良, 王志容, 侯永翠, 兰秀锦, 魏育明. 影响小麦赤霉病抗性的Lophopyrum elongatum染色体定位. 四川农业大学学报, 2001, 19(3): 200-205.
LIU D C, ZHENG Y L, WANG Z R, HOU Y C, LAN X J, WEI Y M. Distribution of chromosomes in diploid Lophopyrum elongatum (Host)A. Love that influences resistance to head scab of common wheat. Journal of Sichuan Agricultural University, 2001, 19(3): 200-205. (in Chinese)
[8] JAUHAR P P, PETERSON T S, XU S S. Cytogenetic and molecular characterization of a durum alien disomic addition line with enhanced tolerance to fusarium head blight. Genome, 2009, 52(5): 467-483.
[9] SHEN X, OHM H. Fusarium head blight resistance derived from Lophopyrum elongatumchromosome 7E and its augmentation with Fhb1 in wheat. Plant Breeding, 2006, 125(5): 424-429.
[10] WANG J R, WANG L, GULDEN S, ROCHELEAU H, BALCERZAK M, HATTORI J, CAO W, HAN F, ZHENG Y L, FEDAK G,QUELLET T. RNA profiling of fusarium head blight-resistant wheat addition lines containing the Thinopyrum elongatum chromosome 7E. Canadian Journal of Plant Pathology, 2010, 32(2): 188-214.
[11] ZHANG X L, SHEN X R, HAO Y F, CAI J J, OHM H W, KONG L R. A genetic map of Lophopyrum ponticum chromosome 7E,harboring resistance genes to Fusarium head blight and leaf rust. Theoretical and Applied Genetics, 2011, 122(2): 263-270.
[12] RABINOVICH S V. Importance of wheat-rye translocations for breeding modern cultivars of Triticum aestivum L.. Euphytica, 1998,100: 323-340.
[13] REN T H, CHEN F, YAN B J, ZHANG H Q, REN Z L. Genetic diversity of wheat-rye 1BL.1RS translocation lines derived from different wheat and rye sources. Euphytica, 2012, 183(2): 133-146.
[14] DRISCOLL C J, ANDERSON L M. Cytogenetic studies of transec-a wheat-rye translocation line. Canadian Journal of Genetics and Cytology, 1967, 9(2): 375-380.
[15] SEARS E R. Use of radiation to transfer alien chromosome segments to wheat. Crop Science, 1993, 33: 897-901.
[16] BIE T D, CAO Y P, CHEN P D. Mass production of intergeneric chromosomal translocationsthrough pollen irradiation of Triticumdurum-Haynaldia villosa amphiploid. Journal of Integrative Plant Biology, 2007, 49(11): 1619-1626.
[17] 陈升位, 陈佩度, 王秀娥. 利用电离辐射处理整臂易位系成熟雌配子诱导外源染色体小片段易位. 中国科学C辑(生命科学), 2008,38(3): 215-220.
CHEN S W, CHEN P D, WANG X E. Radiating the mature female gamete of the whole arm translocation lines to establish small fragments translocation system. Chinese Science C Series(Life Science), 2008, 38(3): 215-220. (in Chinese)
[18] SEARS E R. An induced mutant with homoeologous pairing in common wheat. Canadian Journal of Genetics and Cytology, 1977,19(4): 585-593.
[19] DUBCOVSKY J, LUKASZEWSKI A J, ECHHAIDE M,ANTONELLI E F, PORTER D R. Molecular characterization of two Triticum speltoides interstitial translocations carrying leaf rust and greenbug resistance genes. Crop Science, 1998, 381: 1655-1660.
[20] LARKIN P J, SCOWCROFT W R. Somaclonal variation-a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics, 1981, 60(4): 197-214.
[21] ENDO T R, YAMAMOTO M, MUKAI Y. Structural changes of rye chromosome 1R induced by a gematocidal chromosome. Japanese Journal of Genetics, 1994, 69: 13-19.
[22] CHEN P D, LIU W X, YUAN J H, WANG X E, ZHOU B, WANG S L, ZHANG S Z, FENG Y G,YANG B J. Development and characterization of wheat-Leymus racemosus translocation lines with resistance to Fusarium head blight. Theoretical and Appllied Genetics,2005, 111(5): 941-948.
[23] 刘文轩, 陈佩度, 刘大钧. 利用花粉辐射诱发普通小麦与大赖草染色体易位的研究. 遗传学报, 2000, 27(1): 44-49.
LIU W X, CHEN P D, LIU D J. Studies of the developments of Triticum aestivum-Leymus racemosus translocation lines by pollen irradiation. Journal of Genetics and Genomics, 2000, 27(1): 44-49. (in Chinese)
[24] 杨漫宇, 符书兰, 陈晓明, 张怀琼, 唐宗祥, 任正隆. 小麦-黑麦小片段易位的快中子辐照诱导. 麦类作物学报, 2014, 34(5): 609-614.
YANG M Y, FU S L, CHEN X M, ZHANG H Q, TANG Z X, REN Z L. Creation of wheat-rye small-fragment translocation using fast neutron irradiation. Journal of Triticeae Crops, 2014, 34(5): 609-614.(in Chinese)
[25] 李文静, 葛群, 王仙, 唐雪琴, 徐杰, 唐宗祥, 任正隆, 傅体华. 普通小麦-中间偃麦草易位系08-738的鉴定. 麦类作物学报, 2014,34(4): 443-448.
LI W J, GE Q, WANG X, TANG X Q, XU J, TANG Z X, REN Z L, FU T H. Identification of a translocation line 08-738 between common wheat-Thinopyrum intermedium. Journal of Triticeae Crops, 2014,34(4): 443-448. (in Chinese)
[26] ZHAN H X, ZHANG X J, LI G R, PAN Z H, HU J, LI X, CHANG Z J, YANG Z J, QIAO L Y, JIA J Q, GUO H J. Molecular characterization of a New Wheat-Thinopyrum intermedium translocation line with resistance to powdery mildew and stripe rust. International Journal of Molecular Sciences, 2015, 16: 2162-2173.
[27] ARDALANI S, MIRZAGHADERI G, BADAKHSHAN H. A robertsonian translocation from Thinopyrum bessarabicum into bread wheat confers high iron and zinc contents. Plant Breeding, 2016,doi:10.1111/pbr.12359)Online at 18 Mar 2016
[28] 嵇常宇. 小麦易位系的创造研究进展. 现代农业科技, 2013(13): 23-25.
JI C Y. Research advances on creation of wheat translocation lines. Modern Agricultural Science and Technology, 2013(13): 23-25. (in Chinese)
[29] DVORAK J. Meiotic pairing between single chromosomes of diploid Agropyron elongatum and decaploid A. elongatum in Triticum aestivum. Canadian Journal of Genetics and Cytology, 1975, 17: 329-336.
[30] SHEN X, KONG L, OHM H. Fusarium head blight resistance in hexaploid wheat (Triticum aestivum)- Lophopyrum genetic lines and tagging of the alien chromatin by PCR markers. Theoretical and Applied Genetics, 2004, 108: 808-813.
[31] GUO J, ZHANG X, HOU Y, CAI J, SHEN X, ZHOU T, XU H, OHM H, WANG H, LI A, HAN F, WANG H, KONG L. High‑density mapping of the major FHB resistance gene Fhb7 derived from Thinopyrum ponticum and its pyramiding with Fhb1 by marker‑assisted selection. Theoretical and Applied Genetics, 2015,128: 2301-2316.
[32] 王景雪, 孙毅, 高武军. 一种简便实用的植物总DNA提取方法.山西大学学报(自然科学版), 2000, 23(3): 271-271.
WANG J X, SUN Y, GAO W J. A simple of practical method for plant total DNA. Journal of Shanxi University(Natural Science Edition),2000, 23(3): 271-271. (in Chinese)
[33] CHEN S Q, HUANG Z F, DAI Y, QIN S W, GAO Y Y, ZHANG L L,GAO Y, CHEN J M. The development of 7E chromosome-specific molecular markers for Thinopyrum elongatum based on SLAF-seq technology. PLoS One, 2013, 8(6): e65122.
[34] CHEN S Q, GAO Y, ZHU X, ZHANG C, CAO W G, FEDAK G, HE Z T, CHEN X L, CHEN J M. Development of E-chromosome specific molecular markers for Thinopyrum elongatum in a wheat background.Crop Science, 2015, 55: 2777-2785.
[35] 秦树文, 戴毅, 陈士强, 张璐璐, 刘慧萍, 曹文广, Fedak George,高勇, 陈建民. 基于TRAP的长穗偃麦草SCAR标记的开发及应用.麦类作物学报, 2014, 34(12): 1595-1602.
QIN S W, DAI Y, CHEN S Q, ZHANG L L, LIU H P, CAO W G,FEDAK G, GAO Y, CHEN J M. Development and application of SCAR markers specific to Thinopyrum elongtatum by TRAP technology. Journal of Triticeae Crops, 2014, 34(12): 1595-1602. (in Chinese)
[36] GILL B S, FRIEBE B, ENDO T R. Standard karyotype and nomenclature system for description of chromosome bands and structural aberration in wheat. Genome, 1991, 34(5): 830-834.
[37] ZHANG P, LI W, FRIEBE B, GILL B S. Simultaneous painting of three genomes in hexaploid wheat by BAC-FISH. Genome, 2004,47(5): 979-987.
[38] FU S, LV Z, QI B, GUO X, LI J, LIU B, HAN F P. Molecular cytogenetic characterization of wheat-Thinopyrum elongatum addition,substitution and translocation lines with a novel source of resistance to wheat Fusarium head blight. Journal of Genetics and Genomics, 2012,39: 103-110.
[39] 陈世强, 黄泽峰, 张勇, 葛江燕, 朱雪, 高勇, 陈建民. 中国春背景下长穗偃麦草抗赤霉病相关基因的染色体定位. 麦类作物学报,2012, 32(5): 839-845.
CHEN S Q, HUANG Z F, ZHANG Y, GE J Y, ZHU X, GAO Y,CHEN J M. Chromosomal location of genes associated with FHB resistance of Lophopyrum elongatum in Chinese Spring background. Journal of Triticeae Crops, 2012, 32(5): 839-845. (in Chinese)
[40] LI H J, GUO B H, ZHANG Y M, LI Y W, DU L Q, LI Y X, JIA X,ZHU Z Q. High efficient intergeneric chromosomal translocations between wheat (Triticum aestivum L.) and Dasypyrum villosum arising from tissue culture and irradiation. Acta Genetica Sinica, 2000,27(6): 511-519.
[41] 刘文轩, 陈佩度, 刘大钧. 利用减数分裂期成株电离辐射选育小麦─大赖草易位系的研究. 植物学报, 1999, 41(5): 463-467. LIU W X, CHEN P D, LIU D J. Development of Triticum aestivum-Leymus translocation lines by irradiation adult plants at meiosis. Bulletin of Botany, 1999, 41(5): 463-467. (in Chinese)
[42] SHIRLEY B W, HANLEY S, GOODMAN H M. Effects of ionizing radiation on a plant genome: Analysis of two Arabidopsis transparent testa mutations. The Plant Cell, 1992, 4(3): 333-347.
[43] 曲颖, 李文建, 周利斌, 王转子, 董喜存, 余丽霞, 刘青芳, 何金玉. 重离子辐射植物的诱变效应研究及应用. 原子核物理评论,2007, 24(4): 294-298.
QU Y, LI W J, ZHOU L B, WANG Z Z, DONG X C, YU L X, LIU Q F, HE J Y. Research and application of mutagenic effects in plants irradiated by heavy ion beams. Nuclear Physics Review, 2007, 24(4): 294-298. (in Chinese)
[44] 王林生. 利用电离辐射创造普通小麦外源染色体易位系. 生物学通报, 2009, 44(7): 1-3.
WANG L S. Creation of alien chromosome translocation lines of common wheat by irradiation. Bulletin of Biology, 2009, 44(7): 1-3.(in Chinese)
[45] QIU L, TANG Z X, LI M, FU S L. Development of new PCR-based markers specific for chromosome arms of rye (Secale cereale L.). Genome, 2016, 59: 159-165.
[46] KIM N S, ARMSTRONG K, KNOTT D R. Molecular detection of Lophopyrum chromatinin wheat-Lophopyvum recombinants and their use in the physical mapping of chromosome 7D. Theoretical and Applied Genetics, 1993, 85(5): 561-567.
[47] ZHANG Q, QI L, WANG X, WANG H, LANG S, WANG Y, WANG S, CHEN P, LIU D. Development and characterization of a Triticum aestivum-Haynaldia villosa translocation line T4VS·4DL conferring resistance to wheat spindle streak mosaic virus. Euphytica, 2005, 145: 317-320.
[48] ZHAO W, QI L, GAO X, ZHANG G, DONG J, CHEN Q, FRIEBE B,GILL B. Development and characterization of two new Triticum aestivum-Dasypyrum villosum Robertsonian translocation lines T1DS·1V#3L and T1DL·1V#3S and their effect on grain quality. Euphytica, 2010: 175: 343-350.
[49] QI L, PUMPHREY M, FRIEBE B, ZHANG P, QIAN C, BOWDEN R, ROUSE M, JIN Y, GILL B. A novel Robertsonian translocation event leads to transfer of a stem rust resistance gene (Sr52) effective against race Ug99 from Dasypyrum villosum into bread wheat. Theoretical and Applied Genetics, 2011, 123: 159-167.
[50] QI Z, DU P, QIAN B, ZHUANG L, CHEN H, CHEN T, SHEN J,GUO J, FENG Y, PEI Z. Characterization of a wheat-Thinopyrum bessarabicum (T2JS-2BS·2BL) translocation line. Theoretical and Applied Genetics, 2010, 121: 589-597.
(责任编辑李莉)
Development of Wheat -Thinopyrum elongatum Translocation Lines Resistant to Fusarium Head Blight
ZHANG Lu-lu1, CHEN Shi-qiang2, LI Hai-feng3, LIU Hui-ping1,4, DAI Yi1,4, GAO Yong1, CHEN Jian-min1
(1College of Bioscience and Biotechnology, Yangzhou University, Yangzhou 225009, Jiangsu;2Lixiahe Region Agricultural Scientific
Research Institute of Jiangsu, Yangzhou 225007, Jiangsu;3Yangzhou Polytechnic College, Yangzhou 225012, Jiangsu;4Jiangsu Provincial Key Lab for Agrobiology, Nanjing 210014)
【Objective】The objective of this study was to transfer the chromosome 7E of Thinopyrum elongatum into cultivated common wheat (Triticum aestivam L.) to develop translocation lines resistant to Fusarium Head Blight (FHB) and thereby to provide new germplasm for improving FHB resistance in common wheat.【Method】The F2seeds from the cross between Yangmai16 and DS7E(7B) were radiated using60Co (at 30 000 rad), DS7E(7B) being a substitution line in which the chromosome 7B of ChineseSpring common wheat was substituted with the chromosome 7E of Th. elongatum. The survived M1plants were harvested, after visual selection for agronomic traits. The M2to M4populations were selected for agronomic traits, FHB resistance under single drop injection with Fusarium graminearum, and molecular markers specific to the chromosome and chromosomal arm of 7E for Th. elongatum, followed by cytological confirmation for the presence of 7E chromosomes using Th. elongatum genomic DNA as probe by genomic in situ hybridization (GISH). 【Result】Thirteen M1plants with varying degrees of FHB resistance were selected, and the corresponding M2plants were examined for the presence of previously developed molecular markers specific to chromosome 7E . Seven plants were found to carry the long arm of 7E and 14 were found to carry the short arm of 7E. After selfing, 13 plants carrying markers specific to the long arm of 7E chromosome and 3 plants carrying markers specific to the short arm of 7E chromosome were identified out of 223 M3plants. GISH analysis was conducted for the progenies (M4) derived from 12 M3plants and it was found that the progenies from nine of the M3lines were wheat-Th. elongatum translocation lines (2n=42), and those from two other M3plants were chromosome addition lines with the short arm of 7E (2n=44). Continued selection led to the development of three translocation lines carrying the long arm of 7E, which were named as TW-7EL1, TW-7EL2 and TW-7EL3, respectively. A fourth line was a chromosome addition line with the short arm of 7E and was named as W-DA7ES. These four lines were derived from two different M1plants. Evaluation of FHB resistance indicated that the translation lines were similar to Sumai 3 in FHB resistance, better than Chinese Spring and Yangmai 16, while the addition line was considerably poorer in FHB resistance.【Conclusion】Translocation lines with chromosome 7EL that are resistant to FHB were developed effectively and accurately by joint use of phenotypic selection,screening for chromosome-specific molecular markers to 7E, and genomic in situ hybridization. The chromosome 7EL of Th.elongatum carries FHB-resistant genes.
wheat; Thinopyrum elongatum; Fusarium head blight; translocation lines
2016-04-11;接受日期:2016-06-01
国家自然科学基金(31071406)、国家自然科学-青年基金(31501303)、江苏省农业生物学重点实验室项目(49114042015K003)
联系方式:张璐璐,E-mail:1401757469@qq.com。陈士强,E-mail:sqchen1116@163.com。张璐璐和陈士强为同等贡献作者。通信作者陈建民,Tel:0514-87979286;E-mail:jmchen@yzu.edu.cn

