掺杂改性TiO2紫外光催化降解甲苯的动力学研究
张一兵,游 晴
(1.上饶师范学院化学化工学院,上饶 334001;2.江西省塑料制备成型重点实验室,上饶 334001)
掺杂改性TiO2紫外光催化降解甲苯的动力学研究
张一兵1,2,游晴1
(1.上饶师范学院化学化工学院,上饶334001;2.江西省塑料制备成型重点实验室,上饶334001)
探索了用水热反应制备的锐钛型掺杂改性的TiO2(即A-TiO2)对甲苯的光催化降解作用。通过分析甲苯的初始浓度、TiO2用量、掺铁量和溶液的pH值对光催化速率的影响,研究改性TiO2催化甲苯的动力学行为;结果表明:甲苯溶液初始浓度为1.2 g/L(pH=5)、催化剂用量为2.0 g/L,掺铁量为4%(摩尔分数)、室温下紫外光照(λ=365 nm)反应2 h,甲苯的降解率D%(47.93%)和表观反应速率常数k达到最大值0.2523 h-1。光催化反应符合L-H动力学方程,降解过程表现为拟一级反应。
改性TiO2;光催化;降解;甲苯;动力学
1 引 言
甲苯是重要的化工原料,一般在喷漆、橡胶、皮革、印刷、绝缘材料等行业中作为溶剂或稀释剂。如果接触一定浓度甲苯的时间较长的话,会慢性中毒,甚至导致脑病及肝肾损害,且对人类和生物体有致癌作用。开展对甲苯的光催化降解研究,意义重大[1]。TiO2因为具有无毒,反应条件温和,化学性质相对稳定,催化活性高,氧化能力强,价格低廉,能重复使用,无二次污染,可以将有机污染物降解为CO2、H2O等无毒氧化物等优点,被认为是目前最具有开发前景的绿色环保型光催化剂[2]。在光催化降解有机污染物、自洁净材料等方面应用广泛。TiO2存在三种晶型,其中锐钛矿型即A-TiO2的活性最高,但它本身具有禁带较宽的缺点,通过掺杂改性引入缺陷会显著提高TiO2的光催化活性且掺铁的效果最好[3-6]。本实验以硫酸钛为原料,用水热反应制备了铁掺杂的A-TiO2光催化剂,研究用它在室温下紫外光照(λ=365 nm)降解甲苯的优化条件。
2 实 验
2.1样品制备[7]
用水热法制备锐钛型掺铁改性TiO2光催化剂即掺铁的A-TiO2。
2.2光催化降解甲苯实验
用95%乙醇溶解甲苯配制一定浓度的待测液,以95%乙醇作参比,在其最大吸收波长262 nm处测定甲苯溶液的初始吸光度A0。移取25 mL该浓度甲苯溶液于100 mL的干燥洁净的烧杯中,加一定量自制的掺铁改性A-TiO2粉末,封口置于暗箱中,在17℃左右的室温下磁力搅拌,用波长为365 nm的紫外线光照,于合适时间后取少量反应液(离心以除去A-TiO2粉末)测定其吸光度At。甲苯降解率D%计算如下:降解率D%=[(A0- At)/ A0]× 100。
3 结果与讨论
3.1确定甲苯溶液最大吸收波长
通过测定所需浓度的甲苯溶液在不同波长下的吸光度A0即可确定其最大吸收波长。图1的实验数据表明,甲苯溶液的最大吸收波长λ=262 nm,相应吸光度A0=2.642。
3.2影响光催化降解甲苯的条件优化
3.2.1甲苯初始浓度C0的影响
分别取初始浓度C0等于0.5 g/L、0.8 g/L、1.2 g/L、1.5 g/L和1.8 g/L的甲苯溶液,加铁掺杂量为4%(摩尔分数,下同)自制催化剂样品粉末使其用量等于2.0 g/L,搅拌形成均匀pH=5的自然溶液,置于暗箱中用波长365 nm的紫外线照射2 h对甲苯进行催化降解。对实验数据作lnC0/Ct~t图后线性拟合结果得图2和表1。图2的lnC0/Ct~t较好线性关系说明本实验的光催化降解反应符合一级动力学规律。表1的k:表观反应速率常数,t1/2:半衰期,其计算公式:t1/2=0.693/k。

表1 不同C0下甲苯的光催化反应速率常数
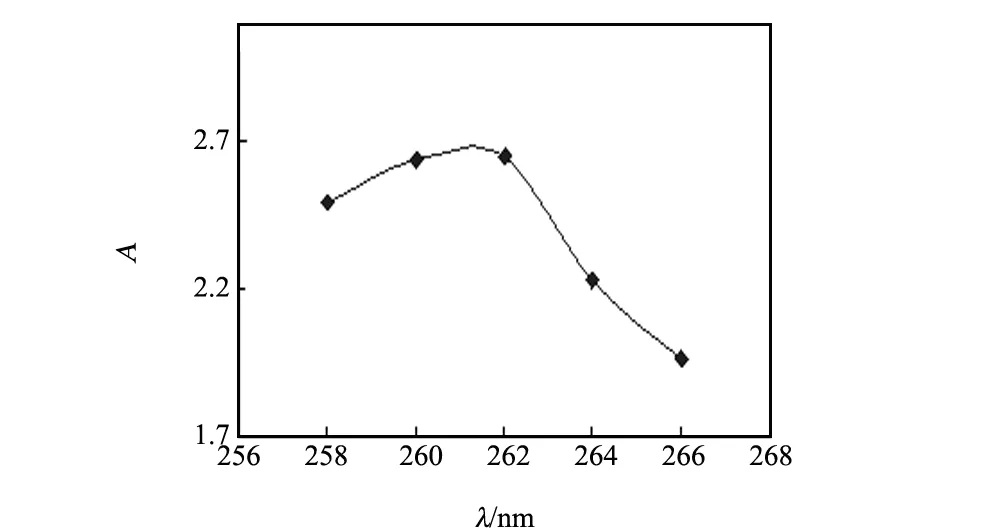
图1 确定甲苯溶液最大波长Fig.1 Determination of the maximum absorptionwavelength of toluene

图2 不同C0下甲苯的光催化降解Fig.2 Degradative of toluene in different C0
图3展示了甲苯的初始光降解速率r0(r0= k×C0)与C0关系曲线,分析发现:r0随着C0的增加先后经历先增大到最大再缓慢下降的过程,吻合于图2的实验结果。综合分析图2、3和表1可知,当C0小于1.2 g/L时,甲苯C0增大其D和k随之变大;C0等于1.2 g/L时它们的值均达最大(各等于47.93%和0.2523 h-1);C0等于1.2 g/L后,甲苯的C0的D、k则随C0增大而减小。这是因为伴随C0的增大,甲苯在TiO2颗粒表面上的吸附量增大,增加了催化降解几率;甲苯初始浓度C0增至一定值后(如本实验的1.2 g/L),降解物甲苯在催化剂表面的吸附量达到最大即饱和了,超出的部分会因吸附在二氧化钛晶体表面而减少催化活性位,反而降低催化效率[8]。
目前公认非均相的光催化降解过程可用L-H(Langmuir-Hinshelwood)动力学方程表示[9]:
r=-dC/dt=k1k2C/(1+k2C)
(1)
图2、图3和表1(浓度影响)结果表明,本实验用自制改性A-TiO2粉末光催化降解甲苯的反应,符合拟一级动力学反应规律,其L-H方程是:
r=-dC/dt=k1k2C/(1+k2C)=kC
(2)
r和C分别为甲苯的总反应速率和浓度,k1:反应速率常数,k2:表观吸附常数,k是表观反应速率常数。由于甲苯的C0很小即k2C<<1,即(1)简化为:
r=-dC/dt≈k1k2C=kC
(3)
(3)式表明在单位时间内,甲苯的降解速率r正比与浓度C为拟一级反应。积分(3)式得:
ln(C0/Ct)=k1k2=kt
(4)
因为ln(C0/Ct)和t呈直线关系,与上述浓度影响的实验结果相一致,k≈k1k2。
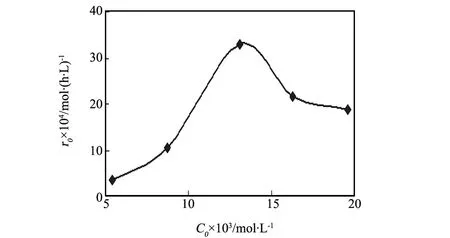
图3 光催化降解速率r0与C0的关系 Fig.3 Effect of the initial phtocatalytic degrdation rate r0of toluene in its initial concentration C0
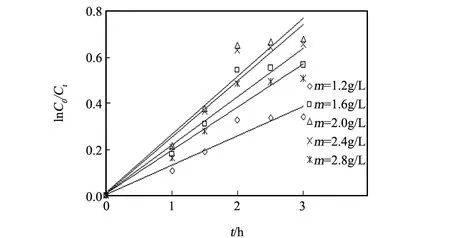
图4 不同TiO2用量下甲苯的光催化降解Fig.4 Degradative of toluene in different dosage of TiO2
3.2.2光催化剂用量的影响
平等移取1.2 g/L甲苯溶液五份,分加铁掺量为4%催化剂样品粉末使其用量依次均为1.2 g/L 、1.6 g/L 、2.0 g/L 、2.4 g/L和2.8 g/L,搅拌形成均匀pH=5的自然溶液,置于暗箱中用波长365 nm的紫外线照射2 h对甲苯进行催化降解,结果得图4和表2。分析表2和图4,反应开始时甲苯的D和k随着催化剂用量的增加而上升,当D和k分别上升到最大值时(47.93%和0.2523 h-1)TiO2用量为2 .0 g/L;如果再增大催化剂样品的用量,降解物甲苯的降解率D和表观反应速率常数k呈现减小现象。因为在同样的光照强度下,催化剂用量增加会提高其晶体表面的光生电子及空穴,导致甲苯的降解增大;当二氧化钛的用量过多时,过量的催化剂颗粒很容易造成对紫外光的散射现象,结果反而降低其光催化性能[10]。

表2 不同TiO2用量下甲苯的光催化反应速率常数
3.2.3掺Fe3+量的影响
分取五份1.2 g/L甲苯溶液,各加自制的掺铁量分别为 0%、1.2%、4%、6%和8%催化剂样品粉(用量均为2.0 g/L),搅拌形成均匀pH=5的自然溶液后置于暗箱中,用波长365 nm的紫外线照射2 h对甲苯进行催化降解,结果得图5和表3。可以由表3和图5可知,掺铁为0%的自制A-TiO2经紫外光照射下的对甲苯的催化降解率低,适当掺铁可提高A-TiO2光催化降解率。反应开始时甲苯的D和k随着掺铁量的增加而上升,到铁掺入量达到4%时,甲苯的D和k分别为47.93%和0.2523 h-1均是最大值;再加大催化剂样品中的掺杂量,降解效率反而变差。金属离子掺杂量存在一个最佳值[11]。掺入的Fe3+俘获空穴或电子越过势垒的复合速率K,取决于分离空穴一电子对的距离(R)。当掺Fe3+量太低时,A-TiO2晶体中俘获载流子的陷阱就相应过少,故A-TiO2光催化效率随掺Fe3+量的增加而提高;当掺Fe3+量高于最佳值时,增加掺Fe3+量会使得陷阱间的平均距离R减小,空穴和电子复合速率K呈指数级快速增长。另外,过高的掺Fe3+量,掺入TiO2晶格中的Fe3+达饱和外,多余的Fe3+会以氧化铁的形式沉积在催化剂固体表面上,形成空穴与电子的复合中心,降低了光催化性能[11,12]。

表3 不同掺铁量下甲苯的光催化反应速率常数
3.2.4pH值的影响
分取五份1.2 g/L的甲苯溶液,调节溶液的pH值为分别为1、3、5、7和11,各加自制的掺铁量分别为4%改性A-TiO2粉末使其用量2.0 g/L,室温磁力搅拌下紫外光照(λ=365 nm)2 h进行催化降解,结果得图6和表4。

表4 不同pH值下甲苯的光催化反应速率常数
表4、图6显示,伴随自然溶液的pH值加大,底物甲苯的降解率D和表观反应速率常数k相继增大,达到最大时的数值分别为47.93%和0.2523 h-1(此时溶液的pH值为5);若继续溶液的pH值,甲苯的D和k反而减小。文献[13]认为,降解物溶液的酸碱度的变化会导致自制的改性催化剂样品颗粒表面的所带电荷产生差异,使得催化剂颗粒在溶液中的分散度不同。在酸性溶液中,催化剂晶体颗粒表面带正电,利于光生迁向TiO2表面,使e-、空穴复合几率下降,有利于甲苯的D和k的升高。需要注意的,溶液的酸碱度影响复杂,原因是pH值变化将造成二氧化钛晶体表面所带何种电荷,电荷种类决定关有机污染物的存在形式及其在催化剂表面的吸附行为[14]。

图5 不同掺铁量下甲苯的光催化降解Fig.5 Degradative of toluene in different amount of iron-doping
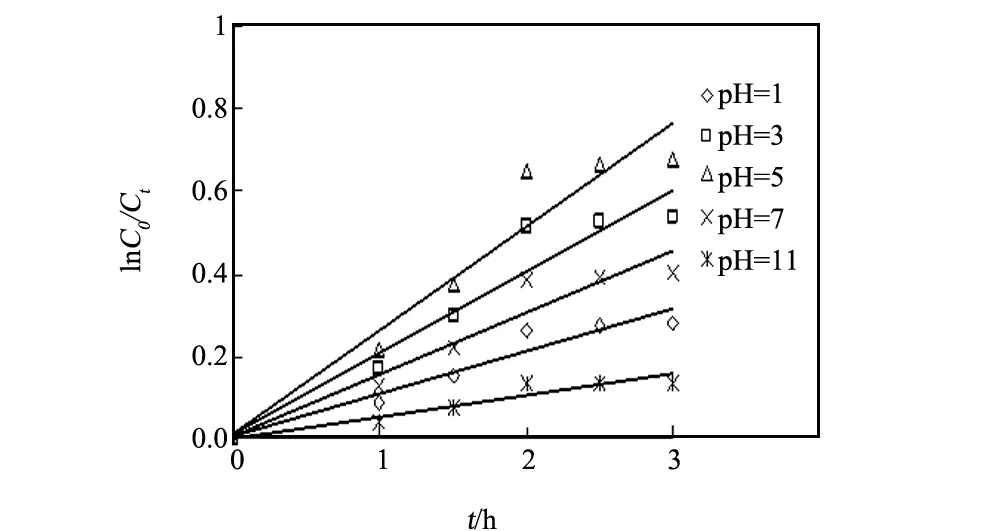
图6 不同pH值下甲苯的光催化降解Fig.6 Degradative of toluene in different pH value
4 结 论
发现运用水热反应制备的掺铁改性A-TiO2光催化降解甲苯的反应遵循Langmuir-Hinshelwood动力学方程,降解过程表现为拟一级反应;优化了光催化降解反应条件:甲苯初始浓度1.2 g/L(pH=5)、催化剂用量2.0 g/L,TiO2掺铁量4%,暗箱中恒温搅拌下经紫外光(λ=365 nm)照射反应2 h,甲苯的降解率D%和表观反应速率常数k达到最大,分别为47.93%和0.2523 h-1。
[1]方奕文,余林,叶飞,等.Ag改性TiO2催化剂的制备、表征及其甲苯气相光催化降解性能[J].分子催化,2011,25(6):569-573.
[2]张传广,赵志换,李彦威.TiO2纳米膜的应用及研究进展[J].化工新型材料,2010,38(9):5-8.
[3]胡金林,杨其浩,陈静,等.介孔二氧化钛功能纳米材料的合成与应用[J].化学进展,2013,25(12):2080-2090.
[4]马晓春,徐广飞.光催化材料研究进展[J].新技术新工艺,2012,34(9):58-61.
[5]颜酉斌,徐建平,唐海.海泡石/TiO2的制备及对甲苯废水的催化降解研究[J].广州化工,2013,41(11):83-85.
[6]杨贞妮,刘强,朱忠其,等.钒掺杂TiO2粉末的制备及性能[J].粉末冶金材料科学与工程,2009,14(1):63-66.
[7]张一兵,周天祥,江雷.掺Fe3+的A-TiO2的水热法制备及光催化性能研究[J].材料导报,2010,24(12):56-58.
[8]程玉红,周婷,何璇,等.纳米锐钛矿TiO2及负载金催化剂的制备与催化性能[J].材料导报,2012,26(7):25-28.
[9]Chen C L,Li X L,Zhao D B,et al.Adsorption kinetic,themodynamic and desorption studies of Th(Ⅳ) on oxidezed multi-wall carbon nanotubes[J].Colloid and Surfaces A:Physicochem Eng Aspects,2007,302(1-3):449-454.
[10]花朵,施春红,袁蓉芳,等.金属掺杂对纳米管TiO2光催化性能的影响[J].功能材料,2013,21(44):3163-3167.
[11]金华峰,李文戈,向纪明.Fe3+/TiO2/SiO2复合纳米微粒的合成及光催化降解NO2[J].应用化学,2001,18(8):637-639.
[12]孙淑珍,王景峰,王悦虹,等.金属离子掺杂TiO2光催化材料的光催化性能研究[J].吉林化工学院学报,2009,26(2):16-18.
[13]孙振宇,牛笛,刘祎飞,等.水热合成法制备纳米TiO2催化剂及其催化性能研究[J].广州化工,2013,41(3):62-65.
[14]钟瞡.陶瓷微滤膜过滤微米、亚微米级颗粒体系的基础研究和应用开发[J].南京化工大学学报,1998,8(5):68-72.
Photocatalysis Degradation Kinetics of Prepared Modified TiO2to Toluene under UV-light
ZHANG Yi-bing1,2,YOU Qing1
(1.School of Chemistry and Chemical Engineering,Shangrao Normal University,Shangrao 334001,China;2.Jiangxi Province Key Laboratory of Polymer Preparation and Processing,Shangrao 334001,China)
The kinetics of as-prepared anatase iron-doping TiO2(i.e. A-TiO2) via hydrothermal reaction catalyzing toluene is researched by analysis of the influence of the toluene’s initial concentration,the TiO2dosage,the amount of iron-doping in TiO2and pH value on photochemical catalysis speed. The results show that the decolorization rate D%(47.93%)and degradation observed rate constant k(0.2523 h-1)of toluene achieve maximum under follow conditions:a toluene's initial concentration 1.2 g/L (pH=5),a catalyst dosage 2.0 g/L,an amount of iron-doping 4% (mole fraction),and an irradiating with ultraviolet light(λ=365 nm)time 2 h at room temperature. The photo-catalytic process of toluene conforms to the rule of L-H kinetics and follows the first-order reaction.
modified TiO2;photo-catalysis;degradation;toluene;kinetics
教育部第四批高等学校特色专业建设点资助项目(TS11524);江西省省级精品课程资助项目(赣教高字〔2011〕74号)
张一兵(1963-),男,硕士,教授.主要从事无机化学与无机材料方面的研究.
X703
A
1001-1625(2016)02-0577-05

