急性温度胁迫对妊娠期许氏平鲉生殖内分泌机能的影响*
张亚晨, 温海深, 李兰敏, 冯启超
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
急性温度胁迫对妊娠期许氏平鲉生殖内分泌机能的影响*
张亚晨, 温海深❋❋, 李兰敏, 冯启超
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
为探究温度对妊娠期许氏平鲉(Sebastesschlegelii)生殖内分泌机能的影响,采用内分泌学和分子生物学方法,对急性温度胁迫后许氏平鲉的血清性类固醇激素的变化及脑和卵巢生殖相关基因表达的变化进行了系统的探究和分析。研究表明:妊娠期许氏平鲉的性腺型芳香化酶(P450aromA)具有温度敏感性。血清中17β-雌二醇(E2)和卵巢雌激素受体α(ERα)表达水平在急性高温胁迫后发生了显著下降,在急性低温胁迫后明显升高。在温度胁迫下,卵巢中雌激素受体β1(ERβ1)和雌激素受体β2(ERβ2)呈现出显著不同的表达方式;急性高温胁迫后,与性腺型芳香化酶基因(CYP19a1a)相比,脑型芳香化酶基因(CYP19a1b)的转录水平上升显著,表明二者在不同组织中承担着不同的生理功能;在妊娠期许氏平鲉脑中,CYP19a1b、E2、ERα间形成了自动反馈调节,促进CYP19a1b的转录;此外,Foxl2能够促进脑中芳香化酶的表达。研究结果表明,妊娠期许氏平鲉对高温胁迫更敏感,所需恢复期更长。在实际生产中,对于进入生殖期的雌鱼,应密切关注养殖水温的变化,减少温度应激。维持水温的相对恒定,以保证亲鱼胚胎发育和产仔进程的顺利进行。
许氏平鲉;温度;生殖内分泌机能;芳香化酶;雌激素受体
引用格式: 张亚晨,温海深,李兰敏,等. 急性温度胁迫对妊娠期许氏平鲉生殖内分泌机能的影响[J].中国海洋大学学报(自然科学版),2016,46(9): 29-37.
ZHANG Ya-Chen, WEN Hai-Shen, LI Lan-Min, et al. Effects of acute temperature stress on the reproductive endocrine function of gestational ovoviviparous black rockfish (Sebastesschlegelii) [J].Periodical of Ocean University of China, 2016,46(9): 29-37.
硬骨鱼类作为一种低等的脊椎动物,其生长、发育与生殖进程很容易受到外界环境的影响。其中,温度对于鱼类的生殖过程起着至关重要的作用,包括配子发育、成熟、排卵或排精、产卵、胚胎发育与孵化等[1-3]。许多研究表明,水温会改变下丘脑-垂体-性腺(HPG)轴中各因素水平从而对鱼类的生殖进程产生影响。在室温范围内,温度升高导致金钱鱼(Scatophagusargus)性腺成熟指数(GSI)和血清E2水平的显著升高[2];高温抑制性腺内基因表达,阻碍性类固醇激素合成酶的合成,使性腺功能受到干扰[3];高温还导致大西洋鲑(Salmosalar)在配子形成期性类固醇合成和肝糖原生成受阻,使肝脏中ERs表达水平发生变化,进而影响亲鱼的能量分配和配子的产生与成熟[4];此外,低温对鱼类生殖进程的影响亦有报道,对文昌鱼(Branchiostomalanceolatum)的研究发现,低温条件下,文昌鱼性腺趋于向雌性分化,这可能与温度变化导致的芳香化酶合成和活性改变有关[5]。
鱼类的生殖过程主要受到HPG轴的调控,下丘脑、垂体和性腺形成一个闭合的自动反馈体系,共同维持鱼类生殖内分泌系统的相对稳定,在性腺分化、发育、成熟及排卵过程中都发挥着十分重要的作用[6]。芳香化酶是细胞色素P450酶系的一种,主要分布在脑和性腺中,是一种催化C19雄激素(睾酮(T)和雄烯二酮不可逆地转化为C18雌激素(E2和雌酮)过程中的关键限速酶[7],并通过其产物调控鱼类的生理和生殖过程。Foxl2能够激活芳香化酶基因的转录[8],参与性类固醇的生物合成途径。ERs是类固醇激素核受体家族的一员,能够间接调控雌激素生理功能的发挥[9]。此外,孕激素在鱼类生殖过程中也发挥着极重要的作用,例如17α,20β-双羟孕酮(DHP)在鲉科鱼的妊娠期中发挥了积极作用[10]。近年来针对孕酮(P4)的研究发现,它能够调控雌鱼卵巢的最终成熟和产卵[11]。
许氏平鲉(Sebastesschlegelii)又名黑鲪、黑石鲈、黑头等,属于鲉形目(Scorpaeniformes)鲉科(Scorpaenidae)平鲉属(Sebastes),主要分布在太平洋西部水域。该鱼具有营养丰富、生长快速、抗病力强等优点,目前已逐步成为人工鱼礁区增殖、网箱和工厂化养殖的鱼类之一,具有重要经济价值。此外,由于许氏平鲉卵胎生生殖方式的特殊性,也使其成为鱼类进化研究的模式动物之一。在自然条件下,许氏平鲉妊娠期处于4~5月,水温为10.0~16.8 ℃,产仔盛期适宜水温为13~16 ℃。对于卵胎生和胎生鱼类,水体温度与妊娠期亲鱼的生理状况和胚胎发育情况均密切相关。因此亲鱼在此时期对温度变化较敏感,水温如发生急剧变化,会导致亲鱼的健康状况、胚胎的发育情况发生改变,进而影响产出仔鱼的优劣程度和种群补充。但目前关于温度对妊娠期许氏平鲉的生理和生殖情况影响的研究鲜有报道。
为进一步探索温度对妊娠期许氏平鲉生殖内分泌机能的影响,本文研究了妊娠期许氏平鲉的血清性类固醇水平、脑和卵巢中生殖相关基因表达水平在急性温度胁迫后的变化情况,为评估亲鱼在温度突变水体中适应性和恢复性提供理论依据,为优化许氏平鲉全人工繁殖提供技术参考。
1 材料与方法
1.1 实验鱼类
实验鱼于2013年5月采自山东省蓬莱市沿海网箱养殖群体。挑选72尾健康无病的妊娠期许氏平鲉(体重(879.03±22.61)g),实验前于20个玻璃水槽(长×宽×高:80 cm×60 cm×40cm)中驯化3d,每缸4尾。驯化期间控制水温在16℃左右,模拟自然光周期14L∶10D,连续充气保持溶氧浓度在7mg/L左右,pH 7.5~7.8。每日上午10:00换水,换水量为1/2水槽水量。
1.2 实验设计
实验设置7、16(室温对照)和25℃,共3个温度水平。急性温度胁迫实验在2个体积为0.785m3的圆柱形塑料桶(直径1m,深度0.8m)中进行。分别使用控温加热棒和海水冰块将桶中海水温度调至25和7℃。从驯化水槽中分别随机选取24尾规格相近、活力较好的许氏平鲉放入7和25℃海水中,另保留剩余24尾于16℃水中作为常温对照组。在高温和低温胁迫2h后,将其转移至16℃海水中恢复。由于许氏平鲉亲鱼在产仔期停止摄食,因此实验过程中不进行投饲。实验期间连续充气,每隔4h校准一次温度;采用HQd便携式多参数数字化分析仪(Hach,美国)监控海水温度和溶解氧含量。
1.3 样品采集与处理
在恢复期第0、6、12、24、48及72h对3组实验鱼进行采样,每组每次随机取鱼4尾。将鱼投入含浓度为200mg/L的MS222的海水中麻醉,尾静脉取血,血样制备血清后移入-20℃保存待测;取血后采集卵巢组织和全部脑组织,于-80℃超低温冰箱内保存备用。
1.4 血清中17β-雌二醇(E2)和P4水平的测定
使用碘[125]I雌二醇放射免疫分析试剂盒(九鼎医学生物工程有限公司,天津)和碘[125]I孕酮放射免疫分析试剂盒,采用RIA液相平衡竞争放射性免疫分析法进行实验鱼血清中E2和P4水平的测定。具体测定方案参考Shi等[12]的方法。
1.5 卵巢和脑中CYP19a1a、Foxl2、ERα、ERβ1和ERβ2表达水平的分析方法
卵巢和脑组织中的总RNA按照trizol法提取。使用PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TAKARA,日本)进行总RNA的纯化和cDNA的反转录。实验所需的CYP19a1b的特异性引物由Primer Premier5.0软件设计(见表1)。由前人研究结果得到CYP19a1a[13]、ERα[12]、ERβ1[14]、ERβ2[14]、Foxl2[13]和内参基因βactin[15]的特异性引物。

表1 基因表达分析的特异性引物
采用SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒(TAKARA,日本)检测CYP19a1a、CYP19a1b、Foxl2、ERα、ERβ1和ERβ2的表达水平;检测过程在StepOnePlusTMReal-Time PCR系统(Applied Biosystems,美国)上进行。
每个样品设置3个重复,特异性引物的退火温度和循环数经优化后如下:95℃变性30s;95℃变性5s,60℃ 退火30s,此步骤循环40次。在PCR运行结束后制作引物溶解曲线,分析其扩增效率以确保引物特异性和产物的单一性。根据实验结果,以βactin为内参基因,根据2-△△CT方法计算得到各基因的相对表达量。
1.6 数据处理
使用SPSS 19.0软件对实验数据进行单因素方差分析(One-Way ANOVA),探究温度和时间对血清性类固醇水平和卵巢中生殖相关基因表达水平的影响。若满足方差齐性,作Student-Neuman-Keuls多重比较,分析不同温度组间或不同恢复时间之间各指标数据的差异显著性;若不满足方差齐性,则采用Games-Howell法进行分析。以p<0.05表示差异显著,结果以均值±标准误(Mean±SE)表示。
2 结果
2.1 血清E2和P4水平
如图1所示,急性温度胁迫后,血清E2水平在恢复期发生显著变化。6h时25℃胁迫组显著低于其他2组(p<0.05),并在12h时降至最低值((4.66±0.88)pg/mL),随后逐渐上升,72h时恢复至对照组水平;7℃胁迫组实验鱼的血清E2水平呈现相反的变化趋势,12h时显著升高(p<0.05),增至(16.11±1.22)pg/mL,显著高于25 ℃胁迫组和对照组(p<0.05),24h时显著降低,恢复至对照组水平(p<0.05)。血清P4水平在25 ℃急性胁迫后第6 h时显著升高(p<0.05),并在12 h升至最高值(6.32±0.74 ng/mL),为对照组的3.05倍,48 h时显著下降(p<0.05),恢复至正常水平;7 ℃急性胁迫后血清P4水平无显著变化(p>0.05),始终维持在正常水平。
2.2 卵巢和脑中CYP19a和Foxl2基因表达水平
如图2所示,25℃急性胁迫后,卵巢中CYP19a1a表达水平在恢复期第6h显著下降(p<0.05),并显著低于其他2组(p<0.05)。12~24h其表达维持在较低水平,随后逐渐上升,至72h时恢复至对照组水平(p<0.05)。7 ℃急性胁迫后,CYP19a1a转录水平未发生显著变化(p>0.05)。实验观察到,2种温度处理后,卵巢中Foxl2的表达水平有一定波动,但无显著差异(p>0.05)。

(图中标注的不同大写字母表示同一时间点不同温度间存在显著性差异(p<0.05),不同小写字母表示同一温度不同时间点间存在显著性差异(p<0.05)。Different capital letters above the bars indicate significant differences (p<0.05) at different temperatures of the same time point and different small letters above the bars indicate significant differences (p<0.05) in different time points of the same temperature in Student -Neuman-Keulsmultiple range test.)
图1急性温度胁迫对妊娠期许氏平鲉血清E2和P4水平的影响
Fig.1Effect of acute temperature stress on serum 17β-estradiol and progesterone of gestationalSebastesschlegelii

(图中标注的不同大写字母表示同一时间点不同温度间存在显著性差异(p<0.05),不同小写字母表示同一温度不同时间点间存在显著性差异(p<0.05)。Different capital letters above the bars indicate significant differences (p<0.05) at different temperatures of the same time point and different small letters above the bars indicate significant differences (p<0.05) in different time points of the same temperature in Student -Neuman-Keulsmultiple range test.)
图2急性温度胁迫对妊娠期许氏平鲉卵巢中CYP19a1a和Foxl2表达水平的影响
Fig.2Effect of acute temperature stress on expression levels of CYP19a1a and Foxl2 mRNAs in ovary of gestationalSebastesschlegelii
如图3所示,25℃急性胁迫后,脑中CYP19a1b和Foxl2表达水平均在6h时显著升高(p<0.05),与对照组差异显著(p<0.05),分别为正常水平的1.66倍和2.11倍。随后二者转录水平逐渐恢复至对照组水平。7℃急性胁迫后的72h恢复期内,CYP19a1b的表达水平呈现先下降后上升的变化趋势,但此变化与对照组水平差异并不显著(p>0.05)。
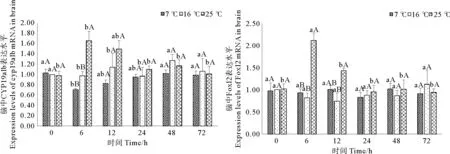
(图中标注的不同大写字母表示同一时间点不同温度间存在显著性差异(p<0.05),不同小写字母表示同一温度不同时间点间存在显著性差异(p<0.05).Different capital letters above the bars indicate significant differences (p<0.05) at different temperatures of the same time point and different small letters above the bars indicate significant differences (p<0.05) in different time points of the same temperature in Student -Neuman-Keulsmultiple range test.)
图3急性温度胁迫对妊娠期许氏平鲉脑中CYP19a1b和Foxl2表达水平的影响
Fig. 3Effect of acute temperature stress on expression levels of CYP19a1b and Foxl2 mRNAs in brain of gestationalSebastesschlegelii
2.3 卵巢和脑中ERα表达水平
实验发现,7 ℃胁迫组的实验鱼卵巢中ERα转录水平显著升高(p<0.05),12h时增至对照组的1.67倍,恢复期第24h时恢复至正常水平;25℃胁迫组中,ERα表达水平在胁迫后恢复期第6h显著下降(p<0.05),并在12h降至最低,与其他温度组水平差异显著(p<0.05)。随后缓慢升高恢复。脑中ERα的表达水平在25℃急性胁迫后恢复第6h时显著升高(p<0.05),显著高于其他2组,为对照组水平的1.97倍,并在12h时恢复正常;与此不同的是,在7℃急性胁迫后,脑中ERα转录水平无显著变化(p>0.05),与对照组持平(见图4)。

(图中标注的不同大写字母表示同一时间点不同温度间存在显著性差异(p<0.05),不同小写字母表示同一温度不同时间点间存在显著性差异(p<0.05).Different capital letters above the bars indicate significant differences (p<0.05) at different temperatures of the same time point and different small letters above the bars indicate significant differences (p<0.05) in different time points of the same temperature in Student -Neuman-Keulsmultiple range test.)
图4急性温度胁迫对妊娠期许氏平鲉卵巢和脑中ERα表达水平的影响
Fig.4Effect of acute temperature stress on expression levels of ERα mRNAs in ovary and brain of gestationalSebastesschlegelii
2.4 卵巢和脑中ERβ1、ERβ2表达水平
如图5所示,急性温度胁迫后,许氏平鲉卵巢中ERβ2表达水平无显著变化(p>0.05)。而ERβ1的表达水平在25℃急性胁迫后恢复期第6h显著升高(p<0.05),并与对照组差异显著,增至对照组的1.72倍,随后逐渐下降,在第72h时恢复至对照组水平。

(图中标注的不同大写字母表示同一时间点不同温度间存在显著性差异(p<0.05),不同小写字母表示同一温度不同时间点间存在显著性差异(p<0.05).Different capital letters above the bars indicate significant differences (p<0.05) at different temperatures of the same time point and different small letters above the bars indicate significant differences (p<0.05) in different time points of the same temperature in Student -Neuman-Keulsmultiple range test.)
图5急性温度胁迫对妊娠期许氏平鲉卵巢中ERβ1、ERβ2表达水平的影响
Fig.5Effect of acute temperature stress on expression levels of ERβ1 and ERβ2 mRNAs in ovary of gestationalSebastesschlegelii
此外,实验发现,许氏平鲉脑中ERβ1、ERβ2的表达水平在7℃和25℃急性胁迫后均无显著变化(p<0.05)(见图6)。

(图中标注的不同大写字母表示同一时间点不同温度间存在显著性差异(p<0.05),不同小写字母表示同一温度不同时间点间存在显著性差异(p<0.05).Different capital letters above the bars indicate significant differences (p<0.05) at different temperatures of the same time point and different small letters above the bars indicate significant differences (p<0.05) in different time points of the same temperature in Student -Neuman-Keulsmultiple range test.)
图6急性温度胁迫对妊娠期许氏平鲉脑中ERβ1、ERβ2表达水平的影响
Fig.6Effect of acute temperature stress on expression levels of ERβ1 and ERβ2 mRNAs in brain of gestational Sebastes schlegelii
3 讨论
鱼类代谢水平和酶活力会受到水环境温度的影响,因此,温度对于鱼类的生殖过程起着至关重要的作用,包括配子发育和成熟、排卵和排精、胚胎发育和孵化、仔稚鱼存活和生长发育等[1-2,10]。研究发现,高温能够抑制性腺内基因表达,阻碍性类固醇激素合成酶的合成,使性腺功能受到干扰,这也导致性类固醇激素(如E2、睾酮(T))含量显著升高[3];当水环境温度超过鱼类的生殖适宜温度时,HPG轴上的一些因子会发生变化来影响性腺发育,进而阻碍产卵进程[15]。
针对真鲷(Pagrosomusmajor)[16]、大西洋鲑[17]等开展的温度调控实验发现,高温会抑制芳香化酶基因的表达,阻碍卵母细胞的发育和成熟。本研究发现,25℃急性胁迫后,许氏平鲉卵巢中CYP19a1a的表达水平发生了显著降低,芳香化酶具有温度敏感性。真鲷在20℃以上的水环境中养殖4~8周后其CYP19a1a的表达水平受到抑制[17]。此外,这种温度敏感性在许多物种的性分化和性别决定方面都有较详尽的阐述[18]。芳香化酶作为一种不可逆催化雄激素转化为雌激素的关键限速酶,其产物—E2的水平与其温度敏感性也有密切关系。Watts等[18]认为,温度对性类固醇合成和卵母细胞发育的显著影响,一定程度上是由于P450芳香化酶的温度调控作用。高温会抑制芳香化酶基因表达,从而可能导致E2合成受阻,阻碍了雌鱼的生殖进程[3]。本实验中,25℃急性胁迫后,实验鱼血清E2显著降低,是性腺中芳香化酶表达水平变化的结果[11]。有研究发现,一些卵胎生鱼的血清E2水平在妊娠后期发生波动,推测除了卵黄积累时期,其在妊娠期也承担一定的生理功能[19]。本实验检测到实验鱼的血清E2水平会随温度产生显著变化,证实了前人的研究结果,E2在妊娠期与其他因子共同发挥作用,调节亲鱼的生理代谢和生殖内分泌机能。
25 ℃急性胁迫后,妊娠期许氏平鲉血清中的P4水平也发生了显著变化,分析认为P4在妊娠期也参与调控生殖内分泌水平。Nagahama等[20]对鲉科鱼类的研究发现,血清P4水平在妊娠后期出现了短暂的高峰,而此时DHP也处于峰值水平,由于P4是DHP的前体类固醇[6],它可能会随后者的水平变化产生一定波动,但也不能排除这种波动可能与P4在妊娠期活动中直接发挥其生理功能有关。
本研究发现,急性高温胁迫后,卵巢中ERα表达水平的变化趋势与血清E2相一致,都发生了显著降低。Shi等[12]研究认为ERα和E2的变化趋势具有相关性,ERs的表达水平可能受到E2的诱导。7℃急性胁迫后,许氏平鲉卵巢中ERα表达水平和血清E2水平均在胁迫后12h显著高于其他2组。有学者研究了大西洋鲑肝脏中ERs与E2的结合特性,结果表明,高温会导致二者的结合率下降[21],使ERα表达水平降低。尽管如此,目前仍不能确定ERα的变化是受到温度胁迫的直接影响,还是由于血清E2水平变化所导致的间接影响。温度对性腺ERα的表达和血清E2的作用机制还需要深入探讨。
在鱼类性腺中,与ERα典型依赖E2的调控方式相比,ERβ的调控方式受到很多因素的影响,包括生殖周期的不同阶段、配体、物种差异性等[22]。本研究发现,在急性高温胁迫后,与ERα的变化趋势相反,许氏平鲉卵巢中ERβ1表达水平显著升高。一些针对哺乳动物的研究发现,ERβ常以一种抗ERα的方式发挥其生物学作用[23],推测本研究结果可能与上述的假设相关。研究发现,某些鱼类肝脏中ERβ2的表达量很高,却未检测到ERβ1的表达,有学者认为ERβ2的高转录水平可能与雌激素在肝脏中的诱导卵黄生成作用有关,在卵黄积累过程中发挥了主要作用[24]。本实验发现性腺中ERβ2表达水平无显著变化,推测对于许氏平鲉该亚型可能也在卵黄生成期发挥其生理功能,而在妊娠期的作用相对较弱。
P450aromB在卵生鱼类产卵期和卵胎生鱼类妊娠期的神经内分泌调控中发挥重要作用,可能涉及神经和突触发生、细胞增殖、凋亡和迁徙以及细胞分化等关键过程,组织和调节神经内分泌循环,从而对脊椎动物的生殖机能起到调控作用[25]。急性高温胁迫后,卵巢处于Ⅴ期的黄颡鱼(Pelteobagrusfulvidraco)CYP19a1b转录水平显著增高[26];尼罗罗非鱼(Tilapianilotica)在32℃胁迫后,CYP19a1b表达水平也发生了明显的升高[27]。对于许氏平鲉的研究发现,CYP19a1b表达水平在妊娠期达到顶峰[28]。在本实验中,妊娠期许氏平鲉脑中CYP19a1b的转录水平在25℃急性胁迫后显著升高。分析认为,许氏平鲉脑中P450aromB受温度调控的方式与性腺中P450aromA相比有很大差别,这可能是由于承担的生理功能存在差异。妊娠期亲鱼在受到急性温度胁迫后,需要较高的雌激素水平来维持脑中相对稳定的环境,从而保证对下游内分泌过程调控作用的正常进行。
有学者发现,鱼类脑中E2水平和芳香化酶表达量最丰富的区域,也是ERs表达水平最高的区域[29]。本研究发现,在25℃急性胁迫后,妊娠期许氏平鲉脑中ERα表达水平在6h显著升高,与CYP19a1b表达的变化情况相一致。分析认为,ERα、E2及CYP19a1b在脑中形成的自动反馈调节通路[30],对于维持脑中的神经内分泌代谢稳定具有重要意义,从而对处于生殖期鱼类的生殖内分泌水平起到调节作用。本研究还发现,妊娠期许氏平鲉脑中ERβ的转录水平在25℃胁迫后无显著变化。对牙汉鱼(Odontesthesbonariensis)[31]的研究发现,相较于ERβ1和ERβ1,ERα与CYP19a1b具有更紧密的神经和功能联系。
Mu等[13]针对许氏平鲉研究发现,在性腺发育阶段,性腺中Foxl2表达量最高的阶段早于CYP19a1a,且二者表达水平显著相关。此外,雌激素还能够促进Foxl2的表达。然而,在本研究中,急性温度胁迫并未引起妊娠期许氏平鲉卵巢中Foxl2表达水平的变化。对于尼罗罗非鱼的研究发现,一种调节因子Sf1能够与Foxl2共同作用来调节CYP19a1a的表达[8]。本研究中Foxl2的表达情况是否是由于受到sf1的影响而未发生变化,有待进一步研究。在许氏平鲉脑中,Foxl2的表达与CYP19a1b显著相关[13],关于虹鳟(Oncorhynchusmykiss)[32]的研究也有类似的报道。本研究中,急性高温胁迫后,妊娠期许氏平鲉脑中Foxl2和CYP19a1b的表达水平均显著升高,表明脑中foxl2对CYP19a1b转录的促进作用。
实验发现,在7℃急性胁迫后,许氏平鲉脑和卵巢中多个基因的转录水平均未检测到显著变化。分析可能是亲鱼对低温胁迫较不敏感,也有可能是胁迫时间较短或胁迫温度仍在阈值范围内。低温对妊娠期许氏平鲉脑中繁殖相关基因的具体作用机制还需进一步探索。
综合分析发现,脑和卵巢中的生殖内分泌活动可能存在紧密联系。Cheshenko等[33]发现,脑中CYP19a1b可能参与卵巢生殖周期的调控;对鮈杜父鱼(Cottusgobio)的研究发现,温度升高4℃导致其产卵期提前,这对配子发育产生了一定影响[34];还有一些学者研究发现,高温条件下产出的胚胎,其孵化出的仔鱼成活率会显著降低[35]。总之,水环境温度的剧烈变化可能会引起HPG轴自上而下发生一系列生殖内分泌变化,最终对亲鱼及仔鱼产生极大影响。
4 结论
本研究首次报道了温度对妊娠期许氏平鲉生殖内分泌机能的影响,对卵胎生鱼类的养殖具有重要的理论意义。研究结果表明,急性温度胁迫对妊娠期许氏平鲉的血清性类固醇水平、性腺和脑中生殖相关基因表达水平均有显著影响,且亲鱼对高温胁迫的敏感性远大于低温胁迫,所需恢复期也更长。此外,研究还发现,鱼类在受到外界环境胁迫时,机体各层次的代谢水平和生理状况都发生了相应变化,不同因子间是相互贯通、相互依存、不可分割的,共同维护机体内环境的相对稳定。综上所述,在许氏平鲉的养殖和亲鱼培育过程中,注意防范水温的骤变显得尤为重要。维持水温的相对恒定,以保证亲鱼胚胎发育和产仔进程的顺利进行。
[1]温海深, 林浩然. 环境因子对硬骨鱼类性腺发育成熟及其排卵和产卵的调控[J]. 应用生态学报, 2001, 12(1): 151-155.
Wen H S, Lin H R. Effect of environmental factors on gonadal maturation as well as its ovulation and spawning in teleost[J]. Chinese Journal of Applied Ecology, 2001, 12(1): 151-155.
[2]张敏智, 邓思平, 朱春华, 等. 温度对金钱鱼卵巢发育的影响[J]. 中国水产科学, 2013, 20(3): 599-606.
Zhang Z M, Deng S P, Zhu C H, et al. Effects of temperature on ovarian development inScatophagusargus[J]. Journal of Fishery Sciences of China, 2013, 20(3): 599-606.
[3]Miranda L A, Chalde T, Elisio M, et al. Effects of global warming on fish reproductive endocrine axis, with special emphasis in pejerreyOdontesthesbonariensis[J]. General and Comparative Endocrinology, 2013, 192: 45-54.
[4]Pankhurst N W, King H R. Temperature and salmonid reproduction: implications for aquaculture[J]. Journal of Fish Biology, 2010, 76(1): 69-85.
[5]翁幼竹, 刘志刚, 方永强, 等. 水温对文昌鱼生殖活动的影响及其内分泌机制[J]. 海洋学报, 2012, 34(4): 163-171.
Wen Y Z, Liu Z G, Fang Y Q, et al. Effects of seawater temperature on the reproductive activity of the amphioxus,Branchiostomabelcheriand its endocrine mechanism[J]. Acta Oceanologica Sinica, 2012,34(4):163-171.
[6]林浩然. 鱼类生理学[M]. 广州: 广州高等教育出版社, 1999: 146-199.
.Lin H R. Physiology of Fishes[M]. Guangzhou:Guangdong Higher Education Press, 1999:146-199.
[7]Kagawa N, Waterman M R. Regulation of steroidogenic and related P450s[M]//Cytochrome P450. New York: Springer Publishing Company, 1995: 419-442.
[8]Wang D S, Kobayashi T, Zhou L Y, et al. Foxl2 up-regulates aromatase gene transcription in a female-specific manner by binding to the promoter as well as interacting with ad4 binding protein/steroidogenic factor 1[J]. Molecular Endocrinology, 2007, 21(3): 712-725.
[9]Woods M, Kumar A, Barton M, et al. Localisation of estrogen responsive genes in the liver and testis of Murray rainbowfishMelanotaeniafluviatilisexposed to 17β-estradiol[J]. Molecular and Cellular Endocrinology, 2009, 303(1): 57-66.
[10]Koya Y. Reproductive Physiology in Viviparous Teleost[M]//Fish Reproduction. Florida: The Chemical Rubber Company Press, 2008: 245-275.
[11]Scott A P, Sumpter J P, Stacey N. The role of the maturation-inducing steroid, 17,20b-dihydroxypregn-4-en-3-one, in male fishes: a review[J]. Journal of Fish Biology, 2010, 76: 183-224.
[12]Shi D, Wen H S, He F, et al. The physiology functions of estrogen receptor α (ERα) in reproduction cycle of ovoviviparous black rockfish,SebastesschlegeliHilgendorf[J]. Steroids, 2011, 76(14): 1597-1608.
[13]Mu W J, Wen H S, Li J F, et al. Cloning and expression analysis of Foxl2 during the reproductive cycle in Korean rockfish,Sebastesschlegeli[J]. Fish Physiology and Biochemistry, 2013, 39(6): 1419-1430.
[14]Mu W J, Wen H S, Shi D, et al. Molecular cloning and expression analysis of estrogen receptor betas (ERβ1 and ERβ2) during gonad development in the Korean rockfish,Sebastesschlegeli[J]. Gene, 2013, 523(1): 39-49.
[15]An K W, Lee K Y, Yun S G, et al. Molecular characterization of gonadotropin subunits and gonadotropin receptors in black porgy,Acanthopagrusschlegeli: Effects of estradiol-17β on mRNA expression profiles[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2009, 152(2): 177-188.
[16]Pankhurst N W, Munday P L. Effects of climate change on fish reproduction and early life history stages[J]. Marine and Freshwater Research, 2011, 62(9): 1015-1026.
[17]Lim B S, Kagawa H, Gen K, et al. Effects of water temperature on the gonadal development and expression of steroidogenic enzymes in the gonad of juvenile red seabream,Pagrusmajor[J]. Fish Physiology and Biochemistry, 2003, 28(1-4): 161-162.
[18]Watts M, Pankhurst N W, King H R. Maintenance of Atlantic salmon (Salmosalar) at elevated temperature inhibits cytochrome P450 aromatase activity in isolated ovarian follicles[J]. General and Comparative Endocrinology, 2004, 135(3): 381-390.
[19]Venkatesh B, Tan C H, Lam T J. Steroid hormone profile during gestation and parturition of the guppy (Poeciliareticulata)[J]. General and Comparative Endocrinology, 1990, 77(3): 476-483.
[20]Nagahama Y, Takemura A, Takano K, et al. Serum steroid hormone levels in relation to the reproductive cycle ofSebastestaczanowskiiandS.schlegeli[J]. Environmental Biology of Fishes, 1991, 30(1-2): 31-38.
[21]Watts M, Pankhurst N W, King H R, et al. Differential effects of temperature and maturity stage on hepatic estrogen receptor characteristics of Atlantic salmon[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2005, 140(3): 377-383.
[22]Nelson E R, Habibi H R. Estrogen receptor function and regulation in fish and other vertebrates[J]. General and Comparative Endocrinology, 2013, 192: 15-24.
[23]Matthews J, Wihlen B, Tujague M, et al. Estrogen receptor (ER) beta modulates ER alpha-mediated transcriptional activation by altering the recruitment of c-Fos and c-Jun to estrogen-responsive promoters [J]. Molecular Endocrinology, 2006, 20: 534-543.
[24]Sumpter J P, Jobling S. Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment[J]. Environmental Health Perspectives, 1995, 103(Suppl): 173-178.
[25]Toran-Allerand C D. Estrogen and the brain: beyond ER-a, ER-b, and 17b-estradiol[J]. Annals of the New York Academy of Sciences, 2005, 1052: 136-144.
[26]Liu M, Wen H, He F, et al. Expression patterns of cytochrome P450 aromatase genes during ovary development and their responses to temperature stress in female yellow catfish (Pelteobagrusfulvidraco)[J]. Journal of Ocean University of China, 2011, 10(4): 409-416.
[27]Tsai C L, Chang S L, Wang L H, et al. Temperature influences the ontogenetic expression of aromatase and oestrogen receptor mRNA in the developing tilapia (Oreochromismossambicus) brain[J]. Journal of Neuroendocrinology, 2003, 15(1): 97-102.
[28]杨艳平, 温海深, 史丹, 等. 许氏平鲉(Sebastesschlegeli)CYP19B 基因 cDNA 克隆及在生殖周期中的表达分析[J]. 海洋与湖沼, 2012, 43(2): 370-375.
Yang Y P, Wen H S, Shi D, et al. Clonging and the expression analysis ofcyp19agene cDNA during the reproductive cycle ofsebastesschlegeli[J]. Oceanologia et Limnologia Sinica, 2012,43(2):370-375.
[29]Menuet A, Pellegrini E, Anglade I, et al. Molecular characterization of three estrogen receptor forms in zebrafish: binding characteristics, transactivation properties, and tissue distributions[J]. Biology of Reproduction, 2002, 66(6): 1881-1892.
[30]Tchoudakova A, Kishida M, Wood E, et al. Promoter characteristics of two cyp19 genes differentially expressed in the brain and ovary of teleost fish[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2001, 78(5): 427-439.
[31]Strobl-Mazzulla P H, Lethimonier C, Gueguen M M, et al. Brain aromatase (Cyp19A2) and estrogen receptors, in larvae and adult pejerrey fishOdontesthesbonariensis: neuroanatomical and functional relations[J]. General and Comparative Endocrinology, 2008, 158(2): 191-201.
[32]Baron D, Houlgatte R, Fostier A, et al. Large-scale temporal gene expression profiling during gonadal differentiation and early gametogenesis in rainbow trout[J]. Biology of Reproduction, 2005, 73(5): 959-966.
[33]Cheshenko K, Pakdel F, Segner H, et al. Interference of endocrine disrupting chemicals with aromatase CYP19 expression or activity, and consequences for reproduction of teleost fish[J]. General and Comparative Endocrinology, 2008, 155(1): 31-62.
[34]Dorts J, Grenouillet G, Douxfils J, et al. Evidence that elevated water temperature affects the reproductive physiology of the European bullheadCottusgobio[J]. Fish Physiology and Biochemistry, 2012, 38(2): 389-399.
[35]King H R, Pankhurst N W, Watts M. Reproductive sensitivity to elevated water temperatures in female Atlantic salmon is heightened at certain stages of vitellogenesis [J]. Journal of Fish Biology, 2007, 70(1): 190-205.
责任编辑朱宝象
Effects of Acute Temperature Stress on the Reproductive Endocrine Function of Gestational Ovoviviparous Black Rockfish (Sebastesschlegelii)
ZHANG Ya-Chen, WEN Hai-Shen, LI Lan-Min, FENG Qi-Chao
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003,China)
This study mainly examinedthe effects of temperature on the reproductive endocrine function of gestational ovoviviparous black rockfish,Sebastesschlegelii. Serum sexual steroids hormones and gene expression related to the reproduction in ovary and brain were detected using endocrinological and molecular biological methods after acute temperature stress (thermal stress, 25℃; chilling stress, 7℃; control, 16℃). Results showed that P450 aromatase A (P450aromA) is sensitive to temperature in gestational black rockfish. The results indicated that the concentration of serum 17β-estradiol (E2) and the expression level of estrogen receptors α (ERα) gene decreased significantlyafteracute heat shock, which were found to be up-regulated after acute chilling stress. On the other hand, expression levels of estrogen receptors β 1(ERβ1) and estrogen receptors β 2(ERβ2) genes varied with different factors. As a precursor of 17α-hydroxy-20β- dihydroprogesterone (DHP), serum progesterone (P4) was thought to have some unknown functions during gestation of black rockfish. No significant change was found in expression level of transcription factor Foxl2 gene in acute heat or cold shock, which might indicate the participation of some other regulators. The expression level of cytochrome P450 19a1b (CYP19a1b) gene in brain elevated significantly in acute thermal stress, which was different from cytochrome P450 19a1a (CYP19a1a) gene in ovary, indicating distinct physiological functions of CYP19s among tissues. It was tentatively suggested that there was an auto-feedback loop involved in regulating expression levels of CYP19a1b, E2and ERα gene in order to promote transcription of CYP19a1b gene. In addition, the results indicated that the expression of aromatase can be up-regulated by Foxl2 in brain. The results indicated the heat-sensitivity of gestational black rockfish require longer recovery time after thermal challenge. When female fish enter the reproductive phase, itwas of great importance to monitor water temperature closely, toavoid damage induced by temperature stress during pregnancy. It was suggested that maintaining the water temperature constant or less changed could benefit the embryonic development and delivery process of gestataional black rockfish.
Sebastesschlegelii; temperature; reproductive endocrine function; aromatase; estrogen receptor
国家自然科学基金项目(41176122);教育部博士点专项基金项目(20120132110008)资助
2015-07-13;
2016-03-30
张亚晨(1990-), 女, 硕士生,研究方向: 鱼类生理学。.E-mail: 494870744@qq.com
❋❋通讯作者:E-mail: wenhaishen@ouc.edu.cn
S945.4; S955.486
A
1672-5174(2016)09-029-09
10.16441/j.cnki.hdxb. 20150254
Supported by the National Science Foundation of China (41176122);Research Fund for the Doctoral Program of Higher Education of China(20120132110008)

