热处理温度对污泥水解效果的影响及其三维荧光光谱特征*
李倩倩, 郭 亮,2,3❋❋, 赵阳国, 佘宗莲, 高孟春, 柳苗苗
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.中国海洋大学山东省海洋环境地质工程重点实验室,山东 青岛 266100;3.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
热处理温度对污泥水解效果的影响及其三维荧光光谱特征*
李倩倩1, 郭亮1,2,3❋❋, 赵阳国1, 佘宗莲1, 高孟春1, 柳苗苗1
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.中国海洋大学山东省海洋环境地质工程重点实验室,山东 青岛 266100;3.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
污水处理厂剩余污泥中含有大量的有机物,热水解可有效破解污泥絮体使有机物释放出来,有利于后续污泥资源化利用。采用65、80、100、121℃分别预处理污泥30min,研究预处理前后胞外聚合物(EPS)和溶解性有机物(DOM)中SCOD、糖、蛋白质的变化,为分析热水解过程中EPS和DOM物质的转化过程,采用三维荧光光谱技术(EEM)结合积分区域法(FRI),分析EPS和DOM中各种组分所占比例。研究表明,不同温度水解预处理对污泥EPS和DOM中可生物降解和难生物降解物质的释放量不同,80 ℃热处理污泥后微生物可利用的有机物量最大,其中可生物降解物质所占比例为58.7%。
热处理;污泥水解;积分区域法;胞外聚合物;溶解性有机物
引用格式:李倩倩,郭亮,赵阳国, 等. 热处理温度对污泥水解效果的影响及其三维荧光光谱特征[J]. 中国海洋大学学报(自然科学版), 2016, 46(9): 102-106.
LIQian-Qian,GUOLiang,ZHAOYang-Guo,etal.Effectofpretreatmenttemperatureonexcesssludgehydrolysisanditscharacteristicsoffluorescenceexcitation-emissionmatrixspectroscopy[J].PeriodicalofOceanUniversityofChina, 2016, 46(9): 102-106.
传统的活性污泥法在城市生活污水和工业废水处理中得到广泛应用,微生物代谢去除水中有机物的过程会产生大量剩余污泥[1],若不得到妥善处置会给环境带来二次污染,然而剩余污泥的处置费用占污水处理厂整体运行费用的50%~60%[2]。近年来,剩余污泥高昂的处置费用成为污水处理厂面临的难题,污泥减量化和资源化利用成为研究热点[3]。
剩余污泥主要由微生物细胞、有机物和无机物构成,由胞外聚合物(ExtracellularPolymericSubstances,EPS)絮凝在一起[4]。EPS是生物絮体的重要组成部分,占活性污泥中总有机物的50%~90%[5],占活性污泥总质量的80%左右[6],是决定活性污泥絮体物化性质和生物性质的关键物质[7]。在污泥利用过程中,溶解性有机物(DissolvedOrganicMatter,DOM)起到重要作用。通过不同的污泥预处理方法,大量的DOM从固体污泥中释放到悬浮液中,包含多糖、蛋白质、有机酸等,研究DOM的组成成分和结构特征有利于探究后续污泥厌氧消化过程[3]。目前,污泥预处理技术主要有机械破碎、超声波破碎、热水解、酶处理及酸碱处理等[8-9]。在污泥的各种预处理方法中,热水解是最简单、高效和节约成本的方法之一[10]。
三维荧光光谱(Excitaton-EmissionMatrix,EEM)技术具有灵敏度高、选择性好等优点,能够获取更多的光谱信息,已经成为一种分析污泥破解后EPS和DOM特性的重要手段[11],成功用于污水中有机物的检测[12-13]。根据特定的光谱范围和荧光强度,三维荧光能够获取EPS和DOM的化学组分构成及整体有机物分布[14-15]。
目前,热水解过程中EPS和DOM物质的转化过程尚不明确。本研究以三维荧光光谱技术为手段,结合荧光积分区域分析方法,检测热水解过程中EPS和DOM特性,并测定其中SCOD、糖、蛋白质的变化。探究65、80、100、121 ℃不同温度水解污泥的效果和物质的转化规律,为后续污泥的资源化利用提供参考。
1 材料和方法
1.1 污泥和水解过程
实验所用剩余污泥取自青岛团岛污水处理厂的二沉池污泥,污泥先经过30min沉淀,弃去上清液,再经过2mm的筛网过滤去除杂质后,4 ℃冰箱中保存备用,其特性如表1所示。
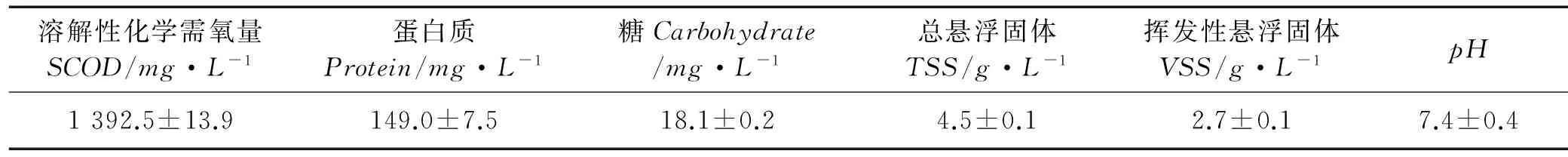
表1 污泥的基本特性
取100mL污泥置于250mL锥形瓶内,放置于恒温水浴锅中,分别在65、80、100 ℃下处理30min;另一组置于高温灭菌锅中,121 ℃处理30min,提取处理前后样品中的EPS和DOM,测定其中的SCOD、蛋白质、糖和三维荧光光谱。
1.2 分析项目及测定方法
实验中TSS、VSS采用重量法测定;SCOD采用微波消解(D7023TP-K7 微波炉, 格兰仕微波炉电器有限公司),重铬酸钾法测定;蛋白质含量采用Folin酚试剂比色测定,以结晶牛清蛋白为标准物[16];糖采用苯酚硫酸法进行测定,以葡萄糖为标准物[17];荧光光谱采用日本日立公司生产的HitachiF-4500荧光分光光度计测定。EPS采用热提法提取,DOM采用快速离心的方法进行提取。
三维荧光数据解析前,对数据进行预处理,以消除瑞利散射和拉曼散射的影响[18]。Chen[19]提出了使用积分区域法(FRI)解析三维荧光数据。FRI方法将三维荧光区域分为5个分别表示不同类型的有机物的区域,包括:酪氨酸、色氨酸、富里酸类、可溶解性微生物产物和腐殖酸类物质。积分区域法计算某荧光区域的积分体积(Φi),标准化体积(Φi,n),表示这一区域的某一结构有机化合物的含量的相对值,计算公式见(1)~(3)。
øi,n=MFiøi=MFi∑ex∑emI(λexλemΔλexΔλem,
(1)
φT,n=∑φi,n,
(2)
Pi,n=φi,n/φT,n×100%。
(3)
式中:Φi,n为荧光区域i的积分标准体积;Φi为荧光区域i的积分体积,au.nm2;λex为激发波长,nm;λem为发射波长,nm;I(λexλem) 为激发、发射波长对应的荧光强度,au;Pi,n为某一荧光区域i的积分标准体积占总积分标准体积的比例,%;MFi为倍增系数,等于某一荧光区域i的积分面积占总的荧光区域积分面积比例的倒数。
2 结果与分析
2.1 污泥EPS和DOM中化学特性的变化
污泥的固体有机物在水解过程中不断溶解、液化,同时溶解的有机物不断水解:脂肪水解成甘油和脂肪酸;碳水化合物水解成小分子的多糖甚至单糖;蛋白质水解成多肽、二肽、氨基酸,氨基酸进一步水解成低分子有机酸、氨及二氧化碳[20]。SCOD是污泥破解程度的重要指示指标,SCOD浓度越高,污泥絮体破解效果越好,越易于微生物利用。蛋白质和糖类是污泥细胞质中的主要成分,易于后续的微生物利用,因此对热解前后污泥EPS和DOM中SCOD、蛋白质和糖进行了分析测定。热处理后污泥EPS中SCOD、蛋白质和糖的变化如图1所示。原污泥EPS中SCOD浓度为864.3 mg/L,蛋白质浓度为830.4 mg/L,糖浓度为44.64 mg/L,经65、80、100、121 ℃处理后,EPS中SCOD、蛋白质和糖浓度均有下降,SCOD分别下降了30.6%、21.1%、8.3%、28.9%,蛋白质分别下降了38.2%、73.5%、80.9%、94.1%,糖分别下降了19.1%、64.3%、70.4%、67.3%。
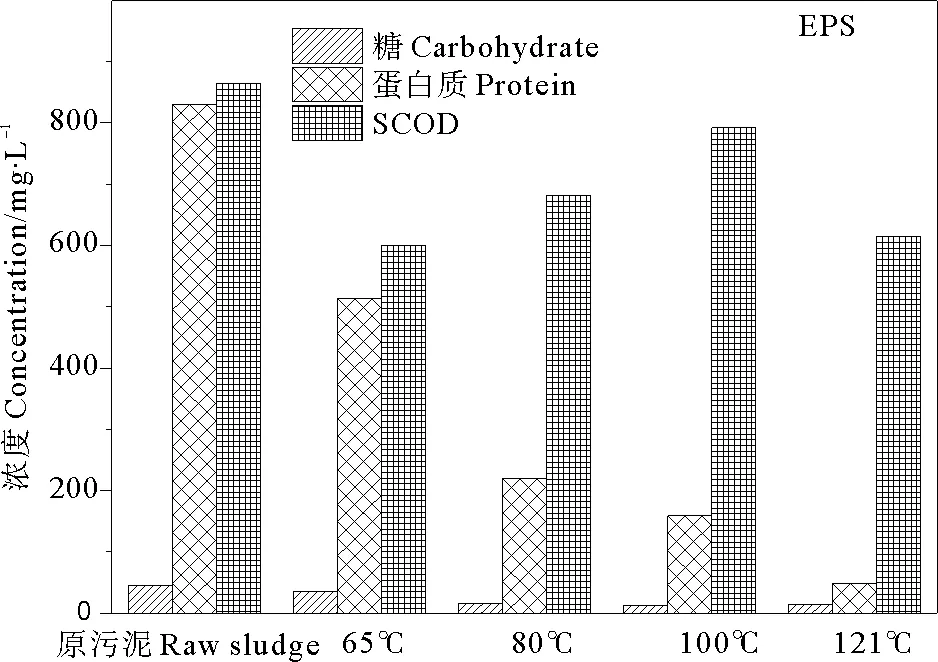
图1 热处理后污泥EPS中SCOD、蛋白质和糖的变化
预处理过程会破坏污泥的絮体结构和微生物细胞结构,有利于蛋白质和多糖从污泥固体中释放到上清液中[3]。热处理后污泥DOM中SCOD、蛋白质和糖的变化如图2所示。原污泥DOM中SCOD浓度为1 392.5 mg/L,蛋白质浓度为149.0 mg/L,糖浓度为18.1 mg/L,经65、80、100、121 ℃处理后,DOM中SCOD、蛋白质和糖浓度均有大幅上升,SCOD分别上升到原污泥浓度的2.2、2.9、6.2、8.1倍,蛋白质分别上升到原污泥浓度的5.3、10.2、18.0、13.8倍,糖分别上升到原污泥浓度的4.2、4.5、4.1、10.7倍。
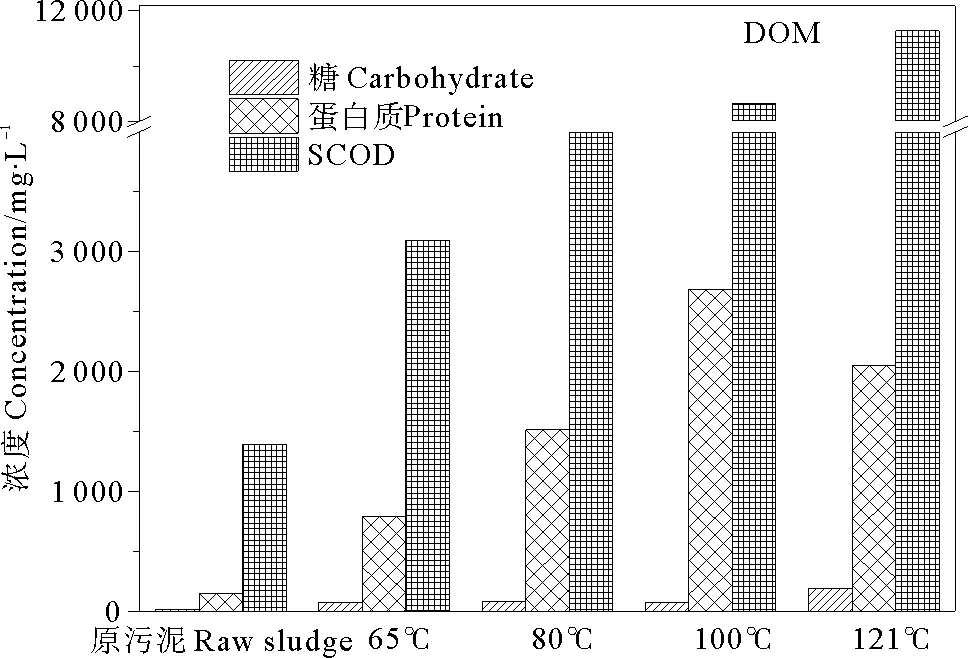
图2 热处理后污泥DOM中SCOD、蛋白质和糖的变化
预处理温度越高,污泥SCOD浓度越大。王志军等[21]研究表明,随着热水解温度的升高,污泥固体的溶解率和有机物水解程度都在增大。本实验中,121 ℃预处理污泥DOM中SCOD浓度最高。蛋白质由于自身特性,并非温度越高污泥中蛋白质浓度越高。Häner等[22]研究表明,70~95 ℃蛋白质将变性,过高的温度反而不有利于污泥中蛋白质浓度的增加。本研究表明100 ℃预处理的污泥DOM蛋白质浓度达到最高,121 ℃开始下降。糖的浓度则在121 ℃预处理时达到最高,且增幅明显,分析认为这是由于糖的热稳定性较高,污泥中的浓度随预处理温度的升高而增加[23]。
2.2 污泥EPS和DOM中光谱特性的变化
根据FRI计算方法,得到EPS和DOM三维荧光光谱5个区域的积分标准体积(见图3、4)。区域Ⅰ主要由酪氨酸等类蛋白质构成,区域Ⅱ主要与色氨酸有关,区域Ⅲ主要由紫外区类富里酸、醌类等物质组成,区域Ⅳ主要由微生物代谢产物构成,如蛋白、辅酶、小分子有机酸、色素等,区域Ⅴ则与可见光区类富里酸、腐殖酸类、胡敏酸、多环芳烃等分子量较大、芳构化程度较高的有机物构成,各区域积分标准体积间接表征了各区域所代表有机物的相对含量[13]。
原污泥EPS主要由Ⅱ色氨酸、Ⅳ溶解性微生物代谢产物构成,分别占36.6%和33.0%。经热水解后,Ⅳ微生物代谢产物所占的比例随温度的上升而下降,而Ⅲ富里酸类物质所占比例随温度的升高而增加。有研究表明,污泥中类腐殖酸荧光物质在热水解过程中发生的主要反应是溶解液化,而类蛋白荧光物质的主要反应是水解[24]。
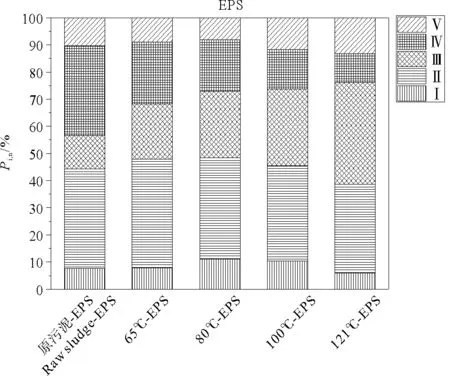
图3 热处理后污泥EPS中荧光区域标准积分体积组成
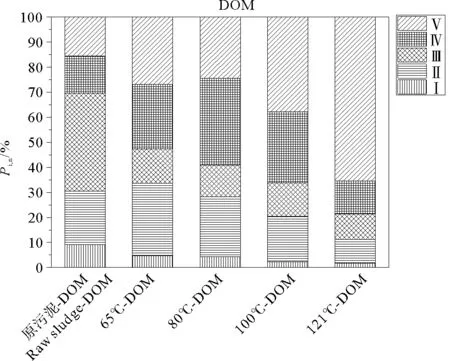
图4 热处理后污泥DOM中荧光区域标准积分体积组成
原污泥DOM中Ⅱ色氨酸、Ⅲ富里酸类物质占主要成分,分别占21.4%、39.1%。经热水解后由于微生物絮体破裂、微生物细胞解体后,其中的蛋白质及一些颗粒状蛋白质也会溶解液化到液相中,其中部分大分子量的还会进一步发生水解作用,生成多肽、二肽、氨基酸等,氨基酸进一步水解成低分子有机酸、氨及二氧化碳[20,24]。热水解前后Ⅰ酪氨酸所占比例较小,易生物降解的Ⅱ色氨酸所占比例随温度的升高而降低,65、80、100 ℃之间降幅较缓,121 ℃降幅明显增加,可能是由于高温导致了蛋白质变性。Ⅳ溶解性微生物代谢产物易于被后续处理工艺的微生物所利用,其所占比例随温度的上升呈现出先增加后减少的趋势,在80 ℃时所占比例最大,达到34.7%,100 ℃时所占比例为28.4%,121 ℃为13.3%,这是由于高温会使蛋白质类物质变性,腐殖酸、富里酸类大分子物质分解成不具有荧光特性的小分子物质,导致其它区域物质所占比例降低。Ⅴ腐殖酸类物质的累积则不利于后续微生物的利用,其所占比例随温度的升高呈现出先减少后增加的趋势,80 ℃所占比例最少,为24.3%,100 ℃时所占比例为37.8%,121 ℃为65.4%。
80 ℃热处理后DOM中可生物降解物质所占比例最高,难生物降解物质所占比例最少。100、121 ℃时蛋白质和糖的释放量较80 ℃有所升高,但部分蛋白质难以被微生物利用,且提高预处理温度会大幅增加能耗成本。综合考虑,80 ℃更有利于后续污泥资源化利用。
3 结语
热水解处理后,污泥絮体结构被破坏,微生物细胞破裂,EPS中有机物释放到DOM中,导致DOM中SCOD、蛋白质、糖浓度增加。DOM中SCOD、糖浓度随温度的升高而增大,121 ℃最高可达原污泥的8.1和10.7倍,而蛋白质浓度随温度的升高先增大后减小,在100 ℃时最高,为原污泥的18.0倍。DOM中可生物利用的溶解性微生物代谢产物所占比例随温度升高呈现出先增大后减小的规律,80 ℃时所占比例最大,且该温度下难生物降解的腐殖酸类物质释放量最少,因此80 ℃热处理更有利于后续污泥资源化利用。
[1]Guo W Q, Yang S S, Xiang W S, et al. Minimization of excess sludge production by in-situ activated sludge treatment processes——a comprehensive review [J]. Biotechnology Advances, 2013, 31(8): 1386-1396.
[2]Campos J L, Otero L, Franco A, et al. Ozonation strategies to reduce sludge production of a seafood industry WWTP [J]. Bioresource Technology, 2009, 100(3): 1069-1073.
[3]Zhang Y, Zhang P, Guo J, et al. Spectroscopic analysis and biodegradation potential study of dissolved organic matters in sewage sludge treated with high-pressure homogenization [J]. Bioresource Technology, 2013, 135: 616-621.
[4]Guo L, Lu M M, Li Q Q, et al. Three-dimensional fluorescence excitation-emission matrix (EEM) spectroscopy with regional integration analysis for assessing waste sludge hydrolysis treated with multi-enzyme and thermophilic bacteria[J]. Bioresource Technology, 2014(171): 22-28.
[5]Urbain V, Block J C, Manem J. Bioflocculation in activated sludge: an analytic approach [J]. Water Research, 1993, 27(5): 829-838.
[6]Magara Y, Nambu S, Utosawa K. Biochemical and physical properties of an activated sludge on settling characteristics[J]. Water Research, 1976, 10(1): 71-77.
[7]Laspidou C S, Rittmann B E. A unified theory for extracellular polymeric substances, soluble microbial products, and active and inert biomass[J]. Water Research, 2002, 36(11): 2711-2720.
[8]Müller J, Lehne G, Schwedes J, et al. Disintegration of sewage sludges and influence on anaerobic digestion[J]. Water Science and Technology, 1998, 38(8): 425-433.
[9]Mller J. Prospects and problems of sludge pre-treatment processes[J]. Water Science and Technology, 2001, 44(10): 121-128.
[10]Guan B, Yu J, Fu H, et al. Improvement of activated sludge dewaterability by mild thermal treatment in CaCl2solution[J]. Water Research, 2012, 46(2): 425-432.
[11]Guo W Q, Yang S S, Pang J W, et al. Application of low frequency ultrasound to stimulate the bio-activity of activated sludge for use as an inoculum in enhanced hydrogen production[J]. RSC Advances, 2013, 3(44): 21848-21855.
[12]李卫华, 盛国平, 王志刚, 等. 废水生物处理反应器出水的三维荧光光谱解析[J]. 中国科学技术大学学报(自然科学版), 2008(6): 601-608.
Li W H, Sheng G P, Wang Z G, et al. Analysis of EEM fluorescence spectra of effluents from bioreactors[J]. Journal of University of Science and Technology of China, 2008(6): 601-608.
[13]姚璐璐, 涂响, 于会彬, 等. 三维荧光区域积分评估城市污水中溶解性有机物去除[J]. 环境工程学报, 2013(2): 411-416.
Yao L L, Tu X, Yu H B, et al. Evaluation of dissolved organic matter removal in municipal wastewater based on fluorescence regional integration[J]. Chinese Journal of Environmental Engineering, 2013(2): 411-416.
[14]Zhen G, Lu X, Wang B, et al. Synergetic pretreatment of waste activated sludge by Fe (II)-activated persulfate oxidation under mild temperature for enhanced dewaterability[J]. BioresourceTechnology, 2012, 124: 29-36.
[15]Wan S, Xi B, Xia X, et al. Using fluorescence excitation-emission matrix spectroscopy to monitor the conversion of organic matter during anaerobic co-digestion of cattle dung and duck manure[J]. Bioresource Technology, 2012, 123: 439-444.
[16]Pin C, Marín M L, Selgas D, et al. Differences in production of several extracellular virulence factors in clinical and food Aeromonas spp. Strains [J]. Journal of Applied Bacteriology, 1995, 78(2): 175-179.
[17]Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[18]Yu G H, Wu M J, Luo Y H. Flourescence excitation emission spectroscopy with regional integration analysis for assessment of compost maturity [J]. Waste Management, 2011, 31(8): 1729-1736.
[19]Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science and Technology, 2003, 37(24): 5701-5710.
[20]Shanableh A, Jones S. Production and transformation of volatile fatty acids from sludge subjected to hydrothermal treatment[J]. Water Science and Technology, 2001, 44(10): 129-135.
[21]王治军, 王伟. 剩余污泥的热水解试验[J]. 中国环境科学, 2005(S1): 56-60.
Wang Z J, Wang W. Thermal hydrolysis test of surplus sludge[J]. China Environmental Science, 2005(S1): 56-60.
[22]Häner A, Mason C A, Hamer G. Death and lysis during aerobic thermophilic sludge treatment: characterization of recalcitrant products[J]. Water Research, 1994, 28(4): 863-869.
[23]王暄, 季民, 王景峰, 等. 好氧颗粒污泥胞外聚合物提取方法研究[J]. 中国给水排水, 2005(8): 91-93.
Wang X, Ji M, Wang J F, et al. Study on the Extraction of Extracellular Polymer from Aerobic Granular Sludge [J]. China Water and Wastewater, 2005(8): 91-93.
[24]欧阳二明, 王伟. 污泥热水解过程中有机物分子量和荧光特征变化规律[J]. 中国环境科学, 2008, 12: 1062-1067.
Ou Y E M, Wang W. The change of spectroscopic characterization and molecular weight distribution in sludge thermal hydrolysis process [J]. China Environmental Science, 2008, 12: 1062-1067.
责任编辑庞旻
Effect of Pretreatment Temperature on Excess Sludge Hydrolysis and Its Characteristics of Fluorescence Excitation-Emission Matrix Spectroscopy
LI Qian-Qian1, GUO Liang1,2,3, ZHAO Yang-Guo1, SHE Zong-Lian1, GAO Meng-Chun1, LIU Miao-Miao1
(1. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China; 2.The Key Laboratory of Ocean Environmental Geology Engineering of Shandong Province, Ocean University of China, Qingdao 266100, China; 3.The Key Laboratory of Marine Environmental and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China)
The excess sludge contains a large quantity of organic matters.Heat pretreatments can disrupt sludge floc and make intracellular materials release into liquid phase, which is in favor of the further utilization. The sludge was heated for 30 mins at different temperatures (65, 80, 100 and 121 ℃),and the SCOD, protein and carbohydrate in EPS and DOM after heat pretreatments were determined to explore the transformation process of the organic matters in EPS and DOM. Then the compositional characteristic of EPS and DOM was also analyzed to evaluate the sludge disintegration using excitation-emission matrix (EEM) with fluorescence regional integration (FRI).The results show that pretreatment temperatures have great influence on the releasing of biodegradable organic matters and non-biodegradable matters. The largest amount of biodegradable organic matters could be released at 80°C, accounted for 58.7%.
heat pretreatment; waste sludge hydrolysis; FRI; EPS; DOM
国家自然科学基金项目(51208481)资助
2015-12-02;
2016-01-07
李倩倩(1988-),女,硕士生。
❋❋通讯作者:E-mail:geletu@ouc.edu.cn
X703.1
A
1672-5174(2016)09-102-05
10.16441/j.cnki.hdxb.20150406
SupportedbytheNaturalScienceFoundationofChina(51208481)

