尼妥珠单抗联合顺铂对人肺腺癌A549细胞的体外实验
周文文,尹端端,薛 雷,杨雁鸿*,吴剑冬,王真真
(1.河北省秦皇岛市第一医院肿瘤二科,河北 秦皇岛 066000;2.承德医学院研究生学院,河北 承德 067000)
·论著·
尼妥珠单抗联合顺铂对人肺腺癌A549细胞的体外实验
周文文1,尹端端1,薛雷1,杨雁鸿1*,吴剑冬1,王真真2
(1.河北省秦皇岛市第一医院肿瘤二科,河北 秦皇岛 066000;2.承德医学院研究生学院,河北 承德 067000)
目的探讨尼妥珠单抗(Nimotuzumab h-R3)联合顺铂对人肺腺癌细胞的增殖抑制作用。方法h-R3和顺铂序贯作用于人肺腺癌A549细胞,试验分为5个组:A组(h-R3单抗,终浓度为200 mg/L)、B组(顺铂单药,终浓度2.0 mg/L)、C组(200 mg/L 的h-R3提前24 h预处理后加用2.0 mg/L的顺铂)、D组(200 mg/L的h-R3和2.0 mg/L的顺铂同时给予)及E组(空白对照组)。用MTT法观察各组药物对细胞的抑制情况,流式细胞术测定细胞周期分布,免疫蛋白印迹法测定细胞周期蛋白D1(Cyclin D1)水平。 结果不同时点比较:各组随着细胞培养时间的延长,对细胞生长的抑制率逐渐升高(P<0.01);组间比较:在24、48和72 h中,B组、C组和D组对细胞生长的抑制率高于A组,C组高于B组,D组低于C组(P<0.01),在所有时点中C组抑制率都是最高的。在不同的细胞周期中,各组对细胞生长的抑制率不同:在G0~G1期,A、B、C、D各组的抑制率均高于E组(P<0.05),C组的抑制率仍最高,D组抑制率低于B组(P<0.05); 在S期,A、B、C、D各组抑制率低于E组(P<0.05),C组的抑制率最低(P<0.05),D组抑制率高于B组和C组(P<0.05);在G2~M期,各组对细胞生长抑制率差异无统计学意义(P>0.05)。 D组中Cyclin D1蛋白表达量反而高于B组。 结论提前应用h-R3干预能加强顺铂对A549细胞的杀伤作用,通过下调Cyclin D1水平将细胞抑制于G0~G1期;同时给予h-R3和顺铂时反而起到拮抗作用,更好地印证了临床上靶向药物应在化疗前给予。
肺肿瘤;细胞周期蛋白D1;顺铂;尼妥珠单抗
10.3969/j.issn.1007-3205.2016.09.022
肺癌是临床上常见的恶性肿瘤之一,随着大气环境污染的加剧,吸烟人群的增加,肺癌成为全世界发病率最高的恶性肿瘤,其病死率在恶性肿瘤中也位居第一位[1]。肺癌分为非小细胞肺癌(non-small-cell carcinoma,NSCLC)和小细胞肺癌(small-cell carcinoma,SCLC),NSCLC比例约占87.05%,每年全球有超过一百万人死于此病[2],肺腺癌是NSCLC中的一个主要类型,约占NSCLC的40%,其发生率呈逐年上升趋势。由于其原发肿瘤较小且多位于外周,经常无明显症状,较容易发生远处转移,大部分患者发现并确诊时已发展为晚期,无法进行手术治疗,所以预后较差。晚期肺癌只能进行姑息性放化疗延缓病情的进展,但晚期肺癌患者体质较差,许多患者无法耐受放化疗的不良反应。随着分子靶向药物的诞生和发展,现已成为晚期NSCLC的又一治疗方法,但是靶向药物用于临床的时间较短,与目前现有化疗药物联合的疗效仍存在较大争议。本研究旨在探讨尼妥珠单抗(Nimotuzumab h-R3)联合顺铂对人肺腺癌细胞的增殖抑制作用,报告如下。
1 材料与方法
1.1细胞培养和试剂细胞培养:人肺腺癌A549细胞株由河北省秦皇岛市第一医院中心实验室保存,用含有10%胎牛血清(fetal bovine serum,FBS;四季青)、100 U/mL青霉素和100 U/mL链霉素双抗合剂的DMEM/高糖(Gibco)培养基37 ℃、5%CO2及饱和湿度条件下的培养箱中培养。主要试剂:顺铂(山东齐鲁制药厂);h-R3(百泰生物药业有限公司)。
1.2方法
1.2.1MTT法测定药物对A549细胞的增殖抑制作用实验分为A组(h-R3单药,终浓度为200 mg/L)、B组(顺铂单药,终浓度2.0 mg/L)、 C组(200 mg/L 的h-R3提前24 h预处理后加用2.0 mg/L的顺铂)、D组(200 mg/L的h-R3和2.0 mg/L的顺铂同时给予)及E组(空白对照组)。取对数生长期的A549细胞,用0.25%的胰酶消化液消化细胞,用含10% FBS的DMEM制备成单细胞悬液,并使其浓度配置为3×104/mL,之后将其按100 μL/孔种于96孔板中,接种细胞贴壁培养12 h后,换用无血清培养基100 μL继续培养12 h。去除旧培养基,加入用含1%FBS培养基稀释的上述不同浓度的药物至总体积相等,均为200 μL,空白对照组只加含1%FBS的培养基。取加药后的24、48、72 h进行MTT检测,每孔加入MTT液(5 g/L)20 μL,37 ℃、5%CO2的培养箱中继续孵育4 h后停止培养,小心吸出孔内培养液,使用PBS小心冲洗孔板2遍,最后每孔加入150 μL DMSO,用吸管反复抽吸10次,使结晶物充分溶解。在波长为492 nm的酶标仪上测定各孔吸光值(OD值),记录结果。实验设6个平行孔,重复3次,取平均值。细胞生长抑制率(%)=(空白对照组OD值-实验组的OD值)/空白对照组OD值×100%。
1.2.2流式细胞术测定各组细胞在药物处理后的细胞周期分布分组及处理同MTT,但细胞培养时换用培养瓶,加入药物培养48 h后用0.25%胰酶消化,制备成单细胞悬液后,移入10 mL离心管,2 000 r/min离心5 min,收集沉淀, PBS洗涤沉淀1次。细胞沉淀中加入预冷的固定液2 mL,4 ℃固定30 min。1 000 r/min离心10 min,加入PI染色液1 mL[33 mg/L PI,0.13 mg/mL RnaseA,10 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),0.5% Triton-100],室温孵育30 min。流式细胞仪检测DNA-PI的荧光强度,调整流式细胞仪的激发光波长488 nm、发射光波长530 nm。采用Modit软件系统进行分析。实验重复3次,取平均值。
1.2.3Western blot测定CyclinD1水平分组及处理同流式细胞术,通过提取蛋白质、电泳、转膜、免疫反应等步骤得出条带。实验重复3次,取平均值。

2 结 果
2.1细胞形态学观察倒置光学显微镜下(调至100倍)观察各组作用于A549细胞。A、B、C、D各组均能使A549细胞数量减少,细胞密度变小,且 C组抑制作用明显高于其他各组(图1)。
2.2各组对A549细胞的增殖抑制作用不同时点比较:各组随着细胞培养时间的延长,对细胞生长的抑制率逐渐升高(P<0.01);组间比较:在24、48和72 h中,B、C和D组对细胞生长的抑制率高于A组,C组高于B组,D组低于C组(P<0.01),在所有时点中C组抑制率都是最高的。见表1。
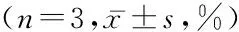

组别24h48h72hFPA组4.40±1.835.58±3.2110.11±6.2210.9140.000B组14.35±0.32*31.19±1.74☆56.97±1.42*☆▲367.2490.000C组17.00±0.76*#51.62±2.37*#☆82.17±1.62*#☆▲1970.5510.000D组11.97±1.08*#△24.39±0.63*#△☆48.39±1.84*#△☆▲661.2290.000F154.972944.891506.742P0.0000.0000.000
*P<0.01与A组比较#P<0.01与B组比较△P<0.01与C组比较☆P<0.01与24 h比较▲P<0.01与48 h比较(SNK-q检验)
2.3各组细胞药物处理后的细胞周期分布不同药物处理方式下4组细胞中的细胞周期呈现不同变化:在G0~G1期,A、B、C、D组对细胞生长抑制率高于E组(P<0.05),B组和C组抑制率高于A组(P<0.05);C组高于B组(P<0.05); 在S期,A、B、C、D组抑制率低于E组(P<0.05);B组、C组抑制率低于A组(P<0.05),C组低于B组(P<0.05),D组高于C组(P<0.05);在G2~M期,各组对细胞生长抑制率差异无统计学意义(P>0.05)。见表2。
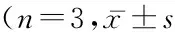
表2 各组细胞药物处理48 h后的细胞周期分布比较 ,%)
*P<0.05与E组比较#P<0.05与A组比较△P<0.05与B组比较☆P<0.05与C组比较(SNK-q检验)
2.4各组中Cyclin D1表达A、B、C、D组中Cyclin D1蛋白的表达均较E组降低,其中C组降低最为明显,D组反而较B组表达量高。
3 讨 论
h-R3是我国第一个自主研发的用于治疗恶性肿瘤的单抗类药物,于2008年获准上市,具有人源性、高选择性和半衰期长的特点[3]。国家食品药品监督管理局批准其适应证为:适用于与放疗联合治疗抗表皮生长因子受体(epidermal growth factor receptor,EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。但目前大量临床研究表明h-R3对于脑胶质瘤、头颈部恶性肿瘤、胰腺癌等多种癌症都有较好的抑制作用,且上述研究已在国外完成其Ⅱ/Ⅲ期临床试验。目前仍有大量临床试验正在研究h-R3单药及其联合化疗用于脑转移瘤、NSCLC、乳腺癌、食管癌、转移性结直肠癌、前列腺癌和宫颈癌等。
h-R3的作用机制为:其特异性结合EGFR,占据EGFR分子的3A表位,阻碍表皮生长因子、肿瘤坏死因子α等天然配体与EGFR结合,从而切断EGFR的下游通路,最终达到抑制增殖、诱导凋亡及抑制肿瘤新生血管的生成[4-8]。该抗体抑制肿瘤细胞增殖,并增强放化疗的杀伤作用。王秀力等[9]研究显示,h-R3在体外单独应用时无明显抑制率,但h-R3联合顺铂后增强了顺铂对CAL-27细胞的杀伤作用,同时还抑制了CAL-27细胞分泌表皮生长因子与血管内皮生长因子。武献珍等[10]研究发现,h-R3可增强放疗对胰腺癌细胞株PANC-1的生长抑制作用,其增敏作用的机制可能与抑制EGFR信号转导通路、诱导细胞凋亡增加等有关。凌华毓等[11]研究表明,体外应用h-R3联合表阿霉素提高了对HepG2细胞的杀伤作用,且2种药物都可以影响HepG2细胞的周期分布,h-R3可使HepG2细胞阻滞于G0~G1期,表阿霉素使细胞阻滞在S期,2药物联合使细胞大量停滞在G0~G1期和S期,G2/M期的细胞比例仅为0.16%。李小燕[12]研究发现,h-R3单独应用时在体外不论对EGFR高表达还是低表达均无明显的抑制作用,联合伊立替康和氟尿嘧啶能增加化疗的敏感性,联合奥沙利铂时与细胞株种类有关,效应机制可能是通过下调PI3K/Akt信号通路,引起细胞发生G0~G1期阻滞。木亚林[13]研究显示,体外单独使用h-R3能使人食管鳞癌EC9706细胞(EGFR高表达)阻滞于G1期,且有微弱的细胞抑制作用,与顺铂或氟尿嘧啶联合起到相加作用,但h-R3无论单药或是联合化疗药物对人食管鳞癌EC1细胞(EGFR低表达)的体外实验均无明显作用。颜莹等[14]研究发现,h-R3单独应用对A549细胞的生长增殖未见明显抑制作用,但增强了照射对A549细胞的生长抑制作用。袁智勇等[15]研究表明,h-R3对肺腺癌细胞株(A549)、人肺癌细胞系(未分化癌,Calu-6)细胞均有抑制增殖作用,不同加药时序影响放射增敏效应,其中放疗前加药放射增敏效应最强。
NSCLC患者中,EGFR过度表达率较高,且与肿瘤分化、局部控制率和远处转移关系密切。国外学者研究表明多种肺癌细胞株应用h-R3可增强放疗疗效,与细胞株的EGFR表达有关,而与EGFR突变无关。齐大亮等[16]研究显示,联合组采用h-R3联合紫杉醇脂质体、卡铂方案治疗,对照组采用紫杉醇脂质体、卡铂方案化疗,联合组能提高疗效,延长患者至疾病进展时间,且不良反应较轻。
本研究结果显示,应用h-R3单药的A组对A549细胞有增殖抑制作用,但效果弱于应用细胞毒性药顺铂的B组,在联合用药中,提前应用h-R3预处理后加用顺铂的C组 较单用顺铂的B组抑制率增加,其机制是通过下调Cyclin D1使细胞抑制于G0~G1期,而同时给予2种药物的D组未显示协同效应,具体机制目前不明,需进一步研究。本实验结果正好为临床上先给予靶向药物再给予化疗药提供了一定的理论基础。(本文图见封三)
[1]赵心想,路玉李,徐二曼,等.多西他赛联合奈达铂新辅助化疗对肺癌手术患者的疗效观察[J].河北医科大学学报,2015,36(11):1314-1316.
[2]王鹏,申文婕,郭其森.晚期非小细胞肺癌靶向药物治疗研究进展[J/CD].中华肺部疾病杂志:电子版,2015,8(3),102-105.
[3]Kreuter A,Wieland U. Images in clinical medicine.Giant condyloma acuminatum of Buschke and Löwenstein[J]. N Engl J Med,2011,365(17):1624.
[4]Song H,Pan B,Yi J,et al. Featured article:autophagic activation with nimotuzumab enhanced chemosensitivity and radiosensitivity of esophageal squamous cell carcinoma[J]. Exp Biol Med(Maywood),2014,239(5):529-541.
[5]Solomon MT,Miranda N,Jorrín E,et al. Nimotuzumab in combination with radiotherapy in high grade glioma patients: asingle institution experience[J]. Cancer Biol Ther,2014,15(5):504-509.
[6]Lin S,Yan Y,Liu Y,et al. Sensitisation of human lung adenocarcinoma A549 cells to radiotherapy by Nimotuzumab is associated with enhanced apoptosis and cell cycle arrest in the G2/M phase[J]. Cell Biol Int,2015,39(2):146-151.
[7]Song HZ,Yi J,Chen J,et al. Nimotuzumab increases chemosensitivity of human lung adenocarcinoma cell lines to docetaxel[J]. Oncol Res,2012,20(1):39-47.
[8]Su D,Jiao SC,Wang LJ,et al. Efficacy of nimotuzumab plus gemcitabine usage as first-line treatment in patients with advanced pancreatic cancer[J]. Tumour Biol,2014,35(3):2313-2318.
[9]王秀力,孟箭.尼妥珠单抗联合顺铂对人舌鳞状细胞癌细胞株CAL-27的抑制作用[J/CD].中华医学口腔研究:电子版,2013,7(1):13-17.
[10]武献珍,韩摇,颜莹,等.尼妥珠单抗联合放疗对人胰腺癌细胞株PANC-1凋亡的影响[J].实用肿瘤学杂志,2011,25(5):453-456.
[11]凌华毓,顾康生.尼妥珠单抗联合表阿霉素对人肝癌细胞株HepG2体外生长的影响[J].临床肿瘤学杂志,2011,16(2):113-118.
[12]李小燕.尼妥珠单抗联合化疗药物对人结肠癌细胞的实验研究及对PI3K/Akt信号通路的影响[D].广州:南方医科大学,2009.
[13]木亚林.尼妥珠单抗联合顺铂或氟尿嘧啶对人食管鳞癌细胞体外生长的影响[D].新乡:新乡医学院,2009.
[14]颜莹,刘园,高纯子,等.尼妥珠单抗联合X射线照射对肺腺癌细胞A549的作用[J].中国肿瘤临床,2011,38(8):433-436.
[15]袁智勇,刘晓斌,庄洪卿,等.尼妥珠单抗不同给药时序对人肺癌细胞系的放射增敏作用[J].中国肿瘤临床,2011,38(17):1019-1023.
[16]齐大亮,王华庆,李燕,等.尼妥珠单抗联合紫杉醇脂质体和卡铂方案治疗晚期非小细胞肺癌的近期疗效与毒副反应[J].中华肿瘤杂志,2012,34(2):152-155.
(本文编辑:许卓文)
2015-10-29;
2016-05-02
秦皇岛市科学技术研究与发展计划(2012023A130)
周文文(1983-),女,山东淄博人,河北省秦皇岛市第一医院主治医师,医学硕士,从事恶性肿瘤诊治研究。
。E-mail:13833520070@163.com
R734.2
B
1007-3205(2016)09-1080-05

