白藜芦醇通过NF-κB信号通路抑制软骨细胞炎症因子的表达*
袁昊 曾晖 肖德明 于斐 林健静
(北京大学深圳医院骨科,广东深圳518036)
白藜芦醇通过NF-κB信号通路抑制软骨细胞炎症因子的表达*
袁昊曾晖**肖德明于斐林健静
(北京大学深圳医院骨科,广东深圳518036)
背景:炎症因子如IL-1β、TNF-α等可通过一系列级联反应引起关节软骨破坏和炎症反应,在骨关节炎软骨病变中尤为重要。白藜芦醇(resveratrol,Res)具有抗炎、抗氧化等作用,研究Res对软骨细胞炎症因子表达的影响可为其预防、治疗骨关节炎提供参考依据。目的:探讨Res对脂多糖(lipopolysaccharides,LPS)诱导小鼠软骨细胞核因子-κB(nuclear factor-kappa B,NF-κB)活化及炎症因子基因表达的调节及其相关机制。方法:体外分离培养小鼠膝关节软骨细胞,Ⅱ型胶原免疫荧光检测进行软骨细胞鉴定。根据加入不同培养物分为3组:LPS组(1μg/m l LPS);Res组(100μmol/LRes+1μg/m l LPS);空白对照组。酶联免疫吸附试验(ELISA)法检测各组软骨细胞中NF-κB抑制蛋白α(inhibitor of NF-κB-α,I-κBα)的表达量,细胞免疫荧光染色观察NF-κB核转位情况,实时定量聚合酶链反应(RT-PCR)测IL-1β、TNF-αmRNA表达量。结果:荧光显微镜下可见软骨细胞核呈蓝色荧光,胞质呈红色荧光。ELISA检测:LPS组的I-κBα表达量低于空白对照组(P<0.05),Res组明显高于LPS组(P<0.01)。细胞免疫荧光染色检测:与空白对照组相比,LPS组中NF-κB发生明显的核转位,而Res组中NF-κB的核转位受到抑制。RT-PCR检测:LPS组中IL-1β和TNF-αm RNA的表达量与空白对照组相比明显上调,而Res组中IL-1β和TNF-αmRNA的表达量与LPS组相比明显下调,均有统计学差异(P<0.05)。结论:Res可通过NF-κB信号通路影响软骨细胞IL-1β、TNF-αmRNA的表达,进而降低软骨细胞炎症反应,延缓关节软骨细胞退变。
骨关节炎;软骨细胞;NF-κB;炎症
【Abstract】Background:Inflammatory cytokines such as IL-1 beta,TNF alpha can lead to cartilage destruction and inflammatory reaction through a series of cascade reaction,especially in cartilage lesions.Resveratrol has anti-inflammatory and antioxidant function.It can provide reference for the prevention and treatment of osteoarthritis by researching the effect of resveratrol on inflammatory cytokines expression of cartilage cells.Objective:To investigate how resveratrol regulates the activation of nuclear factor-Kappa B(NF-κB)and the gene expression of inflammatory cytokines in lipopolysaccharide-induced cartilage cells and its related mechanism.Methods:Mouse knee cartilage cellswere isolated and cultured in vitro,whichwere identified by typeⅡcollagen immunofluorescence.The experimentwas divided into three groups according to different culture:LPS group(1μg/m l LPS),resveratrol group(100μmol/L resveratrol+1μg/m l LPS),and blank control group.The expression level of inhibitor of NF-κB-α(I-κBα)were detected by using enzyme-linked immunosorbentassay(ELISA).NF-κB nuclear translocation was observed by immunofluorescence staining.The expression of IL-1β、TNF-α mRNA wasmeasured by real-time quantitative polymerase chain reaction(RT-PCR).Results:The cell nucleus of chondrocyteswas blue and cytoplasm was red under the fluorescentm icroscope.ELISA detection:the expression of I-κBαin LPS group w as significantly lower than that in control group(P<0.05),w hile the expression of I-κBαin resveratrol group was significantly higher than that in LPS group(P<0.01).Immunofluorescence staining:the nuclear translocation of NF-κB in LPSgroup significantly changed compared with the control group,while the nuclear translocation of NF-κB in resveratrol group was inhibited.RT-PCR test:as compared with the control group,the expression of IL-1βand TNF-αmRNA in LPS groupwereupregulated,while resveratrolgroupwere downregulated compared to LPSgroup(P<0.05).Conclusions:Resveratrol can inhibit the expression of IL-1βand TNF-αmRNA in cartilage cells through NF-κB signal pathway,decrease the inflammatory reaction of chondrocytes,and then delay the degeneration of articular cartilage cells.
【Key w ords】Osteoarthritis;Chondrocytes;NF-Kappa B;Inflammation
白藜芦醇(resveratrol,Res)是一种非黄酮类多酚化合物,多项研究表明其对肿瘤、脑缺血、骨关节炎等多种疾病具有良好的治疗作用,这可能依赖于其抗氧化、抗炎、抗肿瘤活性以及改善细胞内能量代谢等机制[1,2]。关节软骨的退行性变是骨关节炎的主要病理改变,传统观念认为没有炎症因子参与,但近年来的研究发现,代谢性炎症在骨关节炎的发生发展中起重要作用[3]。如果可以找到抑制骨关节炎中炎症因子表达的途径,保护软骨细胞免受过度氧化应激的损伤,将对治疗骨关节炎有重要意义。本研究采用脂多糖(lipopolysaccharides,LPS)作为诱导剂,建立小鼠软骨细胞炎症反应模型[4],观察Res对软骨细胞是否存在保护作用并探讨其可能的作用途径和作用机制。
1 材料与方法
1.1细胞培养和化学试剂
C57BL/6J品系胎鼠9只(动物合格证号:44007200018611),雌雄不限,购于广东省医学实验动物中心,饲养于北京大学/香港科技大学医学中心深圳医院实验动物中心。细胞培养液改良型1640(Hyclone公司提供);Ⅱ型胶原酶、胰蛋白酶、胎牛血清(Gibco公司提供),双抗(青霉素、链霉素);Res、LPS(sigma公司提供);PBS(Hyclone公司提供);抗兔Dylight 488(Jackson公司提供);抗荧光淬灭封片液、DAPI(碧云天公司提供);反转录试剂盒、荧光聚合酶联反应(PCR)试剂盒(TaKaRa公司提供);酶联免疫吸附试验(ELISA)试剂盒(酶联生物科技有限公司提供);TRE-trizol(Invitrogen公司提供),q-PCR引物(南京金斯瑞生物科技有限公司设计合成)。
1.2软骨细胞的获取与培养
无菌条件下截取C57BL/6J胎鼠的膝关节,洁净工作台内将膝关节取下,0.25%胰蛋白酶消化15m in,无菌PBS溶液冲洗后,加无菌0.2%Ⅱ型胶原酶置于37℃、5%CO2恒温箱内消化4 h,用含10%胎牛血清1640培养基终止消化,1000 r/m in、5m in,弃上清。按(3~4)×105/m l接种于25 cm2培养瓶内,37℃恒温、5% CO2饱和湿度培养箱内培养。
1.3软骨细胞爬片和培养
调整细胞悬液浓度为1×104/m l,在24孔板中放入爬片,每孔加1m l细胞悬液后置37℃、5%CO2温箱中培养24 h,之后弃去液体,空白对照组加1m l培养基,LPS组加1m l1μg/m l的LPS,Res组加入100μmol/L Res培养2 h后加1μg/m l LPS继续培养6 h。
取生长良好的软骨细胞24孔板内爬片,PBS液漂洗3次各5m in,4%多聚甲醛固定10m in,PBS液洗3次各5m in,5%BSA封闭30m in,加入一抗4℃过夜,PBS液漂洗3次各5m in,加入二抗37℃放置30m in以上,行显微镜下观察。
1.5NF-κB免疫荧光染色与荧光显微镜观察
吸去孔内培养基,PBS洗涤3次。加入固定液固定15m in,PBS洗涤3次,每次5m in。每孔滴入200μl 3%的H2O2溶液覆盖在爬片上,37℃孵育10m in,PBS洗涤3次,每次5m in。加入BSA封闭液,37℃恒温封闭45 m in。加入NF-κB p65抗体,4℃孵育过夜。PBS洗涤3次,每次5m in。加入抗兔Dylight488,室温孵育1 h。PBS洗涤3次,每次5m in。加入细胞核染色液(DAPI),室温染色5m in,PBS洗涤3次,每次5m in。滴加适量的抗荧光淬灭封片液,盖玻片封片。在波长460 nm处观察细胞核、胞浆颜色,NF-κB p65染色为绿色荧光,DAPI染色为蓝色荧光,高倍镜下观察细胞发生核转位的情况。
1.6ELISA检测软骨细胞NF-κB抑制蛋白α(inhibitor ofNF-κB-α,I-κBα)表达量
小鼠软骨细胞用培养基稀释至1.0×105/m l,培养于6孔板,按不同组进行相应处理,获取软骨细胞后采用反复冻融的方法裂解细胞。应用ELISA检测I-κBα在各组中的表达水平,严格按照实验步骤操作,完成反应后,用酶标仪在450 nm波长下测定吸光度值,通过标准曲线计算样品中I-κBα的浓度。
1.7实时定量聚合酶链反应(RT-PCR)
收集各组细胞,按照Trizol一步法抽提得到总RNA,分光光度计测得RNA的浓度,2%凝胶电泳确定RNA片段的完整性。取1μg总RNA采用反转录试剂盒进行cDNA合成。按照PCR试剂盒说明书进行小鼠IL-1β、TNF-αmRNA的RT-PCR检测。GAPDH作为内参基因。利用2-ΔΔCT法进行分析相应基因表达,每个样本设置3个重复。引物序列如表1所示。

表1 实时定量聚合酶链反应引物序列
1.8统计学处理
应用SPSS 19.0统计软件进行统计学分析,所有数据采用均数±标准差表示,组间计量资料采用单因素方差分析,以P<0.05为有统计学差异。
2 结果
2.1小鼠原代细胞的观察
在倒置相差显微镜下观察可见,未贴壁前细胞呈球形,悬浮于培养液中;12 h左右细胞开始贴壁;24 h后有较多细胞贴壁,且细胞形态发生变化,大部分呈梭形,部分呈多角形,均匀散在生长,出现较多细胞分裂相;7 d左右细胞铺满瓶底,铺满后进行传代。传代后细胞生长较快,细胞数量较多时可呈现“铺路石”样改变。从第6代开始,软骨细胞胞质内出现大量细黑颗粒,细胞呈现凋亡状态,有些甚至出现碎裂。
Ⅱ型胶原是软骨细胞基质内的主要成分,Ⅱ型胶原的合成与分泌可作为鉴定软骨细胞的特定指标[5]。软骨细胞培养3 d后光镜下形态如图1A所示,Ⅱ型胶原免疫荧光染色后在荧光显微镜下观察如图1B所示,可见典型的软骨细胞形态,其中软骨细胞核被DAPI染成蓝色,而胞质呈红色荧光。
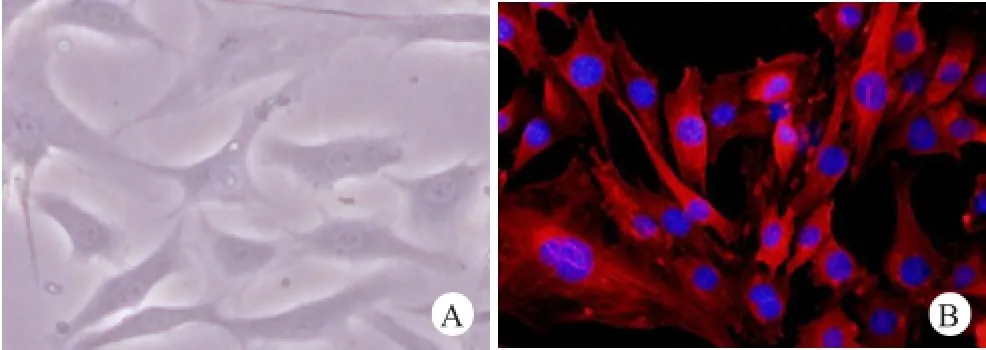
图1 A.软骨细胞培养3 d后光镜下大多呈梭形,少数呈多角形(200×);B.细胞基质内Ⅱ型胶原免疫荧光染色后荧光显微镜下软骨细胞核蓝染,胞质呈红色荧光(200×)
2.3Res对软骨细胞I-κBα蛋白表达的影响
I-κBα是NF-κB的抑制蛋白,通过检测I-κBα蛋白的表达量可以反映NF-κB信号通路的激活情况。ELISA检测结果如图2所示:LPS组中加入LPS后继续培养6 h(LPS终浓度为1μg/m l);Res组加入Res培养2 h后换液,加入LPS继续培养6 h(Res终浓度为100μmol/L,LPS终浓度为1μg/m l);空白对照组(仅加培养液)。ELISA检测三组的I-κBα蛋白表达量分别为:LPS组(41.55±3.83)ng/L、Res组(85.02±6.33)ng/L、空白对照组(71.18±3.83)ng/L,其中LPS组明显低于空白对照组(*P<0.05),Res组明显高于LPS组(**P<0.01)。
2.4Res对软骨细胞NF-κB核转位的影响
细胞免疫荧光染色与荧光显微镜下观察如图3所示:对照组(图3A、B、C)绿色荧光主要分布于胞浆区,而核区很少或不见,核呈蓝色;LPS组(图3D、E、F)胞浆区绿色荧光减弱,胞核有部分绿色荧光,与细胞核蓝色叠加,提示NF-κB发生核转位,处于激活状态;Res组(图3G、H、I)可见胞浆区绿色荧光相比LPS组增强,但弱于空白对照组,提示白Res对NF-κB核转位有一定抑制作用。

图2 Res对软骨细胞I-κBα蛋白表达的影响
2.5Res对软骨细胞炎症因子IL-1β、TNF-αmRNA表达的影响
RT-PCR结果如图4所示,软骨细胞经1μg/m l LPS诱导后,IL-1β、TNF-α的表达量明显上调,加入LPS前2 h分别用不同浓度(10μmol/L,100μmol/L,1000μmol/L)的Res处理。LPS组IL-1β、TNF-α的表达量与空白对照组相比明显上调(*P<0.05),Res组除10μmol/L浓度的IL-1β的表达量无明显差异外,其余浓度组IL-1β和TNF-α的表达量与LPS组相比均明显下降(**P<0.05)。
3 讨论
Res于1940年首次从毛叶藜芦的根茎中获得,是一种存在于葡萄科、百合科、豆科等多种植物中的天然小分子化合物,其具有抗炎、抗氧化、抗衰老、调控细胞凋亡等病理作用。有研究指出Res可抑制软骨细胞凋亡继而起到预防骨关节炎的作用[6]。LPS是革兰氏阴性杆菌外膜的主要组成成分,它可干扰软骨细胞的正常功能,促使软骨细胞表达促炎因子(IL-1β,TNF-α,IL-6)而表现为退化性关节炎的早期阶段[7]。本实验用LPS刺激小鼠软骨细胞模拟骨关节炎软骨细胞的炎症模型[4],在细胞水平研究骨关节炎的相关机制。骨关节炎是一种多致病因素引起的关节退行性病变,年龄、肥胖、炎性反应、过度负载以及关节损伤和疾病均是发病的重要危险因素[8]。目前骨关节炎的早期治疗主要集中在改善关节软骨的营养状况及减少关节软骨的磨损。但随着对骨关节炎患者软骨细胞炎症反应的研究发现,各种细胞因子的调控失调所致的合成和分解效应在软骨退变中起重要作用,炎症细胞因子(如:IL-1β,IL-6和TNF-α等)已被证实可以调节细胞外基质更新周转率,进而加速骨关节炎中软骨细胞退化和诱导软骨细胞凋亡,IL-1、TNF-α是引起骨关节炎炎症反应及软骨基质降解的重要细胞因子,IL-1可能是众多破坏性细胞因子的核心因子[9,10]。因此,控制软骨细胞的炎症反应有利于控制或延缓骨关节炎的进展,并可能成为治疗骨关节炎的关键环节。本研究中观察到,在LPS诱导下软骨细胞炎症因子IL-1β、TNF-αmRNA的表达明显升高,而加入Res后IL-1β、TNF-αmRNA的表达受到抑制,而且呈剂量依赖性,提示Res对软骨细胞炎症因子的表达具有抑制效应。

图3 Res对软骨细胞NF-κB核转位的影响

图4 Res对软骨细胞IL-1β、TNF-αmRNA表达的影响
骨关节炎炎症的产生与NF-κB信号通路的激活有关,许多与炎症反应关系密切的趋化因子、环氧合酶和金属蛋白酶等重要因子均含有κB位点,活化的NF-κB能与特定的κB位点结合,启动调节参与机体的炎症有关的基因转录。软骨细胞合成软骨基质,正常情况下软骨基质的合成和分解处于动态平衡。细胞因子以及外界机械刺激主要通过关节液和软骨基质作用于软骨细胞[11]。体外实验中证实Res可抑制IL-1β诱导的软骨基质的降解[12]。
NF-κB是炎症通路中的一个关键的转录因子,介导炎症反应,刺激细胞分泌基质金属蛋白酶(matrix metalloproteinase,MMPs)和炎症因子等,破坏关节软骨,对骨关节炎患者软骨修复产生不利影响[13]。大量研究已证实,在软骨细胞中NF-κB参与调节炎症因子TNF-α和IL-1β、纤维结合蛋白碎片和机械信号[14,15]。NF-κB蛋白是一类由其家族蛋白亚单位组成的同源或异源二聚体转录因子,不同的组合可以激活不同的效应基因。在人体中最常见的是由p65和p50组成的异源二聚体,NF-κB在胞质内被合成并与其I-κB结合形成三聚体而失活。它可以被多种刺激因素激活而使I-κB磷酸化,从而使NF-κB与I-κB解离并移位至细胞核内与靶基因上游的启动子/增强子上的特定序列(κB位点)结合,从而调控靶基因的表达。由此可知,通过检测I-κB蛋白的表达量可以反映NF-κB信号通路的激活情况。本研究发现,在LPS的刺激下I-κB蛋白的表达量和对照组相比明显下降(P<0.05),而I-κBa作为NF-κB信号通路的抑制蛋白,其含量的减少提示该通路的激活。细胞免疫荧光染色结果提示LPS组NF-κB明显激活,而Res组NF-κB激活受抑制。
本研究针对Res对骨关节炎的防治作用进行了初步探讨,发现Res对软骨细胞NF-κB信号通路具有抑制作用,并且可降低软骨细胞炎症因子IL-1β、TNF-α mRNA的表达。由此认为Res对软骨细胞的保护作用是通过抑制NF-κB信号通路降低炎症因子表达而实现的,为Res用于防治骨关节炎提供了新的参考依据。
[1]Nakata R,Takahashi S,Inoue H.Recent advances in the study on resveratrol.Biol Pharm Bull,2012,35(3):273-279.
[2]Yu W,Fu YC,Wang W.Cellular and molecular effects of resveratrol in health and disease.JCell Biochem,2012,113(3):752-759.
[3]何凡,丁长海,徐建华.代谢性炎症在骨关节炎发病机制中的作用.中华风湿病学杂志,2013,17(9):632-635.
[4]刘维,吴沅皞.青藤碱对炎性刺激下体外培养关节软骨细胞的保护作用.国际免疫学杂志,2011,34(5):309-312.
[5]Pullig O,K ladny B,Weseloh G,etal.[Metabolic activation of chondrocytes in human osteoarthritis.Expression of type IIcollagen].ZOrthop Ihre Grenzgeb,1999,137(1):67-75.
[6]刘弼,肖德明,雷鸣,等.白藜芦醇对硝普钠诱导的软骨细胞凋亡bax及bcl-2表达的影响.中国矫形外科杂志,2012,20(13):1235-1238.
[7]Chang CH,Hsu YM,Chen YC,etal.Anti-inflammatory effects of hydrophilic and lipophilic statins w ith hyaluronic acid against LPS-induced inflammation in porcine articular chondrocytes.JOrthop Res,2014,32(4):557-565.
[8]Suri P,Morgenroth DC,Hunter DJ.Epidemiology of osteoarthritis and associated comorbidities.PM R,2012,4(5 Suppl):S10-S19.
[9]Krasnokutsky S,Attur M,PalmerG,etal.Current concepts in the pathogenesis of osteoarthritis.Osteoarthritis Cartilage,2008,16 Suppl3:S1-S3.
[10]van den BergWB.The role of cytokinesand grow th factors in cartilage destruction in osteoarthritis and rheumatoid arthritis.ZRheumatol,1999,58(3):136-141.
[11]张亚峰,王骏飞,陈东阳,等.核因子κB信号转导途径在大鼠实验性骨性关节炎软骨细胞中被激活.中国临床康复,2006,10(37):71-73.
[12]LeiM,Liu SQ,Liu YL.Resveratrol protects bonemarrow mesenchymal stem cell derived chondrocytes cultured on chitosan-gelatin scaffolds from the inhibitory effectof interleukin-1beta.Acta Pharmacol Sin,2008,29(11):1350-1356.
[13]Torzilli PA,Bhargava M,Park S,etal.Mechanical load inhibits IL-1 induced matrix degradation in articular cartilage.Osteoarthritis Cartilage,2010,18(1):97-105.
[14]Agarwal S,Long P,Seyedain A,etal.A central role for the nuclear factor-kappaB pathway in anti-inflammatory and proinflammatory actions of mechanical strain.FASEB J,2003,17(8):899-901.
[15]Bhatia M,Moochhala S.Role of inflammatorymediators in the pathophysiology of acute respiratory distress syndrome. JPathol,2004,202(2):145-156.
Resveratrol inhibits theexpression of inflammatory cytokines in cartilage cells through NF-κB signaling pathway*
YUAN Hao,ZENG Hui**,XIAODem ing,YU Fei,LIN Jianjing
(Departmentof Orthopedics,Peking University Shenzhen Hospital,Guangdong 518036,China)
2095-9958(2016)02-0075-05
10.3969/j.issn.2095-9958.2016.01-15
国家自然科学基金资助项目(81272032);深圳市科创委资助项目(JCY20130402114702130)
**
曾晖,E-mail:zenghui_36@163.com

