婴儿纤维性错构瘤7例临床及病理分析
常艳华,陈 勇,梁加贝,陈文凯,杨树东
婴儿纤维性错构瘤7例临床及病理分析
常艳华1,陈勇2,梁加贝1,陈文凯1,杨树东1
错构瘤;软组织肿瘤;纤维瘤;肿瘤/病理学
婴儿纤维性错构瘤(fibrous hamartoma of infancy,FHI)是一种少见的婴幼儿表浅软组织肿瘤,多见于2岁以内的婴幼儿,约15%~25%的患儿出生时即被发现,偶见于年龄较大的儿童,但不发生在青春期后[1]。目前,其发病机制尚不清楚,多数认为是胚胎发育不良或错构瘤性良性间质源性病变[2];临床上较为罕见,仅占良性软组织肿瘤的0.02%[3]。2008年1月~2015年12月,笔者医院共诊治7例FHI,现回顾性分析其临床资料,并报道如下。
1 临床资料
1.1一般资料FHI手术标本7例,男性4例,女性3例,患者的年龄及肿块的部位、质地、边界及皮肤改变见表1。肿块均为单发,临床表现为皮下及真皮内结节,无红、肿、热、痛,无皮肤破溃及渗出,术前无一例确诊。7例均由2位副主任以上的病理医师重新阅片,并与皮肤科高年资医师讨论确诊。
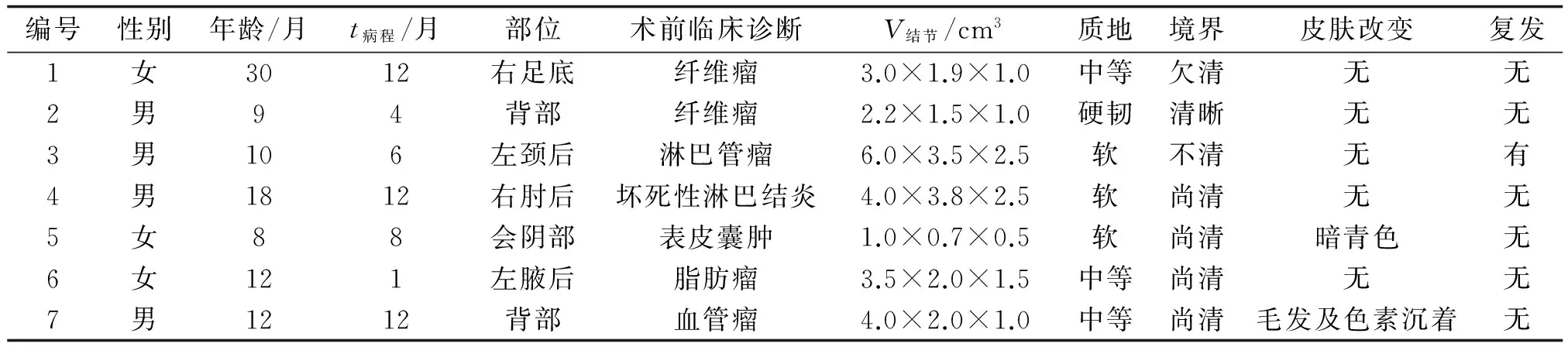
表1 7例FHI患儿的临床特点
1.2方法7例均行手术治疗,手术切除标本经4%中性福尔马林固定24 h,常规石蜡包埋,4 μm厚连续切片,常规H-E染色,光镜下观察其组织病理学特点。免疫组织化学采用EnVison两步法,DAB染色。一抗包括vimentin、S-100、SMA、MSA、Desmin、CD68、CD34、Bcl-2及Ki-67(福州迈新生物技术开发有限公司)。Ki-67阳性定位于细胞核,S-100阳性定位于细胞核/质,SMA阳性定位于细胞膜,CD68、Desmin、vimentin及MSA阳性定位于细胞质,Bcl-2及CD34阳性定位于细胞膜/质。7例患者均以电话方式随访。
1.3结果
1.3.1病理检查结果7例中,除1例(编号3)于术后5月复发外,其余均治愈,随访至今未见复发。肿瘤平均最大径为3.4 cm(1.0~6.0 cm),切面灰白、灰黄色;境界尚清者5例,不清者2例。镜下7例组织形态相似,由成熟的脂肪组织、致密的纤维组织及原始间叶组织构成,3种成分以不同比例构成器官样结构(图1A)。部分病变与肌肉组织粘连,镜下见肿瘤的脂肪组织及原始间叶组织伸至周围正常肌肉组织中,并见少量炎症细胞浸润(图1B,编号3)。大部分肿瘤以成熟脂肪组织为主,内见疏松黏液样基质,并见1例伴有皮肤改变者(编号7),镜下表现为肿块内有增生的毛囊及汗腺组织,肿块表面皮肤基底层见黑色素沉着(图1C~E)。另有1例非真正意义上皮肤改变者(编号5),镜下示肿瘤组织内血管增生、部分血管扩张、充血(图1F)。
1.3.2免疫组织化学检查结果vimentin在FHI的3种成分中呈均呈阳性表达;S-100在成熟脂肪组织中呈阳性表达;Bcl-2在部分病例的梭形细胞成分中呈阳性表达;SMA在部分病例的纤维组织成分特别是胶原化的纤维组织中呈阳性表达;CD34在不成熟的原始间叶细胞成分中呈阳性表达。7例均不表达Desmin、MSA、CD68。Ki-67的增殖活性较低,主要表达于不成熟的原始间叶细胞成分中,约5%的细胞为阳性(图2)。
2 讨 论
2.1临床特点FHI好发于2岁以内的儿童,平均发病年龄为10月,多发于男孩,无家族史。肿块最常见于肩部、腋窝和上臂,几乎都是单发。临床表现为皮下或真皮内结节,可被推动,但境界不清,一般无红、肿、热、痛症状,无皮肤破溃及渗出,偶与下方粘连或累及骨骼肌者才会表现出相应的症状。结节质地及影像学改变与其病理组织成分密切相关。肿块最大径一般<5 cm,偶有最大径>10 cm的报道[4]。FHI在患儿5岁前生长较快,以后生长速度逐渐减缓,但肿块并不会自行停止生长或消失[5]。
极少数FHI伴有皮肤变化,包括汗腺腺体增加、肿块表面皮肤色素增加以及体毛增多[6]。本研究7例中,1例皮肤呈暗青色(编号5),显微镜下并未见皮肤表皮及附属器的变化,故并非真正意义上的皮肤改变,其皮肤色泽的改变考虑与皮下肿瘤组织中血供丰富有关。编号7为唯一1例FHI伴有皮肤改变者,显微镜下示肿块内有增生的毛囊及汗腺组织、毛囊周围原始间叶细胞增生,这可能是诱导肿块表面皮肤毛发增生的原因;另外,肿块表面皮肤基底层可见黑色素沉着,所以肿块表面皮肤颜色略加深。
2.2诊断因FHI患儿无典型的临床表现和特异的辅助检查,临床上常被诊断为肿大的淋巴结、脂肪瘤、血管瘤及其他浅表软组织肿瘤。术前易误诊,诊断主要依靠病理检查。组织学上,FHI由3种成分混合构成特征性器官样结构:(1)梁状交叉排列的富含胶原的纤维组织:细胞呈梭形,细胞核狭长或波浪状,或不规则形,胶原成分多少不等,其内可见散在的炎细胞浸润;(2)富含黏液基质的原始间叶细胞岛:呈巢状或漩涡状排列,细胞呈星形及卵圆形,核深染,胞质少;(3)成熟脂肪组织:灶状或片状分布,有时可为病变的主要成分。细胞异型性及核分裂像罕见。因FHI具有典型的形态学特征,诊断上多无需免疫组织化学支持。但3种成分在不同病例的比例不同,发生年龄越小,肿瘤组织中未分化的原始间叶细胞成分含量就相对越多;发生于较大婴幼儿或儿童时,未分化的原始间叶成分较少,诊断较困难,需要多取材,并仔细寻找每种成分,必要时需行免疫组织化学进一步确定肿瘤中所包含的各种成分,进而明确诊断。
2.3鉴别诊断(1)脂肪瘤:好发于40~60岁体形肥胖的男性,儿童少见,分为浅表性和深部脂肪瘤,为缓慢生长的无痛性肿块,界清,多有菲薄的纤维性包膜,呈球形、类圆形、结节形或分叶状,直径多<5 cm,切面呈淡黄色或黄色,质软。镜下表现:由成熟的脂肪细胞组成,与周围正常脂肪组织相似;瘤细胞排列紧密,并由纤维间隔分成大小不等的小叶。免疫组织化学结果显示S-100阳性。(2)脂肪纤维瘤病:好发于婴幼儿,发病的年龄为1岁(11 d~12岁),男性多见。临床表现为局部缓慢生长的无痛性肿块,外形不规则,周界不清,直径1~7 cm,切面呈黄色或灰白色,质地坚韧,常可见脂肪组织。镜下表现:内含大量脂肪组织,其间可见穿插的条索状纤维结缔组织,内可见少至中等量的胶原纤维,少数病例可伴有黏液样变性。免疫组织化学结果:梭形细胞表达vimentin,灶性表达CD34、Bcl-2、S-100、actins或CD99。(3)婴儿纤维瘤病:发生于8岁以内,尤以1~2岁多见,男性略多见。常发生于肌肉筋膜内,生长迅速,触之质地坚实,边界不清,无包膜,1~10 cm,切面灰白色,质地坚实,瘢痕样。分弥漫型和韧带样型2种类型,弥漫型由排列杂乱的小细胞或短梭形细胞组成,韧带样型由束状排列的较成熟的纤维母细胞组成[7]。vimentin阳性,不同程度表达α-SMA、MSA及Desmin,S-100及CD34阴性。(4)婴幼儿肌纤维瘤病:多发生于新生儿和婴幼儿,80%的病例<2岁,有家族倾向。肿块多发生于头颈部皮肤,可延伸至皮下、肌肉和骨骼,偶可位于骨内,无包膜,直径多数为0.5~1.5 cm,质地坚实,瘢痕样,切面呈灰白色,中央常有黄色坏死区或囊性变区。镜下表现:具有明显的区带现象,周边区由结节状或短束状排列的胖梭形细胞组成,中央区由圆形或多边形的间叶细胞组成。肿瘤的间质呈纤维黏液样,可伴有胶原化或玻璃样变性。肌纤维母细胞性成分和原始间叶细胞性成分均可表达vimentin和α-SMA,肌纤维母细胞性成分还可表达MSA,不表达Desmin和S-100。(5)血管瘤:多见于儿童,常发生在生后数年内。可发生于任何部位,但好发于头面部,尤以口唇及眼睑部为多见。病变隆起于皮肤,边界清晰,鲜红色或紫红色,直径数毫米至2~3 cm,加压不褪色,也不缩小。瘤体由大小不等的血管构成,瘤内血管自成体系,不与周围血管相连。血管内皮细胞CD34阳性,平滑肌细胞SMA阳性。(6)婴儿型纤维肉瘤:发生于2岁以下,男性略多见[8]。临床上表现为生长迅速的无痛性肿块,肿块巨大时可取代一侧肢体。肿块周界不清,分叶状,常浸润至邻近的软组织,直径2~30 cm,切面呈灰白色或淡红色,体积较大者中央可伴有出血和坏死。镜下表现:多数病例肿瘤由交织条索状或鱼骨样排列的梭形细胞组成;少数病例由较为原始的小圆形或卵圆形细胞组成。肿瘤的局部区域内也可见到所谓的血管外皮瘤样排列结构。瘤细胞主要表达vimentin,33%的病例表达α-SMA,29%表达MSA,一般不表达Desmin及CD34。
2.4治疗及预后FHI在临床上呈良性经过,但由于其界限欠清,手术切除不彻底时术后可能复发。对于未完整切除的肿瘤,复发率为15%~16%[9]。本研究7例中,1例(编号3)于术后5月复发。该病例肿块位于左颈后,与周围组织分界不清,镜下见肿瘤组织伸入到周围肌肉组织中,使得临床无法完整切除,这可能是复发的原因。该患者复发后再次入院行肿块切除术,该次手术扩大切除范围,并切除部分项脊肌,术后1~3年电话随访均未复发。因此,该类肿瘤应在术前行超声检查以了解病灶的范围和浸润深度,术中应沿肿瘤外缘0.5~1 cm处尽可能地切除肿瘤,从而降低肿瘤的复发率。由于该病总体预后良好,延期手术不会增加手术并发症的风险,应避免侵袭性治疗[10]。
[1]葛鹏,邹文远,李胜.骶尾部婴儿纤维性错构瘤1例[J].医学影像学杂志,2015,25(6):1051.
[2]Fletcher C D,Bridge J A,Hogendoom P C,et al.WHO classification of tumors of soft tissue and bone[M].Lyon:France:IARC Press,2013:279-280.
[3]Atesok K I,Alman B A,Schemitsch E H,et al.Osteoid osteoma and osteoblastoma[J].J Am Acad Orthop Surg,2011,19(11):678-689.
[4]张楠,郑文涛,周春菊.巨大婴儿纤维性错构瘤临床病理观察[J].中国病案,2012,13(12):48-50.
[5]Yu G J,Wang Y B,Wang G Q,et al.Fibrous hamartoma of infancy:a clinical pathological analysis of seventeen cases[J].Int J Clin Exp Pathol,2015,8(3):3374-3377.
[6]F-Eire P,Fojon J G.Cutaneous changes in fibrous hamartoma of infancy[J].Indian J Dermatol,2013,58(2):160.
[7]赖日权,王蔚.婴幼儿和儿童软组织中间型肿瘤的病理诊断[J].临床与实验病理学杂志,2014,30(11):1282-1286.
[8]Fletcher C D M,Bridge J A,Hogendoorn P C W,et al.World Health Organization classification of tumous.Pathology and genetics of tumours of soft tissue and bone[M].Lyon:IARC Press,2013:74-76.
[9]张莉,安会波,王青霞.婴儿纤维性错构瘤1例[J].临床与实验病理学杂志,2012,28(4):466-467.
[10]张明,张蔚,曲建力,等.婴儿纤维性错构瘤一例[J].中华病理学杂志,2011,40(7):489-490.
(编辑:何佳凤)
2016-03-23
南京医科大学 附属无锡市人民医院,无锡214023 1.病理科;2.肾内科
常艳华(1981-),女,主治医师,医学硕士
杨树东.Email:ysd-zh@163.com
R365;R739.5;R726.1
B
1672-4194(2016)04-0272-03

