分子光谱法研究槲皮苷与DNA的相互作用
乔春玉,张重越,孙艳涛,闫 鹏,肖 雪,朱传勇
(1.黑龙江工程学院 材料与化学工程学院,哈尔滨 150050;2.黑龙江中医药大学 附属第一医院 病理科,哈尔滨 150040;3.吉林师范大学 化学学院,吉林 四平 136000)
分子光谱法研究槲皮苷与DNA的相互作用
乔春玉1,张重越2,孙艳涛3,闫鹏1,肖雪1,朱传勇1
(1.黑龙江工程学院 材料与化学工程学院,哈尔滨 150050;2.黑龙江中医药大学 附属第一医院 病理科,哈尔滨 150040;3.吉林师范大学 化学学院,吉林 四平 136000)
以溴化乙锭(EB)做为DNA的荧光探针,研究了黄酮类化合物——槲皮苷与DNA的相互作用。实验结果表明,离子强度对槲皮苷与DNA的结合常数有一定的影响。在15 ℃、25 ℃、35 ℃和45 ℃时的Stern-Volmer曲线说明了槲皮苷对DNA荧光猝灭的过程。通过计算得到了在不同温度时二者的结合常数,以及相对应的热力学常数ΔH、ΔG和ΔS。
槲皮苷;DNA;荧光猝灭;结合常数
DNA(脱氧核糖核酸),是生物体主要的遗传物质。许多小分子能与DNA发生相互作用,从而传递遗传信息,控制生物体的形态和生理特性,进而影响DNA的复制。因此研究小分子药物与DNA的结合机理,了解其作用方式,对于DNA靶向药物的结构设计具有一定的科学意义[1]。黄酮类化合物(flavonoids)在自然界分布较广泛,其分子中具有2-苯基色原酮(flavone)结构,其羟基衍生物多呈现黄色,故又称黄碱素或黄酮。大多数植物体内都含有黄酮类化合物,它在植物的生长、发育、开花、结果以及抗菌防病等方面起着重要的作用[2],其中槲皮苷(quercitrin,分子结构式见图1(a))具有较好的祛痰、止咳、平喘、抗菌活性和一定的平喘作用,以及抗肿瘤作用和抗血小板聚集作用。利用溴化乙锭(EB,图1(b))做探针,通过光谱法对槲皮苷与DNA的结合机制进行了研究。
1 实验部分
1.1试剂和仪器
鲑鱼精DNA(美国Sigma化学公司);溴化乙锭(长春宝泰克公司, 5.00 mL/mg);槲皮苷(中国药品与生物制品质量检定所)。本实验用NaCl溶液调节溶液的离子强度。
DNA储备液(4.50×10-4mol/L);EB储备液(7.34×10-5mol/L);槲皮苷(1.00×10-3mol/L的乙醇储备液)。用pH 7.4的Britton-Robinson 缓冲溶液来控制反应体系的pH值。
荧光光度计(日本岛津公司,RF-5301 PC);数字酸度计(杭州东兴仪器厂,pHS-3C)。
1.2实验方法
1.2.1DNA与EB的结合
在pH值为7.4的BR缓冲溶液中,对一定量的DNA溶液在有无EB情况下扫描荧光光谱。扫描波长为530~700 nm。
1.2.2荧光性质的研究
向一定浓度的EB溶液中依次加入不同量的DNA溶液,并记录荧光强度值。进而确定DNA与EB在溶液中的最佳比值。
按照DNA与EB的最佳浓度比,在含有一定量DNA-EB溶液的试管中,加入一系列含有不同浓度的槲皮苷溶液,并用缓冲溶液稀释至5.0 mL,混合均匀并恒温后,分别测定在15 ℃,25 ℃,35 ℃和45 ℃时的荧光光谱。
1.2.3离子强度的影响
首先保持NaCl的浓度不变,对一系列含有不同浓度的槲皮苷和恒定浓度的DNA-EB的溶液进行荧光测定;然后改变NaCl在溶液中的浓度,其他条件不变,再进行测定。
2 结果与讨论
2.1EB与DNA的结合性质
研究证实,许多小分子都是DNA灵敏的探针[3-5],溴化乙锭是一种高度灵敏的荧光染色剂,具有高选择性。EB含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团,它与DNA的结合几乎没有碱基序列特异性。EB是研究DNA性质时比较常用的探针分子,许多文献也曾报道过EB与DNA的结合性质[6-7]。
EB与DNA反应的荧光光谱图见图2。由于DNA的内源荧光很弱,这就导致直接利用DNA的荧光性质进行研究受到限制(图2(a))[8]。在所选择的浓度下,曲线EB的荧光强度也很弱(图2(b)),而将EB加入到DNA溶液中,体系的荧光强度得到显著增强(图2(c))。
2.2槲皮苷与DNA的结合
2.2.1荧光性质的研究
实验首先探讨了EB与DNA的浓度比,固定混合溶液中EB的浓度,改变DNA浓度进行荧光测定。结果见图3。由图3可见,荧光强度随着DNA浓度的增加而逐渐增强。当DNA的浓度高于40.00 μmol/L时,体系的荧光强度趋于平缓,这表明此时EB与DNA的结合趋于饱和状态。根据此结果并结合本实验所需,对于2.95 μmol/L的EB,选择DNA的浓度27.00 μmol/L。

图2 DNA(a),EB(b)和DNA-EB(c)的荧光谱图Fig.2 Fluorescence spectrum of DNA (a), EB(b) and DNA-EB(c)

图3 DNA浓度与EB的荧光光谱Fig.3 Fluorescence intensity of EB with increasing concentration of DNA
在上述实验条件下,分别测定DNA-EB体系在加入不同量槲皮苷前后的荧光谱图,结果见图4。

图4 槲皮苷存在时DNA-EB的荧光光谱Fig.4 Fluorescence spectra of DNA-EB in presence of quercitrin
由图4可见,槲皮苷加入后DNA-EB体系的荧光峰的位置几乎不变,而荧光强度则有规律地降低。诱导荧光猝灭的过程通常分为通过碰撞和荧光团与猝灭剂形成复合物,也就是通常所说的动态猝灭和静态猝灭[9]。一般情况下,可以根据猝灭常数随温度的变化来区别动态与静态猝灭。其中动态猝灭是由于荧光物质的激发态分子之间通过碰撞而产生相互作用的过程,此情况下随温度的升高,粒子间有效碰撞的数目将增加,从而加剧了电子的转移,使荧光物的猝灭常数会增大。但静态猝灭升高温度时,复合物的稳定性将会降低,猝灭常数也会减小。因此可利用改变温度的方法来判断猝灭的机理。因此,为了判断反应的猝灭机制,先假设槲皮苷对DNA-EB体系的猝灭过程是动态猝灭,其作用过程遵循Stern-Volmer方程[10-11]:
(1)
式中Kq为荧光猝灭速率常数,L/(mol·s),各类猝灭剂对生物大分子的最大扩散速率常数为2.0×1010L/(mol·s)[12];[Q]为猝灭剂的浓度;F0和F分别为猝灭剂不存在和存在时体系的荧光强度;τ0为猝灭剂不存在时荧光分子的平均寿命,生物大分子的荧光平均寿命约为10-8s[13];KD为动态猝灭常数,即Stern-Volmer猝灭常数,L/mol。
为了避免槲皮苷在激发波长与发射波长处产生吸收带来的影响,测试得到的所有荧光数据均按下式进行校正[14]:
(2)
式中F为实验测得的荧光强度值;FE为校正后的荧光强度值;A和A′分别为在激发波长与发射波长处槲皮苷的吸光度。不同温度下槲皮苷猝灭DNA-EB体系荧光的Stern-Volmer曲线见图5。
由图5可见,温度升高,猝灭常数K值反而降低了,表明槲皮苷与DNA-EB二者之间的猝灭不是动态猝灭。此外通过计算还得到,25 ℃时槲皮苷的扩散速率常数Kq是3.23×1012L/(mol·s),远大于扩散控制的最大碰撞猝灭速率常数2.0×1010L/(mol·s),综上所述,槲皮苷对DNA-EB体系的荧光猝灭是源于两者之间形成了复合物,即静态猝灭过程。
利用静态猝灭公式[15]:
(3)
式中KP为荧光体与猝灭剂的解离常数,与结合常数KB互为倒数,即KB= 1/KP。利用静态猝灭公式得到不同温度时的双倒数Lineweaver-Burk图,斜率KPF0-1与截距F0-1之比为KP,进而得到结合常数KB。不同温度下槲皮苷与DNA-EB体系以1/(F0-F)对[Q]-1做的一元拟合见图6。得到的相应结合常数KB见表1。

图5 在不同温度时槲皮苷-DNA-EB的Stern-Volme曲线Fig.5 Stern-Volmer curves of quercitrin-DNA-EB, respectively

图6 不同温度时槲皮苷的1 / (F0 - F) 对[Q]-1曲线Fig.6 Plots of 1/(F0-F) versus [Q]-1 for quercitrin at various temperatures

Drug15℃KB/(L·mol-1)r25℃KB/(L·mol-1)r35℃KB/(L·mol-1)r45℃KB/(L·mol-1)rquercitrin2.25×1040.99935.96×1040.99966.85×1040.99961.12×1050.9998
由表1可见,槲皮苷与DNA-EB的结合常数随着温度的升高而增加,这说明他们与DNA的结合都是吸热的反应。
2.2.2热力学参数的测定
小分子与DNA间的作用属于分子间的弱相互作用,包括静电作用、氢键、范德华力和疏水作用等几种。可根据不同温度时结合体系的热力学参数,确定其主要作用力。当ΔH≤0,ΔS>0时,主要为静电引力;ΔH>0,ΔS>0时,主要是疏水作用力;ΔH<0,ΔS<0时,主要为范德华力或者氢键作用力[16]。实验测定了不同槲皮苷与DNA-EB体系的结合常数。式(5)和式(6)反映了焓变、自由能变和熵变的关系:
(5)
(6)
计算得到25 ℃时槲皮苷与DNA-EB反应的ΔH、ΔG、ΔS见表2。

表2 槲皮苷与DNA-EB结合反应的热力学参数(25 ℃)
由表2可见,槲皮苷与DNA-EB体系的焓变大于零,说明该结合反应是吸热反应。这与前面的结论是一致。此外,槲皮苷与DNA结合体系的焓变和熵变均大于零,说明槲皮苷与DNA-EB之间的主要作用力是疏水作用。
2.2.3与变性DNA结合的研究
本实验还研究了槲皮苷与变性DNA(即单螺旋DNA)的结合作用。DNA的双螺旋之间是以氢键连接的,DNA变性是指DNA双螺旋碱基对的氢键断裂,双链变成单链,从而使DNA的天然构象和性质发生改变。变性时维持双螺旋稳定性的氢键断裂,碱基间的堆积力遭到破坏。凡能破坏双螺旋稳定性的因素,如加热、极端的pH、有机试剂甲醇、乙醇、尿素及甲酰胺等作用下,均可引起DNA分子的变性。本实验是采用加热的方法得到变性的DNA,然后在与前面相同实验条件下,分别测槲皮苷与单螺旋DNA的结合常数,比较结果见表3。
由表3可见,槲皮苷与单螺旋DNA的结合常数小于与双螺旋的结合常数。说明槲皮苷与DNA的结合程度与DNA的结构有关,DNA经过变性处理后,双螺旋结构被破坏,双链打开变成没有规律的单链。嵌入式结合的槲皮苷无法再与DNA结合在一起,从而表现为结合常数KB减小了。
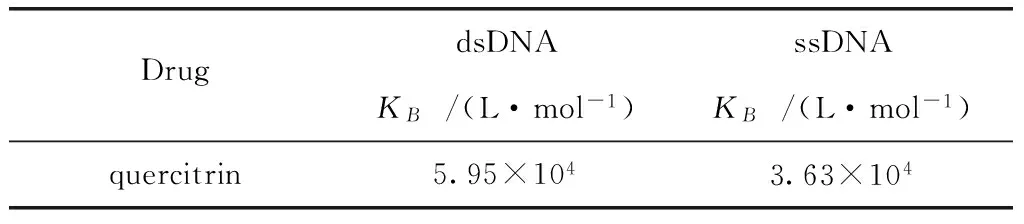
表3 25 ℃时槲皮苷与DNA-EB的结合常数
2.2.4离子强度的影响
实验还利用NaCl来调节体系中的离子强度,测定了离子强度对槲皮苷与DNA-EB结合体系的荧光影响,结果见表4。

表4 NaCl浓度对槲皮苷与和DNA结合常数的影响(25 ℃)
由表4可见,随着NaCl浓度的增加,槲皮苷与DNA的结合能力逐渐减弱。由于NaCl不是DNA的阴离子猝灭剂,它对DNA的影响来自于离子强度[17]。由此判断影响槲皮苷与DNA结合能力的主要是体系中的离子强度。由于DNA骨架是带负电的,带正电荷的钠离子会被DNA分子中的磷酸根所吸引,从而减小了DNA磷酸骨架的静电斥力,DNA双链结构就会变得更加紧凑。这样导致槲皮苷较难再插入到DNA碱基对之间,对DNA-EB体系的荧光猝灭作用也减小。这也说明了槲皮苷与DNA-EB体系的结合方式是嵌入式结合。
3 结 论
选择溴化乙锭作为DNA的荧光探针,研究了槲皮苷对DNA的荧光猝灭过程的性质,计算得到二者的结合常数。文章通过探讨槲皮苷与DNA的结合机制,并且通过单螺旋DNA和离子强度的影响等实验的研究,推测槲皮苷与DNA的主要结合方式是嵌入式结合。
[1]Bi S Y, Wang Y, Pang B, et al. An investigation on the interaction of DNA with hesperetin/apigenin in the presence of CTAB by resonance Rayleigh light scattering technique and its analytical application [J]. Spectrochimica Acta Part A. 2012, 90: 158-164.
[2]Zhou W T, Yiming W L, Ma H, et al. Anti-hypertensive effect of total flavonoids of cydonia oblonga leaves and its mechanism based on anti-inflammatory function [J]. Zhong Yao Cai, 2015, 38(10): 2134-2138.
[3]Hu Y, Lin F, Wu T, et al. Fluorescently Sensing DNA Triplex Assembly Using an Isoquinoline Alkaloid as Selector, Stabilizer, Inducer, and Switch-on Emitter [J]. Chem Asian,2016,11(14):2041-2048.
[4]Liu K, Shang H, Kong X, et al. A novel near-infrared fluorescent probe for H2O2in alkaline environment and the application for H2O2imaging in vitro and in vivo [J]. Biomaterials, 2016, 100: 162-17.
[5]Miao Y B, Ren H X, Gan N, et al. A homogeneous and "off-on" fluorescence aptamer-based assay for chloramphenicol using vesicle quantum dot-gold colloid composite probes [J]. Anal Chim Acta, 2016, 929: 49-55.
[6]Mardanya S, Karmakar S, Mondal D, et al. Homo- and heterobimetallic ruthenium(II) and osmium(II) complexes based on a pyrene-biimidazolate spacer as efficient DNA-Binding probes in the near-infrared domain [J]. Inorg Chem.,2016, 55(7): 3475-3489.
[7]Liu H, Dong Y, Wu J, et al. Evaluation of interaction between imidazolium-based chloride ionic liquids and calf thymus DNA [J]. Science of the Total Environment, 2016, 566-567: 1-7.
[8]肖崇厚. 中药化学 [M]. 上海:上海科学技术出版社,1997.
[9]Lakowitcz J R. Principles of Fluorescence Spectroscopy [M]. New York: Plenum Press, 1999:237-259.
[10] Chen G Z, Huang X Z, Xu J G, et al. The methods of fluorescence analysis, 2nd ed. [M]. Beijing: Science Press, 1990:112.
[11] Dewey T G (Ed.). Biophysical and biochemical aspects of fluorescence spectroscopy [M]. New York: Plenum Press, 1991:1-41.
[12] Qiao C, Bi S, Sun Y, et al. Study of interactions of anthraquinones with DNA using ethidium bromide as a fluorescence probe [J]. Spectrochim Acta A Mol Biomol Spectrosc,2008, 70(1): 136-143.
[13] Chen S, Hong Y, Zeng Y, et al. Mapping live cell viscosity with an aggregation-induced emission fluorogen by means of two-photon fluorescence lifetime imaging [J]. Chemistry,2015, 21(11): 4315-4320.
[14] Steiner R F, Weinryb L. Excited states of protein and nucleic acid [M]. New York: Plenum Press, 1971:40.
[15] Bi S, Zhang H, Qiao C, et al. Studies of interaction of emodin and DNA in the presence of ethidium bromide by spectroscopic method [J]. Spectrochimica Acta Part A,2008, 69(1): 123-129.
[16] Bi S, Qiao C, Song D, et al. Study of interactions of flavonoids with DNA using acridine orange as a fluorescence probe [J]. Sensors and Actuators B,2006, 119: 199-208.
[17] Sun Y, Bi S, Song D, et al. Study on the interaction mechanism between DNA and the main active components in Scutellaria baicalensis Georgi [J]. Sensors and Actuators B, 2008, 129(2): 799-810.
Interactions of quercitrin with DNA by molecular spectrometry
QIAO Chun-Yu1, ZHANG Chong-Yue2, SUN Yan-Tao3, YAN Peng1, XIAO Xue1, ZHU Chun-Yong1
(1.DepartmentofMaterialandChemicalEngineering,HeilongjiangInstituteofTechnology,Harbin150050,China; 2.DepartmentofPathology,FirstAffiliatedHospitalofHeilongjiangUniversityofChineseMedicine,Harbin150040,China; 3.CollegeofChemistry,JilinNormalUniversity,Siping136000,Jilin,China)
Binding of flavonoids, using quercitrin to fish sperm deoxyribonucleic acid (DNA) was studied by using Ethidium Bromide (EB) as a fluorescence probe. The experimental results indicated that the ionic strength had effect on the binding of quercitrin and DNA. Stern-Volmer plots at 15 ℃, 25 ℃, 35 ℃ and 45 ℃ showed that the quenching of fluorescence by quercitrin was a combined quenching process. The apparent binding constantKAat different temperatures and the corresponding thermodynamic parameters ΔH, ΔGand ΔSwere obtained.
Quercitrin; DNA; fluorescence quenching; binding constant
10.13524/j.2095-008x.2016.03.040
2016-06-15
黑龙江省教育厅科学技术研究项目(12541674);国家自然科学基金资助项目(51102081);黑龙江工程学院博士基金项目(2010BJ13)
乔春玉(1980-),女,黑龙江齐齐哈尔人,讲师,硕士,研究方向:光谱化学分析,E-mail:jingjing_3939@sina.com。
O657.3
A
2095-008X(2016)03-0047-06

