CREB辅活因子CRTC2在调节糖、脂代谢及应激反应中的作用
李慧阁傅力
1天津医科大学生理与病理生理学系(天津30070)
2黄淮学院(河南驻马店463000)
CREB辅活因子CRTC2在调节糖、脂代谢及应激反应中的作用
李慧阁1,2傅力1
1天津医科大学生理与病理生理学系(天津30070)
2黄淮学院(河南驻马店463000)
CREB;AMPK;糖异生;自噬;胰岛素抵抗
CRTCs(又名TORC,transducer of regulated CREB)是于2003年利用基因组高通量筛选技术首次被发现的一个调节CREB(cAMP反应元件结合蛋白)转录因子活性的真核蛋白家族[1]。现已证实,功能性CRTCs基因广泛存在于果蝇、线虫、鼠及人类中。哺乳动物的CRTCs家族以3种在N端高度同源亚型形式存在,即CRTC1、CRTC2和CRTC3。高度保守的卷曲-螺旋结构域是该家族的结构特征,能与CREB的碱性亮氨酸拉链结构域(bZIP)相结合,可能涉及CREB依赖性转录调控的生理过程[2]。CRTC1在脑部高表达;CRTC2和CRTC3在组织中普遍表达,其中CRTC2主要分布于肌肉和肝脏,部分脑区亦有少量表达;CRTC3则在淋巴细胞和肺组织分布,肌肉、肝脏、胰腺、肠道等消化系统中呈低水平表达[3,4]。不同的细胞定位及亚型具有功能差异性。CRTC2主要调节不同营养条件下肝脏和肌组织的糖、脂代谢。由于外周组织,尤其是肝脏和骨骼肌的葡萄糖摄取功能障碍在诱发肥胖、2型糖尿病(T2DM)等多种代谢性疾病及并发症中具有潜在作用,本文对CRTC2涉及糖、脂代谢调节及在不同应激反应中的作用与机制研究进展做一综述,为代谢相关疾病的防治提供新的理论依据。
1 CRTC2结构(图1)和活性调节
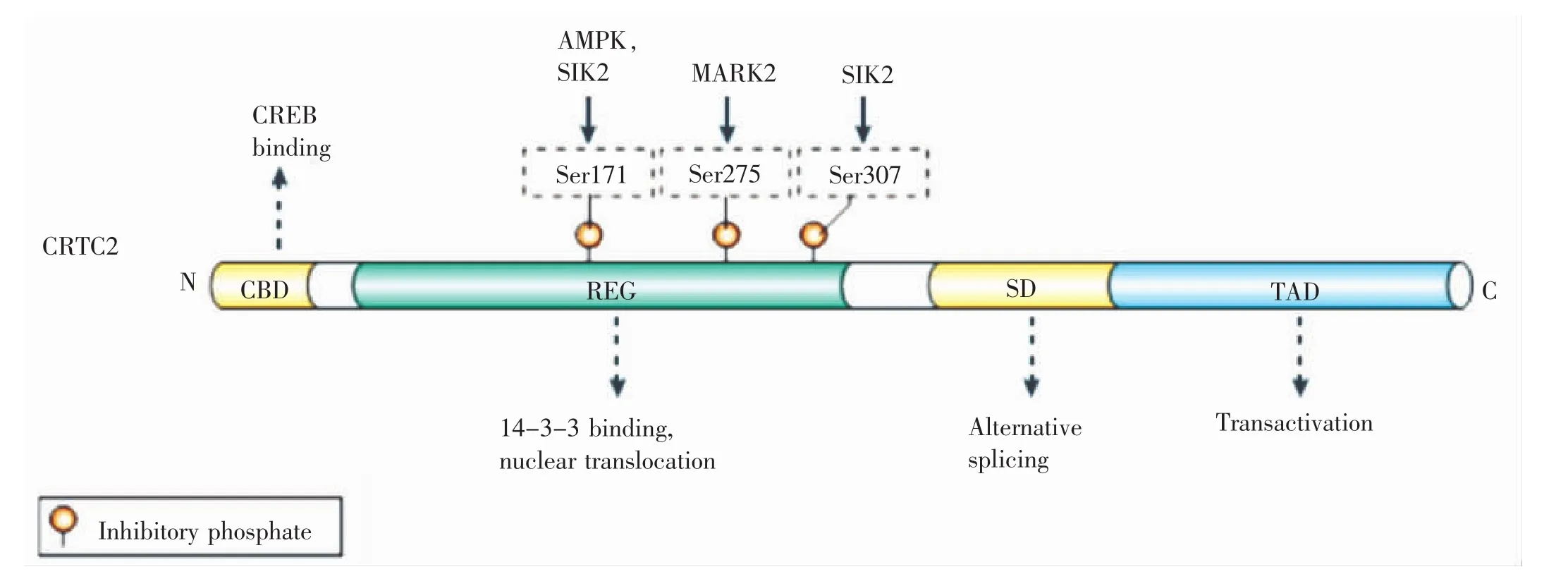
图1 CRTC2的结构[5]
CRTC2由693个氨基酸组成,N端为CREB的bZIP结合区,具有转录活性的C端结合转录激活因子并增强CREB的转录活性[5,6]。结构中丝氨酸富集提示CRTC2可能受多种激酶调节。现已证实CRTC2蛋白质的多个氨基酸位点可以被修饰,如被一磷酸腺苷激酶(adenosine monophosphate kinase,AMPK)和盐诱导激酶2(salt inducible kinase 2,SIK2)调节的Ser171位点、微管亲和调节激酶2(microtubule-affinity regulatingkinases,MARK2)调节的Ser307位点,SIK2依赖激活的Ser307位点的磷酸化状态与转录活性和其在核内定位关系密切。
CRTC2是空腹饥饿状态下血糖代谢的调控子。基础条件下,磷酸化的CRTC2与14-3-3蛋白结合,因核质穿梭受阻而以静息状态滞留于细胞质中,抑制肝糖输出。饥饿时胰高血糖素或cAMP升高,CRTC2去磷酸化与14-3-3蛋白解离,转移入核,募集、结合并激活CREB及其他转录因子,诱导cAMP-CREB-CRTC2信号途径依赖的糖异生相关酶编码基因的表达,如PEPCK,G6Pase和PGC-1α,促进肝糖输出[6,7]。
2 CRTC2在糖、脂代谢中的作用
2.1CRTC2与糖代谢调节
正常生理条件下,效应互为拮抗的胰岛素和胰高血糖素在多个水平上调节机体葡萄糖的生成和消耗。营养状况和激素信号分别通过磷酸酯酶和激酶共同协调CRTC2的转录效应。细胞外信号(如禁食、营养剥夺、激素等)刺激引起Ca2+和cAMP浓度升高,Ca2+可以激活钙调蛋白依赖的磷酸酯酶途径促进CRTC2发生去磷酸反应,而cAMP的积累通过抑制丝/苏氨酸激酶SIK2的活性而降低磷酸化效应,促使CRTC2去磷酸化,继而阻断CRTC2:14-3-3复合体活性,抑制CRTC2向核外输出,使核内CRTC2表达增加并活化,与CREB结合激活下游基因转录[7,8]。由此表明,作为细胞内能量感受器和营养剥夺应激反应调节分子,CRTC2通过细胞核质穿梭作用,在基因转录水平上整合了由营养和激素水平调节的细胞信号通路。但不同刺激如何选择性地利用不同通路的调控机制有待于探索。
除CREB外,CRTC2还与多种蛋白质相结合,如SIK2、CREB结合蛋白(p300/CBP)、E3泛素蛋白连接酶COP1抗体(COP1)等,协同调节肝糖生成过程[9,10]。在肝细胞中未激活的CRTC2持续被激酶SIK2及AMPK家族其他成员在Ser171和Ser307位点磷酸化,不能与核内CREB结合激活[8,11]。空腹饥饿时,胰高血糖素或cAMP增加使蛋白激酶A(PKA)磷酸化并抑制SIK2激酶,引起CRTC2去磷酸化,募集CREB与之结合并激活下游基因转录。另一方面胰岛素激活SIK2激酶,进而重新抑制CRTC2活性,通过COP1泛素化诱导的蛋白质降解促使CRTC2失活,从而有效抑制CREB下游基因的表达[12,13]。综上,通过蛋白质之间相互作用,CRTC2在基因转录水平对细胞外各种刺激的反应进行整合调节。
前期研究认为,细胞对源于神经、应激、激素及营养等的信号作出应答始于CREB与CBP的相互作用,并具有CREB上Ser133位点磷酸化的依赖性[14]。然而,目前基因组学分析表明CREB能与众多基因启动子区的CRE结合,但并不能激活相应基因转录,其中原因可能与CRTCs的机制有关。研究发现,HEK293T细胞中过表达CRTC1/CRTC2均诱导大量的cAMP反应性启动子活性,而对于不含cAMP应答元件的启动子,CRTCs的功能显著降低,提示CRTCs对含有cAMP应答元件的基因具有选择性调节作用[4]。多种激素和生长因子作用使细胞内cAMP积累而诱导CREB磷酸化,增加CRE下游基因转录,促进CREB与p300及CBP的结合,而CRTC2缺失使磷酸化的CREB不能诱导依赖于CRE的转录,且CRTC2与CREB的bZIP区结合不依赖于CREB Ser133位点磷酸化[6]。CRTC2敲除鼠CREB显著下降,在恢复CRTC2表达时被逆转[15],更进一步揭示CRTC2的潜在作用。
除以磷酸化/去磷酸化方式作为转录活性开启方式外,细胞内CRTC2活性还受乙酰化和泛素化方式调控[9,12]。CRTC2应答胰高血糖素转位入核后,去磷酸化形式在Ly628位点被CBP/p300乙酰化,而该位点被COP1的泛素化修饰作用被抑制,使CRTC2稳定性增加。禁食小鼠重新摄食后,胰岛素通过激活CRTC2的磷酸化和泛素化降解作用,抑制糖异生相关酶编码基因的表达。胰岛素还可以通过磷酸化蛋白激酶B(AKT)活化SIK2,致使CRTC2的Ser171磷酸化并向胞浆转移,不能持续在胞核内结合转录因子CREB,从而抑制糖异生过程;另外,重新进食促使SIK2磷酸化p300 Ser89位点,从而使CRTC2发生去乙酰化修饰且活性降低,随后在Ly628位点泛素化并经蛋白酶降解,抑制糖异生相关酶编码基因表达,使血糖下降[13]。Ly628是多种激酶的作用点,能够被p300/CBP识别并泛素化,这一方式引起CRTC2降解也是造成CRTC2活性下降的原因之一。研究认为尽管Ser89位点位于核受体反应区,包含与核受体结合的经典基序,但目前CBP/ p300位点磷酸化调控机制不详,与CRTC2活性调节联系尚不清楚[16,17]。此外,Yoon等[18]报道CRTC2 Ser171磷酸化缺陷过表达使糖异生相关酶编码基因的表达和肝糖输出增加,且饥饿小鼠肝脏中Ser/Thr磷脂酶PP4表达上调,推测该成分可能促进CRTC2的去磷酸化激活效应,然而应答胰高血糖素刺激无显著变化。因此,空腹饥饿和其他应激信号是如何选择性利用CRTC2活性调节发挥作用仍有待研究。
肝脏糖异生增加是机体对饥饿产生的适应性反应,而糖异生失调造成肝脏葡萄糖过度输出是糖尿病形成早期的表现之一。前期研究认为,AMPK在Ser171位点磷酸化CRTC2,阻滞其向核内转移定位,从而阻断下游信号通路的活性转导[12,19]。肥胖患者机体细胞内CRTC2功能亢进,T2DM患者胰岛素受体的失敏感性阻抑AKT2和SIK2的活性,导致CRTC2的活性及核内表达增加,从而增强糖异生效应。持续高血糖症诱导的Ser171糖基化修饰,阻断了SIK2对CRTC2磷酸化的抑制作用,加强CRTC2活性,加剧高血糖表型[13,20]。靶向CRTC2敲除小鼠肝糖异生作用减弱、空腹血糖浓度降低、肝甘油三酯和胆固醇含量下降,高脂诱导小鼠的胰岛素敏感性得到改善[15]。长期的持续性高血糖使患者的血糖控制更加钝化,部分通过细胞间蛋白质的O-糖基化修饰作用加强而引发胰岛素抵抗(IR)[21]。研究发现,肝细胞O-糖基化转移酶(OGT)过表达促进CRTC2 Ser171的磷酸化,诱导糖异生相关酶编码基因的高表达,糖基化修饰增加CRTC2活性,阻断其在该位点的磷酸化修饰,促使CRTC2-CREB结合而升高血糖,且CRTC2高糖基化修饰的小鼠机体肥胖易感性增加。由此认为,CRTC2蛋白O-糖基化修饰可能是加剧IR状态下机体高血糖的原因之一。而过表达去糖基化酶则显著降低肝细胞CRTC2的糖基化水平,有效控制高血糖症[20]。总之,伴随机体IR的高血糖症可能通过CRTC2的糖基化和激活糖异生相关转录因子作用促使肝糖输出。一次性阻断肝细胞CRTC2活性足以降低血糖和甘油三酯含量[10,13,22],基于其在糖异生调节中的多重生物学效应,提示CRTC2的活性控制可能是治疗高血糖的潜在靶点。
作为细胞能量和营养的感受器,AMPK通过影响细胞代谢的多个环节维持细胞能量供求平衡。值得注意的是,长期禁食或激烈运动使细胞能量下降,激发AMPK活性,通过磷酸化CRTCs抑制肝糖生成[8]。降血糖药物二甲双胍激活AMPK,间接抑制CRTCs的磷酸化而降低肝糖输出[8,19]。因此,激活AMPK可能是细胞能量下降抑制CRTCs活性,从而抑制糖异生和增加胰岛素敏感性的原因之一。然而二甲双胍的降糖效应在AMPKα1和AMPKα2双敲除小鼠中无显著变化,提示上游可能存在其他效应调因子[23]。
另有研究认为,饥饿早期CREB-CRTC通路促进肝糖异生可能是一过性的。哺乳动物NAD+依赖的组蛋白去乙酰酶(SIRT1)及其家族成员在热量消耗受限时被激活,具有调节糖、脂代谢的作用。长时间禁食引起CRTC2活性下降,机体可能通过SIRT1的去乙酰化及随后的泛素介导的降解作用,维持机体能量代谢平衡[24]。禁食和运动时骨骼肌中可能通过AMPK依赖方式促使SIRT1活性上升[25]。与此相应,持续禁食引起肝细胞SIRT1活性增加,随后CRTC2在Ly628发生乙酰化,通过COP1调控作用引起CRTC2的泛素化及蛋白酶降解[12]。尽管如此,有关CRTC2在机体葡萄糖稳态中的调节作用仍然存在争议。最近研究报道肝特异性CRTC2敲除后机体葡萄糖耐受表现正常[26]。此外,SIRT1还可能通过乙酰化作用增强其他因子(如FOXO1和PGC-1α)的活性表达,从而在持续禁食状态下维持肝糖异生过程[27,28]。
2.2CRTC2与脂代谢
在生物代谢过程中,糖类与脂类代谢可以通过一些中间产物相互联系与转化,高血糖往往与脂质代谢紊乱有关。CREB-CRTC途径是影响糖、脂代谢的共同途径。研究发现CRTC2及依赖钙调蛋白的磷酸酯酶参与调节卵泡激活激素(FSH)和转录生长因子β(TGF-β)而增加类固醇生成[29]。饥饿引起小鼠肝脏Ser/Thr磷脂酶PP4表达上调,推测该成分可能涉及机体对抗空腹饥饿介导CRTC2的去磷酸化激活而启动的一种细胞保护性应激机制[18]。脂肪组织中,营养缺失诱导SIK2 Ser587位点磷酸化并失活,促进CRTC2的Ser 171位点去磷酸化,促进CREB-CRTC2复合物募集到PGC-1α和解偶联蛋白1(UCP-1)基因的启动子,诱导PGC-1α和UCP-1基因的表达,进而促进糖异生基因表达[30]。
3 CREB-CRTC与胰岛β细胞功能
CREB-CRTC信号通路在转录水平上调节葡萄糖和肠促胰岛素的表达。研究发现胰高血糖素样肽1(GLP-1)在胰岛β细胞生成胰岛素中起调节作用。该通路信号可能调控胰岛素受体底物2(IRS2)与受体结合,进而促进胰岛β细胞存活[7]。胰岛β细胞显性负表达CREB转基因鼠胰岛β细胞质量和增殖能力下降、凋亡增加,表现为高血糖症[31,32]。近期研究表明,器官移植后长期大量服用钙调神经类制剂的患者,胰岛素分泌功能降低,提示CREB-CRTC信号通路对于β细胞功能的维持和细胞增殖至关重要[33]。因此,CRTC2可能作为肠促胰岛素和葡萄糖信号的共同效应子,分别激活cAMP和钙调神经信号通路调节胰岛素敏感性。
4 CRTC2对骨骼肌质量和功能的调节
骨骼肌约占人体体重的40%以上,具有高度可塑性,其质量和功能正常对机体能量代谢平衡和健康具有重要意义。一项研究发现,骨骼肌显性负表达CREB转基因小鼠具有进行性肌萎缩、炎症和细胞坏死等营养不良表型。CREB可能通过SIK1磷酸化II型去乙酰化酶(HDACs)调节肌肉因子基因的表达[34]。作为线粒体功能重要的调控因子,PGC-1α在能量代谢中的作用是不容忽视的。Wu等[35]发现在多个PGC-1α基因的转录调控因子中CRTCs转录活性最高。原代肌细胞过表达CRTC2诱导内源性PGC-1α基因表达上调,增强了PGC-1α调节的细胞线粒体呼吸链和三羧酸循环功能中的靶基因转录。所以CRTC2通过增加核内和线粒体内基因组编码的基因表达改善线粒体代谢功能,与基因表达相一致,骨骼肌细胞线粒体氧化-磷酸化能力亦提高,提示CRTC2通过调控PGC-1α的表达调节呼吸作用及下游相关信号通路而促进线粒体的代谢、提高细胞线粒体氧化-磷酸化的能力。
CRTC2涉及蛋白质翻译后的乙酰化和磷酸化修饰的调节、参与蛋白质的合成与降解。如前所述,在营养能量缺失或应激状态时,CRTC2活性显著提高,通过调控糖和脂肪代谢相关基因的表达协同调节能量代谢。而磷酸化修饰的CRTC2与COP1结合,促使其在Ly628位点被泛素化,增强了26S蛋白酶体介导的CRTC2降解[13]。采用条件性过表达CRTC2的转基因小鼠骨骼肌细胞中,肌纤维横切面积增大,肌膜内甘油三酯和肌糖原含量增加,且小鼠最大运动能力显著提高。值得一提的是,一次性大强度运动后CRTC2去磷酸化增加,激活CREB-CRTC结合,并通过交感神经-儿茶酚胺信号途径促进骨骼肌蛋白质合成[36]。但目前运动与CRTC2的活性调节相关研究鲜有报道。
5 CRTC2对自噬的调节作用
自噬是广泛存在于真核细胞中的生命现象。细胞在营养缺失、生长因子剥夺、能量缺乏等状态下,通过自噬将聚集及错误折叠蛋白、损伤的细胞器等消化清除,促进细胞代谢的原料循环再利用,以维持细胞代谢的稳态平衡。
最近报道揭示了一个新的根据不同程度营养状况来调节自噬的转录机制[37]。研究发现,空腹饥饿或营养缺失使肝细胞CRTC2活性增加,CREB-CRTC2结合增强,上调自噬相关基因,如Atg7、Ulk1和Tfeb的表达,促进了脂质降解、自噬作用。进食或药物干预时,营养/能量敏感性核受体蛋白FXR(类法尼醇)则抑制自噬相关基因的转录,即FXR可能通过干扰CREB与CRTC2之间的相互作用介导自噬抑制反应。由此推测CRTC2可能在转录水平上参与细胞自噬过程介导能量代谢的调节。一直以来涉及自噬的研究多数以转录后信号转导调控为主,该研究揭示了转录调控参与自噬过程,同时提示介导饥饿反应的一些转录机制是否响应能量转换的其他环境,例如在体育运动、限食或疾病等不同的生理、病理情况下。该研究为CRTC2参与自噬协调机体营养和能量代谢的机制提供了新线索。
6 展望
CRTC2的生物学功能涉及到营养和能量代谢、应激反应、自噬及线粒体生物合成等多个重要的细胞生理或病理反应过程。虽然CRTC2在细胞营养和能量代谢中的多重调节作用已有报道,但有关CRTC2在机体能量代谢障碍状态下的作用及调控机制、特别是
CRTC2活性是否受运动干预所调节尚未见报道。因此,深入开展CRTC2的功能研究将有助于揭示营养或能量代谢相关疾病的发病机理,为肥胖、高脂血症、糖尿病等代谢性疾病提供新的防治策略以及药物研发的新靶点。
[1]Iourgenko V,Zhang W,Mickanin C,et al.Identification of a family of cAMP response element-binding protein coactivators by genome-scale functional analysis in mammalian cells.Proc Natl Acad Sci USA,2003,100(21):12147-12152.
[2]ConkrightMD,CanettieriG,ScreatonR,etal.TORCs:transducers of regulated CrEB activity.Mol Cell,2003,12(2):413-423.
[3]Mair W,Morantte I,Rodrigues AP,et al.Lifespan extension induced by AMPK and calcineurin is mediated by CRTC-1 and CREB.Nature,2011,470(7334):404-408.
[4]Wang B,Goode J,Best J,et al.The insulin-regulated CREB coactivator TORC promotes stress resistance in Drosophila. Cell Metab,2008,7(5):434-444.
[5]Altarejos JY,Montminy M.CREB and the CRTC coactivators:sensors for hormonal and metabolic signals.Mol cell Biol,2011,12(3):141-151.
[6]Conkright MD,Guzmán E,Flechner L,et al.Genome-wide analysis of CREB target genes reveals a core promoter requirement for cAMP responsiveness.Mol Cell,2003,11(4):1101-1108.
[7]Screaton RA,Conkright MD,KatohY,etal.TheCREB coactivator TORC2 functions as a calcium-and cAMP-sensitive coincidence detector.Cell,2004,119(1):61-74.
[8]Koo SH,Flechner L,Qi L,et al.The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism. Nature,2005,437(7062):1109-1111.
[9]Rui L.Energy metabolism in the liver.Compr Physiol,2014,4(1):177-197.
[10]Saberi M,Bjelica D,Schenk S,et al.Novel liver-specific TORC2 siRNA corrects hyperglycemia in rodent models of type 2 diabetes.Am.J.Physiol Endocrinol Metab,2009,297(5):E1137-E1146.
[11]Uebi T,Tamura M,Horike,N,et al.Phosphorylation of the CREB-specific coactivator TORC2 at Ser307 regulates its intracellular localization in COS-7 cells and in the mouse liver.Am J Physiol Endocrinol Metab,2010,299(3):E413-E425.
[12]Liu Y,Dentin R,Chen D,et al.A fasting inducible switch modulates gluconeogenesis via activator/coactivator exchange. Nature,2008,456(7219):269-273.
[13]DentinR.LiuY,KooSH,etal.Insulinmodulates gluconeogenesis by inhibition of the coactivator TORC2. Nature,2007,449(7160):366-369.
[14]MayrB,MontminyM.Tanscriptionalregulationbythe phosphorylation dependent factor CREB.Nat Rev Mol Cell Biol,2001,2(8):599-609.
[15]Wang Y,Inoue H,Ravnskjaer K,et al.Targeted disruption of the CREB coactivator Crtc2 increases insulin sensitivity.Proc Natl Acad Sci USA,2010,107(7):3087-3092.
[16]Yuan LW,Gambee JE.Phosphorylation of p300 at serine 89 by protein kinase C.Biol Chem,2000,275(52):40946-40951.
[17]Yang W,Hong YH,Shen XQ,et al.Regulation of transcription by AMP-activated protein kinase:phosphorylation of p300 blocks its interaction with nuclear receptors.Biol Chem,2001,276(42):38341-38344.
[18]Yoon YS,Lee MW,Ryu D,et al.Suppressor of MEK null(SMEK)/proteinphosphatase 4 catalytic subunit(PP4C)is a key regulator of hepatic gluconeogenesis.Proc Natl Acad Sci USA,2010,107(41):17704-17709.
[19]Shaw RJ,Lamia KA,Vasquez D,et al.The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin.Science,2005,310(5754):1642-1646.
[20]Dentin R,Hedrick S,Xie J,et al.Hepatic glucose sensing via the CREB coactivator CRTC2.Science,2008,319(5868):1402-1405.
[21]Veerababu G,Tang J,Hoffman RT,et al.Overexpression of glutamine:fructose-6-phosphate aminotransferase in the liver of transgenic mice results in enhanced glycogen storage,hyperlipidemia,obesity,andimpairedglucosetolerance. Diabetes,2000,49(12):2070-2078.
[22]Erion DM,Ignatova ID,Yonemitsu S,et al.Prevention of hepatic steatosis and hepatic insulin resistance by knockdown of cAMP response element-binding protein.Cell Metab,2009,10(6):499-506.
[23]Foretz M,Hébrard S,Leclerc J,et al.Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/ AMPK pathway via a decrease in hepatic energy state.Clin Invest,2010,120(7):2355-2369.
[24]Imai S,Guarente L.Ten years of NAD-dependent SIR2 familydeacetylases:implicationsformetabolicdiseases. Trends Pharmacol Sci,2010,31(5):212-220.
[25]Canto C,Jiang LQ,Deshmukh AS,et al.Interdependence of AMPK and SIRT1 for metabolic adaptation to fasting and exercise in skeletal muscle.Cell Metab,2010,11(3):213-219.
[26]LeLayJ,TutejaG,WhiteP,etal.CRTC2(TORC2) contributes to the transcriptional response to fasting in the liver but is not required for the maintenance of glucose homeostasis.Cell Metab,2009,10(1):55-62.
[27]Daitoku H,Hatta M,Matsuzaki H,et al.Silent information regulator 2 potentiates Foxo1-mediated transcription through its deacetylase activity.Proc Natl Acad Sci USA,2004,101(27):10042-10047.
[28]Rodgers JT,Lerin C,Haas W,et al.Nutrient control of glucose homeostasis through a complex of PGC-1 α and SIRT1.Nature,2005,434(7029):113-118.
[29]Lai WA,Yeh YT,Fang WL,et al.Calcineurin and CRTC2 mediate FSH and TGFβ1 upregulation of Cyp19a1 and Nr5a in ovary granulosa cells.J Mol Endocrino,2014,53(2):259-270.
[30]Muraoka M,Fukushima A,Viengchareun S,et al.Involvement ofSIK2/TORC2signalingcascadeintheregulationof insulin-induced PGC-1α and UCP-1 gene expression in brown adipocytes.Am J Physiol Endocrinol Metab,2009,296(6):E1430-E1439.
[31]Inada A,Hamamoto Y,Tsuura Y,et al.Overexpression of inducible cyclic AMP early repressor inhibits transactivation of genes and cell proliferation in pancreatic β cells.Mol Cell Biol,2004,24(7):2831-2841.
[32]Blanchet E,Van de Velde S,Matsumura S,et al.Feedback Inhibition of CREB Signaling Promotes Beta Cell Dysfunction in Insulin Resistance.Cell Rep,2015,10(7):1149-1157.
[33]Eberhard CE,Fu A,Reeks C,et al.CRTC2 is required for βcell function and proliferation.Endocrinology,2013,154(7):2308-2317.
[34]Berdeaux R,Goebel N,Banaszynski L,et al.SIK1 is a class II HDAC kinase that promotes survival of skeletal myocytes. Nature Med,2007,13(5):597-603.
[35]Wu Z,Huang X,Feng Y,et al.Transducer of regulated CREB-binding proteins(TORCs)induce PGC-1 α transcription and mitochondrial biogenesis in muscle cells.Proc Natl Acad Sci USA,2006,103(39):14379-14384.
[36]Bruno NE,Kelly KA,Hawkins R,et al.Creb coactivators directanabolicresponsesandenhanceperformanceof skeletal muscle.EMBO J,2014,33(9):1027-1043.
[37]Seok S,Fu T,Choi SE,et al.Transcriptional regulation of autophagy by an FXR-CREB axis.Nature,2014,516(7529):108-111.
2015.03.12
教育部博士点基金(2012202110015)资助;国家自然科学基金面上项目(31571220)
傅力,Email:lifu@tijmu.edu.cn

